溃疡性结肠炎模型鼠中调节性T细胞亚群变化的研究
马亚会, 张 杰, 邵淑琳, 肖鲁瑶, 刘心娟
1.首都医科大学附属北京安贞医院消化内科,北京 100029; 2.首都医科大学附属北京朝阳医院消化内科
溃疡性结肠炎模型鼠中调节性T细胞亚群变化的研究
马亚会1, 张 杰1, 邵淑琳1, 肖鲁瑶1, 刘心娟2
1.首都医科大学附属北京安贞医院消化内科,北京 100029; 2.首都医科大学附属北京朝阳医院消化内科
目的 探讨溃疡性结肠炎(ulcerative colitis,UC)模型鼠不同组织中调节性T细胞(regulatory T cells,Treg)亚群的变化。方法 通过饮用2.5%葡聚糖硫酸钠(Dextran sulfate sodium,DSS)溶液诱导UC模型鼠,应用流式技术测定实验鼠外周血、肠系膜淋巴结、脾脏、回肠固有层、结肠固有层黏膜中Treg细胞亚群、CD4+CD25+FoxP3+IL-17+数量;分选上述组织单个核细胞中Treg细胞中的FrⅢ亚群,检测FoxP3、IL-17、RORC mRNA表达水平。结果 在UC模型鼠的脾脏、肠系膜淋巴结、回肠固有层、结肠固有层黏膜中,Treg细胞FrⅠ亚群水平均显著高于正常对照组(P<0.05)。在外周血、肠系膜淋巴结、回肠固有层、结肠固有层中,UC模型鼠中Treg细胞中FrⅡ亚群水平均显著低于正常对照组(P<0.05),而Treg细胞FrⅢ亚群水平均显著高于正常对照组(P<0.05)。在UC模型鼠的外周血、肠系膜淋巴结、回肠固有层、结肠固有层中,Treg细胞FrⅢ亚群相关基因表达如下:FoxP3 mRNA表达水平低于正常对照组(P<0.05);IL-17A、RORC mRNA表达水平高于正常对照组(P<0.05)。在UC模型鼠的外周血、肠系膜淋巴结、回肠固有层、结肠固有层中,CD4+CD25+FoxP3+IL-17+细胞水平高于正常对照组(P<0.05)。结论 UC模型鼠中存在FrⅡ亚群减少、FrⅢ亚群增多和FrⅠ亚群转化障碍,Treg细胞亚群间的这种变化可能是Treg细胞和Th17细胞失衡的内在原因。
溃疡性结肠炎;Th17细胞;调节性T细胞亚群
溃疡性结肠炎(ulcerative colitis,UC)发病可能与肠道黏膜屏障功能缺陷、异常免疫反应、感染、遗传和肠道微生态失调等有关,其中在免疫反应方面CD4+T细胞在UC中起重要作用[1-2]。文献报道[3]在UC患者肠管黏膜中Treg细胞功能受损伴Th17细胞数量增多,证实UC中Treg细胞和Th17细胞免疫失衡,这种异常免疫可能参与了UC的发病。
Treg细胞依据功能不同可分为3种亚群[4-5],分别是CD45RA+Foxp3lowresting Treg细胞(rTreg,FrⅠ)、CD45RA-Foxp3highactived Treg细胞(aTreg,FrⅡ)和CD45RA-Foxp3low非抑制性T细胞(FrⅢ);其中FrⅡ是主要发挥免疫抑制功能的一群细胞;FrⅡ型细胞的减少严重影响Treg细胞功能;FrⅠ是一群静息状态的Treg细胞;FrⅢ细胞则是没有抑制功能的细胞,但可以分泌IL-17,存在转化为Th17细胞的潜能。在自身免疫病中存在着Treg亚群的异常[6]。本研究通过对Treg细胞亚群的研究,进一步剖析Treg/Th17 细胞失衡的内在原因。
1 材料与方法
1.1 实验动物 实验动物选用C57BL/6小鼠(购自北京维通利华实验动物技术有限公司),6~8周龄,18~20 g,均为雄性,共10只,为SPF级。每日标准饲养、自由饮水及日常光照。
1.2 试剂 葡聚糖硫酸钠(DSS)(MP Biomedical),CD4-PerCP(BD PharmingenTM),CD25-APC(BD PharmingenTM),CD45RA-PE(BD PharmingenTM),IL-17-Alexa Fluor®488(BD PharmingenTM),FoxP3-PE-Cyanine7(eBioscience),CD3e-PE-CF594(BD HorizonTM),CD8a-BV510(BD HorizonTM),fixation and permeabilization(eBioscience),RNeasy Micro Kit(Qiagen)FastQuant RT Kit(With gDNase)(TIANGEN),SuperReal PreMix Plus (SYBR Green)(TIANGEN);GAPDH Primer(PMM04,Shenggong),FoxP3,IL-17 RORC mRNA引物(上海生工生物技术有限公司设计并合成)。引物序列见表1。
表1 小鼠Real-time PCR引物序列
Tab 1 The sequences of primers for Real-time PCR in mice
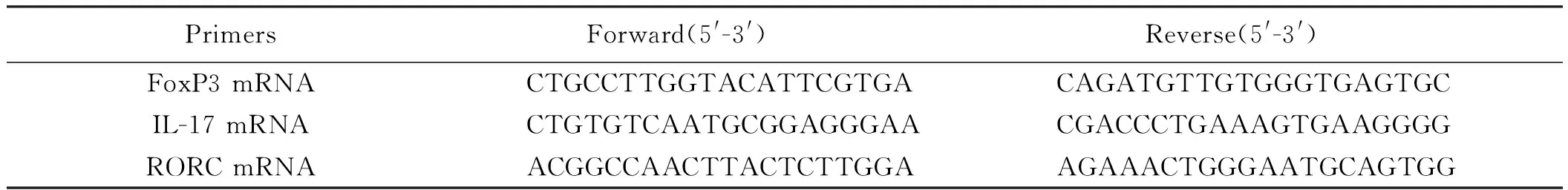
PrimersForward(5'-3') Reverse(5'-3') FoxP3mRNA CTGCCTTGGTACATTCGTGACAGATGTTGTGGGTGAGTGCIL-17mRNA CTGTGTCAATGCGGAGGGAACGACCCTGAAAGTGAAGGGGRORCmRNA ACGGCCAACTTACTCTTGGAAGAAACTGGGAATGCAGTGG
1.3 方法
1.3.1 实验分组:C57BL/6雄性小鼠随机分成正常对照组和溃疡性结肠炎模型组(UC模型组),每组小鼠各5只。正常对照组饮用蒸馏水14 d,UC组口服2.5% DSS溶液7 d,继之改饮蒸馏水7 d;造模为期14 d,14 d后脱颈处死小鼠并取材进行检测。按照Murthy评分系统[7](见表2)评估小鼠UC活动度指数(disease activity index,DAI),结肠组织病理学表现评估UC结肠的炎症,证实造模成功。
表2 小鼠结肠炎疾病活动指数评估(DAI)
Tab 2 The assessment of disease activity index (DAI) in UC mice

分数体质量减轻率(%)粪便黏稠度隐形/肉眼血便0(-)正常(颗粒状、成形)正常11~5 ——26~10松软(糊状不黏附肛门)潜血阳性311~15 ——4>15腹泻(水样、黏附肛门)血便
注:DAI=(体质量减轻率+大便黏稠度+隐形/肉眼血便的总分数)/3。
1.3.2 Treg细胞亚群水平检测:提取小鼠外周血、脾脏、肠系膜淋巴结、回肠固有层黏膜、结肠固有层黏膜单个核细胞,在24孔培养皿中加入2 μl白细胞混合刺激剂/106个细胞,放置恒温箱(5%CO237 ℃)培养5 h,避光孵育CD4、CD25、CD45RA抗体15 min;按照操作手册细胞破膜后避光孵育FoxP3、IL-17抗体20 min,应用Beckman流式细胞仪分析Treg细胞亚群、CD4+CD25+FoxP3+IL-17+水平。
1.3.3 细胞分选:BD FACS Arial Ⅱ流式分选仪分选实验鼠外周血、脾脏、肠系膜淋巴结、回肠固有层黏膜、结肠固有层黏膜的FrⅢ亚群细胞。
1.3.4 FoxP3、IL-17、RORC mRNA检测:应用RNeasy Micro Kit(Qiagen)提取FrⅢ亚群细胞总RNA,用反转录试剂盒将RNA逆转录为cDNA。用Real-time PCR(SYBR Green方法)检测FoxP3、IL-17 RORC mRNA水平。

2 结果
2.1 UC模型鼠不同组织中Treg细胞亚群的变化
2.1.1 UC模型组小鼠不同组织中FrⅠ亚群细胞水平变化及分布特点:UC模型鼠的脾脏、肠系膜淋巴结、回肠固有层黏膜、结肠固有层黏膜中FrⅠ亚群细胞水平显著高于正常对照组(P<0.01),而外周血中两组间比较差异无统计学意义(P=0.3442,见表3)。
UC模型鼠中结肠固有层黏膜中FrⅠ亚群细胞水平显著高于肠系膜淋巴结、脾脏、外周血、回肠固有层黏膜(P<0.01),肠系膜淋巴结、脾脏、外周血、回肠固有层黏膜之间差异无统计学意义(P>0.05);正常对照组中结肠固有层黏膜FrⅠ亚群细胞水平显著高于外周血、脾脏、回肠固有层黏膜、肠系膜淋巴结(P<0.01),脾脏与回肠固有层黏膜间比较差异无统计学意义(P>0.05)。
2.1.2 UC模型鼠不同组织中FrⅡ亚群细胞水平变化及分布特点:UC模型鼠外周血、肠系膜淋巴结、回肠固有层黏膜、结肠固有层黏膜中FrⅡ亚群细胞水平显著低于正常对照组(P<0.05),脾脏中两组间比较差异无统计学意义(P>0.05,见表3)。
UC模型鼠的结肠固有层黏膜中FrⅡ亚群细胞水平显著高于外周血、回肠固有层黏膜、肠系膜淋巴结、脾脏(P<0.01),脾脏、回肠固有层黏膜之间和肠系膜淋巴结、外周血之间差异无统计学意义(P>0.05);正常对照组结肠黏膜固有层黏膜中FrⅡ亚群细胞水平显著高于回肠固有层黏膜、脾脏、肠系膜淋巴结、外周血(P<0.05),肠系膜淋巴结与外周血之间比较差异无统计学意义(P>0.05)。
2.1.3 UC模型鼠不同组织中FrⅢ亚群细胞水平变化及分布特点:UC模型鼠外周血、肠系膜淋巴结、回肠固有层黏膜、结肠固有层黏膜中FrⅢ亚群细胞水平显著高于正常对照组(P<0.05),脾脏中两组间比较差异无统计学意义(P>0.05,见表3)。



组别只数FrⅠ型细胞FrⅡ型细胞FrⅢ型细胞CD4+CD25+FoxP3+IL-17+正常对照组 外周血50.345±0.0350.250±0.0442.628±0.4031.464±0.476 肠系膜淋巴结50.052±0.00960.250±0.0304.370±0.9701.450±0.400 回肠黏膜50.158±0.0180.880±0.0704.540±1.2202.530±0.990 结肠黏膜50.557±0.1201.310±0.2308.800±1.6503.180±0.640 脾脏50.120±0.00940.420±0.0906.750±1.3103.020±0.730UC模型组 外周血50.480±0.1260.160±0.033a5.526±0.707a2.280±0.592a 肠系膜淋巴结50.414±0.095a0.140±0.020a6.570±1.660a2.460±0.630a 回肠黏膜50.397±0.039a0.440±0.100a6.160±0.860a5.340±1.300a 结肠黏膜51.580±0.070a0.850±0.090a17.840±2.190a5.670±1.870a 脾脏50.452±0.074a0.370±0.0908.170±2.2003.300±0.930
注:与正常对照组比较,aP<0.05。
UC模型鼠结肠固有层黏膜中FrⅢ亚群细胞显著高于肠系膜淋巴结、脾脏、回肠固有层黏膜、外周血(P<0.01),肠系膜淋巴结、脾脏、回肠固有层黏膜中比较差异无统计学意义(P>0.05);正常对照组结肠黏膜固有层黏膜中FrⅢ亚群细胞水平显著高于脾脏、肠系膜淋巴结、回肠固有层黏膜、外周血(P<0.05),肠系膜淋巴结与回肠固有层黏膜间比较差异无统计学意义(P>0.05)。
2.1.4 UC模型鼠不同组织中CD4+CD25+FoxP3+IL-17A+细胞水平变化和分布特点:UC模型鼠外周血、肠系膜淋巴结、回肠固有层黏膜、结肠固有层黏膜中CD4+CD25+FoxP3+IL-17A+细胞水平显著高于正常对照组(P<0.05);脾脏中两组间比较差异无统计学意义(P>0.05,见表3)。
UC模型鼠结肠固有层黏膜中CD4+CD25+FoxP3+IL-17A+细胞水平显著高于脾脏、肠系膜淋巴结、外周血(P<0.05),结肠固有层与回肠固有层比较差异无统计学意义(P>0.05),肠系膜淋巴结与外周血差异比较无统计学意义(P>0.05);正常对照组中结肠固有层黏膜显著高于回肠固有层黏膜、肠系膜淋巴结、外周血(P<0.05),脾脏与结肠固有层黏膜间比较差异无统计学意义(P>0.05),肠系膜淋巴结与外周血间比较差异无统计学意义(P>0.05)。
2.2 UC模型鼠不同组织FrⅢ亚群细胞中相关基因表达
2.2.1 UC模型鼠不同组织中FrⅢ亚群细胞FoxP3 mRNA表达:UC模型鼠外周血、肠系膜淋巴结、回肠固有层黏膜、结肠固有层黏膜FrⅢ亚群细胞FoxP3 mRNA表达水平显著低于正常对照组(P<0.05),脾脏中两组间比较FoxP3 mRNA表达水平差异无统计学意义(P>0.05,见表4)。
UC模型和正常对照小鼠不同组织中FrⅢ亚群细胞FoxP3 mRNA表达水平一致:脾脏和结肠固有层黏膜显著高于外周血(P<0.05),外周血、回肠黏膜固有层、肠系膜淋巴结之间差异无统计学意义(P>0.05),脾脏、结肠固有层黏膜、回肠固有层黏膜之间差异无统计学意义(P>0.05)。
2.2.2 UC模型鼠不同组织中FrⅢ亚群细胞IL-17A mRNA表达: UC小鼠外周血、肠系膜淋巴结、回肠固有层黏膜、结肠固有层黏膜FrⅢ亚群细胞IL-17A mRNA表达水平显著高于正常对照组(P<0.05),脾脏中两组间比较IL-17A mRNA表达水平差异无统计学意义(P>0.05,见表4)。
UC模型鼠和正常对照小鼠不同组织中FrⅢ亚群细胞IL-17mRNA表达分布水平一致:回肠固有层黏膜显著高于结肠固有层黏膜、外周血、脾脏、肠系膜淋巴结(P<0.05),结肠固有层黏膜、外周血间比较差异无统计学意义(P>0.05)。
2.2.3 UC模型鼠不同组织中FrⅢ亚群细胞RORC mRNA表达: UC模型小鼠外周血、肠系膜淋巴结、回肠固有层黏膜、结肠固有层黏膜FrIII亚群细胞RORC mRNA表达水平显著高于正常对照组(P<0.05),脾脏两组见比较IL-17A mRNA表达水平差异无统计学意义(P>0.05,见表4)。
UC模型鼠回肠固有层黏膜FrⅢ亚群细胞RORC mRNA表达水平显著高于结肠固有层黏膜、外周血、脾脏、肠系膜淋巴结(P<0.05);正常对照组中回肠固有层黏膜显著高于结肠固有层黏膜、外周血、脾脏、肠系膜淋巴结(P<0.05),外周血与结肠固有层黏膜比较差异无统计学意义(P>0.05)。

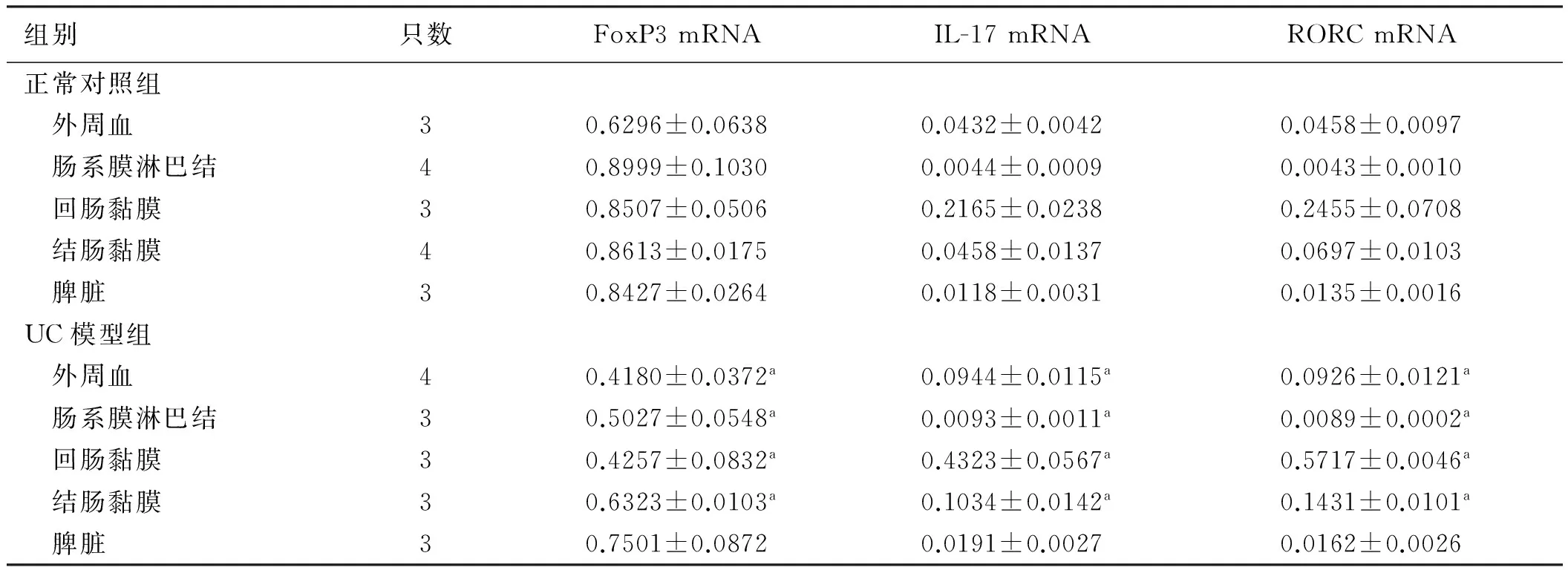
组别只数FoxP3mRNAIL-17mRNARORCmRNA正常对照组 外周血30.6296±0.06380.0432±0.00420.0458±0.0097 肠系膜淋巴结40.8999±0.10300.0044±0.00090.0043±0.0010 回肠黏膜30.8507±0.05060.2165±0.02380.2455±0.0708 结肠黏膜40.8613±0.01750.0458±0.01370.0697±0.0103 脾脏30.8427±0.02640.0118±0.00310.0135±0.0016UC模型组 外周血40.4180±0.0372a0.0944±0.0115a0.0926±0.0121a 肠系膜淋巴结30.5027±0.0548a0.0093±0.0011a0.0089±0.0002a 回肠黏膜30.4257±0.0832a0.4323±0.0567a0.5717±0.0046a 结肠黏膜30.6323±0.0103a0.1034±0.0142a0.1431±0.0101a 脾脏30.7501±0.08720.0191±0.00270.0162±0.0026
注:与正常对照组比较,aP<0.05。
3 讨论
UC属于炎症性肠病的一种常见类型,病变累及结肠黏膜层。研究发现UC存在获得性免疫异常,并且在UC的发病中起重要作用,尤其是Treg和Th17细胞[8]。Treg细胞通过细胞间的直接接触或分泌IL-10和TGF-β等细胞因子作用于效应T细胞,发挥免疫抑制作用,维持机体免疫平衡以及免疫耐受[9-10]。Th17细胞属于炎症反应性细胞,特征性分泌IL-17A、IL-17F等促炎症细胞因子对抗外来病原菌或异物[11],此外,Th17细胞在IL-23促炎症因子的协同下可以引起肠道黏膜和肠道益生菌群的破坏[12]。在正常机体中两者处于动态平衡状态,维持机体免疫平衡。研究[3]发现在UC肠道黏膜中,Treg细胞数量升高伴Treg细胞功能减退;而Th17细胞数量明显升高,且Th17细胞浸润水平与肠道炎症反应呈正相关[13-14]。也有研究[15]报道在UC外周血中Treg细胞数量是升高还是降低存在差异,但发现其功能减弱,同时文献[16]报道UC外周血Th17细胞数量增多。由此可见,在免疫反应方面UC患者中存在Treg细胞和Th17细胞之间的免疫失衡。
本研究将Treg细胞亚群的概念引入UC的研究,研究显示FrⅢ水平升高而FrⅡ水平降低,提示真正发挥免疫抑制功能的Treg细胞减少,取而代之的是FoxP3低表达且没有免疫抑制功能的FrⅢ升高。后者不但没有免疫抑制功能,且有向Th17分化的潜能,表达IL-17,呈现FoxP3和IL-17共表达的特性。已有文献[15]证实在炎症性肠病(IBD)患者中外周血存在共表达FoxP3和IL-17A CD4+T细胞(IL-17和FoxP3 DE CD4+T cell),同时表达RORγt和FoxP3 mRNA。这种细胞处于一种中间状态,在CD4+T细胞因子(比如IL-1β、IL-2、IL-21等)的影响下,可以转变为Th17细胞,同时发现IL-17和FoxP3 DE CD4+T细胞免疫抑制功能减少60%[15]。在IBD患者中,FoxP3和 IL-17A DE CD4+T细胞的存在是导致Treg细胞功能减退以及Th17细胞升高的原因[17]。本研究发现,UC模型鼠FrⅢ型细胞和CD4+CD25+FoxP3+IL-17+细胞较正常对照组升高,FrⅢ型细胞共表达RORC和FoxP3 mRNA基因,提示FrⅢ型细胞是FoxP3和IL-17A DE CD4+T提供者。在UC的病态微环境中Treg细胞获得转化为Th17细胞的潜能,真正发挥免疫抑制功能的FrⅡ细胞数量减少,导致Treg细胞和Th17细胞失衡伴Treg细胞功能减退。
最初人们认为,初始T细胞(naive T)向Treg细胞分化过程中表达了FoxP3,并失去表达RORC的能力,但是近年来研究发现Treg细胞在某些因素的诱导下可重新获得表达RORC的能力,从而向Th17细胞转化,但是这种转化主要发生在外周淋巴组织,而非中枢淋巴系统[18-19]。我们发现在UC模型树中结肠固有层黏膜、回肠固有层黏膜单个核细胞中共表达RORC和FoxP3 mRNA的FrⅢ亚群细胞比例升高,同时CD4+CD25+FoxP3+IL-17+细胞主要存在于结肠固有层黏膜、回肠固有层黏膜,说明FrⅢ型细胞转化为Th17细胞的这一现象主要出现在外周淋巴组织,极少出现在脾脏中。提示在UC中,Treg获得向Th17分化的潜能并失去正常功能,仅发生在外周淋巴组织,不发生在中枢淋巴系统。
FrⅠ亚群细胞是静息状态的细胞,可转化为FrⅡ亚群功能细胞,本研究发现在UC模型鼠中,结肠固有层黏膜、肠系膜淋巴结、回肠固有层黏膜单个核细胞中FrⅠ亚群数量增多,且在结肠固有层黏膜分布最多,提示UC模型鼠中FrⅠ的储备是正常的,可能存在FrⅠ转化障碍,其机制仍需进一步研究[5-6]。
综上所述,UC存在Treg/Th17细胞失衡,在UC模型鼠中增多的FrⅢ亚群细胞共表达FoxP3、RORC mRNA,提示免疫抑制功能下降且存在转化为Th17细胞的潜能。由此可见,FrⅢ亚群增多、FrⅡ亚群减少协同FrⅠ亚群转化障碍可能是Treg细胞和Th17细胞失衡的原因,共同参与了UC的发病。
[1]Danese S, Fiocchi C. Ulcerative colitis [J]. N Engl J Med, 2011, 365(18): 1713-1725.
[2]Gómez-Gómez GJ, Masedo, Yela C, et, al. Current stage in inflammatory bowel disease: What is next? [J]. World J Gastroenterol, 2015, 21(40): 11282-11303.
[3]Maul J, Loddenkemper C, Mundt P, et al. Pripheral and intestinal regulatory CD4+CD25 (high) T cells in inflammatory bowel disease [J]. Gastroenterology, 2005, 128(7): 1868-1878.
[4]Zhang H, Kong H, Zeng X, et al. Subsets of regulatory T cells and their roles in allergy [J]. J Transl Med, 2014, 12: 125.
[5]Miyara M, Yoshioka Y, Kitoh A, et al. Functional delineation and differentiation dynamics of human CD4+T cells expressing the FoxP3 transcription factor [J]. Immunity, 2009, 30(6): 899-911.
[6]Liu X , Gao N, Li M, et al. Elevated levels of CD4+CD25+Foxp3+T cells in systemic sclerosis patients contribute to the secretion of IL-17 and immunosuppression dysfunction [J]. PLoS One, 2013, 8(6): e64531.
[7]Cooper HS, Murthy SN, Shah RS, et al. Clinicopathologic study of dextran sulfate sodium experimental murine colitis [J]. Lab Invest, 1993, 69(2): 238-249.
[8]Shale M, Schiering C, Powrie F. CD4+T-cell subsets in intestinal inflammation [J]. Immunol Rev, 2013, 252(1): 164-182.
[9]Guerin LR, Prins JR, Robertson SA. Regulatory T-cells and immune tolerance in pregnancy: a new targetfor infertility treatment? [J]. Human Reprod Update, 2009, 15(5): 517-535.
[10]Mayne CG, Williams CB. Induced and natural regulatory T cells in the development of inflammatory bowel disease [J]. Inflamm Bowel Dis, 2013, 19(8): 1772-1788.
[11]Cătană CS, Berindan Neagoe I, Cozma V, et al. Contribution of the IL-17/IL-23 axis to the pathogenesis of inflammatorybowel disease [J]. Word J Gastroenterol, 2015, 21(19): 5823-5830.
[12]Xu XR, Liu CQ, Feng BS, et al. Dysregulation of mucosal immune response in pathogenesis of inflammatory bowel disease [J]. World J Gastroenterol, 2014, 20(12): 3255-3264.
[13]Ivanov II, Atarashi K, Manel N, et al. Induction of intestinal Th17 cells by segmented filamentous bacteria [J]. Cell, 2009, 139(3): 485-498.
[14]Niess JH, Leithäuser F, Adler G, et al. Commensal gut flora drives the expansion of proinflammatory CD4 T cells in the colonic lamina propria under normal and inflammatory conditions [J]. J Immunol, 2007, 180(1): 559-568.
[15]Ueno A, Jijon H, Chan R, et al. Increased prevalence of circulating novel IL-17 secreting Foxp3 expressing CD4+T cells and defective suppressive function of circulating Foxp3+regulatory cells support plasticity between Th17 and regulatory T cells in inflammatory bowel disease patients [J]. Inflamm Bowel Dis, 2013, 19(12): 2522-2534.
[16]Dong Z, Du L, Xu X, et, al. Aberrant expression of circulating Th17, Th1 and Tc1 cells in patients with active and inactive ulcerative colitis [J]. Int J Mol Med, 2013, 31(4): 989-997.
[17]Li L, Boussiotis VA. The role of IL-17-producing Foxp3+CD4+T cells in inflammatory bowel disease and colon cancer [J]. Clin Immunol, 2013, 148(2): 246-253.
[18]Voo KS, Wang YH, Santorib FR, et al. Identification of IL-17-producing Foxp3+regulatory T cells in humans [J]. Proc Natl Acad Sci USA, 2009, 106(12): 4793-4798.
[19]Schmidl C, Hansmann L, Andreesen R, et al. Epigenetic reprogramming of the RORC locusduringin vitro expansion is a distinctive feature of humanmemory but not naive Treg [J]. Eur J Immunol, 2011, 41(5): 1491-1498.
(责任编辑:陈香宇)
The changes of regulatory T cell subsets in DSS-induced ulcerative colitis mice
MA Yahui1, ZHANG Jie1, SHAO Shulin1, XIAO Luyao1, LIU Xinjuan2
1.Department of Gastroenterology, Beijing Anzhen Hospital, Capital Medical University, Beijing 100029; 2.Department of Gastroenterology, Beijing Chaoyang Hospital, Capital Medical University, China
Objective To investigate the changes of regulatory T cell (Treg) subsets in ulcerative colitis (UC) mice. Methods Mice were randomly divided into UC group and healthy control group. The UC group were induced by 2.5% Dextran sulfate sodium (DSS) solution. The pathological manifestations of colon tissue were observed by Hematoxylin-Eosin staining. The Treg cell subsets and CD4+CD25+FoxP3+IL-17+were evaluated by flow cytometry, after extracting the mononuclear cells from peripheral blood (PB), spleen (SP), mesenteric lymph node (MLN), lamina propria (LP) of jejunum and colon in DSS-induced UC mice. And FoxP3, IL-17A, RORC mRNA extracted from FrⅢ cells were evaluated by Real-time PCR from above samples. Results In UC mice, the levels of FrⅠ subset cells were decreased among samples including SP, MLN, LP of jejunum and LP of colon compared with healthy control mice (P<0.05); the levels of FrⅡ subset cells were decreased among samples including PB, MLN, LP of jejunum, LP of colon compared with healthy control mice (P<0.05). While the levels of FrⅢ cells were increased among above samples compared with healthy control mice, as to the FoxP3, IL-17, RORC mRNA expressions extracted from FrⅢ cells. In UC mice, the expressions of FoxP3 mRNA were decreased among PB, MLN, LP of jejunum and LP of colon compared with healthy control mice, while the IL-17A and RORC mRNA were increased among above samples compared with healthy control mice (P<0.05). The levels of CD4+CD25+FoxP3+IL-17A+cells were increased among samples including PB, MLN, LP of jejunum, LP of colon compared with healthy control mice (P<0.05). Conclusion The decrease in FrⅡ cells and increase in FrⅢ cells together with a defect in FrI cells in the Treg cells are the reasons of the imbalance between Treg and Th17 cells.
Ulcerative colitis; Th17 cells; Regulatory T cell subsets
10.3969/j.issn.1006-5709.2016.03.016
国家自然科学基金青年基金项目(81300294)
马亚会,硕士,住院医师,研究方向:TLR2介导的Treg细胞塑型在溃疡性结肠炎肠黏膜Treg/Th17细胞间失衡中的作用机制研究。E-mail:18732854035@163.com
刘心娟,博士,副主任医师,研究方向:TLR2介导的Treg细胞塑型在溃疡性结肠炎肠黏膜Treg/Th17细胞间失衡中的作用机制研究。E-mail:lxjw2012@126.com
R574.62
A
1006-5709(2016)03-0294-05
2015-11-17

