肾细胞癌的病理诊断与研究进展
陈 铌,周 桥
(四川大学华西医院病理科,四川成都 610041)
·专家论坛·
肾细胞癌的病理诊断与研究进展
陈铌,周桥
(四川大学华西医院病理科,四川成都610041)
摘要:肾细胞癌是常见的泌尿系统恶性肿瘤。既往肾细胞癌分类主要依赖于形态学,但日渐明晰的分子和遗传学改变将有助于更好地进行分类、治疗选择及预后评估。2012年在加拿大温哥华召开的国际泌尿病理学会(ISUP)共识会议,对肾肿瘤的组织学分类、分期、预后因素、免疫组化和分子标志物等领域的最新进展进行讨论并达成共识,亦将成为下一版WHO分类的基础。本文介绍常见肾细胞癌的病理诊断和研究进展,以及2012年ISUP共识分类中的肾细胞癌新类型的形态学特征、免疫组化标记、分子和遗传学改变。
关键词:肾细胞癌;病理诊断;ISUP共识;分类
肾癌是常见恶性肿瘤之一,其发病率在美国男性恶性肿瘤中位居第7,女性恶性肿瘤中位居第8;2010年新发58 000例,13 000多患者死于肾癌[1]。中国肿瘤登记中心收集全国72 个肿瘤登记地区资料显示2009年国内肾癌发病率为5.75/10万(男性7.07/10 万,女性4.40/10 万)[2]。肾脏恶性肿瘤中,肾细胞癌占85%以上。
现行肾细胞癌的分类为2004版WHO分类[3](表1)。2012年在加拿大温哥华召开的国际泌尿病理协会 (International Society of Urological Pathology,ISUP) 共识会议,对肾肿瘤的组织学分类、标本处理和肿瘤分期、预后因素、免疫组化和分子标志物等领域的最新进展进行讨论并达成共识,即现在许多病理学家已采用的温哥华分类[4-7],亦将成为下一版WHO分类的基础。
目前肾细胞癌的病理诊断仍主要依赖于形态学,但日渐明晰的分子和遗传学改变将有助于更好地进行分类、治疗选择及预后评估。本文介绍常见肾细胞癌的病理诊断和研究进展,以及2012年ISUP共识分类中的肾细胞癌新类型(表1)的形态学特征、免疫组化标记、分子和遗传学改变。
表1肾细胞癌组织学类型

2004版肾细胞癌分类2012年ISUP共识分类中新的肾细胞癌类型①透明细胞肾细胞癌②多房囊性肾细胞癌③乳头状肾细胞癌④嫌色细胞肾细胞癌⑤集合管癌⑥肾髓质癌⑦Xp11.2转位相关肾细胞癌⑧神经母细胞瘤相关肾细胞癌⑨粘液小管梭形细胞癌⑩肾细胞癌,未定类①小管囊性肾细胞癌②透明细胞乳头状肾细胞癌③TFEB转位相关肾细胞癌④获得性囊性肾疾病相关肾细胞癌⑤“遗传性平滑肌瘤病肾细胞癌综合征”相关肾细胞癌
1常见的肾细胞癌类型
1.1透明细胞肾细胞癌(clear cell renal cell carcinoma, CCRCC)CCRCC是最常见的肾细胞癌亚型,约占所有肾脏上皮性肿瘤的60%,转移性肾细胞癌的90%。组织学诊断特征包括透明细胞、腺泡状/片状/管状生长模式及丰富的血管网(图1A)。高核极CCRCC的胞质常呈嗜酸性颗粒状,间质血管可不明显,可出现肉瘤样分化(图1B)。如多处仔细取材,通常能找到典型透明细胞癌区域。较有特异性的辅助诊断指标是肿瘤细胞呈碳酸酐酶IX(CAIX)膜阳性(图1C、1D)以及CD10膜阳性,而CK7和a-甲酰基辅酶A消旋酶 (alpha methylacyl-CoA racemase, AMACR)多为阴性[8]。有时与Xp11转位相关肾细胞癌、透明细胞乳头状肾细胞癌以及其他含有透明细胞的肿瘤鉴别较困难。适当的免疫组化检查和分子检查有助于鉴别[9]。 CCRCC中最常见的分子改变是3p 丢失和VHL (3p25) 突变,散发病例中VHL基因突变或甲基化失活可高达90%[10],提示其可能是肿瘤发生的早期事件。最近报道,约40%的CCRCC中有3p21位点上PBRM1基因的截短突变,该基因产物是染色体重塑复合物SWI/SNF的一部分[11]。

图1透明细胞肾细胞癌的形态学特征(×400)
A、C:HE染色分别示CCRCC经典透明细胞区和肉瘤样区形态学特征;B、D:分别为其对应的CAIX免疫组化染色。
1.2乳头状肾细胞癌(papillary renal cell carcinoma, PRCC)PRCC约占肾脏上皮性肿瘤的10%~15%。2014版WHO分类分为两种亚型:1型乳头表面被覆较小的立方状细胞,胞质较少或中等量,双嗜色性;2型肿瘤细胞较大,核级较高,胞质嗜酸性,细胞核呈假复层排列。2型PRCC的组织形态变化多样,除乳头状结构,也可有小管状、实体状等其他生长模式。因其他类型的肾脏肿瘤(包括Xp11转位相关肾细胞癌、集合管癌、新近描述的获得性囊性肾疾病相关肾细胞癌、透明细胞PRCC等)[12],也可有明显的乳头状结构,需与PRCC仔细鉴别。
免疫组化检查示PRCC 1型多呈CK7弥漫强阳性,但2型阳性率低一些。AMACR亦常呈胞质弥漫阳性;CAIX常阴性或仅局灶阳性。组织学特征和免疫组化检查有助于PRCC与其他具有乳头状结构的肾肿瘤的鉴别,但高核极2型乳头状癌与集合管癌及一些未定类的肾细胞癌的鉴别较困难。PRCC的预后总体比CCRCC好,但2型的预后比1型差一些。转移性PRCC的预后可能比转移性CCRCC差[13]。
散发性PRCC最常见的遗传学改变为7号、17号染色体三体,亦有Y染色体丢失。1型PRCC中比2型更易见7号和17号染色体拷贝数获得。缺乏17号三体的PRCC预后可能较差[14-16]。基因表达谱芯片和基于基因芯片的比较基因组杂交技术(array-based comparative genomic hybridization, aCGH)研究显示,2型PRCC可进一步细分为有预后意义的亚类[17]。 遗传性PRCC中也常见MET基因突变,且13%的散发性1型PRCC中也有MET基因改变[18]。
1.3嫌色细胞肾细胞癌 (chromophobe renal cell carcinoma, CRCC)CRCC占肾脏上皮性肿瘤的6%~11%。其肿瘤细胞的形态特征是体积大、多边形,胞质浅染或细网状,有核周空晕,呈团巢状、腺泡状或实体片状生长,常伴有一些胞质嗜酸的体积较小的肿瘤细胞。CRCC预后好于透明细胞癌,因此区分这两种肾细胞癌类型非常重要。嗜酸细胞成分为主时,称为“嗜酸细胞亚型”CRCC,需与其他嗜酸细胞肿瘤,如嗜酸细胞(腺)瘤(oncocytoma)鉴别。免疫组化示CRCC常呈CK7弥漫、阳性CD117膜阳性,CAIX和AMACR阴性,有助于鉴别。细胞遗传学上,CRCC常有1号和Y染色体丢失,亦可见1、2、6、10、13、17和21号染色体联合丢失[19-20]。
1.4Xp11.2转位相关肾细胞癌Xp11.2转位相关肾细胞癌与其他一些转位相关RCC的遗传学特征是小眼畸形转录因子(MiTF)/转录因子E家族基因的转位。2004版WHO分类中Xp11.2转位/TFE3基因转位相关肾细胞癌已确定为独立的肾癌亚型;常见于儿童或年轻人,但亦见于成人。Xp11.2转位相关肾细胞癌于儿童侵袭性较低[21],而成人患者似侵袭性较强[22]。 位于Xp11.2的TFE3基因,可与多个基因(如ASPL, PRCC, NonO,PSF和CLTC等)融合,导致TFE3蛋白异常表达[23]。Xp11.2转位相关肾细胞癌组织学形态多样,肿瘤细胞有透明胞质或透明/嗜酸性胞质,排列成乳头状、腺泡状或团巢状结构,常见沙砾体形成(图2A),部分病例可见黑色素。免疫组化上,Xp11.2转位相关肾细胞癌可呈上皮标记阴性,或仅为局灶阳性;TFE3核表达具有较特异的诊断价值(图2B),但需要有较好的实验室标准化质量控制[24]。TFE-3分离探针FISH检测有助于更准确地判断转位情况(图2C)[25-26]。
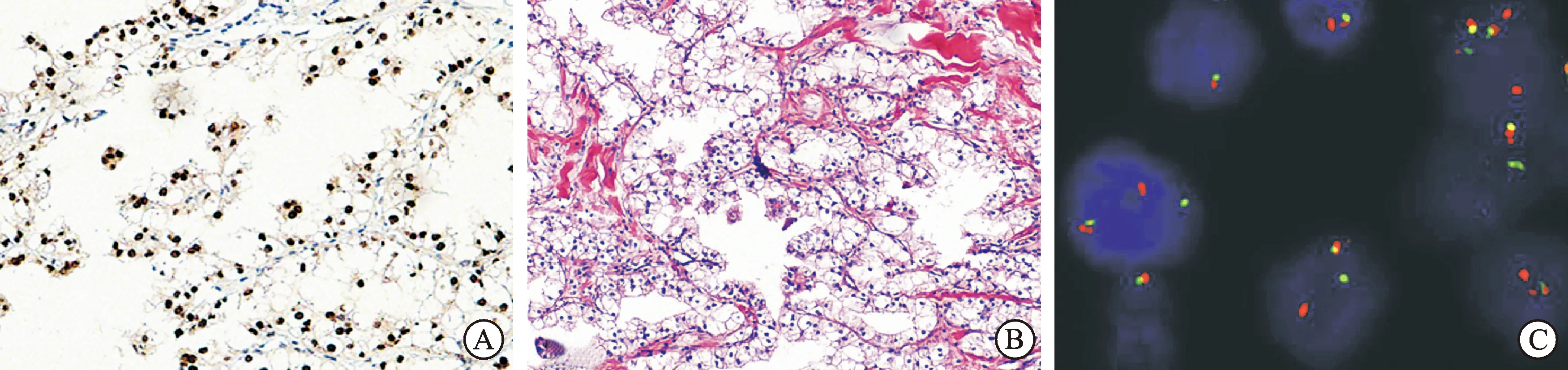
图2Xp11.2转位相关肾细胞癌的特征
A:Xp11.2转位相关肾细胞癌的形态特征(HE,×400);B:免疫组化染色示肿瘤细胞核表达TFE3蛋白(×400);C: FISH检测示红绿信号分离,提示TFE3基因转位(×1 000)。
1.5集合管癌(collecting duct carcinoma, CDC)CDC少见、侵袭性很强[27]。其组织学改变并不特异,诊断较困难,一般是排除其他高级别肿瘤后方可诊断。免疫组化上,CDC常表达高分子量CK(34βE12)、CK7、CD117和EMA。细胞遗传学资料显示,CDC可有1、6、14、15及22号染色体单体,或多条染色体臂(包括1q,6p,8p,13q及21q)杂合性缺失;或1q32.1-32.2小范围缺失。CDC中未见有7号和17号染色体三体及3p丢失[28-29],有助于与高级别PRCC或CCRCC区别。
1.6肾髓质癌肾髓质癌罕见,几乎均发生于有镰刀(sickle cell,SC) 细胞特征的年轻人[30]。肾髓质癌与集合管癌的形态学有重叠。INI1(SNF5/BAF47)核蛋白在肾髓质癌中表达缺失,有助于诊断。
22012 ISUP会议共识分类中的肾细胞癌新类型
2.1小管囊性肾细胞癌(tubulocystic renal cell carcinoma,TCRCC)TCRCC曾被认为是低级别集合管癌[31]。 大体上肿瘤边界清,但无被膜,切面见排列紧密的小到中等大小的囊状结构(图3A)。组织学上,肿瘤由不同程度扩张的小管和囊腔组成,纤维间质分隔。囊腔被覆细胞呈扁平状、立方状或柱状,常可见鞋钉样(hobnail)细胞,胞质嗜酸,核仁可明显(图3B)。免疫组化示TCRCC常表达PAX8,AMACR和CD10。细胞遗传学分析显示,部分TCRCC可出现与PRCC相似的7 号和 17 号染色体拷贝数增加[32-33]。多数TCRCC生物学行为呈惰性,偶见远处转移[33-34]。
2.2获得性囊性肾疾病相关肾细胞癌(acquired cystic disease associated renal cell carcinoma,ACD-RCC)获得性囊性肾疾病相关肾细胞癌是终末期肾病患者、尤其是获得性囊性疾病患者最常见的肾细胞癌类型。大体多表现为囊壁内的附壁结节;切面黄色或棕褐色,常伴出血坏死。镜下见肿瘤细胞排列成腺泡状、小管状、实体-腺泡状、微囊状、乳头状或实体片状结构;大多数肿瘤细胞胞质丰富、嗜酸性,核圆形或卵圆形,染色质空泡状,核仁明显。一个特征性的改变是细胞内 / 细胞间空泡;另一特征性改变是可见肿瘤内草酸盐结晶。免疫组化示获得性囊性肾疾病相关肾细胞癌常呈AMACR弥漫阳性,CK7阴性或偶尔局灶阳性。分子遗传学研究显示多种遗传学改变,如常出现染色体1、2、3、6、7、16 和 Y 染色体拷贝数增加[5]。由于这些患者一般均为长期监测随访的慢性肾脏疾病患者,易早期发现肿瘤,故预后相对较好,但也有一些具有肉瘤样变或横纹样特征的病例出现转移[35]。

图3 小管囊性肾细胞癌的形态学特征
A:肿瘤细胞排列成小管状、囊状结构(HE,×100);B:囊腔被覆鞋钉样细胞(HE,×200)。
2.3透明细胞乳头状肾细胞癌(clear cell papillary renal cell carcinoma)透明细胞乳头状肾细胞癌常边界清楚,被膜完整。镜下见肿瘤由低核级立方状透明细胞组成,细胞排列成乳头状、管状、腺泡状和囊性结构。较有特征性的改变是细胞核不靠近基膜;而是居中或接近腔缘;免疫组化示CAIX 具有特征性的“茶杯状”阳性方式 (胞膜两侧和基底部阳性,腔缘处不着色)。肿瘤也常表达CK7、HCK (34BE12),不表达CD10和AMACR。细胞遗传学分析未见3p25缺失、VHL 基因突变和7 号和 17 号染色体拷贝数增加,有助于与CCRCC和PRCC鉴别。此种肿瘤生物学行为惰性,尚无转移病例报道[5]。
2.4TFEB转位相关肾细胞癌[t(6;11) renal cell carcinoma]此类肾细胞癌的特点是MiTF家族另一成员TFEB基因与位于11q12位点的alpha基因融合,形成 t ( 6; 11)( p21; q12) 转位,导致TFEB核蛋白过表达[36]。 主要见于年轻人(中位年龄28.5岁)。典型组织形态为双相结构,由大、小两群上皮样细胞组成,较小的上皮样细胞常围绕基底膜样物质成簇排列(图4A)。此类肿瘤常表达黑色素细胞分化抗原,如HMB45和MART-1(A103)(图4C),上皮标记常呈阴性或仅局灶阳性。免疫组化检测细胞核中的TFEB蛋白表达是相对敏感和特异的诊断依据(图4B)。TFEB分离探针FISH检测有助于确诊[37]。由于少见,此种肿瘤的生物学行为尚不完全肯定,已报道的 30 例肿瘤中有3例出现远处转移和死亡[5]。

图4TFEB转位相关肾细胞癌的特征(×400)
A:HE染色示TFEB转位相关肾细胞癌的形态特征;B:免疫组化染色示肿瘤细胞核过表达TFE3蛋白;C:胞质表达黑色素分化抗原MART-1(A103)。
2.5“遗传性平滑肌瘤病肾细胞癌综合症”相关肾细胞癌(hereditary leiomyomatosis renal cell carcinoma syndrome associated renal cell carcinoma,HLRCC-RCC)HLRCC-RCC中的肾细胞癌呈乳头状生长,核级高,胞质嗜酸性,以前曾被归入2型乳头状肾细胞癌。最近的遗传分析显示这类患者特征性的分子病理改变是延胡索酸盐(富马酸盐)水合酶基因(FH)胚系失活突变。这一综合征患者有皮肤或子宫的平滑肌瘤,约1/3 患者发生肾细胞癌。肿瘤细胞核大,具有明显的嗜酸性核仁,核仁周可见透明空晕。部分肿瘤可表现为多灶性、实体性或浸润性生长,可有促纤维增生反应,类似集合管癌[38]。 与其他遗传性肾细胞癌或CCRCC、PRCC相比,HLRCC-RCC侵袭性强,预后差。
3ISUP共识中的其他新观点
3.12004版WHO中的多房囊性肾细胞癌(multilocular cystic RCC)改称为低度恶性潜能的多房囊性肾细胞肿瘤(multilocular cystic renal cell neoplasm of low malignant potential)多房囊性肾细胞癌的细胞遗传学改变与CCRCC一致,2004版WHO将其作为CCRCC的一种亚型。其特点是出现多个衬覆低级别透明细胞的囊腔。多组随访资料(>200例患者、随访时间>5年)显示该肿瘤预后良好,未出现转移或因肿瘤死亡的报道。2012年ISUP共识认为此类肿瘤应改称为“低度恶性潜能的多房囊性肾细胞肿瘤”。
3.2增加了杂合性嗜酸细胞/嫌色细胞肿瘤(hybrid oncocytic/chromophobe tumors,HOCTs)偶见既有嗜酸细胞瘤又有CRCC形态学特征的细胞混合组成的肿瘤,称为杂合性嗜酸细胞/嫌色细胞肿瘤。该肿瘤通常见于3种情况:散发、与肾脏嗜酸细胞增多症相关或与Birt-Hogg-Dubé (BHD) 综合征相关。
散发型HOCTs 常为单侧、单发,而BHD综合征患者或嗜酸细胞增多症相关HOCTs常表现为双侧或多发。形态学上,散发性HOCTs 肿瘤细胞主要呈实体-腺泡状结构,核轻度异型,可见颗粒状嗜酸性胞质。嗜酸细胞增多症相关HOCTs典型表现为肿瘤细胞被细小的血管分割成片团状结构;细胞呈圆形或多边形,胞质细颗粒状,核轻度多形性或不规则,核仁可见。与BHD综合征相关的HOCTs有3种形态学表现:①经典的嗜酸细胞瘤和CRCC混合在一起;②在典型的嗜酸细胞瘤的背景中散在分布具有核周空晕,偶有双核的嫌色细胞;③大的嗜酸性细胞具有胞质空泡,轻到中度核异型性,呈嗜酸细胞瘤样巢状排列。[5]
这类肿瘤的分子改变不同于经典的嗜酸细胞瘤和CRCC。ISUP共识认为HOCTs可作为CRCC的一个亚型。
4肾细胞癌诊断
4.1免疫组织化学肾细胞癌诊断中免疫组化的应用有辅助价值,但需根据组织学特征选择合适的标记。CAIX、CD10、CK7、AMACR、TFE3、TFEB、CD117、Kidney-specific cadherin(Ksp-cadherin肾脏特异性钙粘素)、parvalbumin、S100A1、PAX2或PAX8、34bE12、P63、HMB45、Melan A(MART-1, A103)、Synaptophysin等免疫标记较常用[9,12,39]。PAX2 和PAX8是判断转移性肾细胞癌的标记,但需结合肿瘤组织形态和其他恰当的免疫标记。
4.2荧光原位杂交(fluorescence in situ hybridization, FISH)FISH检测在肾细胞癌鉴别诊断有重要价值。7号和17号染色体检测有助于乳头状肾细胞癌的诊断,但其特异性还需要进一步探索。TFE3和TFEB转位的FISH检测对Xp11.2/TFE3转位或TFEB转位相关RCC的诊断很有帮助[25-26]。
4.3其他分子检查基于芯片的SNP和CGH技术已开始应用于临床甲醛固定石蜡包埋组织样本,有助于全面分析基因拷贝数改变和杂合性缺失。基于二代测序技术的大规模或多基因突变筛查、microRNA表达谱分析等也越来越多地用于确定特定分子改变。预计在研究工作基础上开发的新的诊断、预后及预测标记将不断涌现并很快用于临床病理诊断。
5推荐的病理报告内容
ISUP温哥华2012共识除了对肾肿瘤的组织学分类进行了详细讨论,还对标本处理和肿瘤分期、预后因素、免疫组化和分子标志物等领域的最新进展进行了分组讨论并达成共识,讨论结果已发表在美国外科病理学杂志上[40-42]。一份完整的肾细胞癌病理报告除对肿瘤进行组织学分型,还应包括影响肾细胞癌预后的主要因素,包括病理分期、是否有肉瘤样分化或横纹(肌)样分化、核分级、肿瘤性坏死、微血管浸润和切缘情况等。
参考文献:
[1] SIEGEL R, WARD E, BRAWLEY O, et al. Cancer statistics, 2011:the impact of eliminating socioeconomic and racial disparities on premature cancer deaths[J]. CA Cancer J Clin,2011,61(4):212-236.
[2] 张永贞, 杨国庆, 张思维, 等. 中国2009 年肾及泌尿系统其他癌发病和死亡分析[J]. 中国肿瘤, 2013,22(5):333-337.
[3] EBLE JN, SAUTER G, SESTERHEN IA. Pathology and genetics of the urinary system and male genital organs[M]. Lyon:I ARC Press,2004:159-215.
[4] TRPKOV K, GRIGNON DJ, BONSIB SM, et al. Handling and staging of renal cell carcinoma:the International Society of Urological Pathology Consensus (ISUP) conference recommendations[J]. Am J Surg Pathol, 2013,37(10):1505-1517.
[5] SRIGLEY JR, DELAHUNT B, EBLE JN, et al. The International Society of Urological Pathology (ISUP) vancouver classification of renal neoplasia[J]. Am J Surg Pathol,2013,37(10):1469-1489.
[6] DELAHUNT B, EGEVAD L, MONTIRONI R, et al. International Society of Urological Pathology (ISUP) consensus conference on renal neoplasia:rationale and organization[J]. Am J Surg Pathol, 2013,37(10):1463-1468.
[7] DELAHUNT B, CHEVILLE JC, MARTIGNONI G, et al. The International Society of Urological Pathology (ISUP) grading system for renal cell carcinoma and other prognostic parameters[J]. Am J Surg Pathol, 2013,37(10):1490-1504.
[8] TICKOO SK, ALDEN D, OLGAC S, et al. Immunohistochemical expression of hypoxia inducible factor-1alpha and its downstream molecules in sarcomatoid renal cell carcinoma[J]. J Urol, 2007,177(4):1258-1263.
[9] REUTER VE, TICKOO SK. Differential diagnosis of renal tumours with clear cell histology[J]. Pathology,2010,42(4):374-383.
[10] NICKERSON ML, JAEGER E, SHI Y, et al. Improved identification of von Hippel-Lindau gene alterations in clear cell renal tumors[J]. Clin Cancer Res,2008,14(15):4726-4734.
[11] VARELA I, TARPEY P, RAINE K, et al. Exome sequencing identifies frequent mutation of the SWI/SNF complex gene PBRM1 in renal carcinoma[J]. Nature,2011,469(7331):539-542.
[12] TICKOO SK, REUTER VE. Differential diagnosis of renal tumors with papillary architecture[J]. Adv Anat Pathol,2011,18(2):120-132.
[13] MARGULIS V, TAMBOLI P, MATIN SF, et al. Analysis of clinicopathologic predictors of oncologic outcome provides insight into the natural history of surgically managed papillary renal cell carcinoma[J].Cancer,2008,112(7):1480-1488.
[14] KLATTE T, PANTUCK AJ, SAID JW, et al. Cytogenetic and molecular tumor profiling for type 1 and type 2 papillary renal cell carcinoma[J].Clin Cancer Res,2009;15(4):1162-1169.
[15] SANDERS ME, MICK R, TOMASZEWSKI JE, et al. Unique patterns of allelic imbalance distinguish type 1 from type 2 sporadic papillary renal cell carcinoma[J]. Am J Pathol, 2002,161(3):997-1005.
[16] JIANG F, RICHTER J, SCHRAML P, et al. Chromosomal imbalances in papillary renal cell carcinoma:genetic differences between histological subtypes[J]. Am J Pathol,1998,153(5):1467-1473.
[17] YANG XJ, TAN MH, KIM HL, et al. A molecular classification of papillary renal cell carcinoma[J]. Cancer Res,2005,65(13):5628-5637.
[18] SCHMIDT L, JUNKER K, NAKAIGAWA N, et al. Novel mutations of the MET proto-oncogene in papillary renal carcinomas[J]. Oncogene, 1999,18(14):2343-2350.
[19] BUGERT P, GAUL C, WEBER K, et al. Specific genetic changes of diagnostic importance in chromophobe renal cell carcinomas[J]. Lab Invest,1997,76(2):203-208.
[20] KOVACS A, KOVACS G. Low chromosome number in chromophobe renal cell carcinomas[J]. Genes Chromosomes Cancer, 1992,4(3):267-268.
[21] GELLER JI, ARGANI P, ADENIRAN A, et al. Translocation renal cell carcinoma:lack of negative impact due to lymph node spread[J]. Cancer,2008,112(7):1607-1616.
[22] ARGANI P, OLGAC S, TICKOO SK, et al. Xp11 translocation renal cell carcinoma in adults:expanded clinical, pathologic, and genetic spectrum[J]. Am J Surg Pathol, 2007,31(8):1149-1160.
[23] RAO Q, WILLIAMSON SR, ZHANG S, et al. TFE3 break-apart FISH has a higher sensitivity for Xp11.2 translocation-associated renal cell carcinoma compared with TFE3 or cohesion K immunohistochemical staining alone:expanding the morphologic spectrum[J]. Am J Surg Pathol,2013,37(6):804-815.
[24] ARGANI P, LAL P, HUTCHINSON B, et al. Aberrant nuclear immunoreactivity for TFE3 in neoplasms with TFE3 gene fusions:a sensitive and specific immunohistochemical assay[J]. Am J Surg Pathol,2003,27(6):750-761.
[25] MOSQUERA JM, DAL CIN P, MERTZ KD, et al. Validation of a TFE3 break-apart FISH assay for Xp11.2 translocation renal cell carcinomas[J]. Diagn Mol Pathol,2011,20(3):129-137.
[26] ZHONG M, DE ANGELO P, OSBORNE L, et al. Dual-color, break-apart FISH assay on paraffin-embedded tissues as an adjunct to diagnosis of Xp11 translocation renal cell carcinoma and alveolar soft part sarcoma[J]. Am J Surg Pathol,2010,34(6):757-766.
[27] SRIGLEY JR, EBLE JN. Collecting duct carcinoma of kidney[J]. Semin Diagn Pathol,1998,15(1):54-67.
[28] POLASCIK TJ, BOSTWICK DG, CAIRNS P. Molecular genetics and histopathologic features of adult distal nephron tumors[J]. Urology, 2002,60(6):941-966.
[29] SCHOENBERG M, CAIRNS P, BROOKS JD, et al. Freq. uent loss of chromosome arms 8p and 13q in collecting duct carcinoma (CDC) of the kidney[J]. Genes Chromosomes Cancer,1995,12(1):76-80.
[30] DAVIS CJ, JR., MOSTOFI FK, SESTERHENN IA. Renal medullary carcinoma. The seventh sickle cell nephropathy[J]. Am J Surg Pathol,1995,19(1):1-11.
[31] MACLENNAN GT, FARROW GM, BOSTWICK DG. Low-grade collecting duct carcinoma of the kidney:report of 13 cases of low-grade mucinous tubulocystic renal carcinoma of possible collecting duct origin[J]. Urology, 1997,50(5):679-684.
[32] CHEN N, NIE L, GONG J, et al. Gains of chromosomes 7 and 17 in tubulocystic carcinoma of kidney:two cases with fluorescence in situ hybridisation analysis[J]. J Clin Pathol,2014,67(11):1006-1009.
[33] ZHOU M, YANG XJ, LOPEZ JI, et al. Renal tubulocystic carcinoma is closely related to papillary renal cell carcinoma:implications for pathologic classification[J]. Am J Surg Pathol,2009,33(12):1840-1849.
[34] AL-HUSSAIN TO, CHENG L, ZHANG S, et al. Tubulocystic carcinoma of the kidney with poorly differentiated foci:a series of 3 cases with fluorescence in situ hybridization analysis[J]. Hum Pathol,2013,44(7):1406-1411.
[35] KURODA N, TAMURA M, HAMAGUCHI N, et al. Acquired cystic disease-associated renal cell carcinoma with sarcomatoid change and rhabdoid features[J]. Ann Diagn Pathol, 2011,15(6):462-466.
[36] KUIPER RP, SCHEPENS M, THIJSSEN J, et al. Upregulation of the transcription factor TFEB in t(6;11)(p21;q13)-positive renal cell carcinomas due to promoter substitution[J]. Hum Mol Genet,2003,12(14):1661-1669.
[37] ARGANI P, YONESCU R, MORSBERGER L, et al. Molecular confirmation of t(6;11)(p21;q12) renal cell carcinoma in archival paraffin-embedded material using a break-apart TFEB FISH assay expands its clinicopathologic spectrum[J]. Am J Surg Pathol, 2012,36(10):1516-1526.
[38] MERINO MJ, TORRES-CABALA C, PINTO P, et al. The morphologic spectrum of kidney tumors in hereditary leiomyomatosis and renal cell carcinoma (HLRCC) syndrome[J]. Am J Surg Pathol,2007,31(10):1578-1585.
[39] TRUONG LD, SHEN SS. Immunohistochemical diagnosis of renal neoplasms[J]. Arch Pathol Lab Med,2011,135(1):92-109.
[40] DELAHUNT B, CHEVILLE JC, MARTIGNONI G, et al. The international society of urological pathology (ISUP) grading system for renal cell carcinoma and other prognostic parameters[J]. Am J Surg Pathol, 2013,37(10):1490-1504.
[41] TAN PH, CHENG LIANG, RIOUX-LECLERCQ N, et al. Renal tumors diagnostic and prognostic biomarkers[J]. Am J Surg Pathol,2013,37(10):1518-1531.
[42] TRPKOV K, GRIGNON DJ, BONSIB SM, et al. Handling and Staging of Renal Cell Carcinoma The International Society of Urological Pathology Consensus (ISUP) Conference Recommendations[J]. Am J Surg Pathol,2013,37(10):1505-1517.
(编辑何宏灵)
收稿日期:2015-09-11修回日期:2015-11-02
基金项目:国家自然科学基金(No.81272820,81272848)
通讯作者:周桥,博士,教授, E-mail: zhou_qiao@ hotmail.com
作者简介:陈铌(1978-),女(汉族),博士,副教授,研究方向:泌尿系统肿瘤病理.E-mail:chenni1@163.com
中图分类号:R365
文献标志码:A
DOI:10.3969/j.issn.1009-8291.2016.03.002
Advances in the pathologic diagnosis and research of renal cell carcinomas
CHEN Ni, ZHOU Qiao
(Department of Pathology,West China Hospital, Sichuan University, Chengdu 610041, China)
ABSTRACT:Renal cell carcinomas are common malignant tumors of the urinary system. Although current classification of renal cell neoplasms is mainly based on histological features, molecular and cytogenetic characterizations have been increasingly utilized to improve classification, treatment decisions, and prognosis. The 2012 Vancouver conference of the International Society of Urological Pathology (ISUP) has reached consensus in many aspects regarding classification, grading, staging and other prognostic factors, as well as molecular biomarkers of renal cell carcinoma. The consensus will form the basis of the next WHO classification of kidney tumors. This paper briefly reviews the histological diagnostic criteria and advances in research of common renal cell carcinomas, as well as the morphological, immunohistochemical, molecular and cytogenetic characteristics of new entities recognized by the 2012 ISUP consensus.
KEY WORDS:renal cell carcinoma; pathological diagnosis; ISUP consensus; classification

