人前列腺癌组织中热休克蛋白90、糖蛋白96的表达及意义
吕 蔡,刘振湘,白志明
(中南大学湘雅医学院附属海口医院泌尿外科,海南海口 570208)
·基础研究·
人前列腺癌组织中热休克蛋白90、糖蛋白96的表达及意义
吕蔡,刘振湘,白志明
(中南大学湘雅医学院附属海口医院泌尿外科,海南海口570208)
摘要:目的研究人前列腺癌组织中热休克蛋白90(HSP90)、糖蛋白96(gp96)的表达及其临床意义。方法收集我院2010年4月至2014年4月间确诊的前列腺癌组织标本56例(其中新鲜组织16例),同期入院的良性前列腺增生组织标本25例(其中新鲜组织8例)作为对照组。同时收集每例患者完整的临床病理资料。运用实时定量聚合酶链反应(qRT-PCR)和免疫组织化学(IHC)方法分别检测前列腺癌和前列腺增生组织中HSP90、gp96在mRNA和蛋白水平的表达情况及其与患者临床病理资料之间的相关性。结果前列腺癌组织中HSP90、gp96在mRNA水平(P<0.05)及蛋白水平(P<0.01)的表达均明显高于良性前列腺增生组织,且HSP90与gp96表达两者间存在关联性(P<0.01)。结合患者临床病理相关参数分析显示,Gleason评分≥7分的中高危组与7分以下的低危组之间HSP90、gp96的阳性表达率均有显著差异(P<0.05),且gp96的表达还与患者T分期密切相关(P<0.01)。但HSP90、gp96的表达与患者年龄、前列腺体积、血清tPSA值、淋巴结转移均无关。结论前列腺癌组织中HSP90、gp96在mRNA和蛋白水平均明显高表达,对于前列腺癌的发生发展可能起到促进作用,可作为判断前列腺癌恶性程度的指标。
关键词:前列腺癌;热休克蛋白90;糖蛋白96;良性前列腺增生
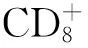
1对象与方法
1.1研究对象收集我院2010年4月至2014年4月间经术后病理确诊的前列腺癌新鲜组织16例和良性前列腺增生(benign prostatic hyperplasia,BPH)新鲜组织8例,新鲜组织均在术后立即经液氮处理后保存于-70 ℃冰箱备用。另在我院病理科收集具备完整临床及病理相关资料的前列腺癌石蜡标本40例和BPH石蜡标本17例,所有石蜡标本均经病理科两位医师分别再次阅片证实病理结果,其中前列腺癌组患者年龄58~84岁,平均(73.2±8.5)岁;BPH组患者年龄56~81岁,平均(71.6±7.4)岁,两组间年龄比较无统计学差异。前列腺癌组患者术前血清总前列腺特异性抗原(total prostate specific antigen,tPSA)值在4.5~100 ng/mL之间,平均(32.6±24.7)ng/mL;患者术前均行了盆腔核磁共振成像(Magnetic Resonance Imaging,MRI)扫描协助临床TNM分期(cTNM)。所有患者术前均未接受放、化疗等相关治疗。1.2实验方法
1.2.1实时定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)取新鲜组织约100 mg匀浆后,按TrIzol试剂盒(TaKaRa,日本)说明提取组织总RNA,并检测RNA浓度及完整性。其中基因组DNA使用无Rnase的Dnase(ABI,美国)去除。取2 μg RNA,按cDNA合成试剂盒 (Invitrogen,美国)操作使用随机引物反转录生成cDNA。待检测基因HSP90、gp96以及内参基因β-actin引物由上海生物工程公司合成,序列分别为:HSP90-F: 5′-CATAACGATGATGAGCAGTACGC-3′;HSP90-R:5′-GACCCATAGGTTCACCTGTGT-3′; gp96-F:5′-CCAGTTTGGTGTCGGTTTCTAT-3′; gp96-R:5′-CTGGGTATCGTTGTTGTGTT-TTG-3′; β-actin-F:5′-GACAGTGTTGTGGGTGTAGGT-3′; β-actin-R:5′-GCTAAGTGTGCTGGGGTCTT-3′。采用SYBRGreen 试剂盒(Roche, 美国)对HSP90和gp96基因mRNA表达水平定量分析,PCR扩增反应条件如下:95 ℃ 30 s,95 ℃ 15 s,58 ℃ 15 s,72 ℃ 15 s,40个循环。每个样本至少做3个重复,数据分析采用2-δδCT(RQ值)。
1.2.2免疫组织化学(immunohistochemistry,IHC)石蜡包埋的前列腺组织切片脱蜡水化,置于EDTA抗原修复液(pH9.0)中10 min进行抗原修复,3%H2O210 min阻断内源性过氧化物酶,分别加入鼠抗人HSP90单克隆抗体(Abcam,工作浓度1∶500)和兔抗人gp96多克隆抗体(Abcam,工作浓度1∶1 000)室温湿盒孵育过夜,按照免疫组化试剂盒(武汉博士德生物公司)说明书操作加入二抗及DAB显色剂。PBS缓冲液代替一抗作为阴性对照。免疫组化结果分别由两位病理医师采用双盲法进行判定。每张切片随机观察计数5个高倍视野,取平均数,根据阳性细胞的百分比打分:≤5%为0分,6%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分;另根据显色的强度打分:不着色为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分,褐色为4分。将两项积分相加:0~2分为阴性,3~5分为弱阳性,6~8分为强阳性,将≥3分归为阳性,便于统计。
1.3统计学方法应用SPSS 17.0统计软件进行统计学分析,各组数据之间比较计量资料采用t检验,计数资料采用χ2检验。以P<0.05为差异有统计学意义。
2结果
2.1前列腺癌组织中HSP90、gp96mRNA的表达qRT-PCR结果显示,前列腺癌新鲜组织中HSP90、gp96mRNA的表达量均明显高于BPH对照组,两组间比较差异有统计学意义(P<0.05,表1)。
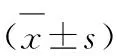

2.2前列腺癌组织中HSP90、gp96蛋白的表达HSP90、gp96强阳性表达在前列腺癌组织中呈棕褐色颗粒,多数弥漫性分布于细胞质内,少数定位于细胞膜。对照组BPH组织中也可见有部分阳性表达(图1)。前列腺癌组织中HSP90、gp96阳性表达率均明显高于BPH组织(P<0.01,表2)。
表2前列腺癌与BPH组织中HSP90、gp96的表达比较
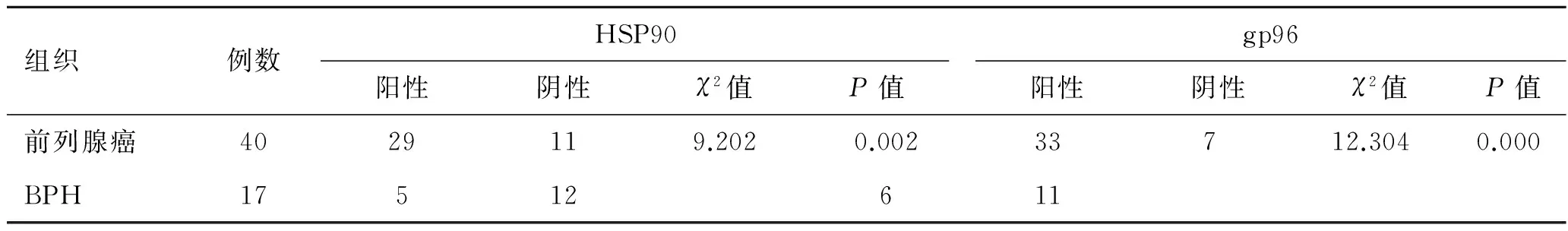
组织例数HSP90阳性阴性χ2值P值gp96阳性阴性χ2值P值前列腺癌4029119.2020.00233712.3040.000BPH17512611
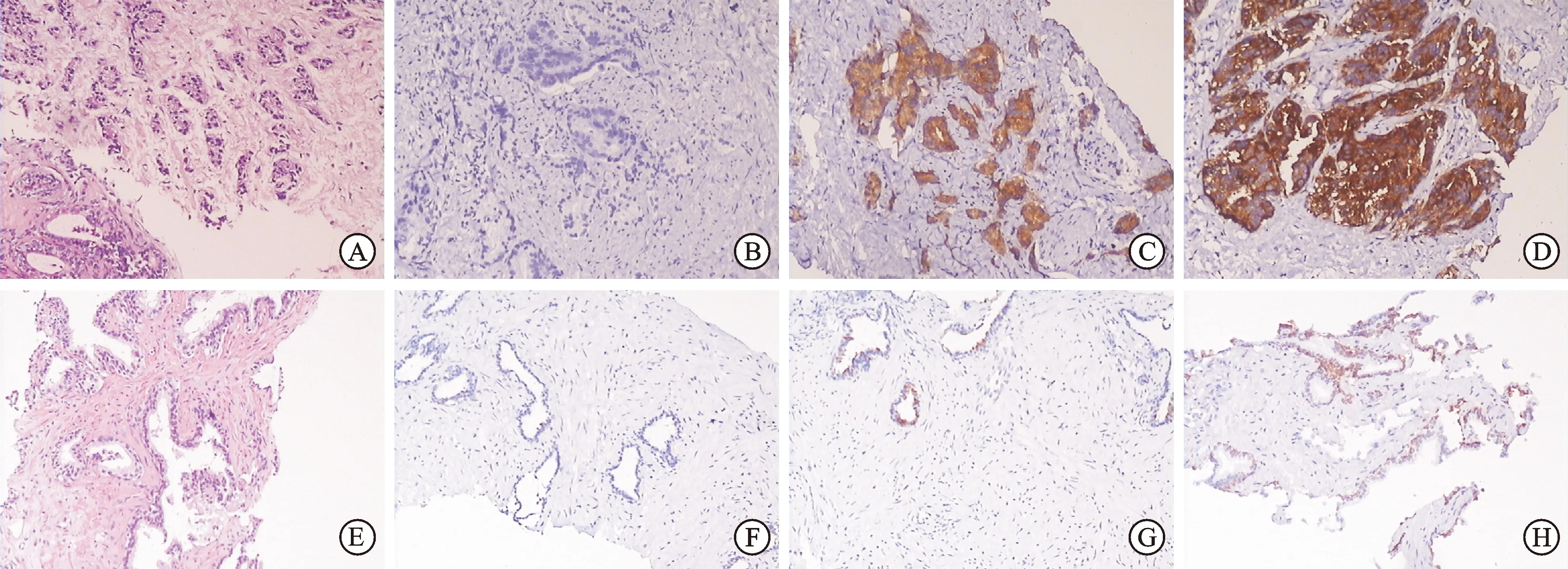
图1HSP90、gp96在前列腺组织中的阳性表达(×200)
A:前列腺癌组织HE染色;B:前列腺癌组织阴性对照;C:前列腺癌组织中HSP90阳性表达;D:前列腺癌组织中gp96阳性表达;E:BPH组织HE染色;F:BPH组织阴性对照;G:BPH组织中HSP90阳性表达;H:BPH组织中gp96阳性表达。
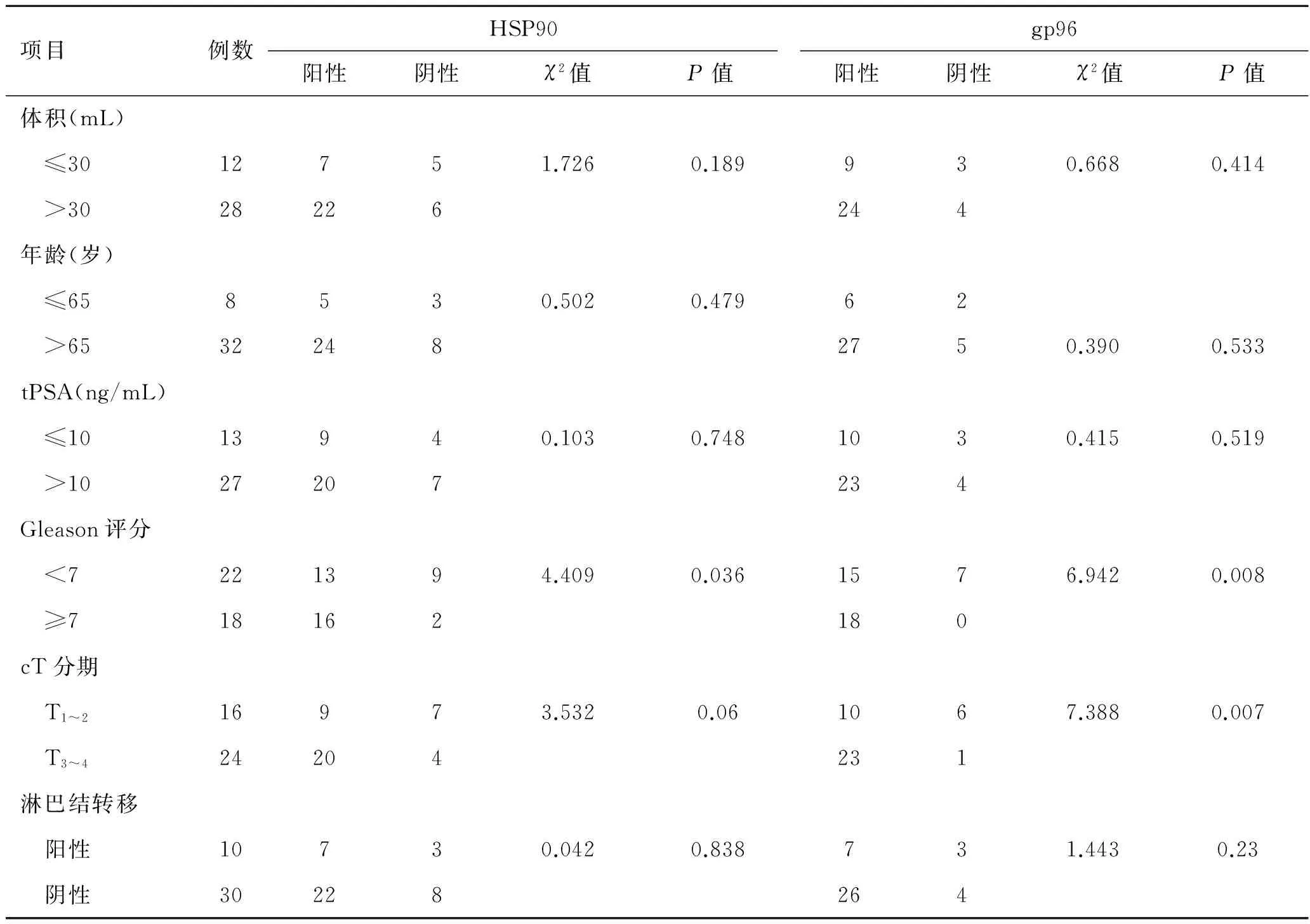
2.3HSP90、gp96的表达与前列腺癌患者临床病理学特征的关系将40例前列腺癌患者分别按照前列腺体积、年龄、血清tPSA值、Gleason评分、T分期以及淋巴结转移等进行分组比较。其中血清tPSA值位于灰区(4~10 ng/mL)的有17例、归为一组,剩余23例归为另一组,便于统计;另外根据术前盆腔MRI扫描结果,如发现有>1 cm的淋巴结判断为伴有淋巴结转移,本组共发现10例患者伴有淋巴结转移表现。结合免疫组化结果显示,HSP90的阳性表达与Gleason评分有关(P=0.036),而gp96的阳性表达与Gleason评分(P=0.008)、cT分期(P=0.007)均显著相关,但两者的表达率均与患者的年龄、前列腺体积、血清TPSA值、淋巴结转移无明显相关性(P>0.05)。详见表3。
表3前列腺癌组织中HSP90、gp96表达与患者临床病理参数间的相关性分析(例)
2.4HSP90、gp96在前列腺癌组织中表达的相关性40例前列腺癌石蜡组织中gp96的阳性率达82.5%(33/40);HSP90的阳性表达率为72.5%(29/40)、两者表达均阳性的占67.5%(27/40),两者间有显著相关性(P=0.004)。详见表4。
表4前列腺癌组织中HSP90、gp96表达的相关性分析
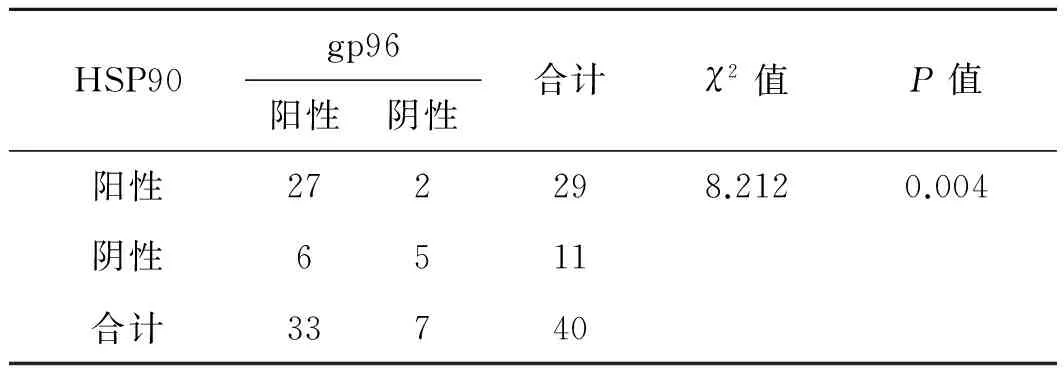
HSP90gp96阳性阴性合计χ2值P值阳性272298.2120.004阴性6511合计33740
3讨论
近年来我国前列腺癌的发病率和检出率呈现明显上升趋势[2]。对于早期前列腺癌患者可选择根治性切除术,但多数患者确诊时可能已处于前列腺癌中晚期,内分泌治疗(maximal androgen blockade,MAB)是其主要治疗手段,大多患者经过平均约24个月的缓解期后会进展至去势抵抗性前列腺癌(castration-resistant prostate cancer,CRPC)阶段。针对CRPC 的治疗目前仍非常棘手。免疫治疗是继传统的手术、放化疗之后治疗肿瘤性疾病的又一重要方法。肿瘤免疫治疗研究的主要目标是寻求肿瘤特异性抗原,进而活化能特异性杀伤肿瘤细胞的T细胞,增强机体抗肿瘤排斥反应。HSP作为分子伴侣参与蛋白质的合成、折叠、积聚、装配、运输和降解,在肿瘤的发展过程中,HSP与肿瘤的生物学行为、细胞凋亡、耐药性及肿瘤免疫反应等相关[3]。
HSP可分为热应激蛋白(heat stress protein,HSP)和糖蛋白(glucose regulated protein,GRP)两大类。HSP90是HSP家族成员中最活跃的分子伴侣之一,作为肿瘤细胞存活过程非常重要的分子伴侣,HSP90在多个癌基因相关通路中发挥重要作用,许多信号转导蛋白的正常功能发挥都依赖于HSP90。研究表明,HSP90在前列腺癌细胞中高表达并可促进肿瘤细胞的侵袭与转移[4]。本研究通过收集临床前列腺癌新鲜组织标本,利用qRT-PCR方法检测发现,与BPH对照组相比,前列腺癌组织中HSP90mRNA的表达量明显升高。进一步通过石蜡组织标本验证了前列腺癌组织中HSP90蛋白的表达水平也显著高于BPH组织,阳性率达72.5%,与文献[5]报道一致。分析HSP90的阳性表达与前列腺癌患者临床病理资料的相关性显示,Gleason评分≥7分的中高危组与7分以下的低危组之间HSP90阳性表达率有显著差异(P=0.036),提示前列腺癌中HSP90的表达与Gleason评分密切相关,而Gleason评分是前列腺癌危险度的重要预测因子,表明HSP90可能作为前列腺癌组织恶性行为改变的早期预测标志物。另外HSP90的阳性表达率两组间按cT分期比较接近统计学差异(P=0.06),可能是本组例数相对较少有一定影响。已有研究报道HSP90抑制剂17-AGG可在体内外实验中抑制激素敏感性和激素难治性前列腺癌细胞系的生长[6]。且第二代HSP90抑制剂NVP-AUY922还可增加CRPC细胞对多西他赛化疗的敏感性[7]。因此,HSP90有望成为前列腺癌诊断和治疗的重要靶点[8]。
gp96,也称为GRP94,属于HSP中的糖调节蛋白,主要存在于细胞内质网中,且在物种间高度保守,是HSP90超家族成员之一。多项研究均发现,gp96的过表达与肿瘤的发生发展密切相关,如gp96通过促进人雌激素受体2(HER2)的二聚化,诱导肿瘤细胞增殖[9];gp96还可通过抑制P53表达从而促进肿瘤细胞生长[10]。研究发现gp96还与上皮性卵巢癌病理进展密切相关[11]。笔者前期的研究也发现gp96在人肾癌细胞中也有高表达[12]。有关gp96在前列腺癌中的研究报道较少[13]。本研究qRT-PCR结果显示,与BPH组织相比,人前列腺癌组织中gp96在mRNA水平(P=0.021)的表达明显升高。进一步通过IHC结果显示,前列腺癌组织中gp96蛋白的表达水平也显著高于BPH组织,阳性率达82.5%。前列腺癌组织中gp96的高表达可能与肿瘤内的多种基因变异,如癌基因突变、抑癌基因失活以及DNA损伤等内环境紊乱有关,这些因素均可能诱导gp96在肿瘤中过表达。分析gp96的阳性表达与前列腺癌患者临床病理资料的相关性显示,Gleason评分≥7分的中高危组与7分以下的低危组之间(P=0.008)、临床分期cT1~2与cT3~4之间(P=0.007)gp96的阳性表达率均有显著性差异,gp96在中高危组和低危组的阳性表达率分别为100%和68.2%;cT3~4组中gp96的阳性表达率(95.8%)也明显高于cT1~2组(62.5%)。提示前列腺癌组织中gp96的表达水平有望作为组织分化恶性程度以及是否进展的预测指标。
本研究结果还显示前列腺癌患者中HSP90和gp96均有阳性表达的占67.5%(27/40),且两者表达间具有显著相关性(P=0.004),提示HSP90和gp96在前列腺癌的发生发展中可能具有协同作用。有文献报道,作为分子伴侣的HSP家族,在肿瘤抗原的加工转运过程中存在接续呈递现象[14],即肿瘤抗原肽可能分别经由HSP70、HSP90以及gp96的“链条式”呈递过程后再与MHC-Ⅰ类分子结合,进而活化效应T细胞,产生针对肿瘤的特异性细胞免疫。目前针对前列腺癌中HSP-抗原肽呈递链的机制研究报道较少,本研究结果为进一步探讨这一机制以及HSP90和gp96在前列腺癌免疫治疗中的作用提供了一定的理论基础。
综合上述研究结果,我们认为不论在mRNA水平还是在蛋白水平,前列腺癌组织中HSP90和gp96的高表达对于前列腺癌的发生发展均起到促进作用,两者的阳性表达可作为判断前列腺癌恶性程度的指标,有望成为未来前列腺癌免疫治疗的新靶点。本研究不足之处:①因患者术后生存期的随访资料不完善,未能探讨HSP90和gp96的阳性表达与前列腺癌患者预后的相关性;②本研究结果中HSP90和gp96的表达与患者的年龄、前列腺体积、血清tPSA值以及区域淋巴结转移之间均无相关性(P>0.05),可能与本研究入组病例数相对较少有关。有待进一步扩大临床样本量并结合体内外相关实验深入探讨HSP90和gp96在前列腺癌发生发展中的作用机制。
参考文献:
[1] 吕蔡, 张杰. 热休克蛋白gp96与肿瘤免疫治疗[J]. 国际肿瘤学杂志,2006,33(1):1-4.
[2] 李鸣, 张思维, 马建辉, 等. 中国部分市县前列腺癌发病趋势比较研究[J]. 中华泌尿外科杂志,2009,30(6):368-370.
[3] NAHLEH Z, TFAYLI A, NAJM A, et al. Heat shock proteins in cancer:targeting the 'chaperones'[J]. Future Med Chem.2012,4(7):927-935.
[4] 刘学光, 郭哗, 阎作勤, 等. 细胞表面热休克蛋白90在人前列腺癌细胞中的表达及其对侵袭能力的影响[J]. 中华肿瘤杂志,2011,33(5):340-344.
[5] 庞自力, 骆雨, 肖传国, 等. 前列腺癌组织中热休克蛋白90α的表达及意义[J]. 中华实验外科杂志,2008,25(8):1045-1046.
[6] TSUTSUMI S, SCROGGINS B, KOGA F, et al. A Small molecule cell-impermeant Hsp90 antagonist inhibits tumor cell motility and invasion[J]. Oncogene,2008,27(17):2478-2487.
[7] KU S, LASORSA E, ADELAIYE R, et al. Inhibition of Hsp90 augments docetaxel therapy in castrate resistant prostate cancer[J]. PLoS One,2014,9(7):e103680.
[8] SUN HW, WANG RF, YAN P, et al. Radioactive iodine labeling of monoclonal antibody against Hsp90α and its use in diagnostic imaging in prostate cancer xenograft model[J]. Eur Rev Med Pharmacol Sci,2015,19(5):835-843.
[9] LI X, SUN L, HOU J, et al. Cell membrane gp96 facilitates HER2 dimerization and serves as a novel target in breast cancer[J]. Int J Cancer,2015,137(3):512-524.
[10] WU B, CHU X, FENG C, et al. Heat shock protein gp96 decreases p53 stability by regulating Mdm2 E3 ligase activity in liver cancer[J]. Cancer Lett,2015,359(2):325-334.
[11] BLOCK MS, MAURER MJ, GOERGEN K, et al. Plasma immune analytes in patients with epithelial ovarian cancer[J]. Cytokine,2015,73(1):108-113.
[12] 吕蔡, 张杰, 赵薇, 等. 热休克蛋白糖蛋白96的量子点荧光标记检测及意义[J]. 中华实验外科杂志,2006,23(12):1578.
[13] YEDAVELLI SP, GUO L, DAOU ME, et al. Preventive and therapeutic effect of tumor derived heat shock protein, gp96, in an experimental prostate cancermodel[J]. Int J Mol Med,1999,4(3):243-248.
[14] COLACO C. Autologous heat-shock protein vaccines[J]. Hum Vaccin Immunother,2013,9(2):275-276.
(编辑何宏灵)
收稿日期:2015-09-18修回日期:2015-11-10
基金项目:海南省国际科技合作项目(No:GJXM201108),海南省卫生厅科研课题(No:琼卫2011-56)
通讯作者:白志明,教授.E-mail:hkbzm@aliyun.com
作者简介:吕蔡(1979-),男(汉族),硕士,副主任医师,泌尿系肿瘤基础与临床研究.E-mail:lvcai815@163.com
中图分类号:R737.25
文献标志码:A
DOI:10.3969/j.issn.1009-8291.2016.03.020
The significance of heat shock protein 90 and glycoprotein 96 in human prostate cancer
LÜ Cai, LIU Zhen-xiang, BAI Zhi-ming
(Department of Urology, Affiliated Haikou Hospital of Xiangya Medical School of Central South University, Haikou 570208, China)
ABSTRACT:ObjectiveTo explore the expression and significance of heat shock protein 90 (HSP90) and glycoprotein 96 (gp96) in human prostate cancer. MethodsA total of 56 prostate cancer cases and 25 benign prostate hyperplasia cases were collected during Apr. 2010 and Apr. 2014. Clinical and pathological data of every case were gathered. The expression of HSP90 and gp96 including mRNA and protein were detected by quantitative real-time polymerase chain reaction (qRT-PCR) and immunohistochemistry (IHC). The correlation was analyzed between clinical and pathological data and the expression of HSP90 and gp96. ResultsThe expressions of HSP90 and gp96 in prostate cancer had statistical significance, including mRNA (P<0.05) and protein (P<0.01) compared with those in benign prostate hyperplasia. There was obvious relevance between HSP90 and gp96 in prostate cancer. The positive rate of HSP90 and gp96 in the group of Gleason≥7 had statistical significance (P<0.05) compared with that in the group of Gleason<7, and gp96 had significant correlation with T stages (P<0.01). There was no relation between the positive rate of HSP90 and gp96 and other data, such as age, prostate volume, total prostate specific antigen and lymphatic metastasis. ConclusionsThe elevated expression of HSP90 and gp96 in prostate cancer may facilitate the occurrence and development of prostate cancer; therefore, they can serve as indexes to estimate the malignancy of prostate cancer.
KEY WORDS:prostate cancer; heat shock protein 90; glycoprotein 96; benign prostate hyperplasia

