miR-19b-1在肾癌中的表达及临床意义的研究
胡 佳,金 露,何 韬,史本涛,来永庆,倪梁朝
(1.广州医科大学,广东广州 510182;2. 北京大学深圳医院泌尿外科,广东深圳 518036)
·基础研究·
miR-19b-1在肾癌中的表达及临床意义的研究
胡佳1,2,金露2,何韬1,2,史本涛2,来永庆2,倪梁朝2
(1.广州医科大学,广东广州510182;2. 北京大学深圳医院泌尿外科,广东深圳518036)
摘要:目的检测肾癌细胞(ACHN、786O、769P)与人胚肾细胞(HEK-293T)、肾癌及对应癌旁组织的miR-19b-1的表达水平,并分析其与临床病理特征之间的关系。 方法利用qPCR技术检测miR-19b-1在肾癌细胞与人胚肾细胞、肾癌组织与配对组织中的表达量,运用统计学方法分析其与临床病理之间有无相关性。结果miR-19b-1在肾癌细胞中的表达量比正常细胞高,在肾癌组织中的表达量是对应癌旁组织的2.2倍,且其差异具有统计学意义(P<0.05),与患者的年龄、性别及病理分期无关(P>0.05)。 结论肾癌组织及肾癌细胞中miR-19b-1表达上调,提示肾癌的发生可能与miR-19b-1上调有关。
关键词:肾癌;microRNA;microRNA-19b-1;表达;病理特征
肾癌(renal carcinoma)亦称肾细胞癌(renal cell carcinoma, RCC)、肾腺癌,是泌尿系统常见的恶性肿瘤,其发病率仅次于膀胱癌[1]。肾癌有10余种病理类型,包括透明细胞癌、乳头状状癌和嫌色细胞癌等[2]。肾癌的早期症状不典型,只有约10%的患者具有典型肾癌三联征,即疼痛、血尿、肿块[3]。肾癌的发病原因至今不清,其可能的危险因素包括:遗传、吸烟、肥胖、石棉、高血压等[4]。
微小RNAs(microRNAs, miRNAs)是非编码RNA(non-coding)家族的新成员,是一类约有22~24个核苷酸长度的小分子,约一半的蛋白质编码基因受其调节[5]。主要在转录后水平发挥其调控作用,通过对mRNA降解或蛋白质翻译抑制来调控靶基因。据报道,miR-19b-1是miR中的重要组成部分,参与人体多种病理生理调节[6],在肿瘤的发生、侵袭、转移及肿瘤新生血管的形成中扮演了重要的角色[6]。本实验选取30例手术切除的肾癌标本及相应癌旁组织,通过qPCR技术测算miR-19b-1在肿瘤组织的表达量,分析其在肾癌发病机制中的所起的作用。对miR-19b-1在肾癌发病机制中的研究有望为肾癌的治疗提供一种有效的新策略[7]。
1资料与方法
1.1标本及临床资料实验标本30对(已获医院伦理委员会批准,并获得患者知情同意),均来自北京大学深圳医院2013年3月至2014年11月手术切除的肾癌及癌旁组织(与病灶间隔5 cm以上),切除的组织在RNA保护液中储存,约24 h后置入-80 ℃液氮中保存。每例都有完整的病理学资料(表1)。其中男20例,女10例,平均年龄为52岁。肾癌的组织学分型采用国际通行的2004年WHO的分类标准,临床分型参考国际抗癌协会TNM分类标准。
1.2细胞培养将肾癌细胞(ACHN、786O、769P)和人胚肾细胞(HEK-293T)置于培养皿内,加入全培养基(含90%DMEM培养基、1%谷氨酰胺、1%抗生素、10%胎牛血清)4 mL,在适宜的温度、适宜的CO2浓度及pH等环境中培养。
1.3主要试剂和仪器RNA提取试剂Trizol(Invitrogen,USA)、miRNA专用反转录试剂盒 miScript Reverse Transcription Kit (Qiagen,Germany)、普通RT-PCR仪(BIQ-RAD,USA)、miScriptSYBR Green PCR Kit(Qiagen,germany)、ABI PRISM7000荧光定量PCR仪(Applied Biosystems,USA)、NanoDrop2000c紫外线分光光度仪。相关普通试剂及实验常用设备由北京大学深圳医院广东省男性生殖与遗传重点实验室提供。
1.4miRNA前期测序及筛选华大基因研究所(Illumina Hiseq2000测序仪)进行前期测序,筛选出在肾癌及对应癌旁组织的表达具有差异性的microRNA。miR-19b-1 作为研究对象被选取。
1.5总RNA的提取根据Trizol说明书的指导,将30对标本在-80 ℃液氮中研磨,总RNA由Trizol试剂提取,通过紫外线分光光度仪测量RNA的质量及浓度。总RNA反转录为cDNA:参考miScript Reverse Transcription Kit说明书要求,逆转录在普通PCR仪上进行,20 μL的反应体系中加入1 μg RNA,将反应体系温度设置为37 ℃ 60 min, 95 ℃ 5 min,然后稀释10倍,合成后的产物在-40 ℃冰箱保存备用。
1.6荧光定量qPCR检测miR-19b-1根据miScript SYBR Green PCR Kit试剂说明书,模板是反转录合成的cDNA,qRT-PCR反应在LC480荧光定量PCR仪上进行。反应体系的总体积为10 μL,其中QuantiTect SYBR Green PCR Master Mix有 5 μL,miR-19b-1的上游引物(5'-AGTTTTGCAGGTTTGCATCCAGC-3')及下游通用引物miScript Universal primer(Qiagen公司赠送)各有0.4 μL,RNase-free water有3.2 μL。内参基因U6snRNA的上游引物为5'-CTCGCTTCGGCAGCACA-3',下游引物为5'-ACGCTTCACGAATTTGCGT-3'。反应条件:95 ℃ 2 min,94 ℃ 10 s,55 ℃ 30 s,70 ℃ 30 s,共进行45个循环。
1.7数据处理及统计学分析qPCR仪所得数据用U6作为内参处理后,再运用△△CT法进行分析,△CT=CTmiR-19b-1-CTU6,△△CT=△CTRCC-△CTN。最后将得到的△CT通过2-△CT计算还原为miR-19b-1相对表达量,经对数转换后得到正态分布图型。miR-19b-1在癌组织中的表达量是正常组织表达量倍数由2-△△CT计算得出。经统计学软件分析,比较miR-19b-1在肾癌及癌旁组织中表达量可用配对t检验,四格法χ2检验用于比较miR-19b-1在肾癌及癌旁组织中表达量与临床病理之间的关系,P>0.05时认为无统计学意义。
2结果
2.1miR-19b-1在肾癌细胞(786O、ACHN)及肾癌组织中表达上调通过qPCR检测miR-19b-1在细胞系中的表达水平,结果miR-19b-1在肾癌细胞(786O、769P、ACHN)中表达水平显著高于正常人胚肾细胞(HEK-293T)(图1 A)。由2-ΔCT计算miR-19b-1在两者中相对表达量(图1 B)。由2-ΔΔCT计算miR-19b-1在癌组织相对癌旁组织表达倍数的平均值为11倍。miR-19b-1的表达量在癌组织及癌旁组织中比值进行Log2(C/N)转换(图2),其中表达下调有3例(10%),上调27例(90%)。

图1 miR-19b-1在不同细胞及组织中的表达情况
A:miR-19b-1在肾癌细胞(ACHN、769P、786O)及正常胚肾细胞(293T)中的相对表达量。与正常胚肾细胞相比,miR-19b-1在肾癌细胞中高表达(*P<0.05);B:miR-19b-1在癌旁及肾癌组织中miR-19b-1的相对表达量。与癌旁组织相比,miR-19b-1在肾癌组织中高表达(**P<0.05)。
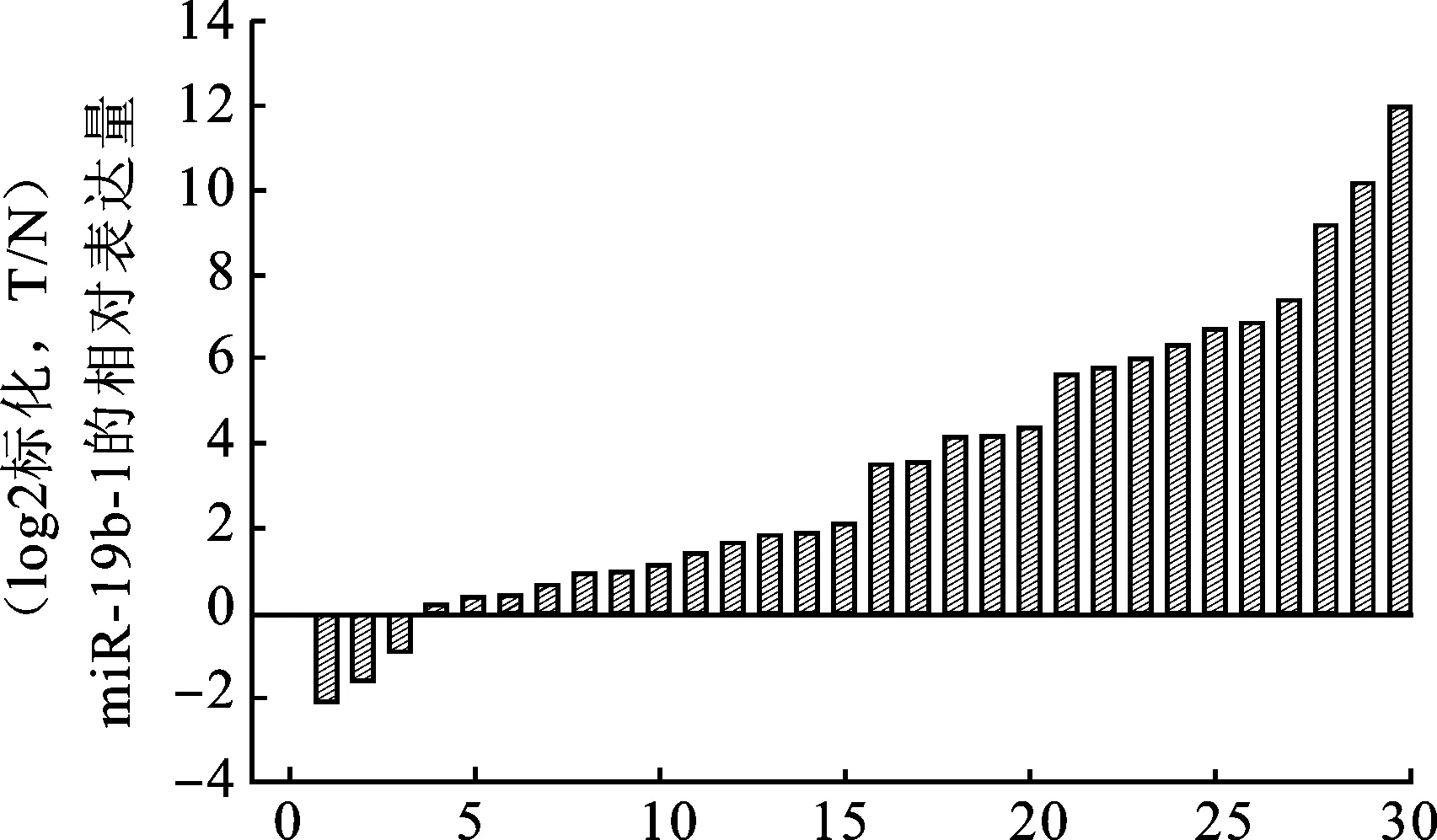
图2 30对肾癌组织中miR-19b-1的相对表达量
与正常组织相比,miR-19b-1在肾癌组织中表达明显上调(27/30,P<0.05)。
2.2miR-19b-1在肾癌组织中的表达水平与患者年龄、性别、病理分期及组织学类型之间无相关性样本的高表达组与低表达组的分类以miR-19b-1的相对表达量的平均值2.20为界分为高表达组、低表达组。两组间的年龄、性别、肿瘤病理分期差异均无显著性统计学意义(P>0.05,表1)。
表1miR-19b-1在肾癌中的表达与临床病理(例)

3讨论
肾癌是起源于肾实质泌尿小管上皮的恶性肿瘤,约占成人恶性肿瘤的2%~3%,我国目前的发病率在6.0/10万左右[8]。其发病原因不明,流行病学调查显示部分肾癌的发病与吸烟、肥胖、高血压以及一些工业物质如黄曲霉素、放射线等有一定关系,此外还可能有遗传因素[9]。肾癌的临床症状不典型,许多患者发现后已进入中晚期,预后较差[10]。肾癌标记物的研究可提高患者的临床诊断率,对患者的预后及治疗至关重要[11]。现已知肾癌的发生与抑癌基因的失活及原癌基因的激活密切相关。MiR-19b-1是一种非编码RNA基因,在肾癌中的表达失控很常见。对靶基因的沉默取决于miR与靶基因的互补程度,若miR与靶基因完全互补时,则会导致靶mRNA的降解;若互补程度较低时,则会导致mRNA的翻译抑制[12]。人们在线虫中发现了首个mircoRNA-lin-4,并证实其对线虫幼虫的发育具有调控作用,经过多年研究证实,蛋白质编码基因约50%受mircoRNA的调控,提示在人体内可能存在另一种全新的调控模式[13]。因此对mircoRNA在肾癌调控中的研究有助于揭示肾癌的发病机制。
通过前期测序,选择在肾癌及癌旁组织中有表达差异的miR-19b-1作为实验对象,研究其在肾癌和癌旁组织中表达的差异性,并对其与临床病理之间的相关性做进一步研究。结果证实,miR-19b-1在肾癌中的表达水平明显高于癌旁组织,约为2.2倍。据此推测miR-19b-1在组织中高表达可能会导致肾癌的发生,其在肾癌的诊断及预后方面可能具有重大的临床价值。另外,miR-19b-1在肾癌组织中的高表达与患者年龄、性别及病理分期无关(P>0.05)。
大量文献报道了miR-19b-1与其他疾病的发生也具有密切关系,如乳腺癌[14]、前列腺癌[15]、肺癌[16]等。以肺癌为例,miR-19b-1促进了肺泡上皮间质转化(EMT)进而形成了肺癌细胞(A549)、还能减少细胞之间的粘附,这导致肺癌细胞更容易转移[17]。
MiR-19b-1在肾癌组织中高表达,或许可以通过某种抑制剂来抑制其在肾癌组织中的表达,从而为肾癌的治疗提供一种新的方法。
参考文献:
[1] FENG H, ZHANG W, LI J, et al. Different patterns in the prognostic value of age for bladder cancer-specific survival depending on tumor stages[J]. Am J Cancer Res, 2015, 5(6):2090-2097.
[2] ROTHERMUNDT C, BAILEY A, CERBONE L, et al. Algorithms in the first-line treatment of metastatic clear cell renal cell carcinoma-analysis using diagnostic nodes[J]. Oncologist, 2013,7(8):323-331.
[3] JUNUZOVIC D, KERLETA AI, The frequence of renal cell carcinoma in population of patients with kidney tumors[J]. Med Arch,2013,67(1):27-30.
[4] GUAN R, XU Y, LEI H, et al, A novel protein is lower expressed in renal cell carcinoma [J]. Int J Mol Sci, 2014,15(5):7398-7408.
[5] REDDY K B, MicroRNA (miRNA) in cancer[J]. Cancer Cell Int, 2015,15(3):38-45.
[6] OHIRA T, NAOHIRO S, NAKAYAMA Y, et al. miR-19b regulates hTERT mRNA expression through targeting PITX1 mRNA in melanoma cells[J]. Sci Rep, 2015, 5(6): 8201-8209.
[7] FAN Y, YIN S, HAO Y, et al. miR-19b promotes tumor growth and metastasis via targeting TP53[J]. RNA,2014,20(6):765-772.
[8] SONG W, LI L, HE D, et al. Infiltrating neutrophils promote renal cell carcinoma (RCC) proliferation via modulating androgen receptor (AR)->c-Myc signals[J]. Cancer Lett, 2015,25(3):332-441.
[9] GUO H, GERMAN P, BAI S, et al. The PI3K/AKT Pathway and Renal Cell Carcinoma [J]. J Genet Genomics, 2015,42(7):343-353.
[10] LI Y, WU X, GAO H, et al. PIWI-interacting RNAs are dysregulated in renal cell carcinoma and associated with tumor metastasis and cancer specific survival [J]. Mol Med, 2015,7(9):201-211.
[11] ROMERO-LAORDEN N, DOGER B, HERNANDEZ M, et al. Predictive biomarker candidates to delineate efficacy of antiangiogenic treatment in renal cell carcinoma[J]. Clin Transl Oncol, 2015,23(7):767-786.
[12] LI J, HUANG J H, QU QH, et al. Evaluating the microRNA-target gene regulatory network in renal cell carcinomas, identification for potential biomarkers and critical pathways[J]. Int J Clin Exp Med, 2015,8(5):7209-7219.
[13] SELLITTI D FDOI S Q. MicroRNAs in Renal Cell Carcinoma[J]. Microrna, 2015,9(6):453-463.
[14] LI X, XIE W, XIE C, et al. Curcumin modulates miR-19/PTEN/AKT/p53 axis to suppress bisphenol A-induced MCF-7 breast cancer cell proliferation[J]. Phytother Res, 2014, 28(10):1553-1560.
[15] TIAN L, FANG Y X, XUE JL, et al. Four microRNAs promote prostate cell proliferation with regulation of PTEN and its downstream signals in vitro[J]. PLoS One, 2013,8(9):758-769.
[16] LIN J, LIN H, WANG B, et al. miR-130a regulates macrophage polarization and is associated with non-small cell lung cancer[J]. Oncol Repor,2015,7(2):1226-1236.
[17] LI J, YANG S, YAN W, et al. MicroRNA-19 triggers epithelial-mesenchymal transition of lung cancer cells accompanied by growth inhibition[J]. Lab Invest,2015,95(9): 1056-1070.
(编辑王玮)
收稿日期:2015-08-22修回日期:2015-09-29
基金项目:国家自然科学基金(No.81101922);广东省自然科学基金(No.S2012010008365)
通讯作者:倪梁朝,主任医师. E-mail:13609618222@163.com
作者简介:胡佳(1990-),男(汉族),硕士在读.研究方向:泌尿男生殖系肿瘤. E-mail: 1150416827@qq.com
中图分类号:R737.11
文献标志码:A
DOI:10.3969/j.issn.1009-8291.2016.03.019
Expression and clinical significance of miR-19b-1 in renal cell cancer
HU Jia1,2, JIN Lu2, HE Tao1,2, SHI Ben-tao2, LAI Yong-qing2, NI Liang-chao2
(1. Guangzhou Medical University, Guangzhou 510182; 2. Department of Urology, Shenzhen Hospital of Peking University, Shenzhen 518036, China)
ABSTRACT:Objective To detect the expression of miR-19b-1 in renal cell carcinoma (RCC), paired tissues, kidney cancer cells (ACHN/786O/769P) and human embryo kidney cell line 293T (HEK-293T), and to analyze its relation with clinicopathological features. MethodsThe expression level of miR-19b-1 in renal carcinoma cells, normal kidney cells, renal tumor and corresponding adjacent tissues was detected with quantitative real-time PCR (qRT-PCR), and the correlation with clinicopathological features was analyzed.ResultsThe expression of miR-19b-1 in renal tumor cells was significantly higher than in normal renal cells. In RCC tissues, it was approximately 2.2 times than in paired healthy tissues. The difference was statistically significant (P<0.05). It was not related with the patient’s age, gender and pathological stage (P>0.05).ConclusionThe miR-19b-1 was up-regulated in renal cancer tissues and kidney tumor cells, which indicated that it might be related with the occurrence of renal cell carcinoma.
KEY WORDS:renal cell carcinoma; microRNA; microRNA-19b-1; expression level; clinicopathological features

