ADAM12基因表达沉默对CD133阳性胶质瘤细胞自我更新能力的影响☆
刘波杨学军张辰于圣平林雨海龙周星辰李帅李涛王伟程铖杨亦寒
ADAM12基因表达沉默对CD133阳性胶质瘤细胞自我更新能力的影响☆
刘波*杨学军*张辰*于圣平*林雨*海龙*周星辰*李帅*李涛*王伟*程铖*杨亦寒*
目的研究解整合素-金属蛋白酶12(a disintegrin and metalloprotease 12,ADAM12)基因表达沉默抑制CD133阳性(CD133+)胶质瘤细胞的自我更新能力。方法 采用shRNA重组慢病毒转染技术沉默胶质瘤U87细胞系ADAM12基因表达分为ADAM12基因表达干扰序列组(shRNA-ADAM12)、阴性对照组(shRNA-NC)及空白对照(shRNA-C)组。通过Western blotting以及Real-time PCR验证各组细胞ADAM12表达情况;采用悬浮培养得到胶质瘤细胞球以富集CD133+的胶质瘤细胞;并通过免疫荧光染色技术检测ADAM12与CD133在细胞球与贴壁细胞的表达情况;通过神经肿瘤球形成实验检测三组细胞的自我更新能力;利用Western blotting分别检测三组细胞成球后未分化或分化相关蛋白CD133、GFAP及TUBB3以及Notch通路靶基因Hes1的蛋白表达情况。结果慢病毒转染技术可显著下调U87胶质瘤细胞ADAM12的mRNA及蛋白的表达量,shRNA-ADAM12组与shRNA-NC组较shRNA-C组mRNA的相对表达量为0.22±0.03与0.98±0.06(F=425.37,P<0.01);三组ADAM12蛋白的相对表达量分别为28.72%±2.36%、69.21%±3.92%及69.04%±3.57%(F=145.42,P<0.01);免疫荧光染色显示细胞球中ADAM12与CD133表达量明显高于普通细胞;神经肿瘤球形成实验结果显示,三组成球数分别为45.5±2.3、104.2±5.8以及109.6±6.2,与shRNA-NC组及shRNA-C组相比,shRNA-ADAM12组的成球能力明显降低,差异具有统计学意义(F=147.03,P<0.01)。shRNA-ADAM12组与shRNA-C组相比,GFAP与TUBB3蛋白表达量分别上调约166%与146%,CD133与HES1的蛋白表达量分别下调了54%与50%,差异均具有统计学意义(P<0.01)。结论 ADAM12基因表达沉默可能通过抑制Notch通路活性降低CD133+胶质瘤细胞的自我更新能力。
解整合素-金属蛋白酶12 CD133+胶质瘤细胞 自我更新
【Key words】A disintegrin and metalloprotease 12 CD133 positive glioma cells Self-renewal
胶质瘤干细胞在恶性胶质瘤的发生、发展过程中发挥了重要作用[1,2]。研究表明,在干细胞表型的维持中,Notch通路活化的作用最为显著[3]。在恶性胶质瘤中,Notch通路活性与胶质瘤干细胞表型的维持也已被证明[4]。解整合素-金属蛋白酶 12(a disintegrin and metalloprotease 12,ADAM12)是一类具有金属蛋白酶作用的跨膜蛋白,具有蛋白酶以及解聚素等多种作用,胚胎实验中已证明ADAM12对于Notch通路配体DLL1的胞外域具有蛋白水解作用,同时ADAM12的表达量与胶质瘤细胞Notch通路活性呈正相关[5]。那么,ADAM12是否可以通过水解DLL1胞外域以解除其对于自身受体的顺式抑制实现对Notch通路活性的调控,最终影响胶质瘤干细胞的表型?本研究通过慢病毒转染技术沉默ADAM12基因的表达,探究其对于胶质瘤干细胞自我更新能力的影响以及相关机制,以证实其在胶质瘤干细胞表型维持中的作用。
1 材料与方法
1.1研究对象 人胶质瘤细胞系U87MG购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所细胞库。慢病毒购自上海吉凯基因化学技术有限公司,shRNA-ADAM12干扰序列为5'-GCCACAAUUUCGGGAUGAATT-3',shRNA-NC无义序列为 5'-TTCTCCGAACGTGTCACGT-3'。ADAM12抗体、GFAP抗体、TUBB3抗体以及HES1抗体均为美国Abcam公司产品。CD133抗体购自美国santa cruz公司。内参GAPDH、辣根过氧化物酶标记的山羊抗小鼠IgG以及山羊抗兔IgG均购自北京中杉金桥生物技术有限公司。逆转录聚合酶链反应所需引物购自苏州金唯智生物科技有限公司。RT-PCR逆转录试剂盒为美国Promega公司产品。细胞培养瓶及培养皿均购自美国Corning公司。
1.2细胞培养与慢病毒转染 胶质瘤U87细胞系采用含10%胎牛血清的完全培养基(由gibco公司的DMEM basic培养基与Hyclone胎牛血清配置)置于5%CO2恒温培养箱进行培养。神经肿瘤球形成实验所需干细胞培养基由gibco公司的DMEM/ F12(1:1)培养基、EGF(20μg/L)、bFGF(20μg/L)以及B-27(1:50)配置。将细胞用胰酶消化重悬后种于六孔板中,待细胞汇合约70%进行病毒转染,shRNA-ADAM12组 、shRNA-NC组 以及 shRNA-C),转染48h后使用嘌呤霉素进行抗性筛选,存活细胞即为稳转细胞系,进行传代培养为后续实验备用。
1.3 RT-PCR检测ADAM12基因的mRNA表达水平 提取不同处理组细胞系的总RNA,将GAPDH作为内参对照,对总RNA进行逆转录及实时聚合酶链反应扩增。引物序列:ADAM12:Forward 5'-GCA CCT CCC TTC TGT GAC AAG TTT-3';Reverse 5'-CTT GGT GTG GAT ATT GTG GAG CAG-3'。GAPDH:Forward 5'-AAT CCC ATC ACC ATC TTC CAG GAG-3';Reverse 5'-GCA TTGCTG ATG ATC TTG AGG CTG-3'。采用2-△△CT计算ADAM12 mRNA的相对表达量。每组设置3个平行实验孔,实验条件不变重复3次。
1.4 Western blotting检 测 ADAM12、HES1、GFAP、TUBB3以及CD133的表达 提取不同处理组细胞总蛋白,储存于-80℃以备后续实验。取不同处理组总蛋白样品进行SDS-PAGE凝胶电泳,冰浴条件下以80V电压转至醋酸纤维素膜(PVDF膜),时间为80min。使用PBST缓冲液洗膜后,脱脂奶粉封闭1.5h。分别加入对应抗体后4℃孵育过夜,抗体稀释比为:小鼠抗人ADAM12抗体、兔抗人HES1抗体、小鼠抗人GFAP以及兔抗人TUBB3均为1:1000,兔抗人CD133抗体为1:200。次日室温复温1h,清洗后加入对应二抗室温孵育1h。使用凝胶成像分析系统采集条带结果,使用Image J软件对条带进行量化分析。
1.5神经肿瘤球形成实验检测不同处理组细胞的自我更新能力 3组细胞分别加入胰酶消化后重悬,1000r/min,离心5min;弃上清后加入无血清培养基重悬,再次以1000r/min,离心5min,弃上清液;使用无血清培养基制成无血清单细胞悬液,细胞计数板计数后,将1000个细胞接种于培养瓶中,加入干细胞培养基3mL,封口置于5%CO2恒温培养箱进行培养,第3天半量换液;第7天对细胞球进行计数。
1.6免疫荧光染色检测普通细胞及细胞球ADAM12与CD133的表达情况 将U87细胞接种于盖玻片,待细胞伸展后4%多聚甲醛固定10min,PBS缓冲液冲洗后加5%山羊血清室温封闭1h,弃血清后加入小鼠抗人ADAM12抗体(1:100)以及兔抗人CD133抗体(1:50)4℃过夜。次日PBS缓冲液冲洗后加入Alexa Fluor 594标记的山羊抗兔、Alexa Fluor 488标记的山羊抗小鼠荧光二抗,避光条件下37℃恒温箱内孵育1h,PBS缓冲液冲洗后加入DAPI溶剂染核10min。抗淬灭封片剂封片,避光条件下荧光显微镜观察及采集图像。细胞球免疫荧光染色时,将细胞球接种于使用多聚赖氨酸预先包被的盖玻片上,其余步骤同普通细胞。
1.7计算方法 研究中涉及蛋白与mRNA表达抑制率=(shRNA-C组平均值-shRNA-ADAM12组平均值)/shRNA-C组平均值×100%。
1.8统计学方法 所获数据应用SPSS19.0分析,计量资料采用x±s,计量资料之间的比较分析采用单因素方差分析,两两比较采用SNK检验,检测水准α=0.05。
2 结果
2.1 ADAM12在不同处理组细胞系中的表达情况RT-PCR检测不同处理组细胞系中ADAM12 mRNA表达情况,shRNA-ADAM12组与 shRNA-NC组相对于shRNA-C组的2-△△CT值分别为0.22±0.03与0.98±0.06,结果表明shRNA-ADAM12组的ADAM12 mRNA表达量明显降低(F=425.37,P<0.01)(图1A)。Western blotting检测不同处理组细胞系中ADAM12蛋白表达情况,采用GAPDH作为内参对照,shRNA-ADAM12组、shRNA-NC组及shRNA-C组的ADAM12相对表达量分别为:28.72%±2.36%、69.21%±3.92%及69.04%±3.57%,总体比较差异具有统计学意义(F=145.42,P<0.01);与shRNA-NC组及shRNA-C组相比,shRNA-ADAM12组的ADAM12表达量明显降低(P<0.05)(图1B)。
2.2免疫荧光染色观察细胞球与贴壁细胞中ADAM12与CD133的表达采用免疫荧光染色技术检测细胞球与普通贴壁细胞中ADAM12与CD133的表达,绿色荧光代表ADAM12蛋白表达,红色荧光代表CD133蛋白表达,蓝色为细胞核;荧光显微镜下可见细胞球中ADAM12与CD133表达量高于普通贴壁细胞(图2)。

图1不同处理组的U87细胞系ADAM12 mRNA与蛋白表达情况A:Real-time PCR检测不同处理组细胞系ADAM12 mRNA的表达情况;B:Western bloting检测不同处理组细胞ADAM12蛋白表达情况。1.shRNA-ADAM12组,2.shRNA-NC组,3.shRNA-C组。aP<0.05

图2免疫荧光显微镜观察细胞球与普通贴壁细胞ADAM12与CD133的表达情况(×200)
2.3神经肿瘤球形成实验检测不同处理组细胞的体外成球能力 倒置相差显微镜观察不同处理组细胞的成球情况,shRNA-ADAM12组细胞球体积较小,成球数较少;shRNA-NC组与shRNA-C组成球体积较大,成球数较多(图3)。体外神经肿瘤球形成实验结果显示,shRNA-ADAM12组、shRNA-NC组以及shRNA-C组的每1000个细胞的成球数分别为45.5±2.3、104.2±5.8以及109.6±6.2,三组总体比较统计学差异明显(F=147.03,P<0.01);相比于另外两组,shRNA-ADAM12组细胞的成球能力明显降低,差异具有统计学意义(P<0.05)。

图3倒置相差显微镜观察不同处理组细胞成球情况(×200)
2.4不同处理组细胞系相关蛋白表达情况 采用Western blotting检测相关分化特异性蛋白GFAP与TUBB3,以GAPDH作为内参对照,与shRNA-NC组及shRNA-C组相比,shRNA-ADAM12组的GFAP (F=164.81,P<0.01)与TUBB3(F=82.29,P<0.01)蛋白表达量明显升高,未分化蛋白CD133(F=305.12,P<0.01)表达明显降低,HES1(F=238.36,P<0.01)蛋白表达明显降低(表1,图4);与shRNA-C组相比,shRNA-ADAM12组的GFAP与TUBB3蛋白表达量分别上调约166%与14 6%,CD133与HES1的蛋白表达量分别下调了54%与50%。
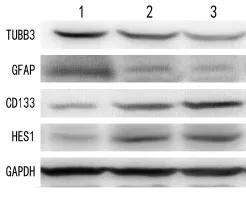
图 4 Western blotting检测不同处理细胞系相关蛋白的表达情况。1.shRNA-ADAM12组,2.shRNA-NC组,3.shRNA-C组
3 讨论
恶性胶质瘤预后差以及对化疗与放疗的抵抗主要与一部分具有干细胞表型的肿瘤细胞亚群即胶质瘤干细胞有关[1]。胶质瘤干细胞也称为胶质瘤起始细胞,在胶质瘤的肿瘤形成及复发过程中发挥了关键作用。自我更新能力是指干细胞通过分裂得到单个或一对与母代细胞具有相同表型的子代细胞的能力[3]。对于胶质瘤干细胞自我更新能力及多向分化潜能的分子机制进行深入研究将有助于进一步了解恶性胶质瘤的生物学特点。
ADAM12在乳腺癌、肺癌以及膀胱癌等多种恶性肿瘤的发生及发展过程中发挥了重要作用[6]。同时,有研究表明ADAM12在高级别胶质瘤中选择性高表达,而在低级别胶质瘤中未见明显表达[7]。但是其在恶性胶质瘤中具体发挥了何种作用目前仍缺乏深入研究。本研究通过慢病毒转染技术获得稳定敲低ADAM12的U87胶质瘤细胞系,采用神经肿瘤球形成实验检测其成球能力较对照组明显下降,表明敲低ADAM12后抑制了胶质瘤干细胞的自我更新能力。GFAP与TUBB3分别是星形胶质细胞与神经元的特异性分子标记物,ADAM12敲低组成球后的GFAP与TUBB3的蛋白表达量较对照组均明显升高,表明ADAM12敲低后促进了胶质瘤干细胞向星形胶质细胞与神经元的分化。有研究证明,CD133是胶质瘤干细胞的细胞表面标记物[8],本实验通过免疫荧光染色技术检测结果表明成球培养可以富集CD133阳性的胶质瘤细胞。同时ADAM12敲低组成球后CD133的蛋白表达量较对照组明显下降,表明ADAM12敲低组的胶质瘤干细胞比例下降。

表1不同处理组细胞相关蛋白的相对表达量
然而,ADAM12是通过何种途径影响胶质瘤干细胞的自我更新能力的呢?研究表明,在干细胞表型维持中,Notch通路活化的作用最为显著[9]。在恶性胶质瘤中,Notch通路活性与GSCs表型的维持也已被证明[4,10]。本实验检测了Notch通路的靶基因HES1在不同处理组中的蛋白表达量,结果显示ADAM12敲低组HES1表达量较对照组明显下降,表明ADAM12有可能是通过激活Notch通路活性实现维持胶质瘤干细胞的自我更新能力。但是ADAM12对Notch通路发挥调控作用的具体分子机制还需要深入探究。
综上所述,敲低ADAM12可抑制胶质瘤干细胞Notch通路活性,并最终导致其自我更新能力下降,表明ADAM12在维持胶质瘤干细胞自我更新能力及阻止其分化的过程中发挥了重要作用。但是ADAM12对Notch通路的调控机制还需深入研究,本研究组将继续探索,为胶质瘤的治疗提供创新性思路。
[1]XIE Q,FLAVAHAN WA,BAO S,et al.The tailless root of glioma:cancer stem cells[J].Cell Stem Cell,2014,15(2):114-116.
[2]赵鹏飞,杨学军,张辰,等.敲低S100A4表达对胶质瘤细胞系SNB19侵袭和迁移的影响[J].中国神经精神疾病杂志,2014,40(12):746-751
[3]HE S,NAKADA D,MORRISON SJ.Mechanisms of stem cell self-renewal[J].Annu Rev Cell Dev Biol,2009,25:377-406.
[4]XU P,ZHANG A,JIANG R,et al.The different role of Notch1 and Notch2 in astrocytic gliomas[J].PLoS One,2013,8(1):e53654.
[5]DYCZYNSKA E,SUN D,YI H,et al.Proteolytic processing of delta-like 1 by ADAM proteases[J].J Biol Chem,2007,282(1):436-444.
[6]DUHACHEK-MUGGY S,ZOLKIEWSKA A.ADAM12-L is a direct target of the miR-29 and miR-200 families in breast cancer[J].BMC Cancer,2015,15:93.
[7]KODAMA T,IKEDA E,OKADA A,et al.ADAM12 is selectively overexpressed in human glioblastomas and is associated with glioblastoma cell proliferation and shedding of heparin-binding epidermalgrowthfactor[J].AmJPathol,2004,165(5):1743-1753.
[8]BRESCIA P,ORTENSI B,FORNASARI L,et al.CD133 is essential for glioblastoma stem cell maintenance[J].Stem Cells,2013,31(5):857-869.
[9]VALDEZ JM,ZHANG L,SU Q,et al.Notch and TGFbeta form a reciprocal positive regulatory loop that suppresses murine prostate basal stem/progenitor cell activity[J].Cell Stem Cell,2012,11(5):676-688.
[10]CHARLES N,OZAWA T,SQUATRITO M,et al.Perivascular nitric oxide activates notch signaling and promotes stem-like character in PDGF-induced glioma cells[J].Cell Stem Cell,2010,6(2):141-152.
(责任编辑:甘章平)
Effect of silencing a disintegrin and metalloprotease 12 expression on self-renewal capacity of CD133 posi-tive giloma cells.
LIU Bo,YANG Xuejun,ZHANG Chen,YU Shengping,LIN Yu,HUANG Yubao,HAI Long,ZHOU Xingchen,LI Shuai,LI Tao,WANG Wei,CHENG Cheng,YANG Yihan.Department of Neurosurgery,General Hospital of Tianjin Medical University,154 Anshan Road,Tianjin 300052,China.Tel:022-60814469.
Objective To investigate the inhibitory effect of a disintegrin and metalloprotease 12 silenced by shRNA on self-renewal capacity of CD133 positive giloma cells.Methods The shRNA recombinant lentivirus aimed at silencing ADAM12 was prepared.Human glioma cells U87 were employed in this study and assigned into three groups:shRNA-ADAM12,shRNA-NCandshRNA-C.ADAM12 expression was detected at mRNA and protein level using Real-time quantitative-PCR and western bloting,respectively.U87 cells were cultured with stem cell culture medium,toobtain cell sphere formation in which CD133 positive glioma cells were enriched.Immunofluorescence was employed to detect the expression of ADAM12 and CD133 in cell spheres and U87 cells;Self-renewal was tested by using tumor sphere formation assay.Molecular markers for differentiated or undifferentiated cells(CD133,GFAP and Tuj1)were detected at protein using western blotting.Western blotting was employed to test protein expression of HES1.Results ADAM12 shRNA significantly down-regulated the mRNA and protein expression levels of ADAM12.Compared with shRNA -C group,the relative expression levels of mRNA in shRNA-ADAM12 group and shRNA-NC group were 0.22±0.03 and 0.98±0.06(F=425.37,P<0.01).The relative expression levels of protein in shRNA-ADAM12 group,shRNA-NC group and shRNA-C group were 28.72%±2.36%,69.21%±3.92%and 69.04%±3.57%,respectively(F=145.42,P<0.01). Immunofluorescence staining showed that expression levels of ADAM12 and CD133 in cell spheres were significantly higher than those in normal cells.The number of spheres in three groups were 45.5±2.3、104.2±5.8 and 109.6±6.2,tumor sphere formation ability of shRNA-ADAM12 group was lower than that of shRNA-NC group and shRNA-C group(F= 147.03,P<0.01).Compared with the shRNA-NC group and shRNA-C group,the protain expression of GFAP and Tuj1 were increased up to 166%and 146% (P<0.01)whereas the protein expression levels of CD133 and HES1 were down-regulated by 54%and 50%(P<0.01).Conclusion Knockdown of ADAM12 may suppress self-renewal ability of CD133 positive glioma cells by inhibiting the Notch pathway activity.
R739.4
A
10.3969/j.issn.1002-0152.2016.01.009
☆国家自然科学基金(编号:81272782、81472352);高等学校博士学科点专项科研基金(编号:20131202110006);天津市应用基础与前沿技术研究计划(编号:15JCZDJC36200)资助
*天津医科大学总医院神经外科(天津 300052)
(E-mail:ydenny@126.com)
2015-10-09)

