合成碳酸二甲酯宏观动力学及反应器数值模拟
闫亚辉,丁晓墅,王淑芳,王延吉
河北工业大学绿色化工与高效节能河北省重点实验室,天津 300130
合成碳酸二甲酯宏观动力学及反应器数值模拟
闫亚辉,丁晓墅,王淑芳,王延吉
河北工业大学绿色化工与高效节能河北省重点实验室,天津 300130
在固定床反应器中研究了PdCl2-CuCl2-KOAc/AC催化剂上甲醇气相氧化羰基化合成碳酸二甲酯(DMC)反应的宏观动力学,建立了以CO、O2、甲醇分压表示的幂函数动力学模型,统计检验表明所得模型具有较高的可信度。依据动力学模型,建立了用于该反应过程的固定床反应器二维拟均相模型,借助Matlab软件,模拟分析了空速、原料组成、进口温度、操作压力和管外介质温度等因素对反应过程的影响。模拟计算结果显示,操作压力和空速对反应器的热点温度影响显著,而甲醇的转化率及DMC对CO的选择性受原料组成影响较大。优化确定了在PdCl2-CuCl2-KOAc/AC催化剂上甲醇气相氧化羰基化合成碳酸二甲酯适宜的条件为:进料组成CH3OH/CO/O2的体积比为0.20:0.27:0.53,空速7 500 h-1,进口温度160 ℃,操作压力0.30 MPa。在该条件下,床层的热点温度为214.96 ℃,甲醇的转化率为51.69 %,DMC对CO的选择性为65.92 %。
碳酸二甲酯 宏观动力学 参数估计 二维拟均相模型
碳酸二甲酯(DMC)是一种用途广泛、低毒、反应活泼的环境友好型基础有机化学品,DMC可替代光气、氯甲烷、硫酸二甲酯和氯甲酸甲酯等剧毒物进行羰基化、羰基甲氧基化、甲基化及甲氧基化等反应[1]。碳酸二甲酯的合成方法主要有光气法、酯交换法、尿素醇解法、甲醇液相氧化法、甲醇气相氧化羰基化法和二氧化碳直接合成法等,甲醇气相氧化羰基化法合成DMC的工艺具有原料便宜易得、毒性小、工艺简单和成本低等优点[2,3]。
针对甲醇气相氧化羰基化法合成DMC的催化剂已有大量文献报道[4-8],主要为Wacker型催化剂和无氯铜基催化剂。本课题组前期关于PdCl2-CuCl2-KOAc/AC催化剂的研究工作表明[5,8,9],在反应压力0.30 MPa、反应温度150 ℃、CH3OH/CO/O2的体积比为4.4:2.9:1、原料气空速7 168 h-1时,DMC的空时收率达785 g/(L·h)。本研究将对PdCl2-CuCl2-KOAc/AC催化剂催化甲醇气相氧化羰基化合成DMC的动力学进行研究,建立宏观动力学模型,并建立二维固定床反应器模型,模拟分析主要操作变量对反应性能的影响,以期为该过程的工业化提供理论指导。
1 宏观动力学的建立
1.1 实验方法
实验原料气摩尔分数组成为:30%~60% CO,13%~43% O2,其余的为甲醇。催化剂PdCl2-CuCl2-KOAc/AC填装量为0.42 g(20~40 目),与1 mL同粒度的石英砂均匀混合后装填,催化床层上下两端分别填装同粒度的石英砂。实验压力为0.10~0.30 MPa,反应温度为150~180 ℃。
采用GC-3420气相色谱仪分析反应产物,热导检测器(TCD)检测,由Propark-Q色谱柱(3 m×3 mm)和分子筛色谱柱(2.5 m×3 mm)串联分析气相组成,由Propark-Q色谱柱分析液相产物组成。检测器温度为150 ℃,汽化室温度130 ℃,载气流速30 mL/min,载气为H2。
1.2 实验结果
不同条件下PdCl2-CuCl2-KOAc/AC催化剂上进行甲醇气相氧化合成DMC的反应结果如表1所示。

表1 甲醇气相氧化合成DMC的反应结果Table 1 Experimental data of gas-phase oxidation of methanol to DMC
1.3 反应动力学模型
原料在PdCl2-CuCl2-KOAc/AC催化剂上除了发生甲醇气相一步制DMC的反应外,还存在CO氧化生成CO2的副反应。

选取DMC、CO2为关键组分,设关键组分的幂函数型动力学方程如下:

设固定床反应器瞬时总流量为N,mol/h;DMC、CO2的摩尔分率分别为yDMC、yCO2。物料衡算表如表2所示。

表2 物料衡算表Table 2 Material balance sheet
由物料衡算表可以得到:

1.4 参数估值
以关键组分DMC、CO2摩尔分率的实验值与模型计算值的残差平方和为参数估计的目标函数,采用单纯形法和四阶龙格库塔相结合的方法对动力学方程进行参数估值,得到动力学方程为:

1.5 动力学模型的检验
动力学模型的统计检验结果见表3,表中的MP为模型参数个数,M为实验次数,F为回归均方和与模型残差均方和之比,ρ2为决定性指标,F0.05为显著水平5%相应自由度下的F表值。动力学模型的统计检验表明,F大于10F0.05、ρ2大于0.9,一般认为宏观动力学模型是适宜的。

表3 动力学模型统计检验结果Table 3 Statistic results of the kinetic models
反应器出口DMC、CO2摩尔分率的模型计算值与实验值的比较分别见图1和图2。所有的数据点皆处于±10%的误差线以内,表明动力学方程(11)、(12)计算的反应器出口DMC、CO2摩尔分率值与实验值吻合良好。

图1 出口DMC摩尔分率的计算值与实验值比较Fig.1 Comparison of the calculated and experimental values for molar fraction of DMC in the outlet gas
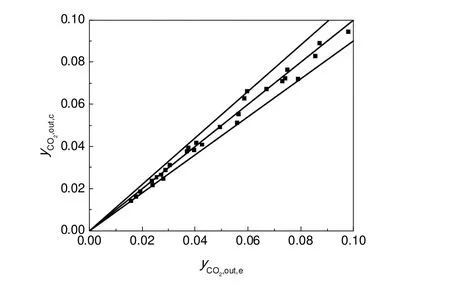
图2 出口CO2摩尔分率的计算值与实验值比较Fig.2 Comparison of calculated and experimental values for molar fraction of CO2in the outlet gas
2 固定床反应器中反应过程的模拟
2.1 反应器模型
甲醇氧化羰基化合成DMC、CO氧化合成CO2均是强放热反应,高的热效应可能导致固定床反应器存在显著的径向温度梯度,进而影响产物分布,因此采用二维拟均相固定床模型描述该反应过程,并提出以下假定条件:反应达到稳态;气体物性符合理想气体状态方程;所用的催化剂为圆柱颗粒,填充床的空隙率较大,忽略床层压降[10];气流在反应器入口截面均匀分布,性质均一。对所用的催化剂进行内扩散影响估算,求得ϕ2ηi为9.97×10-7,根据ϕ2ηi小于0.16内扩散对反应无显著影响的标准[11],可知催化剂内扩散影响不大,因此在进行反应器模拟时似采用了实验室在20~40 目下得到的动力学方程。
甲醇氧化羰基化合成DMC二维拟均相固定床模型为[12]:

2.2 模型参数与模型求解
管壳式固定床反应器结构参数为:反应器尺寸30 mm×5 mm,管长(H)5 m,反应管为1根。反应管装填3 mm×2 mm圆柱状的碳酸二甲酯合成催化剂1.57 L,催化剂堆密度为420 kg/m3。
采用相关经验公式分别计算混合气体物性,包括粘度[13]、比热容[14]、导热系数[13]和二维模型参数,包括径向有效导热系数[12]、壁面传热系数[15]。根据文献的报道将式(11)中的反应热表示为温度的函数。二维拟均相固定床模型为偏微分方程组,首先采用有限差分的Crank-Nicolson法,将其转化成一组代数方程,然后用Matlab软件求解。
2.3 模拟结果讨论
在空速7 500 h-1,原料气体积组成CH3OH/CO/O2为0.20:0.40:0.40,进口温度160 ℃,操作压力0.30 MPa,管外沸腾水温度180 ℃的条件下,反应温度的轴径向分布、甲醇转化率的轴径向分布分别见图3和图4。可见,在管中心处,反应温度沿床层方向先上升,达到热点温度后逐渐下降,床层的出口温度为207.22 ℃;反应管径向中心处的反应温度最高,沿径向方向逐渐减低,径向最高温差达17.08 ℃。在同一个轴向处,因管中心的温度最高,故甲醇转化率也最高,随着温度沿径向的下降,甲醇转化率也沿径向逐渐减低。

图3 床层中的温度分布Fig.3 Temperature distributions in the bed

图4 床层中甲醇转化率分布Fig.4 Conversion distributions of methanol in the bed
2.3.1 空速对床层温度分布的影响
在上述实验条件下,模拟了不同空速时床层中心的轴向温度分布以及0.5H床层高度的径向温度分布,结果见图5和图6。

图5 不同空速下床层中心温度的轴向分布Fig.5 Axial temperature distributions at the center of bed under different space velocities

图6 不同空速下床层中心温度的径向分布Fig.6 Radial temperature distributions at the center of bed under different space velocities
提高空速即降低了反应物在反应器的停留时间,同时管内的传热系数增大,强化了传热,并且过量的反应物带走了反应热。可知,随着空速降低,热点温度升高且径向温度梯度增大。因为低空速意味在相同段床层内的停留时间增长,会在进口很短床层内产生大量的热,难以及时移除热量,故沿径向温度梯度较大。考虑到反应温度的控制和催化剂的失活问题,适宜的空速应在7 500~9 500 h-1。
2.3.2 原料气组成的影响
在甲醇摩尔分数0.20,进口温度160 ℃,操作压力0.30 MPa,管外沸腾水温度180 ℃,空速7 500 h-1条件下,不同CO与O2配比时床层中心温度的轴向分布、甲醇平均转化率沿管长分布以及DMC对CO选择性的轴向分布的模拟结果见图7、图8和图9。模拟结果显示,原料中CO/O2体积比增加,甲醇转化率降低;当CO/O2比由1/2提高到2/1时,DMC对CO的选择性由60%降至24%,热点温度由215.03 ℃增至264.47 ℃,热效应明显。这是由于更多的CO选择合成CO2,在高的CO浓度下更有利于完全氧化副反应的发生有关。综合考虑CO/O2比在1/2时,甲醇转化率和DMC对CO的选择性均较高,故选取适宜CO/O2体积比为1/2。

图7 原料中不同CO/O2体积比时床层中心温度的轴向分布Fig.7 Axial temperature distributions at the center of bed under different volume ratios of CO to O2in the feed

图8 原料中不同CO/O2体积比时甲醇平均转化率的轴向分布Fig.8 Axial distributions of average methanol conversion under different volume ratios of CO to O2in the feed
当CO/O2体积比为1/2时,改变原料中甲醇的摩尔分数,模拟床层中心温度的轴向分布、甲醇平均转化率的轴向分布结果以及DMC对CO选择性的轴向分布结果见图10、图11和图12。可知,随着进口甲醇的摩尔分数增大,热点温度降低,甲醇的转化率降低。甲醇的摩尔分率由0.4降至0.2时,DMC对CO的选择性由61.52%提高至65.92%,这说明在CO与O2体积比不变的条件下,适当降低进料中甲醇浓度,对提高主副反应速率都有一定作用,且对两个反应的竞争性影响不大。因此选取适宜的甲醇摩尔分数为0.20。

图10 不同甲醇摩尔分率下床层中心温度的轴向分布Fig.10 Axial temperature distributions at the center of bed under different molar fractions of methanol
2.3.3 进口温度的影响
不同进口温度条件下(160,170,180 ℃)的模拟结果表明,进口温度的变化对床层温度分布和甲醇转化率分布的影响均较小,故选择进口温度160 ℃较适宜。
2.3.4 操作压力的影响
操作压力影响组分分压,进而影响合成DMC、CO2的速率。在原料气体积组成CH3OH/CO/O2为0.20:0.27:0.53,进口温度160 ℃,空速7 500 h-1,管外沸腾水温度180 ℃条件下,模拟不同操作压力下床层中心温度的轴向分布和甲醇平均转化率轴向分布,结果见图13和图14。操作压力由0.1 MPa升至0.3 MPa,床层的热点温度由185.08 ℃增至214.96 ℃,甲醇的转化率由8.65 %提高到51.69 %。可见,增加操作压力,促进了DMC、CO2的合成,热点温度上升明显,甲醇转化率增加。增加操作压力有利于提高甲醇转化率,但压力过高,热点温度显著升高,致使温度不宜控制。压力为0.30 MPa可作为适宜的压力。

图9 原料中不同CO/O2体积比时DMC对CO选择性的轴向分布Fig.9 Axial selectivity profile of DMC to CO distributions at the center of bed under different volume ratios of CO to O2in the feed

图11 不同甲醇摩尔分率下甲醇平均转化率的轴向分布Fig.11 Axial distributions of average methanol conversion under different molar fractions of methanol

图12 不同甲醇摩尔分率下DMC对CO选择性的轴向分布Fig.12 Axial selectivity profile of DMC to CO distributions under different molar fractions of methanol

图13 不同操作压力下下床层中心温度的轴向分布Fig.13 Axial temperature distributions at the center of bed under different operating pressures
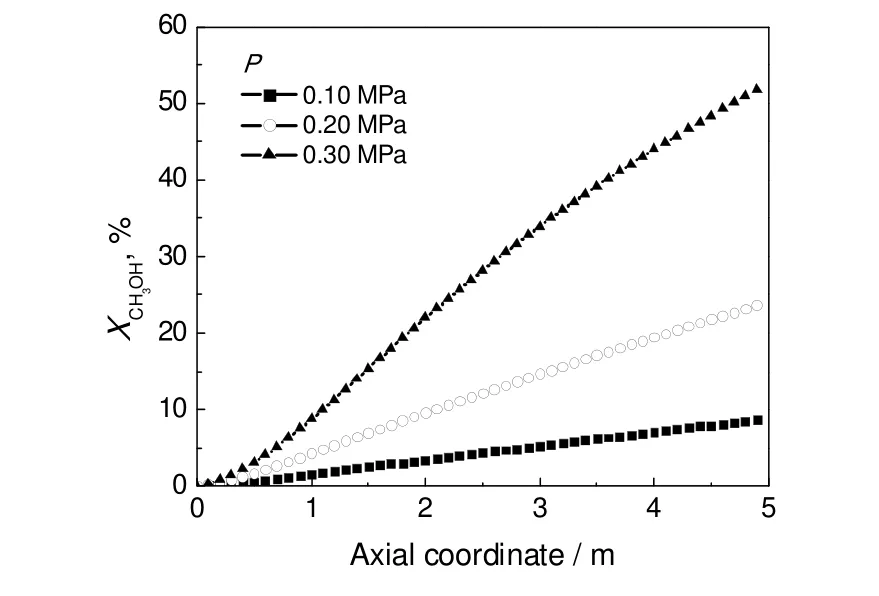
图14 不同操作压力下甲醇平均转化率的轴向分布Fig.14 Axial distributions of average methanol conversion under different operating pressures
3 结 论
a)在小试规模的固定床反应器中测定了在PdCl2-CuCl2-KOAc/AC催化剂上的甲醇氧化羰基化合成碳酸二甲酯的反应数据,建立了幂函数型宏观动力学模型,反应器出口的DMC、CO2组成的计算值与实验值的偏差皆在10%以内;模型的残差分析和统计检验表明,所得动力学模型是可靠的。
b)甲醇气相氧化羰基化合成碳酸二甲酯的二维拟均相固定床模拟结果表明,操作压力显著影响反应行为,压力从0.10 MPa升至0.30 MPa,反应速率加快,温升在30 ℃左右;进料温度对反应影响较小;空速增加,热点温度降低,甲醇转化率降低;甲醇的转化率及DMC对CO的选择性则受原料组成影响较大。
c)优化确定了在PdCl2-CuCl2-KOAc/AC催化剂上,适宜的甲醇气相氧化羰基化合成碳酸二甲酯的操作条件为:原料组成CH3OH/CO/O2的体积比为0.20:0.27:0.53,空速7 500 h-1、进口温度160 ℃,操作压力0.30 MPa。此条件下,甲醇的转化率为51.69%,DMC对CO的选择性为65.92%。在该条件下,床层的热点温度为214.96 ℃,甲醇转化率为51.69%,DMC对CO的选择性为65.92%。

参考文献:
[1] 王延吉, 赵新强. 绿色催化过程与工艺 [M]. 北京: 化学工业出版社, 2005: 76-153.
[2] 宋军超, 李长有, 赵天生, 等. 甲醇气相氧化羰化法合成碳酸二甲酯的Cu-AC催化剂活性研究 [J]. 精细石油化工, 2010, 27(6):1-5. Song Junchao, Li Changyou, Zhao Tiansheng, et al. Cu-AC catalyst for synthesis of dimethyl carbonate by direct vapor phase oxidative carbonylation of methanol [J]. Speciality Petrochemicals, 2010, 27(6):1-5.
[3] King S T. Reaction mechanism of oxidative carbonylation of methanol to dimethyl carbonate in Cu-Y zeolite [J]. J Catal, 1996,161(2):530-538.
[4] 杨 平. 负载型Wacker催化剂及其甲醇气相氧化羰化合成碳酸二甲酯研究 [D]. 上海: 复旦大学, 2003.
[5] 王淑芳. 气相直接合成碳酸二甲酯PdCl2-CuCl2-KOAc/AC催化剂的研究 [D]. 天津: 河北工业大学, 2002.
[6] Yang P, Cao Y, Deng W L, et al. Effect of chemical treatment of activated carbon as a support for promoted dimethyl carbonate synthesis by vapor phase oxidative carbonylation of methanol over Wacker-type catalysts [J]. Appl Catal A: Gen, 2003, 243(2):323-331.
[7] 王瑞玉. 完全无氯铜基催化剂制备与催化甲醇氧化羰基化的研究 [D]. 太原: 太原理工大学, 2010.
[8] Jiang R X, Wang Y J, Zhao X Q, et al. Characterization of catalyst in the synthesis of dimethyl carbonate by gas-phase oxidative carbonylation of methanol [J]. J Molecul Catal A: Chem, 2002, 185(1):159-166.
[9] 王淑芳, 赵新强, 王延吉. 甲醇气相合成碳酸二甲酯的催化反应条件分析 [J]. 化学反应工程与工艺, 2004, 20(1):29-35. Wang Shufang, Zhao Xinqiang, Wang Yanji. Analysis of influencing factors on gas phase catalytic synthesis of dimethyl carbonate from methanol [J]. Chemical Reaction Engineering and Technology, 2004, 20(1):29-35.
[10] Nemec D, Levec J. Flow through packed bed reeactor: 1. Single-phase flow [J]. Chem Eng Sci, 2005, 60(24):6947-6957.
[11] 朱开宏, 袁渭康. 化学反应工程分析 [M]. 北京: 高等教育出版社, 2002:167-197.
[12] 朱炳辰. 化学反应工程 [M]. 第四版. 北京: 化学工业出版社, 2007:154-155.
[13] 马沛生. 石油化工基础数据手册 [M]. 北京: 化学工业出版社, 1993:40-70.
[14] 李 忠. 甲醇氧化羰基化洁净合成DMC催化反应研究 [D]. 太原: 太原理工大学, 2004.
[15] 陈敏恒. 化工原理上册 [M]. 第三版. 北京: 化学工业出版社, 2011: 184-185.
Macrokinetics and Numerical Simulation of the Dimethyl Carbonate Synthesis in the Fixed-Bed Reactor
Yan Yahui, Ding Xiaoshu, Wang Shufang, Wang Yanji
Hebei Province Key Lab of Green Chemical Technology and Efficient Energy Saving, Hebei University of Technology, Tianjin 300130, China
The macrokinetics of dimethyl carbonate (DMC) synthesized by the gas-phase oxidative carbonylation of methanol over PdCl2-CuCl2-KOAc/AC was investigated in the fixed-bed reactor. The kinetic model of power functions presented by the form of partial pressures of carbon monoxide, oxygen and methanol was established. The statistic test showed that the model had high credibility. Based on the macrokinetics model, a two-dimensional pseudo-homogeneous fixed-bed reactor model of this process was established. The effects of space velocity, feed composition, inlet temperature and operating pressure on the process were simulated and analyzed by Matlab, respectively. The results showed that the hot-spot in the reactor was greatly influenced by the operating pressure and the space velocity, while the conversion of methanol and the selectivity of DMC to CO were largely influenced by the feed composition. The optimum operating conditions of dimethyl carbonate synthesis by the gas-phase oxidative carbonylation of methanol over PdCl2-CuCl2-KOAc/AC was determined as follows: the volume ratio of CH3OH/CO/O2was 0.20:0.27:0.53, the space velocity was 7 500 h-1, the inlet temperature was 160 ℃ and the operating pressure was 0.30 MPa. The hot-spot temperature was found to be 214.96 ℃, the methanol conversion was 51.69% and the selectivity of DMC to CO was 65.92% under this condition.
dimethyl carbonate; macrokinetics; parameter estimation; two-dimensional pseudo-homogeneous model
1001—7631 ( 2016 ) 03—0252—09
2016-02-17;
2016-03-23。
闫亚辉(1990—),女,硕士研究生;王延吉(1962—),男,教授,通讯联系人。E-mail:yjwang@hebut.edu.cn。
国家自然科学基金(21236001);高等学校博士学科点专项科研基金(20121317110009);河北省重大技术创新项目(12275603Z);河北省高等学校科学技术研究项目(QN2015163);河北省青年科学基金项目(B2016202256)。
TQ223.2; O643.11
A

