异柄4苯氧化制过氧化异丙反应工艺优化
异柄4苯氧化制过氧化异丙反应工艺优化

首先在反应器中装入约1 000 mL异丙苯,加入一定量的CHP作为引发剂,并使液位高度高于填料高度。开启导热油加热到设定反应温度,开启循环泵,然后通入空气开始反应,并计时。
1.2 产物分析方法
产物组分在Agilent LC1100液相色谱仪上进行分析,紫外整列检测器,毛细管柱,采用程序升温,50 ℃保持6 min,然后5 ℃/min升温至180 ℃,保持10 min,再以10 ℃/min升温至220 ℃,保持20 min,最后以10 ℃/min升温至250 ℃,维持31 min。
采用间接碘量法测定CHP的浓度,精确称取一定样品于锥形瓶中,加入等体积冰醋酸和饱和碘化钾溶液,60 ℃下加热搅拌5 min,然后用硫代硫酸钠标准溶液滴定至淡黄色,加入淀粉指示剂2滴,继续滴定至蓝色消失,即为终点。按相同步骤,对不加样品的溶液做空白实验。
2 结果与讨论
2.1 异丙苯过氧化反应机理分析
异丙苯氧化生成过氧化异丙苯是一个液相、自由基链式反应[7]。反应产物过氧化异丙苯对反应能自动加速,因此是自催化氧化反应。其反应机理涉及链引发、链传递和链终止。

式中,RH,ROOH,ROH,ROOR,R1OCH3和R-R分别代表异丙苯、CHP、二甲基苄醇、过氧化二异丙基苯、苯乙酮和联二异丙苯分子。
链引发反应阶段,即反应初期,反应速率的决定因素是ROOH(CHP)的浓度,在没有引发剂存在的情况,CHP浓度很低,反应速率较慢。链增长阶段,反应速率的决定因素是溶解氧的浓度。通过强化气液传质,提高溶解氧的浓度,能够提高氧化反应反应速率。链终止反应,反应速率决定性因素是自由基的浓度,也就是CHP浓度,过高的CHP浓度会促进链增长副反应的发生。
综上所述,过氧化二异丙基苯(ROOR)的生成与CHP的浓度密切相关,CHP浓度高,会生成更多的ROOR,二甲基苄醇的生成则与链引发有关。在实际苯酚工业装置生产工艺中,过氧化二异丙苯以及二甲基苄醇在后续流程中会通过酸分解和加氢转化为异丙苯进行回收,因此微量过氧化二异丙苯和二甲基苄醇的生成不会造成产品的实际损失。
苯乙酮是RO·自由基热裂解的产物,因此,高温有利于苯乙酮的生成。苯乙酮是苯酚装置的关键杂质,苯乙酮的生成不但会严重影响产品质量,而且会造成物耗的增加。
2.2 不同型式反应器中的异丙苯氧化反应
在反应温度90 ℃,空气体积空速9.0 h-1,无引发剂的条件下,考察了填料塔反应器和空塔反应器中氧气转化率和CHP浓度随反应时间变化情况,结果见图2。由图可知,在非填料塔反应器中,异丙苯过氧化反应速率慢,氧气转化率始终低于6%,连续反应52 h,氧化产物中CHP浓度只有2.5%;在填料塔反应器中,随着反应时间的增加,过氧化反应速率大幅度上升,在最大平衡转化期(31 h后),氧气维持在高转化率(80%~93%),CHP浓度呈线性增加趋势。这是由于在反应器中装填惰性高效填料,强化气液传质,能够促进氧的溶解速率和溶解氧的浓度,进而促进氧化反应速率。

图2 不同反应器中的异丙苯过氧化反应Fig.2 Peroxidation of cumene in different reactor
由图2还可以看出,在填料塔反应器中,氧气转化率随时间的变化呈特征的S型曲线,整个氧化反应过程可以分为三个阶段:诱导期(0~18 h)、加速期(18~31 h)和最大平衡转化期(31 h后),在诱导期末期,反应液CHP浓度为0.8%左右,加速期末期(31 h),CHP浓度累积达到5%。说明在原料中加入CHP作为引发剂,可消除诱导期,并大幅度提高氧化反应效率。
2.3 引发剂用量的影响
在反应温度90 ℃,空气体积空速9.0 h-1条件下,考察引发剂含量对氧气转化率的影响,结果如图3所示。由图可见,加入6%的引发剂CHP,诱导期几乎完全消失,这一结果和前述结论完全一致。随着反应原料中引发剂CHP含量的逐渐增加,氧化反应速率也逐渐提高,达到平衡转化率的时间也越短。由图3可见,在反应液中加入6%的CHP作为引发剂,诱导期完全消失,但加速期仍较长。进一步增加反应原料中引发剂CHP含量分别为10%、15%、20%,加速期也显著缩短,当初始CHP浓度达到20%时,加速期缩短到1 h左右。显然,反应原料中引发剂CHP浓度越高,氧化反应速率也越高。这可能与两个方面的作用有关:一方面CHP浓度的提高,增加了自由基物种的浓度,因此强化了自催化作用;另一方面,由于极性相近,较高浓度的CHP可能增加了溶液的氧气溶解能力。
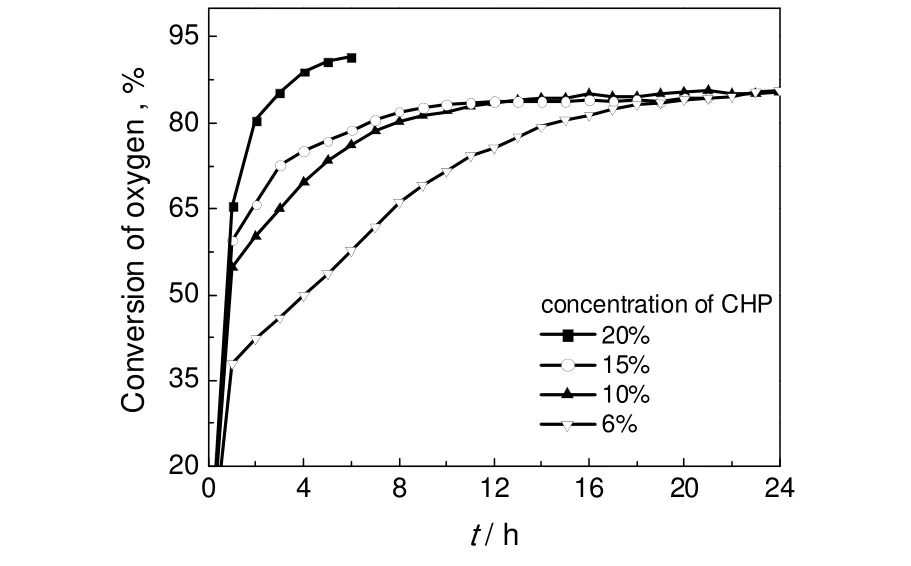
图3 不同引发剂含量下的氧气转化率Fig.3 Oxygen conversion under different initiator contents
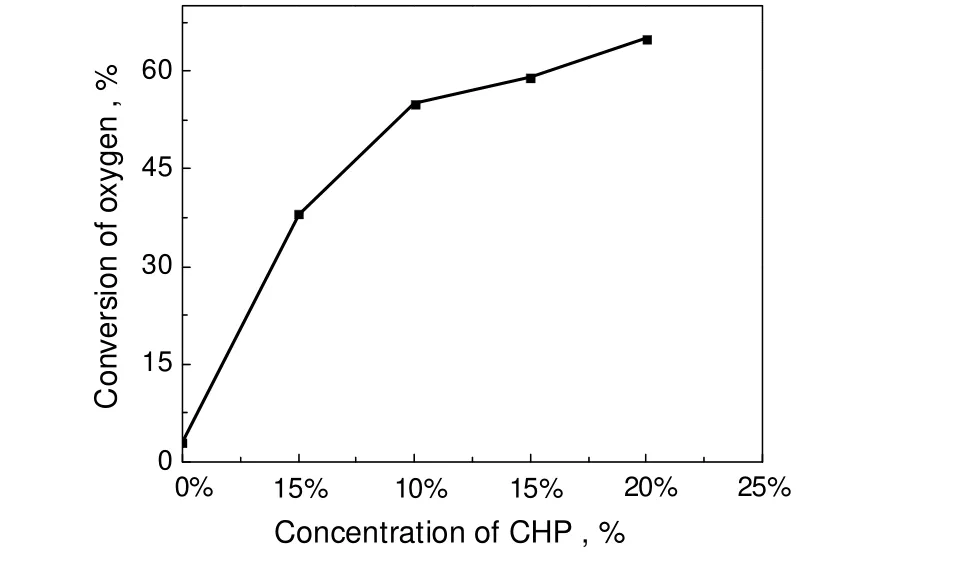
图4 引发剂浓度和氧气初始转化率的关系Fig.4 Initial oxygen conversion rate under different initiator CHP concentrations
图4进一步给出了引发剂浓度和氧气初始转化率的关系。由图可见,当引发剂浓度小于10%时,随引发剂浓度增加,氧气转化率增加和引发剂浓度呈现线性增加的关系。当引发剂CHP浓度大于10%时,随引发剂浓度的增加,氧气转化率的增加幅度逐渐降低。
综上分析,对于异丙苯过氧化反应,要消除诱导期,引发剂CHP浓度应该大于5%,要获得高的反应速率和高的氧气转化率,原料中引发剂CHP浓度应该大于10%。
2.4 空气空速的影响
引发剂的浓度对最终反应平衡后的氧气转化率没有影响,为了更清楚地观察空气空速对氧气转化率的影响,实验选在引发剂含量5%条件下进行。在反应温度90 ℃条件下,不同空气空速时氧气转化率与反应时间的关系如图5所示。由图可见,空速越高,转化率越低。同时达到氧气最大平衡转化率的时间也越长。在5%引发剂CHP存在下,在所有空速条件下,反应诱导期都消失。然而随着反应时间的延长,也都经过了加速期和最大平衡转化期。
在较高的空气空速条件下,氧气转化率随反应时间的曲线几乎呈平行的曲线,尤其,在最大平衡转化阶段。这说明在较高空速条件下,异丙苯氧化反应的速率主要取决于自由基的生成速率。
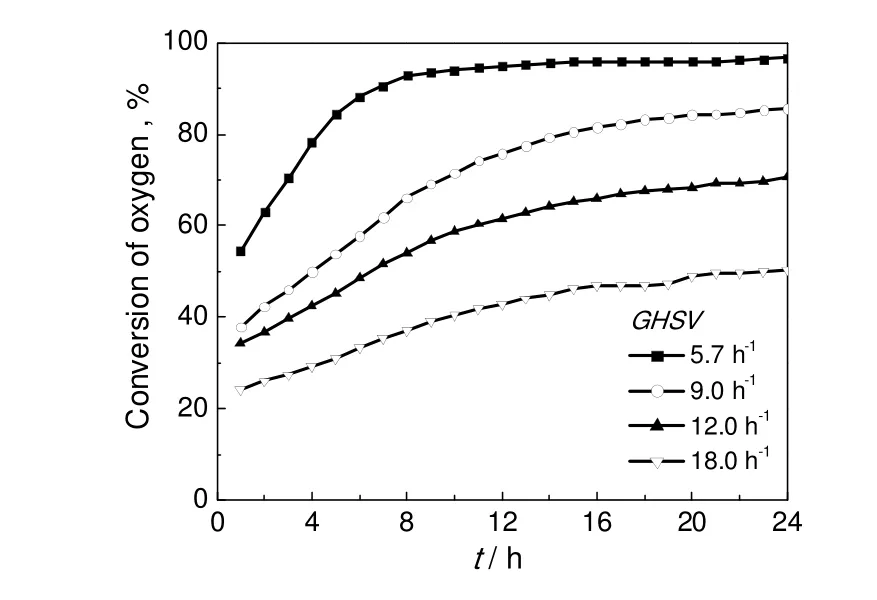
图5 不同空速条件下的氧气转化率Fig.5 Oxygen conversion under different space velocities
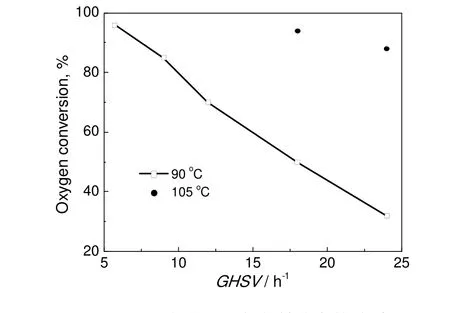
图6 空气空速和氧气转化率的关系Fig.6 Relationship between the space velocity and the oxygen conversion
图6 进一步给出了空速和氧气平衡转化率的关系。由图可见,在反应温度90 ℃,引发剂含量5%的条件下,随空气空速的增加,氧气的平衡转化率呈线性下降。进一步提高温度到105 ℃,在空气空速为18 h-1和24 h-1的高空速条件下,氧气的转化率分别达到87%和92%。温度的提高会显著提高链增长反应的速率。这说明在填料塔反应器中,气液传质效率大幅度提高,在高空速条件下,异丙苯氧化反应速率的取决于自由基的生成速率。
2.5 反应温度的影响
2.5.1 反应温度对氧气转化率的影响
不同反应温度条件下,氧气转化率和反应时间的关系如图7所示。实验是在引发剂CHP含量15%的条件下进行的。由图可见,在空气体积空速9.0 h-1,引发含量15%的条件下,诱导期完全消失,并且达到氧气平衡转化率的时间也大幅度缩短。由图可见,随反应温度提高,氧气平衡转化率逐渐提高。温度越高,达到氧气平衡转化率的时间也越短。在100 ℃,空气体积空速9.0 h-1的条件下,氧气几乎完全转化。
图8进一步给出了反应温度和氧气平衡转化率的关系。由图可见,无论在低空速条件下,还是高空速条件下,温度提高,氧气转化率线性增加。在空气空速18.0 h-1,反应温度90 ℃,引发剂含量15%的条件下,氧气转化率在50%左右,提高反应温度到105 ℃,氧气转化率可以达到90%以上。温度提高,显著提高了自由基反应链引发及链增长的速率,因此,提高温度能够显著提高反应速度。
上述结果说明,在空速一定条件下,异丙苯氧化反应速率对温度高度敏感。温度提高,氧气转化率显著提高,通过适当调节反应温度,可以控制氧气转化率,调控尾氧含量。
综合考虑空速实验和温度实验结果,尾氧含量的限制(7%)以及氧气转化效率,最佳反应区间为图8所示的矩形区间。空气空速9.0~18.0 h-1,反应温度85~105 ℃,此时氧气转化率为70%~95%。
2.5.2 反应温度对产物选择性的影响
表1给出了不同温度条件下,CHP及其副产物的选择性变化情况。为了避免产物中CHP浓度过高,造成安全隐患,根据反应的其他条件的变化,对反应时间进行了相应调整,以控制CHP浓度在安全的范围之内。异丙苯氧化产物的主要副产物有二甲基苄醇、α-甲基苯乙烯(AMS)、过氧化二异丙苯(DCP)以及苯乙酮。在苯酚装置中二甲基苄醇、过氧化二异丙苯都会经过分解脱水转变为α-甲基苯乙烯,α-甲基苯乙烯通过加氢进一步转化为异丙苯。因此,少量苄醇、AMS及DCP的生成并不会显著增加物耗,而苯乙酮的生成会增加装置的物耗。

图7 不同温度条件下的氧气转化率Fig.7 Oxygen conversion under different reaction temperatures
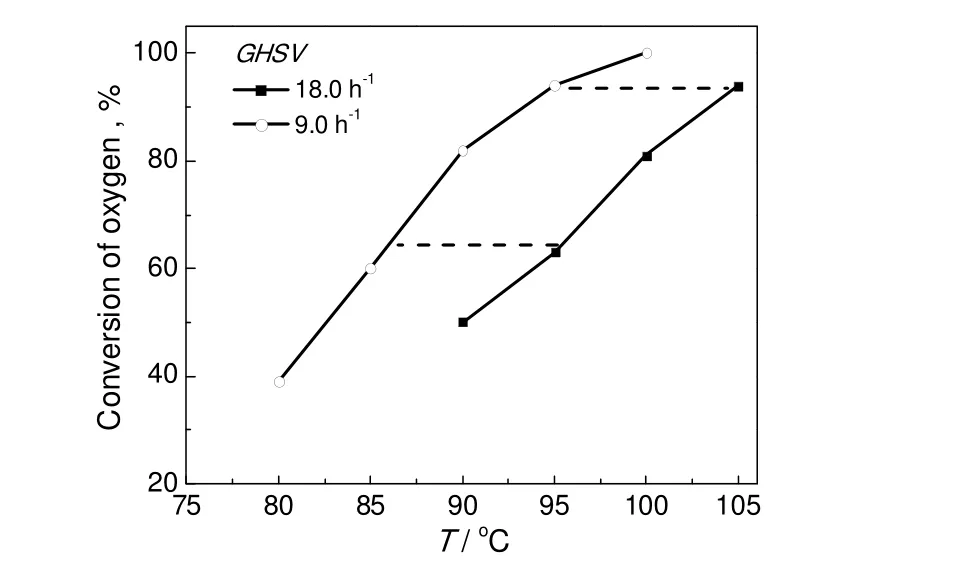
图8 反应温度和氧气转化率之间的关系Fig.8 Relationship between the reaction temperature and the oxygen conversion
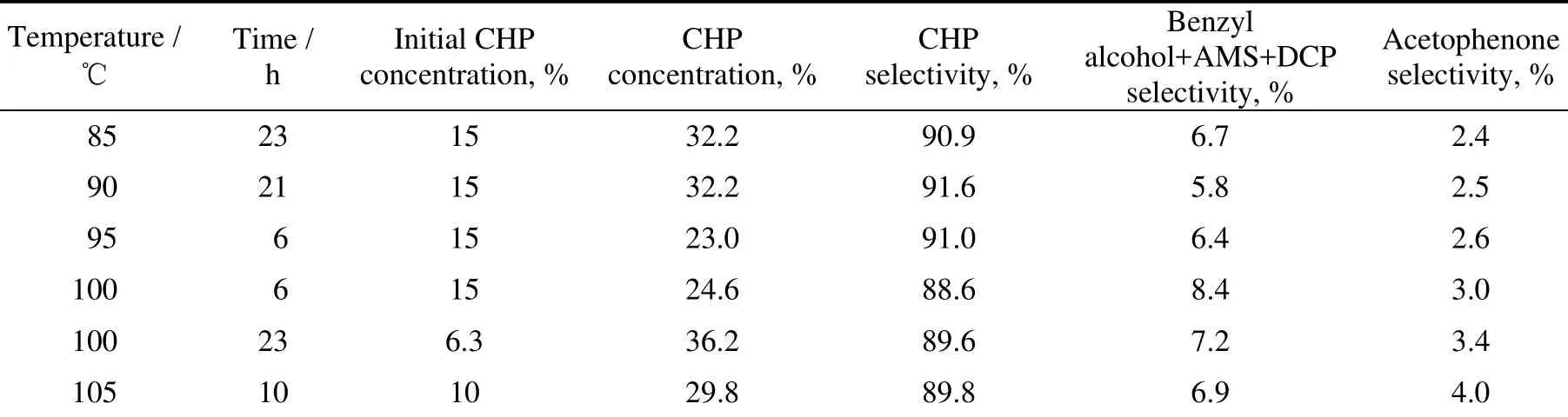
表1 反应温度对氧化产物的影响Table 1 Effect of the reaction temperature on oxidation products
由表1可见,随反应温度提高,CHP选择性呈下降趋势,同时苯乙酮选择性呈增加趋势,尤其当反应温度超过100 ℃时,苯乙酮的选择性增加更加显著:90 ℃时苯乙酮选择性在2.5%,105 ℃时苯乙酮选择性为4.0%,增加幅度超过50%。显然,温度会显著影响产物中杂质的含量,从提高CHP选择性、降低物耗的角度考虑,氧化反应温度应该控制在100 ℃以下。
2.6 反应压力的影响
在引发剂含量15%,反应温度95 ℃的条件下,图9给出了反应压力对氧气转化率的关系。对于空气和异丙苯过氧化这一气液两相反应,反应压力的影响并不如人们通常认为的那样显著。只有在反应压力小于0.20 MPa时,压力的影响才比较明显。超过0.20 MPa后,压力继续提高,氧气转化率几乎不再提高。如:在空气空速12 h-1,常压下,氧气转化率为64%;压力0.20 MPa时,转化率为77%;进一步提高压力到0.30 MPa,氧气转化率仍然保持在77%。
上述结果说明,在实验条件下,空气压力的变化,不会显著影响液相中氧的溶解能力。决定异丙苯氧化反应速率的关键因素是温度、空速以及反应器形式。由图9可见,在空气体积空速分别为9.0 h-1和12.0 h-1条件下得到的反应压力和转化率曲线的变化趋势很相似,几乎也呈平行状态。总之,随着压力提高,氧气的转化率提高,但压力对异丙苯氧化反应影响并不显著,最佳的压力为0.20~0.30 MPa。
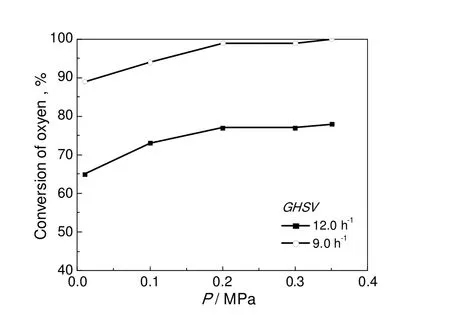
图9 反应压力和氧气转化率的关系Fig.9 Effect of reaction pressure on the oxygen conversion
3 结 论
a)空气氧化异丙苯制备过氧化异丙苯是典型的链式自由基反应机理。在反应器中装填高效填料,强化了传质效果,大幅度提高了异丙苯过氧化的反应效率。当引发剂CHP浓度大于5%时,反应诱导期完全消除。随着空气空速的增加,氧气的平衡转化率呈线性下降。当压力提高时,氧气的转化率呈增加趋势,但压力对异丙苯氧化反应的影响并不显著。
b)异丙苯氧化反应速率对温度高度敏感,温度提高,氧气转化率显著提高,通过适当调节反应温度,可以控制氧气转化率,调控尾氧含量。此外,温度会显著影响产物中杂质的含量。从提高CHP选择性、降低物耗的角度考虑,氧化反应温度应该控制在100 ℃以下。
c)优化的反应工艺条件:采用填料塔工艺,填料高度1.2 m左右,在氧化温度85~100 ℃,反应压力0.20~0.30 MPa,空气体积空速12~18 h-1的条件下,最终氧化产物中CHP浓度大于24%(w),尾氧浓度小于6%。
[1] Schmidt R J. Industrial catalytic processes: phenol production [J]. Appl Catal A: Gen, 2005, 280 (1):89-103
[2] 任永利, 米振涛. 过氧化氢氧化苯制苯酚的催化剂研究进展 [J].化工进展, 2002, 21 (11):827-830. Ren Yongli, Mi Zhentao. Process on the catalyst used for direct oxidation of benzene into phenol by hydrogen peroxide [J]. Chemical Industry and Engineering Progress, 2002, 21 (11):827-830.
[3] Han L, Wang Y, Zhang J, et al. Acidic montmorillonite/cordierite monolithic catalysts for cleavage of cumene hydroperoxide [J]. Chin J Chem Eng, 2014, 22 (8):854-860
[4] Yadav G D, Asthana N S. Selective decomposition of cumene hydroperoxide into phenol and acetone by a novel cesium substituted heteropolyacid on clay [J]. Appl Catal A: Gen, 2003, 244 (2):341-357
[5] He Y F, Wang R M, Liu Y Y, et al. Study on oxidation mechanism of cumene based on GC-MS analysis [J]. J Mol Catal A: Chem, 2000, 159 (1):109-113
[6] 刘明鑫, 许志美, 孙伟振等. 非催化条件下异丙苯液相过氧化反应动力学 [J]. 化工学报, 2015, 66(5):1710-1715. Liu Mingxin, Xu Zhimei, Sun Weizhen, et al. Reaction kinetics of non-catalytic peroxidation of liquid phase isopropyl benzene [J].Journal of Chemical Industry and Engineering, 2015, 66(5):1710-1715.
[7] Somma I D, Marotta R, Andreozzi R, et al. Dicumyl peroxide thermal decomposition in cumene: development of a kinetic model [J]. Ind Eng Chem Res, 2012, 51 (22):7493–7499.
[8] Bhattacharya A. Kinetic modeling of liquid phase autoxidation of cumene [J]. Chem Eng J. 2008, 137(2):308-319.
Process Research of Cumene Hydroperoxide by Peroxidation of Cumene
Zhang Lijun, Gao Huanxin, Xu Ming
Shanghai Research Institute of Petrochemical Technology, SINOPEC, Shanghai 201208, China
Cumene oxidation is an important process in industrial production of acetone and phenol. In this paper, the packed column reaction process was firstly studied and optimized. With efficient loading and packing, gas-liquid mass transfer could be reinforced, thus the efficiency of the oxidation reaction is greatly improved. Secondly, through optimization of initiating agent, space velocity and reaction temperature, the reaction induction period was completely eliminated with a substantial increase in oxidation rate and oxygen conversion rate of the oxidation products. The impurities in the oxidation products met the industrial indexes. Finally, the reaction conditions were optimized as the reaction temperature of 85-100 ℃, pressure of 0.20-0.30 MPa and the volume space velocity of 12-18 h-1. The CHP concentration in the final product was greater than 24% (w) and the tail oxygen concentration was less than 6%.
cumene; oxidation; cumene hydroperoxide; packed column

