缺氧诱导因子1α调控claudin-1蛋白表达对肠道粘膜屏障功能的影响
徐卫华,高胜东
孝昌县第一人民医院消化内科(湖北 孝昌 432900)
缺氧诱导因子1α调控claudin-1蛋白表达对肠道粘膜屏障功能的影响
徐卫华,高胜东
孝昌县第一人民医院消化内科(湖北 孝昌 432900)
目的观察缺氧诱导因子1α(HIF1α)对紧密连接蛋白claudin-1及肠道屏障功能的影响。方法在常氧和缺氧条件下培养大鼠小肠上皮细胞系IEC-6细胞,Elisa法检测HIF1α的分泌,RT-PCR及免疫印迹法观察claudin mRNA和蛋白表达,肠上皮细胞跨上皮电阻检测通透性。结果与常氧组比较,缺氧可明显增加HIF1α分泌,减少claudin-1蛋白表达,减小跨上皮电阻(P<0.01;P<0.001)。以重组HIF1α处理常氧状态下IEC-6细胞24~72 h,可明显抑制claudin-1的mRNA表达(P<0.01;P<0.001)。结论缺氧状态下IEC-6细胞分泌HIF1α增多,抑制claudin-1表达,进而增强肠上皮细胞通透性,导致屏障功能受损。
缺氧诱导因子1α;Claudin-1;缺氧;肠道屏障功能
【Abstract】Objective To observe the effects of Human hypoxia-inducible factor 1α (HIF1α) on claudin-1 expression and intestinal epithelial barrier function.Methods Intestinal epithelial cell line IEC-6 was cultured under the condition of normal oxygen and hypoxia. HIF1α secretion from IEC-6 was measured by Elisa and the expression of claudin-1 mRNA and protein was detected by reverse transcription-polymerase chain reaction and western blot,respectively.Transepithelial electrical resistance was measured by resistance test instrument.Results Compared with the normoxia group,HIF1α secretion significantly increased in the hypoxia group and suppressed claudin-1 protein expression.Moreover,transepithelial electrical resistance was also reduced under hypoxia.IEC-6 cells under normoxia condition with recombinant HIF1α suppressed claudin-1 mRNA expression.Conclusions Under the hypoxia condition, HIF1α was increasingly secreted from IEC-6 cells and it suppressed claudin-1 expression,which in turn enhanced intestinal permeability and resulted in intestinal epithelial barrier dysfunction.
【Key words】Human hypoxia-inducible factor 1α;Claudin-1;hypoxia;intestinal epithelial barrier function
肠黏膜机械屏障主要由紧密连接(tight junction,TJ)这一结构组成,为选择性屏障,可阻止大多数亲水性溶质透过[1]。TJ主要由相关蛋白复合物组成,成员包括claudin、 occludin家族、ZO(zonula occludens)家族、连接黏附分子等,其中最主要的结构蛋白为claudin-1[2]。大量研究表明,肠黏膜屏障功能调控与局部缺氧关系密切。缺氧可导致缺氧诱导因子1α(HIF1α)稳定表达[3]。然而HIF1α是否参与调控claudin-1表达,进而影响肠黏膜屏障功能尚不清楚。本研究通过体外细胞实验观察HIF1α在缺氧条件下对claudin-1表达以及肠上皮屏障功能的调控作用。
1 材料与方法
1.1主要试剂及仪器大鼠小肠上皮细胞系 IEC-6细胞购自中国科学院细胞库;HIF1α购自艾美捷科技有限公司;HIF1α ELISA试剂盒购自R&D Systems中国分公司;胎牛血清、胰蛋白酶购自美国Sigma 公司;抗大鼠闭合蛋白(claudin-1)购自美国Abcam公司;Transwell小室、Millicell ERS-2电阻测定仪、化学发光检测试剂盒、PVDF膜均购自美国Millipore公司;电泳仪、垂直电泳仪购自美国 BioRad公司;Trizol,RT-PCR引物及RT-PCR相关试剂盒购自上海捷瑞生物工程有限公司。
1.2IEC-6的培养与分组IEC-6细胞在 37℃、5% CO2饱和湿度的条件下用含10% 胎牛血清及100 U/L胰岛素的DMEM高糖培养基培养。细胞培养至90%以上融合后分为常氧组(21%氧浓度)培养24 h、缺氧组(2%氧浓度)培养4 h后,改用常氧继续培养20 h。
1.3Elisa法检测HIF 1α采用双抗体夹心酶联免疫吸附实验(ELISA)方法,参照试剂盒说明书进行,于酶标仪上测定450 nm处的吸光度值。每孔设3个复孔,取平均值。
1.4RNA的提取及RT-PCR检测IEC-6细胞以 6×105密度每孔接种于6孔板中,培养至90%以上融合后施加HIF1α处理24 h。之后以预冷PBS漂洗细胞,每孔加入1 mL Trizol,按说明书步骤提取总RNA并定量后,取1 μg按照 Primescript逆转录试剂盒进行逆转录 (20 μL体系),合成cDNA。RT-PCR扩增条件:95℃ 5 min,94℃ 45 s,55~58℃ 30 s,72℃ 45 s,共30个循环, 最后72℃延伸10 min。取8 mL PCR扩增产物行琼脂糖凝胶电泳,以凝胶图像分析仪(Bio-Rad公司)Imaging软件分析 Claudin-1的灰度值,数据以检测基因与内参照 β-肌动蛋白灰度值比值表示。Claudin-1引物序列:上游5’-CCTGCCCCAATGGAAGATTT-3’,下游5’-CCGATGACAGCCATCCACAT-3’。β-肌动蛋白引物序列:上游5’-ACGGTCAGGTCATCACTACG-3’,下游5’-GGCATAGAGGT CTTTACGG ATG-3’。
1.5免疫印迹实验细胞处理后,加入蛋白裂解液收集蛋白后BCA法进行蛋白定量,按每孔蛋白上样量为30 μg进行SDS-PAGE电泳。之后将蛋白转移至PVDF膜上,用含5%小牛血清白蛋白的TBST溶液室温封闭30 min后,分别与抗claudin-1单克隆抗体,抗β-actin单克隆抗体4℃孵育过夜,洗膜后与二抗(HRP标记的鼠抗)室温孵育1 h,之后加入ECL试剂显影,采用凝胶图像分析仪(Bio-Rad公司)拍照,并对条带感光密度进行定量分析。
1.6肠上皮细胞跨上皮电阻(transepithelial electrical resistance,TER)检测IEC-6细胞以 5×105密度每孔接种于24孔板的Transwell小室内,24 h更换培养基,并用电阻测定仪测定TER,待期数值稳定后进行缺氧处理,之后检测处理TER值,以原始数值减去空白对照 (小室内未接种细胞)数值表示。
2 结果
2.1缺氧导致HIF 1α表达增加、claudin-1表达降低与常氧组比较,缺氧4 h后继续培养细胞至24 h、48 h、72 h,ELISA结果显示HIF 1α表达增多,最高峰为48 h,差异有显著统计学意义(P<0.01;P<0.001),见表1。与常氧组比较,缺氧4 h后继续培养细胞至24 h、48 h、72 h,免疫印迹结果显示claudin-1显著下降,以缺氧后48 h表达量最低,差异有显著统计学意义(P<0.01;P<0.001),见图1。
表1 缺氧对不同培养时间IEC-6 HIF 1α
注:与常氧组比较,*P<0.01;**P<0.001。

图1 免疫印迹法检测常氧组(对照)、缺氧后不同时间Claudin-1蛋白表达 A. 免疫印迹蛋白条带。CON:常氧组;1:缺氧4 h后培养24 h组;2:缺氧4 h后培养48 h组;3:缺氧4 h后培养72 h组。B.灰度分析统计图。n=3,与对照组比较,*P<0.01;**P<0.001。
2.2缺氧降低TER与常氧组比较缺氧4 h后继续培养细胞至24 h、48 h、72 h,TER明显降低,以48 h降低为最大幅度,差异有统计学意义(P<0.01;P<0.001),见表2。
表2缺氧对IEC-6 TER的影响

组别培养24h培养48h培养72h常氧组126.6±10.8134.5±11.6140.8±11.5缺氧组90.4±8.6*71.5±8.2**88.6±10.3*
注:与常氧组比较,*P<0.01;**P<0.001。
2.3降低IEC-6细胞claudin-1 mRNA表达在常氧状态下,以重组HIF 1α蛋白(10 ng/mL)处理IEC-6细胞 24~72 h后,可见claudin-1 mRNA表达明显下调,呈时间依赖性(P<0.01;P<0.001),见图2。
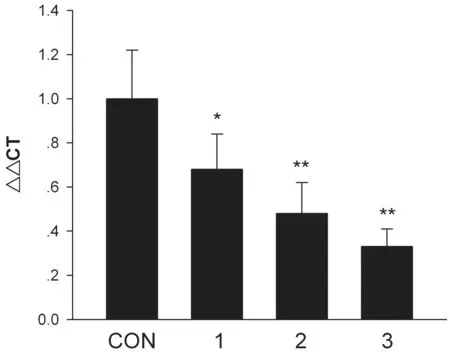
图2 RT-PCR检测常氧条件下HIF 1α组处理IEC-6细胞24~72 h后Claudin-1 mRNA表达 CON:对照组,未加HIF 1α处理;1:HIF 1α处理24 h组;2:HIF 1α处理48 h组;3:HIF 1α处理72 h组。n=3,与对照组比较,*P<0.01;**P<0.001。
3 讨论
正常的肠道屏障功能可阻止肠腔内细菌、内毒素等抗原侵入机体,具有重要的防御作用。在各种内外病理性因素如应激、感染等刺激之下,肠上皮屏障功能受损,通透性增加,肠道细菌、内毒素等可进入全身血循环,严重者可引发全身性炎症反应综合征、多器官功能障碍等[4-5]。肠道屏障可分为机械屏障、免疫屏障、生物屏障和化学屏障,其中以机械屏障最为重要。近年来的研究表明,多种内外病理性因素刺激可导致肠道局部微环境缺氧,导致肠道的机械屏障功能受损,但其机制并不十分清楚[6]。本组结果表明,缺氧可诱导肠道上皮细胞表达HIF1α表达增多,后者可抑制TJ关键性的结构蛋白claudin-1的表达,进而影响肠道机械屏障功能。
在缺氧条件下,细胞最重要的应答反应之一即为HIF1α的诱导性表达上调。HIF1α普遍存在于人和哺乳动物细胞内,在常氧状态下(21%O2)有低度表达,但其在缺氧条件下才可稳定表达[7]。HIF1α蛋白N末端和C末端均存在反式激活结构域(transactivationdomain,TAD),即TAD-C和TAD-N,其中TAD-C发挥精细调整作用,TAD-N为激活转录所必需。作为参与缺氧适应性反应的重要核转录因子,表达增加的HIF1α蛋白转位入细胞核,与HIF1β形成异源二聚体复合物,后者识别并与靶基因调控序列的缺氧反应元件(hypoxiaresponseelement,HRE)相结合,调控靶基因的表达[8]。本研究结果显示,claudin-1 表达受到HIF1α蛋白调控,说明claudin-1基因为HIF1α的靶基因。基因启动子序列分析发现,claudin-1基因启动子区域存在多个HRE序列,这可能是HIF1α发挥作用的基础。后续我们将进一步采用染色质免疫沉淀的方法,对二者之间的结合进行确认。
TJ的分子成分包括细胞之间内在的跨膜蛋白、连接粘附分子和若干胞质附着蛋白,其中claudin是TJ最重要的结构基础[9]。claudins属于跨膜蛋白,目前已发现其有24个家族成员,其中claudin-1是组成TJ的必要组成部分,其蛋白羧基端和氨基端都在胞质与构成细胞骨架的肌动蛋白相连。多种疾病与claudin-1 蛋白表达或突变有关。例如慢性酗酒患者肠屏障性结构受损,这与claudin-1表达降低有关[10];claudin-1蛋白基因缺乏与致死性皮肤渗透性缺陷病密切相关等[11]。本研究发现,claudin-1表达降低的同时,肠上皮细胞跨上皮电阻明显降低,说明肠上皮黏膜屏障功能受损。他人的工作也表明:以特异性抑制剂环巴胺阻止claudin-1蛋白表达下调后,可改善缺氧导致的肠上皮细胞屏障功能损伤。
综上所述,缺氧状态下IEC-6细胞分泌HIF1α增多,可抑制claudin-1表达,进而增强肠上皮细胞通透性,导致屏障功能受损。进一步对claudin在TJ中的结合方式、调节过程等方面开展研究,将为缺氧所致的肠上皮黏膜屏障功能受损提供新的防治靶点。
[1]PijlsKE,JonkersDM,ElaminEE,etal.Intestinalepithelialbarrierfunctioninlivercirrhosis:anextensivereviewoftheliterature[J].LiverInt,2013,33(10):1 457-1 469.
[2]BarmeyerC,SchulzkeJD,FrommM.Claudin-relatedintestinaldiseases[J].SeminCellDevBiol,2015(42):30-38.
[3]ZhengL,KellyCJ,ColganSP.Physiologichypoxiaandoxygenhomeostasisinthehealthyintestine.AReviewintheTheme:CellularResponsestoHypoxia.AmJPhysiolCellPhysiol,2015,309(6):350-360.
[4]谭小宇,张晟晃,陈念平.ω-3多不饱和脂肪酸对梗阻性黄疸肠道屏障保护作用的研究[J].湖北民族学院学报(医学版),2008,24(4):24-26.
[5]MárquezM,FernándezGutiérrezdellamoC,Girón-GonzálezJA.Gutepithelialbarrierdysfunctioninhumanimmunodeficiencyvirus-hepatitisCviruscoinfectedpatients:Influenceoninnateandacquiredimmunity[J].WorldJGastroenterol,2016,22(4):1 433-1 448.
[6]LeiQ,QiangF,ChaoD,etal.AmeliorationofhypoxiaandLPS-inducedintestinalepithelialbarrierdysfunctionbyemodinthroughthesuppressionoftheNF-κBandHIF-1αsignalingpathways[J].IntJMolMed,2014,34(6):1 629-1 639.
[7]ScholzCC,TaylorCT.TargetingtheHIFpathwayininflammationandimmunity[J].CurrOpinPharmacol,2013,13(4):646-653.
[8]NguyenMP,LeeS,LeeYM.Epigeneticregulationofhypoxiainduciblefactorindiseasesandtherapeutics[J].ArchPharmRes,2013,36(3):252-263.
[9]KwonMJ.Emergingrolesofclaudinsinhumancancer[J].IntJMolSci,2013,14(9):18 148-18 180.
[10]WangY,TongJ,ChangB,etal.Effectsofalcoholonintestinalepithelialbarrierpermeabilityandexpressionoftightjunction-associatedproteins[J].MolMedRep,2014,9(6):2 352-2 356.
[11]WatoK,HaraT,YamanaK,etal.Aninsightintotheroleofbarrierrelatedskinproteins[J].IntJPharm,2012,427(2):293-298.
责任编辑:牟冬生
Human Hypoxia-Inducible Factor 1α Suppresses Claudin-1 Expression and Impairs Intestinal Epithelial Barrier Function
Xu Weihua,Gao Shengdong
(Department of Digestion in the First People′s Hospital of Xiaochang,Xiaochang 432900,China)
国家自然科学基金青年项目(81302112)。
徐卫华(1968- ),男,湖北孝昌人,副主任医师,研究方向:炎症性肠病。
R363
A
1008-8164(2016)02-0006-04
2016-03-05

