首乌方对左旋多巴诱发异动症模型大鼠脑内氨基酸类神经递质水平的影响
刘 洋,焦 玥,孙丹丹,王丹巧,赵小亮,李 涛,张美玉
(中医药防治重大疾病基础研究北京市重点实验室 中国中医科学院医学实验中心, 北京 100700)
首乌方对左旋多巴诱发异动症模型大鼠脑内氨基酸类神经递质水平的影响
刘洋,焦玥,孙丹丹,王丹巧,赵小亮,李涛,张美玉
(中医药防治重大疾病基础研究北京市重点实验室 中国中医科学院医学实验中心, 北京100700)
【摘要】目的观察中药首乌方(shou wu fang,SWF)对左旋多巴诱发异动症(levodopa-induced dyskinesias, LID)模型大鼠行为学指标及其脑内氨基酸类神经递质的影响,探讨首乌方干预异动症的作用机制。方法采用6-羟多巴胺(6-hydroxydopamine,6-OHDA)脑内立体定位注射造成偏侧帕金森病(parkinson’s disease,PD)大鼠模型,成模动物灌胃投予左旋多巴(levodopa, L-DOPA)或L-DOPA+不同剂量SWF,分为L-DOPA组、L-DOPA+SWF低剂量组、LID+SWF高剂量组,另设假手术组。所有动物连续给药22 d,给药期间对大鼠进行异常不自主运动(abnormal involuntary movement, AIM)评分。第 22天采用微透析技术对清醒大鼠纹状体细胞外液进行取样,并采用高效液相-荧光法检测样本中谷氨酸(glutamate, Glu)、γ-氨基丁酸(GABA)水平动态变化。结果大鼠给服L-DOPA后,逐渐出现AIM,至给药结束,与假手术组相比,L-DOPA组AIM评分显著升高(P < 0.01);与L-DOPA组相比,L-DOPA+SWF高剂量组AIM评分显著降低(P < 0.05)。第22天,与假手术组相比,各给药组大鼠纹状体细胞外液Glu、GABA水平升高,其中L-DOPA组Glu、GABA水平表现出统计学差异(P < 0.05);与L-DOPA组相比,L-DOPA+SWF高剂量组Glu水平明显降低(P < 0.05)。给药后60 min,L-DOPA+首乌方各剂量组Glu、GABA水平均显著低于L-DOPA组(P < 0.05, P < 0.01)。结论SWF能够减轻L-DOPA引起的副反应,改善LID大鼠行为学症状,其作用机制或与其改善LID大鼠脑内异常的氨基酸类神经递质水平有关。
【关键词】左旋多巴诱发异动症;首乌方;微透析;谷氨酸;γ-氨基丁酸
帕金森病(parkinson’s disease,PD)是临床常见的神经退行性疾病,多发于老年人。左旋多巴(levodopa,L-DOPA)自20世纪60年代问世以来,一直是治疗PD最有效的药物。然而,随病情的发展,长期使用此类药物会引起症状波动和运动并发症,如左旋多巴诱发异动症(levodopa-induced dyskinesis,LID)等[1]。值得注意的是,药物的副反应比疾病本身更加严重[2-3],运动并发症是晚期PD患者致残的重要原因[4]。这不仅给PD的治疗增加困难,也得病人带来更为沉重的生理、心理负担。因此,深入了解LID发病机制,减少或避免LID的产生,对于帕金森病的治疗具有重要意义。
中药首乌方(shou wu fang,SWF)是临床有效的中药复方,用于PD治疗。与L-DOPA配伍应用,可以减少L-DOPA用量,提高治疗组的总有效率[5]。课题组前期研究结果提示[6],SWF增加6-羟基多巴胺(6-OHDA)灌流后大鼠纹状体细胞外液DA递质的浓度,并使外源性L-DOPA引起的DA波动平缓,这在一定程度上提示了SWF或对LID始动环节具有干预作用。进一步研究表明SWF能够改善LID大鼠行为学症状,改善LID大鼠脑内糖类物质代谢障碍[7]、减轻LID大鼠纹状体内过氧化损伤[8],这在一定程度上提示了SWF干预LID发病的作用机制,然而,其深入的作用机制尚需要进一步探索。
本实验中采用L-DOPA诱发6-OHDA损毁致PD模型大鼠产生异动症,同时配伍SWF,大鼠纹状体细胞外液谷氨酸(glutamate)和γ-氨基丁酸(GABA)水平变化进行动态观察,从SWF调节脑内氨基酸类神经递质水平的角度,进一步对首乌方干预LID的作用机制进行探索,为临床中西药合用治疗帕金森病、防治西药引起的副反应提供思路。
1材料和方法
1.1材料
1.1.1实验动物
清洁级雄性SD大鼠24只,7周龄,体重200~250 g。购于北京维通利华实验动物技术有限公司【SCXK(京)2010-0001】。实验动物饲养于中国中医科学院基础理论研究所实验动物中心【SYXK(京)2010-0021】,温度控制在24℃,自由饮食饮水,每日12 h光照。
1.1.2试剂与药品
6-羟多巴胺(6-hydroxydopamine,6 OHDA)、抗坏血酸(antiscorbic acid)、谷氨酸(glutamate,Glu)、γ-氨基丁酸(GABA)为Sigma公司产品;阿扑吗啡为中国食品药品检定研究所提供;美多芭(0.25 g/片,每片含L-DOPA 200 mg+苄丝肼50 mg)为上海罗氏公司产品(批号:SH1556);复方氯化钠注射液为北京双鹤药业股份有限公司产品,首乌方水煎液由课题组自行制备。
1.1.3仪器设备
脑内微透析系统为瑞典CMA公司产品,包括:CMA/12探针(透析膜长4 mm)及探针套管、CMA/120清醒动物装置、CMA/102微量泵、CMA/W70低温样品自动收集器;其他:微量进样针为上海高鸽工贸有限公司产品;大鼠脑立体定位仪STRONG8003、动物体温维持仪-69001、颅钻/90-102购自深圳瑞沃德公司。
1.2方法
1.2.1造模与分组
参考文献报道方法[9],SD大鼠脑内右侧黑质致密部(substantia nigra compacta,SNc)、中脑腹侧被盖部(ventral tegmental area,VTA)注射6-OHDA建立PD模型;假手术组在相同位点注射含0.05% antiscorbic acid的生理盐水,其余操作均与模型组相同。注射后3周,大鼠皮下注射阿扑吗啡(0.5 mg/kg),待出现稳定旋转症状后,记录1 h内大鼠向健侧旋转总圈数,大于100 圈/h即视为PD模型制作成功[10]。成模动物随机分为L-DOPA组、L-DOPA+SWF低剂量组、L-DOPA+SWF高剂量组。另设假手术组。1.2.2L-DOPA诱发LID及给药
L-DOPA组大鼠给投予美多芭(30 mg/kg/d,相当于L-DOPA 24 mg+ 苄丝肼 6 mg,以下相同,灌胃给药(intragastric administration,i.g.),L-DOPA+SWF低剂量组组投予美多芭(30 mg/kg/d)及低剂量首乌方水煎液(生药量18 g/kg/d,i.g.),L-DOPA+SWF高剂量组组投予美多芭(30 mg/kg/d)及高剂量首乌方水煎液(生药量36 g/kg/d,i.g.),假手术组投予等体积纯水(i.g.)。给药1次/d,连续给药22 d。1.2.3异常不自主运动(abnormal involuntary movement, AIM)评分
参照文献方法[11-12],于给药第 1、7、14、21天对各组大鼠进行AIM评分,每30 min评分1次,评价持续120 min(共评分4次)。AIM包括刻板动作和对侧旋转行为,其中刻板动作又包括上肢AIM、轴性AIM和口面部AIM。根据其症状有或无以及严重程度划分为五个等级(0~4分),其中0分:无;1分:偶尔出现;2分:经常出现;3分:持续存在,刺激使之停止;4分:持续存在,刺激也不能使之停止(理论上每只动物最高评分为64分)。
1.2.4大鼠清醒状态下纹状体微透析取样
给药第21天,末次行为学评价后,大鼠采用腹腔注射10%水合氯醛(0.35 mL/100 g)进行麻醉,头颅水平位固定在脑立体定位仪上,于大鼠脑右侧纹状体内(A:+0.2 mm,R:+3.0 mm,V:-3.5 mm)埋入探针套管。次日,大鼠在清醒自由活动状态下插入微透析探针。用复方氯化钠溶液以2.5 μL/min的速度灌流,平衡60 min后,开始收集透析液,每30 min收集1管,灌流至90 min时动物灌胃给药1次,继续灌流至240 min。取前3管收集液测定目标检测物,计算均值作为基础水平(0 min),透析液收集方案见图1。
图1 透析液收集方案Fig.1 Dialysate collection protocol
1.2.5纹状体透析液中Glu、GABA含量测定
衍生液配制:将5 mg OPA溶于120 μL甲醇中,加入10 μL β-巯基乙醇和1 mL 0.2 mol·L-1硼酸缓冲液(pH 9.2),混匀,放于暗处。流动相:A液为缓冲液:甲醇:四氢呋喃(V∶V∶V=400∶95∶5);B液为缓冲液:甲醇(V∶V)=120∶380(缓冲液为20 mmol·L-1乙酸钠溶液,pH 7.2)。流速:0.8 mL/min;PMT:12;柱温:40 ℃。梯度洗脱:0~10 min为0%~63%,B液;10~12 min为63%B液;12~17 min为100%B液;17~18 min为100%~0%B液;18~21 min为0%B液。OPA柱前自动衍生,激发波长:340 nm,发射波长:455 nm。
1.3数据分析与统计

2结果
2.1SWF对LID大鼠行为学的影响
个别大鼠首次给药后即出现轻微异动症症状,随给药时间增加,各组大鼠均逐渐表现出较为严重的异动症症状,表现为吐舌、首尾相接状像健侧发生旋转、健侧前肢呈拍打样动作、颈部向健侧扭转,身体失去平衡、跌倒等(见图2)。给药至第21天,与假手术组相比,各给药组AIM评分均明显升高,其中L-DOPA组AIM评分差异显著(P< 0.01);与L-DOPA组相比,L-DOPA+SWF高剂量组AIM评分较低,差异有统计学意义(P< 0.05)。数据见表1。

注: A:躯干肌肉张力障碍,左前肢拍打样动作;B:向健侧发生旋转;C:重复性咀嚼样动作,伴有偶尔吐舌;D:轴性张力障碍,躯干向健侧扭转。图2 LID大鼠行为学症状Note: A:Muscular dystonia with repetitive movements of the left forelimb;B:Contraversive rotation, contralateral to the dopamine-denervated striatum;C:Repetitive chew-like movements associated with protrusion of the tongue;D:Axial dystonia manifested as contraversive rotation, contralateral to the dopamine-denervated striatum.Fig.2 Behaviors of LID model rats


分组Group异常不自主运动评分AIMscore第1天1days第7天7days第14天14days第21天21days假手术Sham0.0±0.00.0±0.0*0.0±0.0*0.0±0.0*左旋多巴L-DOPA2±327±17#30±15##36±16##左旋多巴+首乌方(低剂量)L-DOPA+SWF(L)2±212±9 17±19 20±20 左旋多巴+首乌方(高剂量)L-DOPA+SWF(H)1±28±125±5*9±9*
注:与假手术组比较,#P<0.05,**##P<0.01;与L-DOPA组比较,*P<0.05,**P<0.01。
Note: v.s. Sham,#P<0.05,**##P<0.01; v.s. LID,*P<0.05,**P<0.01.
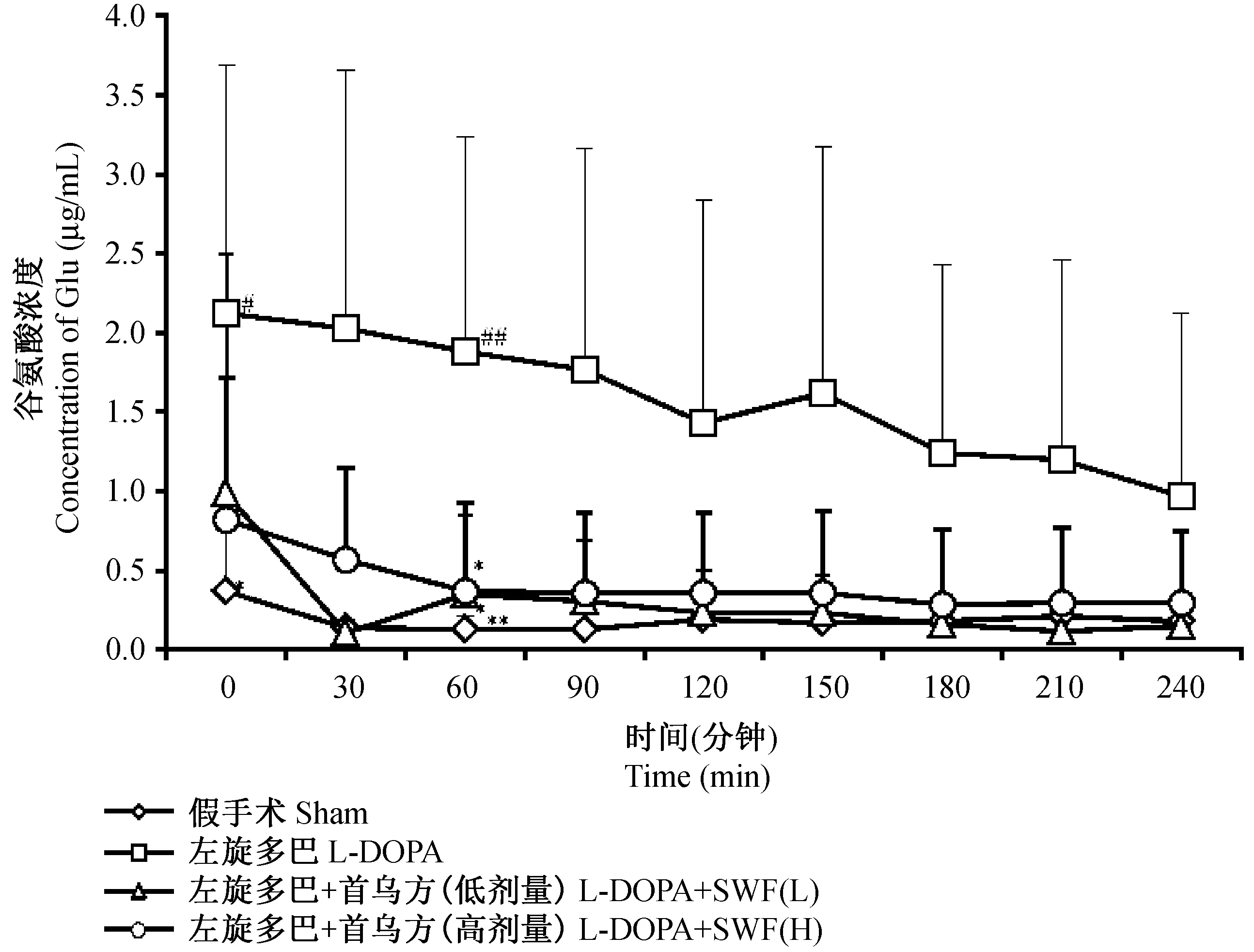
注:与假手术组比较,# P<0.05, ## P<0.01;与L-DOPA组比较,*P<0.05, **P<0.01。图4 首乌方对异动症模型大鼠纹状体Glu水平的影响 ±s, n=6)Note: v.s. Sham, # P<0.05, **## P<0.01; v.s. LID, *P<0.05, **P<0.01.Fig.

注:与假手术组比较,# P<0.05, ##P<0.01。与L-DOPA组比较,*P<0.05, **P<0.01。图5 首乌方对异动症模型大鼠纹状体GABA水平的影响 ±s, n=6)Note: v.s. Sham, # P<0.05, ##P<0.01, v.s. LID, *P<0.05, **P<0.01.Fig.
0 min,与假手术组相比,给药组大鼠纹状体内Glu含量增加,其中L-DOPA组显著升高(P<0.05);与L-DOPA组相比,L-DOPA+SWF组大鼠纹状体内Glu水平降低,但差异无统计学意义。末次给药后60 min,L-DOPA组Glu水平显著高于假手术组(P<0.01);与L-DOPA组相比,L-DOPA+首乌方各剂量组Glu水平均降低(P<0.05)。60 min后,各组间Glu水平虽未见显著差异,但透析0~240 min内,L-DOPA组Glu水平始终高于其他各组,数据见图4。

与假手术组相比,给药组大鼠纹状体内GABA含量增加,L-DOPA组显著升高(P<0.05);与L-DOPA组相比,L-DOPA+SWF各剂量组大鼠纹状体内GABA水平降低,但差异无统计学意义。末次给药后60 min,与假手术组相比,L-DOPA组GABA水平显著高于假手术组(P<0.01);与L-DOPA组相比,L-DOPA+首乌方各剂量组GABA水平均降低(P<0.01)。60 min后,L-DOPA组GABA水平始终高于给药组,但差异无统计学意义,数据见图5。
3讨论
左旋多巴诱发异动症(levodopa-induced dyskinesis,LID)发生机制复杂,纹状体多巴胺(DA)耗竭被公认为是LID发生的重要病理学因素[13],然而一些严重PD模型动物始终未出现LID[14-15],这表明,LID的发生、发展还涉及到其他一些重要因素。近年来,非多巴胺能神经递质在LID发生中的作用受到越来越多的关注,如氨基酸类、神经肽类、胆碱类等。其中,Glu和GABA作为体内重要的兴奋性和抑制性神经递质[16],均与PD、LID的发生有着密切关系。有学者[17]提出,LID发生是由于纹状体多巴胺D1受体和D2受体分别介导的直接通路和间接通路活动失衡,最终导致基底节-丘脑-皮质环路活动异常。直接通路的活化引起大脑皮层释放传递至纹状体区的Glu增加,而GABA释放的增加同样可以反映直接通路的过度激活在LID发生中的作用[18]。因此,以上研究结果提示Glu、GABA参与LID过程,但目前研究成果尚不能完全揭示Glu、GABA等氨基酸类神经递质参与LID发生、发展的机制。
对于LID的治疗,目前主要包括应用长效DA制剂、氨基酸受体拮抗剂、神经保护剂、立体定向苍白球损毁术等,但效果并不令人满意。值得肯定的是,中医中药对于神经退行性疾病的治疗体现出独特的优势。首乌方是根据古方记载、参考现代研究、结合课题组人员的临床经验优选出的中药复方,由首乌、鹿茸、天麻、钩藤、等中药组成。现代药理研究表明,方中药物的提取物及相关制剂对神经元损伤模型动物具有神经保护作用[19-21],这为首乌方治疗神经退行性疾病提供了药理学基础。临床上,首乌方与L-DOPA配伍应用,可以减少L-DOPA用量,提高治疗组的总有效率[22]。课题组前期研究中采用清醒自由活动大鼠血-脑双位点微透析采样的方法,同步观察首乌方对L-DOPA在帕金森病(PD)大鼠血液和纹状体细胞外液药动学的影响。结果表明,首乌方能够减慢L-DOPA消除,增加血液L-DOPA的吸收,减少纹状体L-DOPA药物浓度波动[23]。而临床上认为L-DOPA小剂量、多次给药,减少L-DOPA血药浓度的波动,可能延缓LID的发生[24]。以上均提示首乌方可能对LID具有干预作用。
研究表明,对于6-OHDA损伤的大鼠慢性注射L-DOPA后,纹状体细胞变化与PD病人长程注射L-DOPA所展示的运动障碍相似[25],给6-OHDA损伤的大鼠长期注射L-DOPA,可复制出用为研究L-DOPA诱导运动障碍神经机制的动物模型[26]。该方法操作简单,结果较为稳定,可用于进行疾病相关的机制研究,评价药物对疾病的干预作用和药物机制研究等,是目前研究LID采用的常用动物模型之一。本研究中首先建立6-OHDA立体定向损毁PD大鼠模型,模型动物采用高剂量L-DOPA灌胃3周,诱发PD大鼠产生LID。依据文献报道,高剂量L-DOPA诱发PD大鼠产生LID的几率增加,同时也能够较早地诱发严重LID[27]。本研究中,PD模型大鼠给服L-DOPA后1~3周时间即出现LID,随给药时间延长,动物AIM症状逐渐加重,这与文献报道[28]结果基本一致。在行为学观察的基础上,本研究动态观察了LID大鼠纹状体内Glu和GABA含量的变化,结果与课题组前期研究结果及文献报道一致[29-30]。这可能与PD/LID状态下,皮质-纹状体谷氨酸投射系统活动增强有关。LID模型大鼠基底节谷氨酸转运体GLT1水平上升,Glu受体表达异常,Glu水平病理性升高[31-34],GABAA受体表达增加[35-36],GABA能神经元活性普遍提高[37]。同时,由于Glu经谷氨酸脱羧酶 67(GAD67)激活催化,生成GABA。与非LID状态的6-OHDA损伤大鼠模型相比,出现LID大鼠脑内纹状体、苍白球内GAD67活性增加,这可能也是LID大鼠纹状体内GABA含量显著增加的原因。经配伍首乌方,病理状态下异常升高的Glu和GABA水平下降,与假手术组水平趋于接近。
综上所述,首乌方配伍L-DOPA能够减轻LID模型大鼠的行为学异常症状,提示临床应用首乌方或能够达到对多巴胺替代疗法“增效减毒”的作用,其作用机制可能与其对纹状体内Glu、GABA水平的调节作用有关,本研究结果为进一步展开中药干预LID早期发病和减轻LID症状提供了实验依据。
[1]Ahlskog JE, Muenter MD. Frequency of levodopa-related dyskinesias and motor fluctuations as estimated from the cumulative literature [J]. Mov Disord, 2001, 16 (3): 448-458.
[2]Zesiewicz TA, Sallivan KL, and Hauser RA. Levodopa induced dyskinesia in Parkinson′s disease: epidemiology, etiology, and treatment[J]. Curr Neurol Neurosci Rep, 2007, 7 (4): 302-310.
[3]Tse W. Optimizing pharmacotherapy: strategies to manage the wearing-off phenomenon [J]. J Am Med Dir Assoc, 2006, 7 (Suppl 2): 12-17.
[4]van Laar T. Levodopa-induced response fluctuations in patients with Parkinson' s disease: strategies for management [J]. CNS Drugs, 2003, 17 (7): 475-489.
[5]李永梅, 李霞, 周兆丽. 何首乌提取物对百草枯引起的小鼠多巴胺神经元损伤的保护作用 [J]. 中国临床药理学杂志, 2007, 23 (5): 395-396.
[6]王丹巧, 王巍, 赵德忠. 建立脑内灌流6-OHDA所致大鼠纹状体细胞外液羟自由基升高的模型 [J]. 中国药理学通报, 2006, 22 (6): 765-768.
[7]刘洋, 焦玥, 孙丹丹, 等. 首乌方对美多芭诱发异动症模型大鼠行为学及脑内糖代谢的影响 [J]. 中华中医药杂志, 2015, 30 (1): 73-77.
[8]焦玥, 刘洋, 孙丹丹, 等. 首乌方对左旋多巴致异动症大鼠的干预作用及其机制 [J]. 中国生化药物杂志, 2015, 35 (02): 1-4, 9.
[9]管强, 曹学兵, 孙圣刚, 等. 左旋多巴诱发异动症大鼠纹状体神经元电生理活动的变化 [J]. 中华神经医学杂志, 2006, 5 (9): 875-879.
[10]Justin D Oh, Christina L Vaughan, Thomas N Chase. Effect of dopamine denervation and dopamine agonist administration on serine phosphorylation of striatal nmda receptor subunits [J]. Brain Res, 1999, 821 (2): 433-442.
[11]Lee CS, Cenci MA, Schulzer M,etal. Embryonic ventral mesencephalic grafts improve levodopa- induced dyskinesia in a rat model of Parkinson disease [J]. Brain, 2000, 123 (Pt 7): 1365-1379.
[12]徐岩, 孙圣刚, 曹学兵. 左旋多巴诱发异动症大鼠模型的制作及其行为学评估 [J]. 中华物理医学与康复杂志, 2005, 27 (11): 649-652.
[13]Boyce S, Rupniak NM, Steventon MJ,etal. Nigrostriatal damage is required for induction of dyskinesias by L-DOPA in squirrel monkeys [J]. Clin Neuropharmacol, 1990, 13 (5): 448-58.
[14]Guigoni C, Dovero S, Aubert I, Li Q,etal. Levodopa-induced dyskinesia in MPTP-treated macaques is not dependent on the extent and pattern of nigrostrial lesioning [J]. Eur J Neurosci, 2005, 22 (1): 283-287.
[15]Cenci MA, Lee CS, and Björklund A. L-DOPA-induced dyskinesia in the rat is associated with striatal overexpression of prodynorphin- and glutamic acid decarboxylase rnRNA [J]. Eur J Neurosci, 1998, 10 (8): 2694-2706.
[16]Watanabe M, Maemura K, Kanbara K,etal. GABA and GABA receptors in the central nervous system and other organs [J]. Int Rev Cytol, 2002, 213: 1-47.
[17]Obeso JA, Rodriguez-Oroz MC, Rodriguez M,etal. Pathophysiology of levodopa-induced dyskinesias in Parkinson’s disease: problems with the current model [J]. Ann Neurol, 2000, 47 (4 Suppl 1): S22-32.
[18]Flora Mela, Matteo Marti, Simone Bido,etal. In vivo evidence for a differential contribution of striatal and nigral D1 and D2 receptors to l-DOPA induced dyskinesia and the accompanying surge of nigral amino acid levels [J]. Neurobiol Dis, 2012, 45 (1): 573-582.
[19]李永梅, 李霞, 周兆丽. 何首乌提取物对百草枯引起的小鼠多巴胺神经元损伤的保护作用 [J]. 中国临床药理学杂志, 2007, 23 (5): 395-396.
[20]周琳, 袁梦石, 夏健, 等. 何首乌制剂在Aβ致海马神经元凋亡中的Bax表达 [J]. 中风与神经疾病杂志, 2006, 23 (2): 143-145.
[21]杨建宇, 杨扬, 张小超, 等. 天麻醒脑胶囊对血管性痴呆动物认知功能障碍的影响 [J]. 中药药理与临床, 2009, 25 (1): 56-59.
[22]崔玲, 于向东, 崔军. 自拟补肾平颤方配合美多巴片治疗帕金森病的临床疗效观察 [J]. 中国中西医结合杂志, 2003, 23 (7): 504-507.
[23]孙晓芳, 王丹巧, 吴兆恩, 等. 首乌方对帕金森病模型大鼠血液和纹状体细胞外液左旋多巴药代动力学影响的研究 [J]. 中国实验方剂学杂志, 2011, 17 (11): 111-115.
[24]Rodriguez-Oroz MC, Marin C, de Fabregues O. Continuous dopaminegic stimulation: clinical aspects and experimental bases [J]. Neurologist, 2011, 17 (6 Suppl): 30-37.
[25]范凯, 马坚妹, 马晓凯. 6-羟多巴胺脑内注射制备帕金森病大鼠模型的研究[J]. 中国实验动物学报, 2005, 13 (1): 20-22.[26]Henry B, Crossman AR, Brot chie JM,etal. Characterization of enhanced behavioral responses to L-DOPA following repeated administration in the 6-hydroxydopamine- lesioned rat model of Parkinson’s disease [J]. Exp Neurol, 1998, 151 (2): 334- 342.[27]Lindgren HS, Rylander D, Ohlin KE,etal. The “motor complication syndrome” in rats with 6-OHDA lesions treated chronically with L-DOPA: relation to dose and route of administration [J]. Behav Brain Res, 2007, 177 (1): 150-159.[28]徐岩, 孙圣刚, 曹学兵. 左旋多巴诱发异动症大鼠模型的制作及其行为学评估 [J]. 中华物理医学与康复杂志, 2005, 27 (11): 649-652.
[29]吴兆恩, 王丹巧, 李鹏, 等. 帕金森病6-OHDA模型大鼠左旋多巴血药浓度与纹状体细胞外液氨基酸类递质结合研究的方法 [J]. 中国药理学通报, 2010, 26 (10): 1395-1399.
[30]浦政, 戚辰, 干静, 等. 左旋多巴给药频度与异动症大鼠纹状体神经递质 [J]. 中国现代医学杂志, 2013, 23 (11): 31-35. [31]Mela F, Marti M, Bido S,etal. In vivo evidence for a differential contribution of striatal and nigral D1 and D2 receptors to L-DOPA induced dyskinesia and the accompanying surge of nigral amino acid levels [J]. Neurobiol Dis 2012; 45 (1): 573-582.[32]Jonkers N, Sarre S, Ebinger G,etal. MK801 suppresses the L-DOPA- induced increase of glutamate in striatum of hemi-Parkinson rats [J]. Brain Res, 2002, 926 (1-2): 149-155.
[33]Robelet S, Melon C, Guillet B,etal. Chronic LDOPA treatment increases extracellular glutamate levels and GLT1 expression in the basal ganglia in a rat model of Parkinson’s disease [J]. Eur J Neurosci, 2004, 20 (5): 1255-1266.
[34]Dupre KB, Ostock CY, Eskow Jaunarajs KL,etal. Local modulation of striatal glutamate efflux by serotonin 1A receptor stimulation in dyskinetic, hemiparkinsonian rats [J]. Exp Neurol, 2011, 229 (2): 288-299.
[35]Calon F, Goulet M, Blanchet PJ,etal. Levodopa or D2 agonist induced dyskinesia in MPTP monkeys: correlation with changes in dopamine and GABAA receptors in the striatopallidal complex [J]. Brain Res, 1995, 680 (1-2): 43-52.
[36]Calon F, Morissette M, Rajput AH,etal. Changes of GABA receptors and dopamine turnover in the postmortem brains of parkinsonians with levodopa-induced motor complications [J]. Mov Disord, 2003, 18 (3): 241-253.
[37]Levy R, Herrero MT, Ruberg M,etal. Effects of nigrostriatal denervation and L-dope therapy on the GABAergic neurons in the striatum in MPTP - treated monkeys and Parkinson' s disease: an in situ hybridization study of GAD67 mRNA [J]. Eur j Neurosci, 1995, 7 (6): 1199-1209.
〔修回日期〕2015-10-21
[基金项目]国家自然科学基金项目(81274121);中国中医科学院基本科研业务费自主选题项目(ZZ2012010)。
[作者简介]刘洋(1984-),女,助理研究员,研究方向:中药防治神经退行性疾病研究。Email: echoinapril@163.com。 [通讯作者]王丹巧(1959-),女,研究员,研究方向:中西医结合防治老年病相关研究。Email: dq_wang96@sohu.com。
【中图分类号】R-332
【文献标识码】A
【文章编号】1671-7856(2016) 01-0007-07
doi:10.3969.j.issn.1671.7856. 2016.001.002
Effect of shou wu fang on amino acids neurotransmitters in levodopa-induced dyskinesia model rats
LIU Yang, JIAO Yue, SUN Dan-dan, WANG Dan-qiao, ZHAO Xiao-liang, LI Tao, ZHANG Mei-yu
(Beijing Key Laboratory of TCM Basic Research on Prevention and Treatment of Major Disease, Experimental Research Center, China Academy of Chinese Medical Sciences, Beijing 100700, China)
【Abstract】Objective To investigate the effect of SWF on the behaviors and striatal levels of amino acids neurotransmitters of LID model rats,and to explore the effect of SWF on the mechanism of dyskinesias. Methods SD rats were injected with 6-hydroxydopamine (6-OHDA) to produce hemi-lateral nitro-striatum lesion. 6-OHDA lesioned rats were daily given L-DOPA, or L-DOPA plus SWF at different doses. Sham group was also established. All rats were treated for 22 days, once per day. During the treatment, abnormal involuntary movements (AIMs) were evaluated. On 22nd day, in vivo microdialysis was used to collect striatal extracellular fluid as the rats were in sober and free-moving condition. All dialysates were analyzed by high performance liquid-fluorescence (HPLC-FLD) detection. ResultsAfter treatment of L-DOPA, 6-OHDA lesioned rats developed AIM. AIM scores of L-DOPA-treated rats were higher than the sham-operated rats (P<0.01). L-DOPA plus high dose of SWF-treated rats had lower AIM scores than L-DOPA-treated rats (P<0.05). On 22nd day, in L-DOPA-treated rats, striatal levels of glutamate and GABA increased (P<0.05) than sham group. 60 min after last treatment, levels of glutamate and GABA in L-DOPA-plus SWF-treated rats were significantly lower than the sham-operated and L-DOPA plus SWF-treated rats (P<0.05, P<0.01). ConclusionsThe findings in this study suggested that as SWF was combined, side effects of L-DOPA mitigated as AIMs scale rating were reduced in LID rats. SWF protected 6-OHDA lesioned rats from LID by regulating abnormal striatal concentrations of glutamate and GABA.
【Key words】Parkinson’s disease (PD); Levodopa-induced dyskinesia (LID);Shou wu fang (SWF);Microdialysis;Glutamate;GABA

