慢性给予皮质酮对小鼠抑郁样行为和突触素的影响
孙秀萍,杨久山,徐艳峰,徐玉环,宋铭晶,秦 川
(1. 北京协和医学院比较医学中心,中国医学科学院北京协和医学院实验动物研究所,卫生部人类疾病比较医学重点实验室,国家中医药管理局人类动物模型三级实验室,北京 100021;2. 山东中医药大学附属医院,济南 250014)
慢性给予皮质酮对小鼠抑郁样行为和突触素的影响
孙秀萍1,杨久山2,徐艳峰1,徐玉环1,宋铭晶1,秦川1
(1. 北京协和医学院比较医学中心,中国医学科学院北京协和医学院实验动物研究所,卫生部人类疾病比较医学重点实验室,国家中医药管理局人类动物模型三级实验室,北京100021;2. 山东中医药大学附属医院,济南250014)
【摘要】目的通过饮入方式,慢性给予皮质酮,观察皮质酮对动物抑郁样行为和海马突触素的影响。 方法 c57雄性小鼠随机分为正常组和皮质酮组,每组10只。皮质酮组饮用含皮质酮的0.45%羟丙基-β-环糊精溶液,5 mg/kg/d。正常组动物给予0.45%羟丙基-β-环糊精溶液。造模35 d后,进行行为学实验。行为学实验结束后,动物灌注固定,应用免疫组化方法,检测突触素-1的表达。结果糖水偏爱测试结果表明,正常组和皮质酮组糖水偏爱指数无显著性差异(P >0.05)。强迫游泳实验结果表明,皮质酮组强迫游泳不动时间显著延长(P < 0.05)。空场实验结果显示,正常组和皮质酮组总路程和速度无显著性差异。皮质酮组中央区停留时间、路程及进入中央区频次减少,边缘区停留时间增加(P < 0.05,P < 0.01,P < 0.01,P< 0.01)。新奇抑制摄食实验结果表明,皮质酮组摄食潜伏期显著延长(P < 0.05),5 min内摄食量无变化。免疫组化结果显示,皮质酮组突触素-1表达显著下降(P < 0.05)。结论通过饮入方式,慢性给予皮质酮,动物出现抑郁样表现,可能与海马突触素-1表达减少,神经突触传递效能降低有关。
【关键词】皮质酮;抑郁;突触素;小鼠
应激生活事件是抑郁症发生发展的重要外因,海马是应激损伤的敏感区[1]。外源性的应激会引起下丘脑-垂体-肾上腺轴(hypothalamus-pitutary-adrenal,HPA)负反馈失调,促使体内糖皮质激素释放,通过一系列神经生化机制,导致海马、前额皮层等受损,出现抑郁症状[2]。啮齿类动物的糖皮质激素称为皮质酮(corticosterone,CORT)。皮质酮抑郁模型即基于上述应激理论而形成的一种神经内分泌模型。通过皮下注射、饮入等方式,增加动物体内的皮质酮水平,模拟抑郁症患者的神经生物学变化,用于抑郁症神经生化机制的研究[3]。近年来,神经突触功能失调和结构受损成为抑郁症病理基础的研究热点[4]。抗抑郁药物可能通过调控突触可塑性而非神经发生发挥抗抑郁作用[5]。突触素(synapsin-1,Syn-1)位于突触囊泡上,与突触结构和功能关系密切,其表达的水平可有效地反映突触的状态和功能[6]。本研究通过饮入方式,给予小鼠皮质酮,观察皮质酮对小鼠抑郁样行为及海马不同分区突触素表达的影响。
1材料和方法
1.1实验动物
SPF级c57雄性小鼠,8周龄,体重23~25 g。由北京华阜康生物科技股份有限公司提供【SCXK(京)2014-0004】,本实验在中国医学科学院医学实验动物研究所行为学实验室进行【SYXK(京)2014-0029】。动物自由进食进水,室内温度:23~25℃,相对湿度:(55±10)%。维持12 h光照/12 h黑暗的昼夜节律。动物适应环境一周进行实验。
1.2仪器
动物行为学视频跟踪系统(Noldus Information Technology,EthoVision XT,The Netherlands)
1.3实验方法
动物随机分为正常组和皮质酮组,每组10只。模型组动物皮质酮组参照文献[7],将皮质酮溶于0.45%羟丙基-β-环糊精溶液中,35 μg/mL/d(相当于5 mg/kg/d),避光,动物在造模和行为学检测期间连续饮用。正常组动物给予0.45%羟丙基-β-环糊精溶液。造模35 d后,进行行为学实验。行为学实验结束后,每组取3只动物,灌注固定,进行免疫组化检测。
1.3.1糖水偏爱测试
根据文献报道[8],糖水偏爱测试方法分为训练期和测试期。训练期内,使动物适应蔗糖饮水,第一个24 h,给予动物两瓶1%蔗糖水,第二个24 h,给予动物一瓶1%蔗糖水,一瓶纯水。测试前不禁食禁水,测试期间,同样给予动物一瓶1%蔗糖水,一瓶纯水,测试时间为15 h。为避免位置偏爱影响因素,测试中间,将两瓶位置互换。测试结束,计算糖水偏爱指数(糖水偏爱指数=糖水消耗/ 总液体消耗×100%)。
1.3.2空场实验
根据报道,方形空场环境尺寸为50×50×30 cm(长×宽×高)。中央区是以方形空场对角线交点为中心,边长20 cm的正方形区域,边缘区宽8cm。将小鼠置于空场,观察5 min 内动物的自发活动。实验采用动物行为学视频跟踪系统(Noldus Information Technology,EthoVision XT,The Netherlands),记录动物的运动路程、速度及在各区的停留时间等。
1.3.3强迫游泳实验
动物在测试房间适应1 h后,进行强迫游泳实验。根据文献[9],将小鼠放入高20 cm,直径12 cm,水深10 cm的圆形玻璃容器中,水温25℃,观察6 min,记录后4 min的累计不动时间。判定不动的标准是动物在水中停止挣扎,呈漂浮状态,仅有细小的肢体运动以保持头部浮在水面。
1.3.4新奇抑制摄食实验
根据Marcussen等[10]报道,采用方形敞箱(52×42×30 cm,长×宽×高),中心放一食丸。小鼠在禁食(不禁水)24 h后,放入敞箱中,每次从同一方向、同一位置放入,记录5 min内第一次摄食潜伏期(以开始咬食食丸为标准),即动物自放入笼中至首次摄取食物的时间。
1.3.5免疫组化检测
行为学实验结束后,每组取3只动物,用10%水合氯醛麻醉,开胸,应用蠕动泵,灌注生理盐水,再用4%多聚甲醛灌注固定,取脑。固定的脑组织,制备石蜡切片,脱蜡水化。微波炉加热,进行抗原修复,PBS洗三次,羊血清封闭20 min。加入synapsin-1抗体(1∶1000),4℃,过夜。加入二抗,室温孵育30 min.。DAB显色,二甲苯透明,封片。
1.4统计学处理
2结果
2.1皮质酮模型对糖水偏爱测试、强迫游泳实验的影响

注:* P < 0.05,与正常组比较。图1 皮质酮模型对糖水偏爱指数及强迫游泳不动时间的影响Note: * P<0.05, compared with the control group.Fig.1 Effect of CORT on the sucrose preference test and immobility time in the forced swim test in mice

注:* P < 0.05,** P < 0.01,与正常组比较。图2 皮质酮模型对空场实验的影响Note: * P < 0.05, ** P < 0.01,compared with the control group).Fig.2 Effect of CORT on the open field test in mice
如图1A所示,皮质酮模型组糖水偏爱指数与正常组比较,无显著性差异(P>0.05)。如图1B所示,皮质酮模型组强迫游泳不动时间显著延长,与正常组比较,具有显著性差异(P< 0.05)。
2.2皮质酮模型对空场实验的影响
如图2A和2B所示,皮质酮模型组和正常组总路程无显著性差异(P>0.05)。如图2C、2D、2E和2F所示,皮质酮模型组中央区时间、路程及进入频次显著减少,边缘区时间显著延长,和正常组相比,具有显著性差异(P<0.05,P<0.01,P<0.01,P< 0.01)。2.3皮质酮模型对新奇抑制摄食的影响
如图3A所示,皮质酮模型组摄食潜伏期显著延长,与正常组比较,具有显著性差异(P< 0.05)。如图3B所示,皮质酮模型组和正常组5 min 内摄食量无显著性差异(P>0.05)
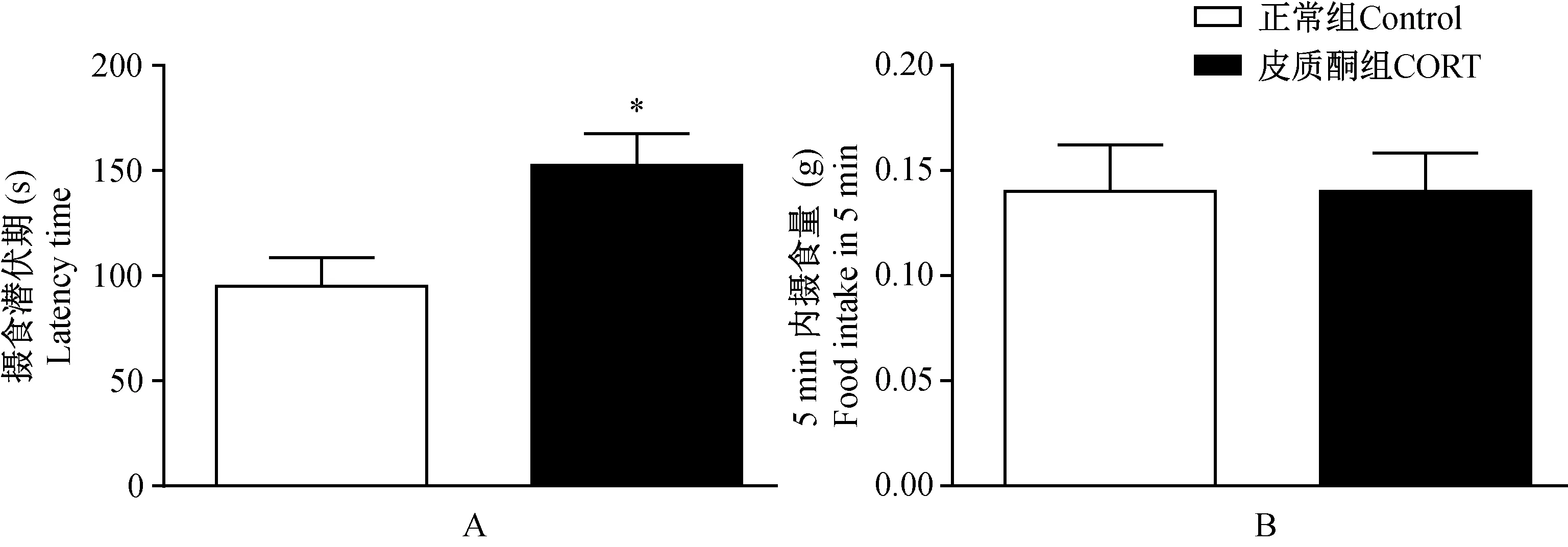
注:* P < 0.05,与正常组比较。图3 皮质酮模型对新奇抑制摄食实验的影响Note: * P < 0.05, compared with the control group.Fig.1 Fig.3 Effect of CORT on novelty suppressed food test latency time
2.4皮质酮模型对海马不同分区突触素表达的影响
如图4所示,突触素阳性表达产物呈棕色颗粒,正常组动物海马CA1区、DG区和CA3区棕色颗粒粗大密集、沉积成带。皮质酮组棕色颗粒稀疏,突触素表达显著降低。

注:A、B:CA1区;C、D:DG区;E、F:CA3区;正常组:A、C、E;皮质酮组:B、D、F。图4 皮质酮对海马不同分区突触素的影响(标尺=200 μm)Note:A、B:CA1;C、D:DG,E、F:CA3;Control group:A、C、E;CORT group:B、D、F.Fig.1 Fig.4 Effect of CORT on hippocampus Synapsin-1 expression(Bar=200 μm)
3讨论
动物模型的转化效度评价包括结构效度(construct validity)、预测效度(predictive validity)和表观效度(face validity)三个层面[12]。结构效度指模型与某个假说理论的符合程度。皮质酮抑郁模型是通过皮下注射或饮入等方式,人为增加动物体内皮质酮水平,模拟抑郁症神经生化机制的发生和发展过程,因此具有良好的结构效度。预测效度指治疗药物能有效干预动物模型的相应症状表现。已有研究表明丙咪嗪可缩短皮质酮损伤模型的强迫游泳不动时间,并逆转皮质酮引起的海马结构损伤,显示该模型良好的预测效度[13]。表观效度指动物模型中动物和人类之间症状学的相似性。该模型具有一定的抑郁症行为学表型,但与传统应激抑郁模型又有所不同。本研究结果显示,皮质酮抑郁模型对动物的糖水偏爱测试没有影响,这与文献报道结果一致,即该模型并不能模拟抑郁症的核心症状-快感缺失[14]。强迫游泳实验是检测抑郁模型及抗抑郁药物药效的另一个经典实验,动物被迫在一个局限的空间游泳,首先试图挣扎逃跑,随后处于一种间歇性不动状态,抑郁模型的强迫游泳不动时间延长,而抗抑郁药物则能缩短动物的不动时间[15]。本研究结果表明,皮质酮模型小鼠强迫游泳的不动时间显著延长。新奇抑制摄食实验最初用于动物焦虑行为的评价,后来发现也可应用于动物抑郁行为及抗抑郁药物的药效学评价[16]。本实验结果表明皮质酮可显著延长动物的摄食潜伏期,5 min内动物摄食量与正常组相比无差异,提示皮质酮模型对动物的食欲没有影响。强迫游泳实验和新奇抑制摄食实验提示皮质酮模型具有良好的表观效度。空场实验中,皮质酮模型组运动路程和运动速度与对照组比较均无显著性差异,说明该模型对动物的运动行为无影响。皮质酮和正常组在空场实验的分区活动情况差异显著,皮质酮模型组在边缘区时间增加,而在中央区时间、路程及进入频次减少,显示其焦虑状态。综上,皮质酮模型小鼠具有抑郁症模型的表观效度,同时表现出焦虑行为。
突触是神经元之间在功能上发生联系的部位,也是信息传递的关键部位[17]。近年来,神经突触传递效能降低,结构受损成为抑郁症病理基础的研究热点。应激事件可激活HPA轴, 增加机体内皮质酮水平。皮质酮在高浓度下激活海马等部位的糖皮质激素受体,改变突触传递功能与可塑性的诱导,并导致区域特异性的脑区形态和结构上的改变,如神经棘突变短,突触减少,从而影响情绪、学习记忆等认知功能[3]。突触素-1(synapsin-1)作为突触前轴索终末的特异性标记物, 是突触结构及功能的标志之一, 可用来检测突触的密度和分布。本研究采用人为方式,增加小鼠体内皮质酮水平,免疫组化结果均显示皮质酮模型组海马的CA1、CA3、DG三个亚区均出现突触素-1表达减少,提示高水平的皮质酮降低海马神经元突触的数量及功能,这与以往研究结果一致[3]。
综上所述,通过饮入方式,人为增加动物体内皮质酮水平,可诱导动物的抑郁样行为,而这种抑郁样行为可能与海马等脑区的突触素表达减少,神经突触传递效能降低有关
参考文献:
[1]严璘璘. 慢性应激对海马损伤的影响及其分子机制[J].神经解剖学杂志,2008,24(05):556-559.
[2]Navarria, A., A. Tamburella, F. A. Iannotti,etal. The Dual Blocker of Faah/Trpv1N-Arachidonoylserotonin Reverses the Behavioral Despair Induced by Stress in Rats and Modulates the Hpa-Axis[J].Pharmacol Res, 2014,87 (2014) :151-159.
[3]Gourley, S. L., A. M. Swanson and A. J. Koleske. Corticosteroid-Induced Neural Remodeling Predicts Behavioral Vulnerability and Resilience[J].J Neurosci,2013,33(07):3107-3112.
[4]陈伟恒, 陶长路, 时美玉,等. 突触可塑性与脑疾病的神经发育基础[J].生命科学,2014,(06):583-592.
[5]Bessa, J. M., D. Ferreira, I. Melo,etal. The Mood-Improving Actions of Antidepressants Do Not Depend on Neurogenesis but Are Associated with Neuronal Remodeling[J].Mol Psychiatry,2009,14(08):764-773.
[6]华冰, 程瑞凤, 景晶,等. 甘草总黄酮抗大鼠应激抑郁作用及对突触可塑性关键蛋白syp/Psd-95的调节作用[J].中国新药杂志, 2014,23(10):1180-1187.
[7]Le Dantec, Y., G. Hache, J. P. Guilloux,etal. Nrem Sleep Hypersomnia and Reduced Sleep/Wake Continuity in a Neuroendocrine Mouse Model of Anxiety/Depression Based on Chronic Corticosterone Administration[J].Neuroscience. 2014,274( 2014 ): 357-368.
[8]Pothion, Stéphanie, Jean-Charles Bizot,etal. Strain Differences in Sucrose Preference and in the Consequences of Unpredictable Chronic Mild Stress[J].Behavioural Brain Research,2004,155(01):135-146.
[9]Kristen A. Stedenfeld, Sarah M. Clinton, Ilan A. Kerman,etal. Novelty-seeking behavior predicts vulnerability in a rodent model of depression [J]. Physiology & Behavior.2011,103(2011):210 - 216.
[10]Castagne, V, P Moser, S Roux,etal. Rodent Models of Depression: Forced Swim and Tail Suspension Behavioral Despair Tests in Rats and Mice[J].Curr Protoc Neurosci,2011,2(08):10-15.
[11]Marcussen, A. B., P. Flagstad, P. E. Kristjansen,etal. Increase in Neurogenesis and Behavioural Benefit after Chronic Fluoxetine Treatment in Wistar Rats[J].Acta Neurol Scand,2008,117(02):94-100.
[12]孙秀萍, 张楠, 高杰,等. 慢性束缚应激模型致焦虑和抑郁共病的行为学研究[J].中国比较医学杂志,2015,25(06):18-22.[13]Crupi, R., E. Mazzon, A. Marino,etal. Melatonin Treatment Mimics the Antidepressant Action in Chronic Corticosterone-Treated Mice[J].J Pineal Res.2010,49(02):123-129.
[14]Guilloux, J. P., M. Seney, N. Edgar,etal. Integrated Behavioral Z-Scoring Increases the Sensitivity and Reliability of Behavioral Phenotyping in Mice: Relevance to Emotionality and Sex[J].J Neurosci Methods,2011,197(01):21-31.
[15]Micale, Vincenzo, Anna Arezzi, Liborio Rampello,etal. Melatonin Affects the Immobility Time of Rats in the Forced Swim Test: The Role of Serotonin Neurotransmission[J].European Neuropsychopharmacology,2006,16(07):538-545.
[16]Stedenfeld, Kristen A., Sarah M. Clinton, Ilan A. Kerman,etal. Novelty-Seeking Behavior Predicts Vulnerability in a Rodent Model of Depression[J].Physiology & Behavior.2011,103(02):210-216.
[17]Abush, H. and I. Akirav. Cannabinoids Ameliorate Impairments Induced by Chronic Stress to Synaptic Plasticity and Short-Term Memory[J].Neuropsychopharmacology,2013,38(08):1521-1534.
〔修回日期〕2015-12-25
[基金项目]北京市自然科学基金资助项目(7142105);国家自然青年科学基金项目(31301890)。
[作者简介]孙秀萍(1974-),女,博士, 研究方向:神经精神疾病药理及方法学。
[通讯作者]秦川,教授,研究方向:神经疾病研究。
【中图分类号】R-332
【文献标识码】A
【文章编号】1671-7856(2016) 01-0014-05
doi:10.3969.j.issn.1671.7856. 2016.001.003
The effect of chronic corticosterone administration on depressive-like behaviour and synapsin-1 expression in mice
SUN Xiu-ping1, YANG Jiu-shan2,XU Yang-feng1,XU Yu-huan1,SONG Ming-jing1,QIN Chuan1
(1.Comparative Medicine Center,Peking Union Medical College(PUMC),and Institute of LaboratoryAnimal Science,Chinese Academy of Medical Sciences(CAMS);Key Laboratory of Human DiseaseComparative Medicine,Ministry of Health;Key Laboratory of Human Disease Animal Models, State Administration of Traditional Chinese Medicine,Beijing 100021,China;2. Affiliated Hospital of Shandong University of Traditional Chinese Medicine,Jinan 250014,China)
【Abstract】ObjectiveTo investigate the effect of chronic corticosterone administration on depressive-like behaviour and synapsin-1 expression in mice. Methods C57BL/6J mice were randomly separated into 2 groups (n=10 per group): control and Corticosterone ( CORT). CORT was dissolved in vehicle (0.45%hydroxypropy-β-cyclodextrin, β-CD). Corticosterone (5mg/kg/day) was delivered for 35 days in drinking water and continued when the behavioral tests were performed. Control animals received vehicle(β-CD) in drinking water during the entire experiment. The behavior tests were applied to evaluate depressive-like behavior of the model. ResultsThe sucrose preference test showed no significant difference in sucrose intake between control and CORT group (P >0.05). The immobility time was increased in the forced swim test (P < 0.05). The cumulative duration,distance moved and frequency in the center area were decreased in the open field test(P < 0.05,P < 0.01,P < 0.01). The cumulative duration in the border area was increased(P < 0.01). Latency to food was decreased in the novelty suppressed test(P < 0.05). Immunohistochemisty analysis showed a notably decreased expression of Syn-1 in the hippocampus CA1,CA3 and DG. ConclusionsChronic administration of CORT induced depressive-like behavior and decreased Syn-1 expression.
【Key words】Corticosterone; Depression;Synapsin-1; Mice

