不同饲料对诸氏鲻虾虎鱼生长和利用效果的影响
魏远征,林忠婷,李建军,叶惠欣
(广东省实验动物监测所,广东省实验动物重点实验室,广州 510663)
不同饲料对诸氏鲻虾虎鱼生长和利用效果的影响
魏远征,林忠婷,李建军,叶惠欣
(广东省实验动物监测所,广东省实验动物重点实验室,广州510663)
【摘要】目的初步探讨过渡期诸氏鲻虾虎鱼的营养需求,为专用配合饲料的开发及相关标准的制定提供数据参考。方法分别采用卤虫无节幼体(Arternia nauplii, CK)和7种商业化配合饲料 (P30L8,P35L8,P50L8,P55L8;P50L12,P53L12,P55L12) 饲喂过渡期虾虎鱼幼鱼,8周生长实验以测定存活率(survival rate,SR)、增重率(weight gain, WG)、特定生长率(specific growth rate, SGR)和摄食率(feeding rate, FR)、饲料系数(feed conversion ratio, FCR) 等生长指标,并测定不同营养水平下虾虎鱼全鱼(除去内脏)的基本组份。结果SR饲料组SR (51.78±8.98~68.22±4.95) 较对照组CK (58.22±6.51) 均无显著差异(P>0.05);WG除P30L8 (130.76±23.67)、P50L12组 (220.86±16.9) 外,各实验组均优于对照组CK (206±41.91, P<0.05),且饲料粗脂肪含量相同(8%,12%;能量值相差不大)时,WG随饲料粗蛋白含量的升高而上升; SGR在粗脂肪含量相同时SGR也随饲料粗蛋白含量的升高而上升;FR,FCR P50L8,P55L8;P50L12,P53L12,P55L12组均优于对照组CK (1.74±0.36),且饲料粗脂肪含量8%时随粗蛋白含量上升而下降。此外虾虎鱼鱼体基本组份均与饲料中粗蛋白、粗脂肪含量关系不大 (P<0.05)。结论配合饲料饲替代生物饵料是可行的,且能取得较好的生长效果;饲料粗蛋白、粗脂肪含量对虾虎鱼鱼体基本组份影响不显著 (P<0.05);饲料粗蛋白50%,粗脂肪8%时,饲料利用率最好且过渡期虾虎鱼可获得较好的生长效果。
【关键词】诸氏鲻虾虎鱼; 配合饵料; 过渡期生长; 饲料利用; 鱼体基本组份
近年来斑马鱼 (Daniorerio)、剑尾鱼 (Xiphophorushellerii) 等水生实验动物已发展成模式生物,在遗传学、环境毒理学、药理学、分子发育生物学、免疫学研究等方面发挥着越来越重要的作用[1-2]。诸氏鲻虾虎鱼 (Mugilogobiuschulae),即朱拉氏鲻虾虎鱼,属于鲈形目 (Perciformes)、虾虎鱼亚目 (Gobioide)、虾虎鱼科 (Gobiidae)、鲻虾虎鱼属 (Mugilogobius);该鱼个体小,繁殖周期短,繁殖力强,是一种暖水性底层小型海水鱼类,广泛分布于香港、菲律宾、日本、泰国及西太平洋海域[3]。本实验室已开展室内全人工繁育、生长遗传特性分析、毒力分析等一系列实验,初步结果表明其具备良好的鱼类实验动物开发潜力[4-10]。同时诸氏鲻虾虎鱼的生物饵料替代实验表明配合饲料部分替代卤虫无节幼体也能获得较好的生长效果[11],这为其饲养的规范化提供了可能。
实验动物是“活的精密仪器”,其区别于其他动物最显著的特征是实验动物实施标准化的质量控制[12],其中实验用鱼饲料营养的质量是实验动物质量标准体系的重要组成部分,其标准的制定关系到实验动物研究的科学性和准确性。由于生物饵料营养成份存在差异,且存在携带病原等不可控因素,因此从质量可控的角度考虑,优质适宜的配合饲料饲喂实验动物更有优势。目前哺乳动物已制定实施了针对实验动物的饲料标准 (GB 14924.1-2001)。截止2012年农业部已发布实施了21项水产饲料行业标准,涵盖了我国主要的水产养殖品种[13];主要代表性经济鱼类蛋白质、脂肪等的营养需要参数已初步确立[13],个别地方也制定了实验用鱼类质量控制系列标准 (DB11/T 1053.5-2013)[12],但实验用鱼特别是海水性实验鱼对蛋白质、脂肪、碳水化合物、维生素等的营养需求及饲料方面的研究十分有限。实验鱼的饲料营养的标准化问题已经是影响实验用鱼质量的一个亟待解决的问题[14]。国内外关于虾虎鱼营养需求的研究数据,不足以支持诸氏鲻虾虎鱼专用配合饲料的开发。本实验在力求原料组份相同的前提下,研究了7种商业化配合饲料 (8%粗脂肪含量,4蛋白水平;12%粗脂肪含量,3蛋白水平) 对诸氏鲻虾虎鱼生长和利用效果的影响,旨在探讨饲料营养成份对虾虎鱼过渡期 (80~120 d) 生长和饲料利用的影响,以期为诸氏鲻虾虎鱼专用配合饲料的开发及相关标准制定提供数据支持,并为进一步营养需求的研究提供参考。
1材料和方法
1.1实验鱼与养殖条件
实验诸氏鲻虾虎鱼为本实验室引种驯化(原种群为深圳大鹏湾沿岸),选用80日龄幼鱼,体重 0.08~0.12 g。实验条件下集中驯养2周,每天投喂等量混合的实验饲料。实验开始前将暂养鱼集中禁食24 h,选择体质健壮、规格均匀的虾虎鱼随机分为8组,每组3个重复,每缸75尾。。
饲喂实验在室内加装循环水系统的塑料水族箱 (90 cm×45 cm×15 cm)中进行,水温为24~26 ℃、盐度22 ‰~28 ‰,pH 7.5左右,氨氮≤0.5 mg/L,余氯≤0.05 mg/ L,12 : 12 h光照周期。
1.2饲料与投喂
分别选取2水平粗脂肪 (8%,4个蛋白水平;12%,3个蛋白水平)的7种商业化配合饲料(即P30L8,P35L8,P50L8,P55L8;P50L12,P53L12,P55L12)和卤虫无节幼体(Arternianauplii, CK)进行投喂实验。饲料基本生化组成见表1。依据过渡期虾虎鱼的口径,手工碾磨并过筛处理,以获得最佳粒径的饲料(80 d:0.5 mm;94~110 d:0.8 mm;≥110 d:1~1.5 mm)。
实验投喂时间为每天9:00和16:00,每次投喂量以实验鱼20 min内吃完为宜。每天吸污并补充定量海水,观察水质和鱼活动情况。投喂实验结束后,称15 g饲料放入实验缸中,10 min后回收。同时70 ℃烘干称重,计算饲料的溶失率以校正实际摄食量。
1.3鱼体及饲料取样、样品分析
8周实验结束时分别取对照组CK和各实验组虾虎鱼每组约160尾进行全鱼成份的测定。具体方法如下:鱼体成份测定方法参照GB/T18654.10-2008方法[5],去除鳍和内脏,捣碎,混匀,制备样品。
每组200 g饲料样品,均机械碾磨后混匀后称重取样。饲料样品中粗蛋白、粗脂肪、水分和灰分等的测定方法参照国标方法 (GB 5009.5-2010、GB 5009.6-2003、GB 5009.3-2010和GB 5009.4-2010) 进行。具体如下:粗蛋白测定采用凯氏定氮法;粗脂肪的测定采用乙醚索氏抽提法进行;水分含量通过在105℃烘箱中烘至恒重进行测定;样品灰分含量通过在马弗炉中550℃充分灼烧测定,每个样品重复测定2次,结果取偏差小于2%的两个平均数,当误差大于5%时重复测定。

表1 饲料成份分析
注:以上7种配合饲料均为原料基本相同(白鱼粉,磷虾粉,啤酒干酵母,小麦粉,螺旋藻,鱼油,虾青素,复合维生素和矿物质),且粗蛋白、粗脂肪来源确定,呈梯度变化的商业化饲料;P、L分别代表饲料粗蛋白和粗脂肪水平,例如:P30L8表示饲料粗蛋白含量30%,粗脂肪8%。
Note:The ingredients of 7 diet are exactly the same (white fish meal, krill meal, yeast, weatmeal, spirulina, fish oil, astaxanthin, compound vitamins and minerals) and the source of crude protein and crude lipid are confirmed. P: crude protein level; L: crude lipid level, for example, P30L8: 30% protein and 8% lipid.
1.4数据处理及统计分析
饲喂实验前2周,每周统计各处理组存活率。饲喂实验持续8周(80~150 d),结束前停食24 h,计算总存活率及其它数据。实验鱼存活率(survival rate SR)、增重率(weight gain, WG)、摄食率(feeding rate, FR)、特定生长率(specific growth rate, SGR)、饲料系数(feed conversion ratio, FCR)、肥满度(fullness, FUL)的计算如下:
1)存活率(%)=终尾数/初尾数
2)摄食率(%)=摄食量/[养殖天数 ×(初体重+末体重)/2]
3)增重率(%)=(终体重-初体重)/初体重
4)特定生长率(%)=(ln终体重 - ln初体重)/投喂天数
5)饲料系数=摄食量/(终体重 - 初体重)
6)肥满度 (%)=(W / L3)W,体重(g);L,体长(cm)
采用SPSS软件进行单因素方差(One-way ANOVA)分析,计算不同饲料投喂对虾虎鱼生长的影响,差异显著时进行Duncan’s 多重比较。
2结果
2.1存活与生长
8 周饲喂实验,虾虎鱼幼鱼经过渡期 (80~120 d) 至成鱼期 (120~250 d)[4],平均体重增加至0.295~0.513 g。采用单因素方差分析实验组与对照组 (卤虫投喂组) 存活率 (SR)、增重率 (WG)、特定生长率 (SGR) 和饲料利用率 (FCR) 等的差异 (表3);同时为探究最优的饲料饲喂效果,以指标最优的实验组为参考,进行组间多重比较,以分析不同饲料对虾虎鱼的生长及利用率的效果。结果显示:不同营养水平的配合饲料对虾虎鱼幼鱼存活、摄食和生长的影响存在差异。
2.1.1存活率(SR)
饲料组SR较卤虫组CK,均无显著差异 (P>0.05);其中P55L12 SR最高 (68.22%),其次为P55L8 (66.67%),P30L8 (51.78%)SR最低。组间差异分析表明:P55L8、P55L12 组SR显著高于P30L8 (P<0.05),且与其它实验组均无显著差异 (P>0.05)。
饲料粗脂肪含量相同时 (8 %,12 %),SR与饲料粗蛋白含量无线性相关,即SR不随粗蛋白含量的变化 (30%~55%;50%~55%) 而出现线性上升,且粗蛋白含量超过50 %时,实验组间均无显著差异 (P>0.05)。说明配合饲料可替代卤虫作为虾虎鱼过渡期的生长饲料,且粗蛋白含量50%左右时能获得较高的存活率。
2.1.2增重率(WG)
P50L8组WG最大 (473.1±52.9) 且显著大于其它实验组 (P<0.05),其次为P35L8、P55L12和 P55L8,WG最小的为P30L8组 (130.76±23.67);P30L8与卤虫组CK无显著差异 (P>0.05)。这说明低粗蛋白、粗脂肪含量的配合饲料与卤虫均不能满足虾虎鱼过渡期生长的营养需求。
粗蛋白、粗脂肪含量最高的P55L12组 (53.3%、13.2%) 虾虎鱼WG反而小于低水平的P35L8组 (35.5%、8.1%),说明适当粗蛋白、粗脂肪含量的饲料就能获得较好的生长效果;过高蛋白、脂肪含量的饲料反而造成能量浪费。
2.1.3特定生长率(SGR):P50L8组过渡期SGR最大,且除P50L12外各实验组较对照组CK均有显著差异 (P<0.05,表2)。同时P50L8组特定生长率较其它实验组有显著差异(P<0.05)。
饲料粗脂肪含量相同(8%,12%)时,SGR与饲料粗蛋白含量呈线性相关(图1, 2),即SGR随粗蛋白含量的升高而出现线性上升,但粗蛋白含量超过50%时,实验组间均无显著差异(P>0.05)。同时,粗蛋白、粗脂肪含量最高的P55L12组SGR小于低水平的P35L8、P50L8,说明配合饲料粗蛋白含量在一定范围内对生长有显著影响。

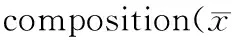

饲料Diet存活率/%survivalrate增重率/%weightgain,WG摄食率/%feedingrate,FR特定生长率/%specificgrowthrate,SGR饲料系数feedconversionratio,FCR肥满度/%fullness,FULP30L851.78±8.98a130.76±23.67a2.5±0.19b0.92±0.12b2.93±0.63b1.99±0.18abP35L862.00±12.4a358.00±41.29b1.89±0.14a1.69±0.01b1.33±0.15a2.23±0.16aP50L859.11±14.48a473.10±52.9b1.38±0.11b1.93±0.11b0.89±0.11b2.2±0.11aP55L866.67±8.3a354.20±50.58b1.25±0.12b1.68±0.12b0.89±0.13b2.31±0.13aP50L1261.78±5.38a220.86±16.9a1.39±0.05b1.29±0.06a1.16±0.83ab2.28±0.13aP53L1257.33±11.09a312.08±33.2b1.27±0.09b1.57±0.01b0.94±0.11b2.19±0.01aP55L1268.22±4.95a355.60±50.6b1.5±0.29b1.66±0.27b1.1±0.35b2.34±0.22aCK58.22±6.51a206.00±41.91a1.92±0.19a1.24±0.02a1.74±0.36a2.22±0.01a
注:以卤虫投喂组CK为对照进行显著性分析,同一列上不同字母表示差异显著:ab代表差异显著(P<0.05),b表示差异极其显著(P<0.01)。
Note:CK,Arternianauplii; means with different superscripts are significantly different (P<0.05), ab means significant different (P<0.05); b means extremely significant different (P<0.01).
2.2饲料利用
2.2.1摄食率(FR)
7种配合饲料与卤虫投喂组CK相比,除P35L8组外均有显著差异 (P<0.05);P30L8组FR最大 (2.5±0.19),P55L8组最小 (1.25±0.12)。组间比较结果显示:FR最小的P55L8组与P30L8 和P35L8 均存在显著差异 (P<0.05),且其与P55L12也有显著差异 (P<0.05),这说明虽然饲料经手工磨制、过筛(粒径0.8 mm~1.0 mm)达到要求,但饲料粗蛋白、粗脂肪含量对FR仍有决定作用。
2.2.2饲料系数 (FCR)
虾虎鱼FCR最大的为P30L8组 (2.93±0.63),其次为卤虫饲喂对照组CK,蛋白含量较高的P50L8和P55L8组FCR最小。饲料粗脂肪含量8%时,FCR随饲料中蛋白含量的增加而下降(图1)。
饲料组与对照组CK相比,除P35L8组外均差异显著 (P<0.05) (表2)。P50L8、P55L8组FCR相等且最低,其显著小于P30L8、P35L8组 (P<0.05)。粗蛋白、粗脂肪含量最高的P55L12 (53.3%、13.2%) FCR大于P50L8、P55L8组 (49.2%、8.7%;52.9%、8.3%),这说明饲料中粗蛋白、粗脂肪含量过高时,营养物质不易被鱼体充分利用,反而造成能量浪费,甚至可能影响鱼体健康。
2.3饲料粗蛋白质、粗脂肪含量对虾虎鱼肥满度及鱼体基本组份的影响
2.3.1肥满度
P55L12组虾虎鱼肥满度最高 (2.34±0.22),肥满度最小的为P30L8 (1.99±0.18);其中P30L8组虾虎鱼较对照组CK有显著差异 (P<0.05,表2),其它实验组均无显著差异 (P>0.05)。这可能是由饲料营养水平不同造成的:饲料粗脂肪、粗蛋白含量过低不利于生长,过高易造成脂肪的积累,但对与鱼体健康的影响仍需进一步研究。
2.3.2鱼体组份
为分析饲料粗蛋白、粗脂肪含量对虾虎鱼鱼体组份的影响,选用除去内脏后的卤虫饲喂组CK和配合饲料组虾虎鱼进行鱼体组份分析。结果表明:不同粗蛋白、粗脂肪含量的配合饲料对虾虎鱼鱼体基本组份 (表3) 无显著影响 (P>0.05),即鱼体粗蛋白、粗脂肪和灰分与饲料中粗蛋白、粗脂肪含量关系不大(P<0.05)。
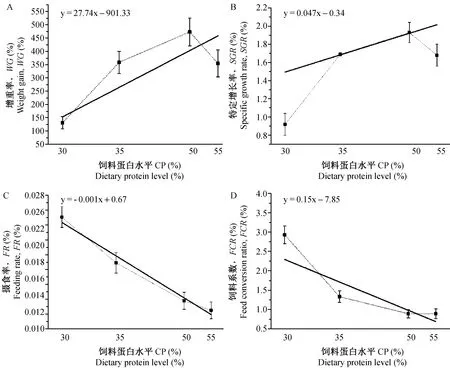
注:图中横坐标30、35、50、55分别代表4种粗蛋白含量的饲料,即P30L8(26.9%)、P35L8(35.5%)、P50L8(49.2%)、P55L8(52.9%);其中实线代表线性分析结果,虚线为各个点实际值的连接线。图1 饲料粗蛋白含量(8%粗脂肪)对虾虎鱼生长及利用率的影响Note:Abscissa 30, 35, 50, 55: 4 different compound feeds P30L8 (26.9%), P35L8 (35.5%), P50L8 (49.2%) and P55L8 (52.9%); full line means the linear analysis of differnet protein levels; imaginary lines means connecting line of the actual value. Fig.1 Effect of different protein level (8% lipid) on growth performance and feed conversion of Mugilogobius chulae
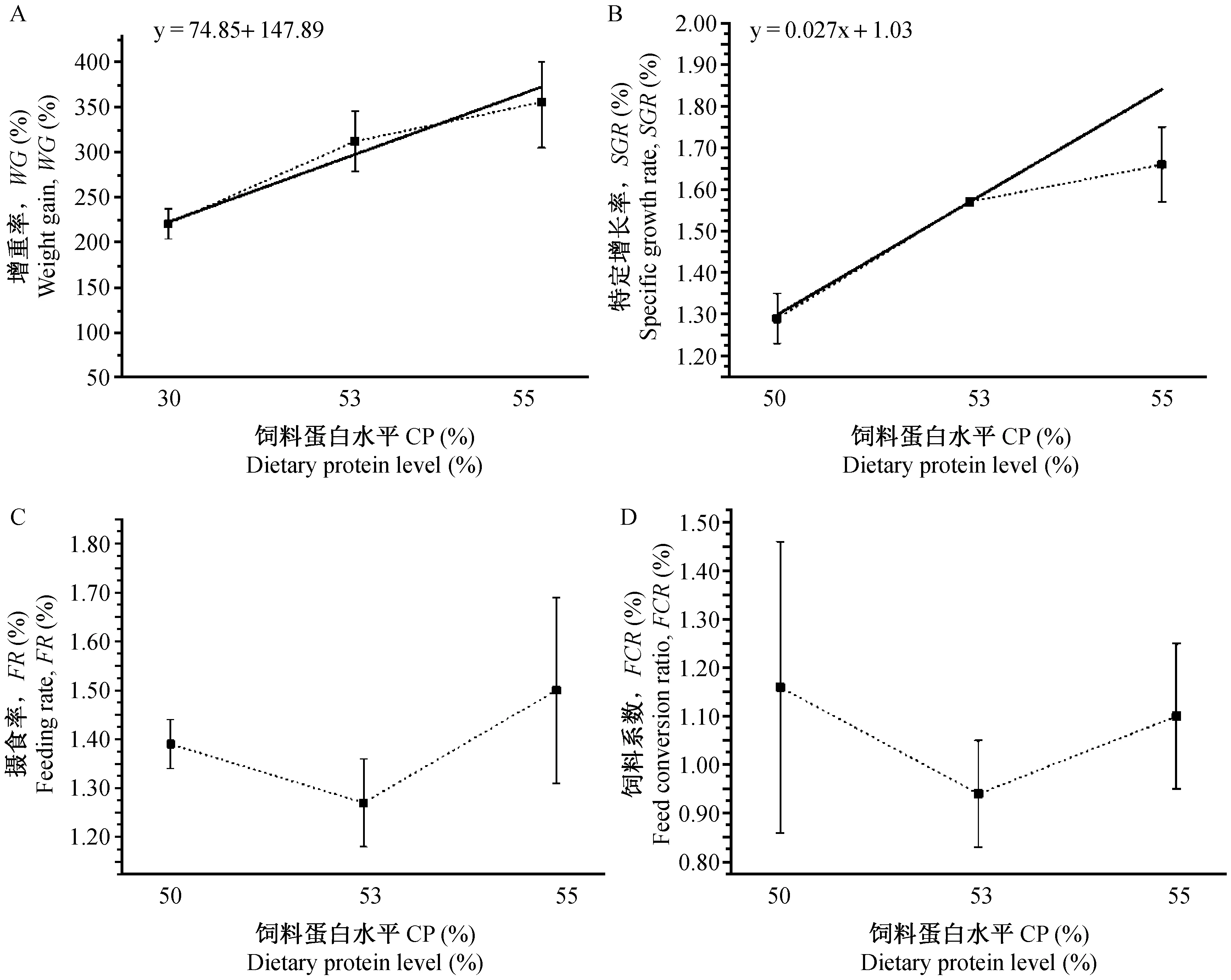
注:图中横坐标50、53、55分别代表3种粗蛋白含量的饲料,即P50L12(47.4%)、P53L12(52.2%)、P55L12(53.3%);其中实线代表线性分析结果,虚线为各个点实际值的连接线,粗脂肪含量12% 时FR、FCR均无线性关系。图2 饲料粗蛋白含量(12%粗脂肪)对虾虎鱼生长及利用率的影响Note:Abscissa 50, 53, 55: 3 different compound feeds P50L12(47.4%)、P53L12(52.2%) and P55L12(53.3%); full line means the linear analysis of differnet protein levels; imaginary lines means connecting line of the actual value; FR and FCR have no linear relationships with differnet protein levels.Fig.2 Effect of different protein level (12%lipid) on growth performance and feed conversion of Mugilogobius chulae
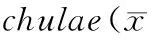
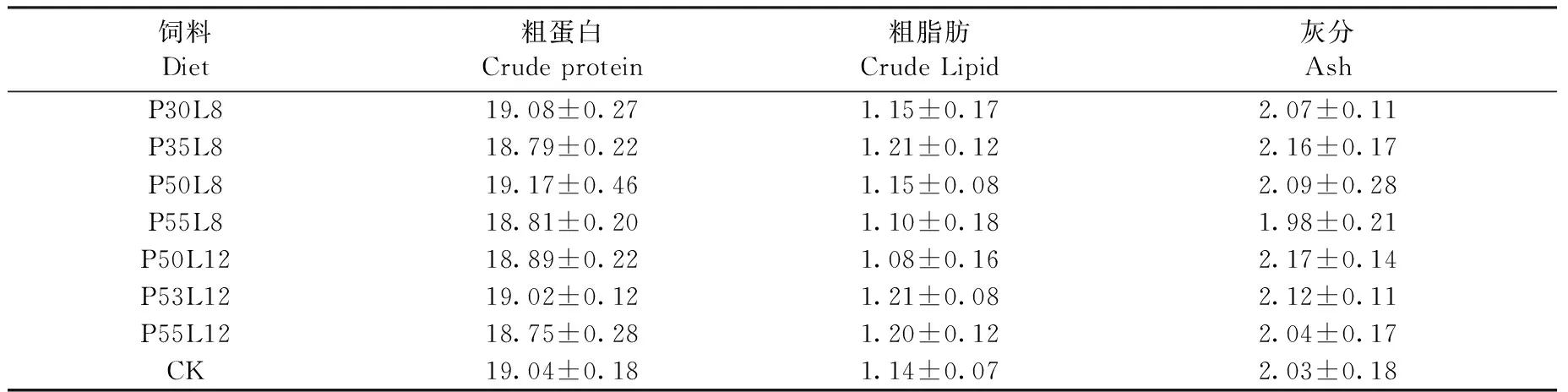
饲料Diet粗蛋白Crudeprotein粗脂肪CrudeLipid灰分AshP30L819.08±0.271.15±0.172.07±0.11P35L818.79±0.221.21±0.122.16±0.17P50L819.17±0.461.15±0.082.09±0.28P55L818.81±0.201.10±0.181.98±0.21P50L1218.89±0.221.08±0.162.17±0.14P53L1219.02±0.121.21±0.082.12±0.11P55L1218.75±0.281.20±0.122.04±0.17CK19.04±0.181.14±0.072.03±0.18
注:各实验处理平均值间均无显著差异(P>0.05)
Note: There were no significantly difference between the means of treatments (P>0.05)
3讨论
适宜的饵料配方受鱼种类、发育阶段、养殖环境等的影响。诸氏鲻虾虎鱼的胚后发育根据其形态和性腺发育程度,可分为仔鱼期 (0~25日龄)、稚鱼期 (25~35日龄)、幼鱼期 (35~80日龄)、过渡期 (80~120日龄)、成鱼期和衰老期[4];其中过渡期作为幼鱼至成鱼的关键期,饲料营养关系到其生长和能否作为实验动物进行标准化管理。目前斑马鱼已开展了较多的相关实验,研究了饲料营养水平对斑马鱼开口、生长、繁殖等各个时期的影响[15-21],为其室内标准化饲养奠定了基础。剑尾鱼标准化配合饲料的研究也取得了一定的成果[22-24]。诸氏鲻虾虎鱼的初步研究证实配合饲料可替代生物饵料[11],本研究选用的7种配合饲料均为商品化饲料且原料基本相同,由于饲料粗脂肪含量为12%时,多项生长指标组间无显著差异且FR、FCR均无线性相关(图2),因此本实验主要以粗脂肪含量8%的4个粗蛋白水平进行讨论分析,12%粗脂肪含量的饲料仅作相同粗蛋白含量的对照。鉴于糖类、矿物盐和维生素等对生长的影响,该讨论存在一定局限性,但可为进一步饲料最适营养范围的研究提供数据参考。
本实验中7个饲料组SR较卤虫组均无显著差异 (P>0.05),而之前研究表明投喂卤虫的成活率高于配合饵料 (P<0.05)[11]。这可能与投喂时间点的选择有关:之前研究选择稚鱼期 (30日龄) 虾虎鱼进行实验;本研究为过渡期虾虎鱼 (80日龄)。鱼类(特别是肉食性鱼类)的消化酶活性与日龄相关,在驯化过程中呈现动态变化:瓦氏黄颡鱼稚鱼 (45日龄) 时,活饵组与饲料组脂肪酶活性均无显著差异 (P>0.05);而50日龄时,活饵组与饲料组间差异显著(P<0.05)[25]。真鲷 (Pagrosomumajor)[26]、欧洲黑鲈 (Dicentrachuslabrax)[27]等的研究也证实其消化酶活性与此类似。虾虎鱼作为肉食性鱼类,在长期进化过程中形成了特定的消化酶表达活性,与自然环境中其特定的食物组成相适应。研究显示:活饵料的某些微量活性物质是仔稚鱼酶分泌的诱导因子[28]。其存在可促进稚鱼蛋白酶分泌量的增加,而配合饲料虽富含鱼类所需的营养成分,但由于诱导因子的缺乏,导致消化酶活性低于活饵料。因此消化酶的活性差异导致营养摄入不同,进而影响其存活率。
一定粗蛋白、粗脂肪含量的配合饵料 (P35L8、P50L8、P55L8,以及P53L12、P55L12) WG和SGR均显著高于卤虫组CK (P<0.05),说明配合饲料促进虾虎鱼过渡期生长的效果优于生物饵料组。同时饲料粗脂肪含量8%时,虾虎鱼WG与SGR未随蛋白水平的升高而一直上升(图1),当饲料粗蛋白含量超过50%时均出现下降,且与饲料组蛋白含量线性相关性较差;同时粗蛋白含量55%时,P55L8、P55L12组WG与SGR均无差异 (P>0.05);饲料粗脂肪含量12%时,增加粗蛋白含量 (50%~55%),P53L12组WG与SGR均显著优于P50L12组。这说明饲料粗蛋白含量对虾虎鱼过渡期生长的影响大,且粗脂肪含量相同时,粗蛋白含量是其生长的限制因素。这与之前的研究结果相同:饲料粗蛋白含量对剑尾鱼WG、SGR有显著影响,但粗脂肪含量对其生长参数无显著影响[24]。
此外分析显示:饲料粗脂肪含量相同 (8%) 时,实验组P30L8 FR要显著大于P35L8、P50L8和P55L8 (P<0.05),FR随饲料粗蛋白含量的上升而降低(图1)。这说明饲料粗蛋白含量低的实验组,其较高的摄食率可能是为了满足鱼体对营养的需求而做出的补偿性调节。同时,饲料粗蛋白含量在一定范围内 (30%~55%),FCR随粗蛋白含量的升高而下降(图1),饲料粗蛋白含量高的实验组表现出较低的FCR,说明鱼类对高蛋白饲料具有较好的利用效率。饲料系数是衡量饲料品质最重要的指标,在一定程度内提高饲料蛋白水平可获得较低的FCR,进而达到较好的生长效果。对FR、GR、SGR和FCR进行线性分析时,发现除FCR外,GR、SGR和FR的拟合度并不高(R2均在0.6左右),蛋白水平超过50%时GR、SGR和FR随蛋白水平线性变化的可信度不高,仅在粗蛋白含量30%、35%和50%时有较高的可信度。这说明当饲料蛋白水平达到一定量时,其它因素往往成为生长的限制因素,因此在饲料的配制过程中应综合考虑各组份的比例。美鳊(Notemigonuscrysoleucas)[29]、石斑鱼(EpinephelusCoioides)[30]等的研究表明:当鱼体摄入过高的饲料蛋白质后,过量的蛋白质会通过脱氨基作用造成能量浪费,进而导致生长降低。
之前研究表明饲料营养水平影响鱼体基本组份:罗非鱼鱼肉蛋白含量与饲料粗蛋白水平正相关[31];饲料营养水平会影响斑马鱼全鱼肌肉及脂肪含量[21]。虾虎鱼鱼体全鱼(除去内脏)基本组份(粗蛋白、粗脂肪和灰分)的测定结果表明,较对照组CK,饲料组鱼体组份无显著差异 (P>0.05,表3)。这与大多数的研究结果相同,例如:大菱鲆(ScophthalmusmaximusL.)[32]、银汉鱼(Menidiaestor)[33]等的体蛋白和灰分含量与饲料中蛋白水平无显著差异。剑尾鱼除去内脏的全鱼组份也不受饲料中蛋白水平的影响[34]。这提示适当配比的配合饲料在满足多数鱼健康生长需求时,并不改变其特性。
总之本研究比较了不同配合饲料饲喂下,诸氏鲻虾虎鱼的生长参数、鱼体组份的差异,并初步探讨配合饲料粗蛋白、粗脂肪含量对其过渡期生长的影响。但虾虎鱼饲料的标准化配制及饲料中蛋白、脂肪等的最适范围仍需进一步研究。
参考文献:
[1]贾顺姬, 孟安明. 中国斑马鱼研究发展历程及现状[J]. 遗传, 2012, 34(9): 1082-1088.
[2]杨笑波, 李建军, 刘继芳. 水生动物的实验研究与应用[J]. 中国比较医学杂志, 2005, 15(1): 48-50.
[3]伍汉霖, 钟俊生等. 中国动物志硬骨鱼纲鲈形目(五)虾虎鱼亚目[M]. 北京:科学出版社. 2008,497-498.
[4]李建军, 陈小曲, 林忠婷, 等. 诸氏鲻虾虎鱼的形态与生长特性分析[J]. 实验动物与比较医学, 2012, 32(4): 334-340.
[5]李建军, 郑伟强, 陈小曲, 等. 诸氏鲻虾虎鱼含肉率及肌肉营养成分分析[J]. 中国比较医学杂志, 2013, 23(12): 35-39.
[6]李建军, 吴美慧, 叶惠欣, 等. 不同发育期诸氏鲻虾虎鱼对钻井液的敏感性比较[J]. 中国比较医学杂志, 2013, 23(4): 48-51.
[7]蔡磊, 陈小曲, 郑伟强, 等. 诸氏鲻虾虎鱼多态性微卫星标记的开发及评价[J]. 中国实验动物学报, 2015, 23(1): 57-62.
[8]李建军, 林忠婷, 陈小曲, 等. 四种重金属离子对诸氏鲻虾虎鱼的单一和联合毒性[J]. 海洋环境科学, 2014, (2): 236-241.
[9]陈小曲, 黄韧, 李建军. 诸氏鲻虾虎鱼染色体组型分析[J]. 热带海洋学报, 2013, (6): 88-95.
[10]李建军, 黄韧. 不同发育阶段诸氏鲻虾虎鱼对水污染物的敏感性比较[J]. 实验动物与比较医学, 2013, 33(5): 354-357.
[11]王颖, 陈小曲, 林忠婷, 等. 卤虫无节幼体和配合饵料饲喂诸氏鲻虾虎鱼效果比较[J]. 河北渔业, 2012, 217(1): 28-30.
[12]孙德明, 王天奇, 朱晓红, 等. 实验用鱼遗传质量控制及标准化[J]. 遗传, 2012, 34(9): 1202-1207.
[13]麦康森, 赵锡光, 谭北平, 等. 我国水产动物营养研究与渔用饲料的发展战略研究[J]. 浙江海洋学院学报:自然科学版, 2001, 20: 1-5.
[14]祝梅香, 王天奇, 张长勇, 等. 实验用斑马鱼剑尾鱼营养需求及饲料现状分析[J]. 中国比较医学杂志, 2009, 19(12): 61-65.
[15]Lawrence C. The husbandry of zebrafish (Daniorerio): A review[J]. Aquaculture, 2007, 269(1): 1-20.
[16]Tocher D R. Nutritional regulation of hepatocyte fatty acid desaturation and polyunsaturated fatty acid composition in zebrafish (Daniorerio) and tilapia (Oreochromisniloticus)[J]. Fish Physiology & Biochemistry. 2001, 24(4): 309-320.
[17]Rd S A, Garris H W, Jones W T,etal.. Growth and survival of zebrafish (Daniorerio) fed different commercial and laboratory diets[J]. Zebrafish. 2009, 6(3): 275-280.
[18]Markovich M L, Rizzuto N V, Brown P B. Diet affects spawning in zebrafish[J]. Zebrafish. 2007, 4(1): 69-74.
[19]Lawrence C, Ebersole J P, Kesseli R V. Rapid growth and out-crossing promote female development in zebrafish (Daniorerio)[J]. Environmental Biology of Fishes. 2008, 81(2): 239-246.
[20]Spence R, Fatema M K, Ellis S,etal.. Diet, growth and recruitment of wild zebrafish in Bangladesh[J]. Journal of Fish Biology. 2007, 71(1): 304-309.
[21]Smith D L Jr, Barry R J, Powell M L,etal.. Dietary protein source influence on body size and composition in growing zebrafish[J]. Zebrafish. 2013, 10(3): 439-446.
[22]吴淑勤, 黄志斌, 石存斌, 等. 鱼类实验动物与剑尾鱼水生实验动物化[C] 第六届中国北京国际科技产业博览会暨论坛报告会, 2003, 231-231.
[23]Chong A S C, Ishak S D, Osman Z,etal.. Effect of dietary protein level on the reproductive performance of female swordtailsXiphophorushelleri(Poeciliidae)[J]. Aquaculture, 2004, 234(1): 381-392.
[24]Shirley L, Roshada H, Sagiv K, et al.. Effect of varying dietary lipid and protein levels on growth and reproductive performance of female swordtailsXiphophorushelleri(Poeciliidae)[J]. Aquaculture Research, 2006, 37(13): 1267-1275.
[25]李芹, 刁晓明. 不同饵料对瓦氏黄颡鱼稚鱼生长和消化酶活性的影响[J]. 水生态学杂志, 2009, 2(1): 98-102.
[26]陈品健, 王重刚. 真鲷仔,稚,幼鱼期消化酶活性的变化[J]. 应用海洋学学报, 1997, 16(3): 245-248.
[27]Nolting B M, Uebersch B, Rosenthal H. Trypsin activity and physiological aspects in larval rearing of European sea bass (Dicentrarchuslabrax) using live prey and compound diets[J]. Journal of Applied Ichthyology, 1999, 15(3): 138-142.
[28]Jeannine P R, Alexandre J C, Thébaud L,etal. Marine Fish Larvae Feeding: Formulated Diets or Live Prey?[J]. Journal of the World Aquaculture Society, 1993, 24(2): 211-224.
[29]Lochmann R T, Phillips H. Dietary protein requirement of juvenile golden shiners (Notemigonuscrysoleucas) and goldfish (Carassiusauratus) in aquaria[J]. Aquaculture, 1994, 128(1): 277-285.
[30]Luo Z, Liu Y J, Mai K S,etal. Optimal Dietary Protein Requirement of Grouper Epinephelus Coioides Juveniles Fed Isoenergetic Diets In Floating Net Cages[J]. Aquaculture Nutrition, 2004, 10(4): 247-252.
[31]徐捷. 尼罗罗非鱼饲料中最适蛋白含量的研究[J]. 全国鱼虾饲料学术讨论会论文集学术期刊出版社, 1988: 27-33.
[32]Lee J K, Cho S H, Park S U,etal. Dietary protein requirement for young turbot (ScophthalmusmaximusL.)[J]. Aquaculture Nutrition, 2003, 9(4): 283-286.
[33]Martínez-Palacios C A, Ríos-Durán M G, Ambriz-Cervantes L,etal. Dietary protein requirement of juvenile Mexican Silverside (MenidiaestorJordan 1879), a stomachless zooplanktophagous fish[J]. Aquaculture Nutrition. 2007, 13(4): 304-310.
[34]石存斌, 吴淑勤, 黄志斌, 等. 剑尾鱼人工配合饵料中最适蛋白质含量的初步探讨[J]. 中国比较医学杂志, 2000, 10(1): 11-14.
〔修回日期〕2015-12-25
[基金项目]实验动物质量评价方法及其标准化研究与应用(2013BAK11B02)。
[作者简介]魏远征(1987-),男,硕士,研究方向:实验动物营养学。E-mail: yzwei87@163.com。 [通讯作者]李建军(1975-),男,高级工程师。E-mail: lijianjun1125@126.com。
【中图分类号】R-332
【文献标识码】A
【文章编号】1671-7856(2016) 01-0029-08
doi:10.3969.j.issn.1671.7856. 2016.001.006
Effect of dietary nutrient level on the growth and feed utilization ofMugilogobiuschulae
WEI Yuan-zheng, LIN Zhong-ting, LI Jian-jun, YE Hui-xin
(Guangdong Laboratory Animals Monitoring Institute, Key Laboratory of Guangdong Laboratory Animals, Guangzhou 510663, China)
【Abstract】ObjectiveTo preliminary study nutrition requirement of Mugilogobius chulae in the transitional period and provide reference data for the research and development of compound feed and relevant standards. MethodsArtemia (Artemia nauplii, CK) and 7 commercial compound feeds (P30L8, P35L8, P50L8, P55L8; P50L12, P53L12, P55L12) were used to feed goby in transitional period. At the end of 8 weeks growing experiment, some data like survival rate (SR), weight gain (WG) and specific growth rate (SGR) and so on were measured. While, 8 groups’ body compositions were also measured. ResultsSR Treatment groups (51.78±8.98~68.22±4.95) and CK (58.22±6.51) have no significant different (P>0.05). WG Treatment groups except P30L8 (130.76±23.67) and P50L12 (220.86±16.9) were significant larger than CK (206±41.91, P<0.05). Using equal lipid (8% and 12%) dietary, WG increased with protein level rising.SGR Treatment groups’ SGR also increased with protein levels rised.FR, FCR P50L8, P55L8; P50L12, P53L12, P55L12’s FR and FCR were better than group CK (P<0.05). Using equal lipid (8%) dietary, FR and FCR were decreased with protein level rised. In addition, different feed feeding group’s body composition showed no significant difference (P<0.05). ConclusionsRear goby with compound feed replace the living food was viable and supported appreciable growth. Their crude protein and lipid have no effect to the goby’s body composition (P<0.05). Dietary with crude protein 50% and crude lipid 8% could obtain a better growth in transitional period.
【Key words】Mugilogobius chulae; Compound feed; Transitional period; Growth; Feed utilization; Body composition

