心肌淀粉样变心电学特征研究
黄静涵,陆敏杰,孙兴国,赵世华
心肌淀粉样变心电学特征研究
黄静涵,陆敏杰,孙兴国,赵世华
摘要
目的: 分析总结无创性心电学检查诊断心肌淀粉样变(CA) 的特点。
方法: 回顾分析2008-08至2013-12我院诊断为CA的60例患者的临床及其心电学特征。
结果: 60 例CA患者中男性 48 例,女性 12 例。初诊率低,确诊平均年龄(54. 5±14. 2)岁。60例患者中:(1)合并心力衰竭32例(53.3%),胸腔或心包积液12例(20%),房性心律失常20例(33.3%),室性心律失常8例(13.3%),窦房阻滞4例(6.7%),房室阻滞15例(25%),左束支阻滞4例(6.7%),右束支阻滞5例(8. 3%),室内阻滞8例(13.3%);(2)合并肢体导联低电压32例(53.3%),胸前导联假性Q波52例(86. 7%),ST-T改变48例(60%),其中30例同时合并肢体导联低电压和假性Q波;(3)合并胸腔或心包积液、胸前假性Q波患者出现肢体导联低电压比例显著升高,但仍有22例(45. 8%)不存在胸腔或心包积液的患者出现肢体导联低电压;(4)QRS间期为(104±26)ms,QT间期为(404±34)ms,QTc为(462±35)ms。aVR导联最小负向R波电压均值为0.17 mV、QRS波电压均值为0.30 mV,肢体导联和V1~3导联R波电压均值均<0.5 mV,V1~3的Q或S波电压均值分别为0.62 mV、1.61 mV及1.56 mV。V1~3导联R/S的比值分别为0.19、0.12和0. 20。
结论: CA患者胸前导联假性Q波发生率最高,同时合并肢体导联低电压、胸前导联假性Q波伴深Q或S波以及ST-T改变有助于CA的鉴别诊断。
关键词 心电描记术;淀粉样变性;心肌
Objective: To study the diagnostic characteristics of cardiac amyloidosis (CA) by non-invasive electrocardiography (ECG)in relevant patients.
Methods: We retrospectively analyzed 60 CA patients diagnosed in our hospital from 2008-08 to 2013-12 for their clinical and ECG characteristics.
Results: There were 48 male and 12 female patients with the ratio of 4: 1. The first time diagnosis rate was low and the average age for confirmed diagnosis was at (54. 5±14. 2) years. ①There were 32 (53. 3%) cases combining heart failure, 12 (20%) with pleural effusion, 20 (33. 3%) with atrial arrhythmia, 8 (13. 3%)with ventricular arrhythmia, 4 (6. 7%)with sinoatrial block, 15 (25%)with atrio-ventricular block, 4 (6. 7%) with left bundle branch block (LBBB), 5 (8. 3%)with RBBB and 8 (13. 3%)with intra-ventricular block. ② There were 32 (53. 3%) cases with low voltage on limb leads, 52 (86. 7%) with pseudo-infarct pattern, 48 (60%) with ST-T abnormality and 30 (50%) combining low voltage on limb leads with pseudo-infarct pattern.③The patients combining pleural effusion and with pseudo-infarct pattern had the increased ratio of low voltage on limb leads, while there were still 22 (45. 8%) cases without pleural effusion had low voltage on limb leads. ④ ECG characteristics for 60 CA patients were as follows: QRS duration (104±26) ms, QT interval (404±34) ms, QTc (462±35)ms; the R wave of avR 0. 17 mV, QRS wave 0.30 mV; the R wave of limb leads and V1-3were all<0.5mV, the S wave of V1-3were 0. 62mV, 1. 61mV, 1. 56mV; the R/S ratio of V1-3were 0. 19, 0. 12, 0. 20 respectively.
Conclusion: CA patients had the highest incidence of pseudo-infarct pattern; meanwhile, combining with low voltage on limb leads, pseudo-infarct with long Q or S wave and ST-T abnormality but normal QRS duration was helpful for differential diagnosis of CA in clinical practice.
Key words Electrocardiography; Amyloidosis; Myocardium
(Chinese Circulation Journal, 2016, 31:596.)
不可溶性纤维淀粉样蛋白沉积于器官或组织细胞间,引起结构和功能改变,最常受累的器官为心脏,在心脏沉积引起的疾病称为心肌淀粉样变(CA),常常引起心力衰竭。由于CA症状不典型,特别是早期仅显示心脏壁厚度逐渐增加和心室顺应性异常,临床上一些CA患者可能被误诊为肥厚性心脏疾病(主要是非阻塞性肥厚型心肌病)[1-5]。超声心动图和对比增强计算机断层摄影术(CT)均不能很好识别CA,心内膜心肌活检(EMB)可确诊CA。1922 年Bennhold发现该物质在刚果红染色呈砖红色,在偏光显微镜下出现苹果绿双折光现象,但作为一种有创性的检查方法,受到诸多因素包括技术和经济条件的限制。心脏磁共振成像(CMR)对诊断CA具有独特的优势[6-10]。然而,目前EMB和CMR检查很难广泛应用。心电图作为常规用于评估心脏疾病的无创性诊断工具,方便实用,可作为筛查疾病的常用工具。本研究旨在通过分析CA患者心电学特征,为CA的早期发现和诊断提供线索。
1 资料与方法
研究人群: 作为单中心回顾性研究,选择从2008-08至2013-12就诊于我院的CA患者60例,CA确诊至少满足以下条件中的一项: (1)临床和实验室证据存在淀粉样变;(2)临床和CMR检查[7]显示CA特定图形特征,包括平均左心室壁的厚度(隔部或后壁)大于12 mm,在不合并肺或系统性高血压的情况下右心室游离壁增厚及左心室增厚。60例患者中 40例 CA患者的组织或器官活检与Congored染色和示范下偏振光苹果绿双折射阳性,其中5例患者心脏移植术后病理检查确诊CA,7例确诊多发性骨髓瘤合并淀粉样变,28例患者经器官或组织活检确诊。其余20例患者通过CMR和临床症状被诊断为CA。
数据收集: (1)收集患者的一般临床资料,并通过电话或门诊对患者进行随访。60例患者入院时进行标准12导联心电图检查。(2) 心电图的数据包括:心率、传导异常包括左或右束支阻滞、电压(肢体导联低电压定义为在肢体导联每个肢体QRS波群的电压幅度≤0.5 mV)[11],假Q波模式即假性心肌梗死图形为没有阻塞性冠状动脉疾病的心电图至少两个相邻导联病理性Q波。此外,计算全部12导联R波的电压(定义为R波的最大值),Q或S波(定义为Q或S波的最大值)和QRS波群(定义为QRS波的最大总和),心电图的电压单位为mV。QT间期(通常为300~440 ms)的计算从QRS波开始至T波的结束,即从QRS波的起点到T波降支与基线交点的时间[12]。校正的QT(QTc)持续时间(一般为440 ms)采用Bazett公式计算[13]。(3)所有患者均行CMR检查,并获取左心室射血分数(LVEF)及左心室壁厚度参数。
统计学方法: 应用 SPSS 20.0 软件包进行统计分析。计量资料以±s表示,计量资料的比较采用t检验;计数资料以百分数表示,比较采用χ2检验进行统计学分析,以P<0.05 为差异有统计学意义。
2 结果
患者的一般临床特点(表1): 60 例CA患者中男性占80%。9例(15%)患者初诊为限制性心肌病,其中仅1例患者结合外院皮肤组织病理检查诊断为CA。15例(院外)初诊为肥厚型心肌病(包括肥厚型非梗阻性心肌病),6例患者初诊为冠心病,11例患者初诊为心肌病(包括扩张型心肌病4例、心肌致密化不全1例),另19例以心力衰竭待诊或病因不明入院。
心电学特点(表2): 60例CA患者最常见的心电学异常包括胸前导联假性Q波[52例(86.7%)]、ST-T改变[48例(60%)]及肢体导联低电压[32例(53.3%)]。其中30例患者同时合并假性Q波及肢体导联低电压。
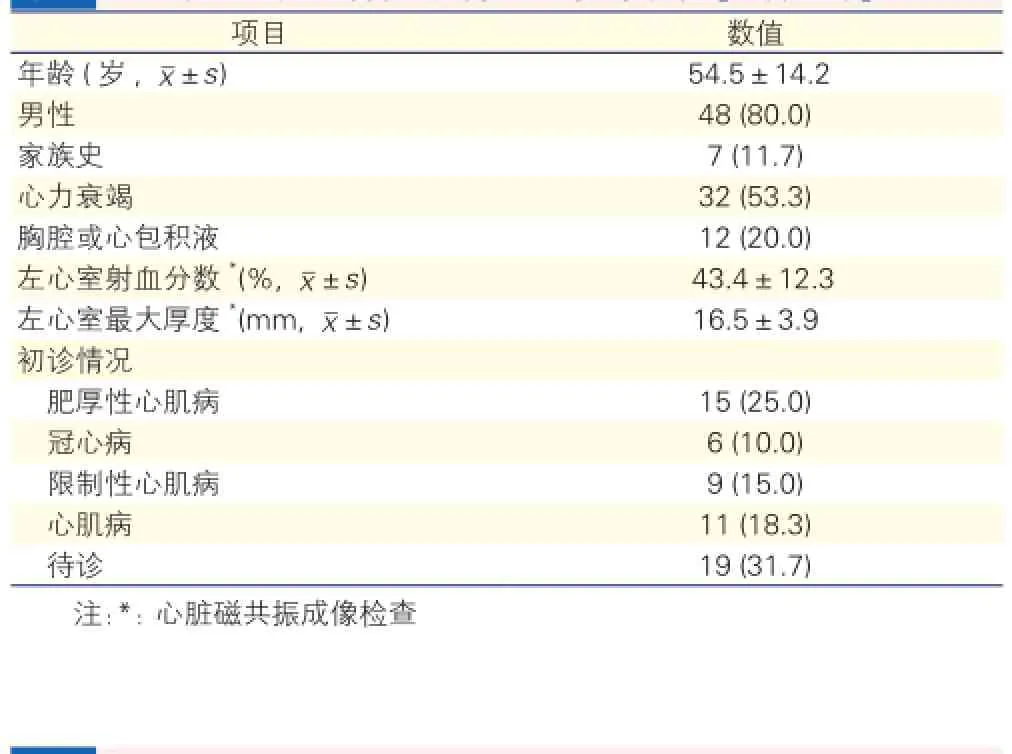
表1 60例心肌淀粉样变患者一般临床特点[例(%)]
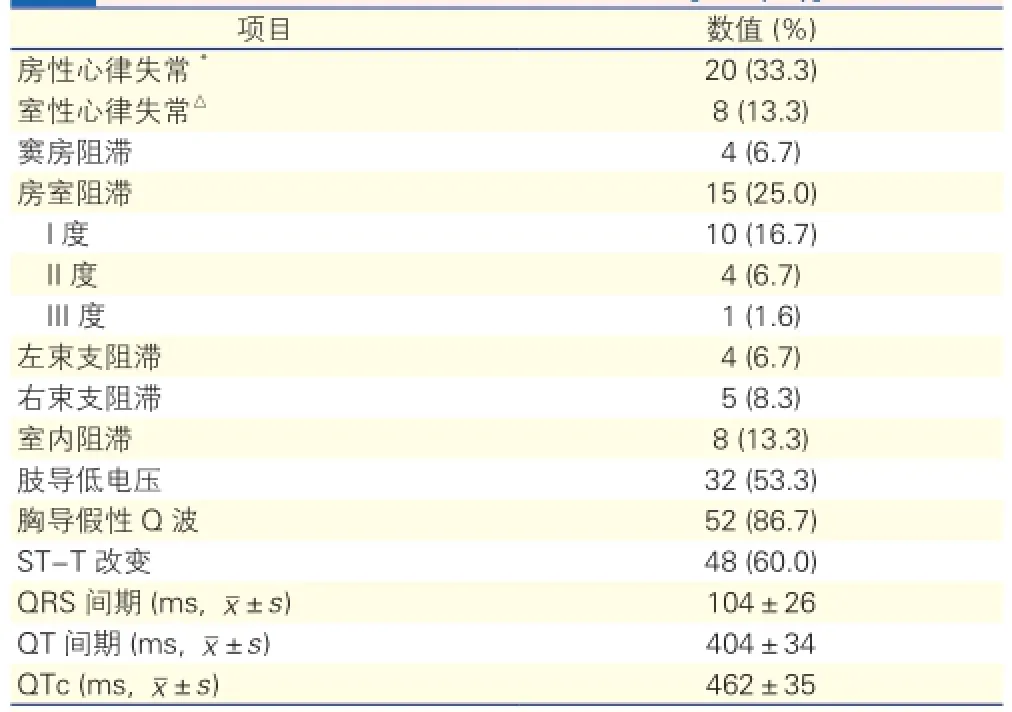
表2 60例心肌淀粉样变患者心电学特点[例(%)]
12导联QRS电压值(表3): 因胸前导联假性Q波及肢体导联低电压是CA发生率最高的心电学特征,为了进一步探索关联性,本研究量化分析了标准12导联的QRS波电压值。肢体导联QRS电压的平均值为(0.30~0.52)mV,aVR、Ⅰ、aVL导联的电压最小,肢体导联aVR的负向R波电压值最小仅为0.17 mV、QRS波电压均值为0.30 mV,Ⅰ导联R波电压值为0.26 mV、QRS波电压均值为0.36 mV,肢体导联以及胸前导联V1-3的平均R波电压和均≤0.5 mV。胸前导联呈现假性心肌梗死图形即胸前导联递增不良,V1~3导联的R波矮小甚至缺失,呈大S波或Q波图形,V1~4的S波电压平均值分别为0.62 mV、1.61 mV、1.56 mV 及1.08 mV。V1~4的R/S均<1。
表3 60例心肌淀粉样变患者心电图12导联QRS波电压(mV,±s)
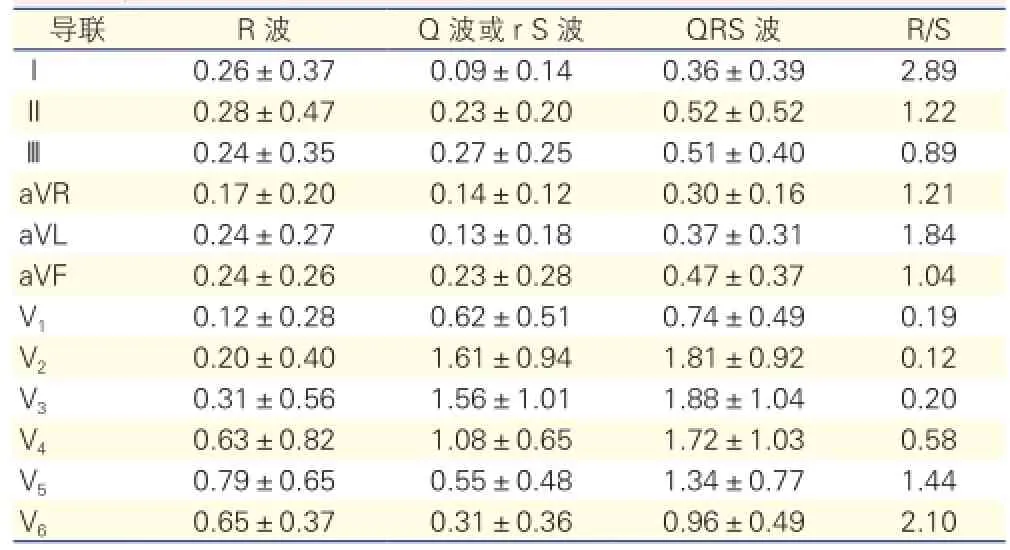
表3 60例心肌淀粉样变患者心电图12导联QRS波电压(mV,±s)
导联 R波 Q波或r S波 QRS波 R/S Ⅰ0.26±0.37 0.09±0.14 0.36±0.39 2.89 Ⅱ0.28±0.47 0.23±0.20 0.52±0.52 1.22 Ⅲ0.24±0.35 0.27±0.25 0.51±0.40 0.89 aVR 0.17±0.20 0.14±0.12 0.30±0.16 1.21 aVL 0.24±0.27 0.13±0.18 0.37±0.31 1.84 aVF 0.24±0.26 0.23±0.28 0.47±0.37 1.04 V10.12±0.28 0.62±0.51 0.74±0.49 0.19 V20.20±0.40 1.61±0.94 1.81±0.92 0.12 V30.31±0.56 1.56±1.01 1.88±1.04 0.20 V40.63±0.82 1.08±0.65 1.72±1.03 0.58 V50.79±0.65 0.55±0.48 1.34±0.77 1.44 V60.65±0.37 0.31±0.36 0.96±0.49 2.10
CA患者呈肢体导联低电压的关联因素(表4):根据CA患者是否合并心力衰竭、胸腔或心包积液、胸前导联假性Q波,进一步观察患者心电图检查结果是否合并肢体导联低电压情况,表4显示合并胸腔或心包积液、胸前导联假性Q波的患者出现肢体导联低电压的比例显著升高,但是仍有22例(45.8%)不存在胸腔或心包积液的患者出现肢体导联低电压。图1、2显示2例CA患者的心电图表现。
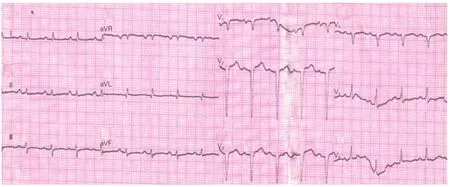
图1 一例43岁男性心肌淀粉样变患者(心脏磁共振成像提示少量心包积液),心电图示窦性心律,胸前导联假性Q波
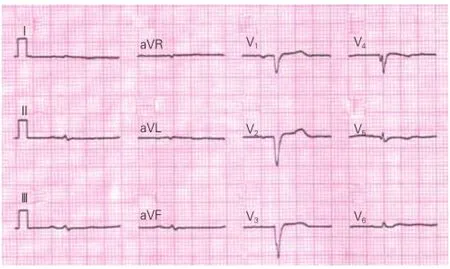
图2 一例65男性心肌淀粉样变患者,心电图示窦性心律,肢体导联低电压以及胸前导联假性Q波
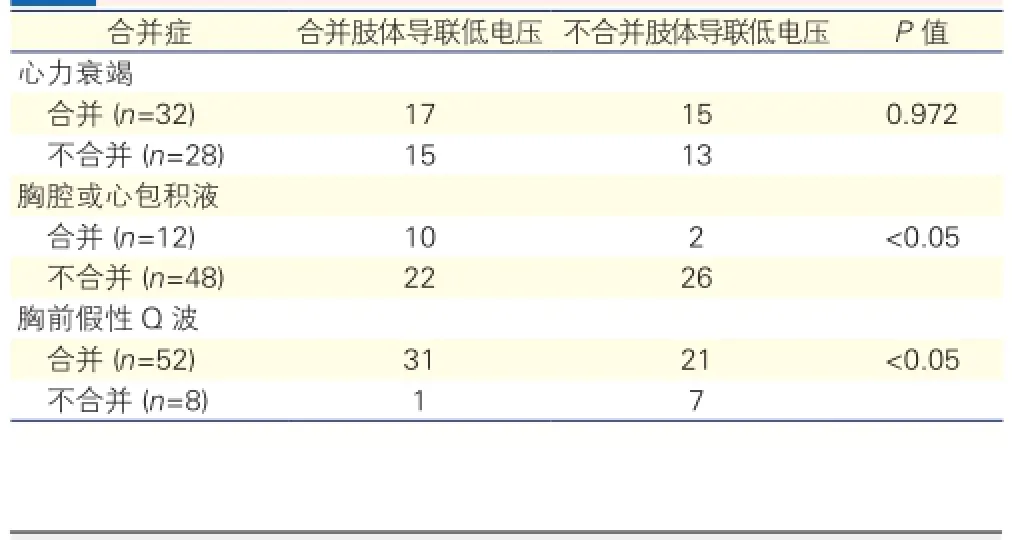
表4 60例心肌淀粉样变患者心电图呈肢体导联低电压的关联因素
3 讨论
CA是一种心肌结构功能紊乱的疾病,淀粉样变性的疾病是由错误折叠的不溶性蛋白聚集在细胞外沉积引起的,淀粉样变浸润在心肌组织内沉积引起心脏结构与功能的改变[14]。临床上一般分为原发性和继发性: 发生于结核、类风湿性关节炎、溃疡性结肠炎、慢性骨髓炎、慢性化脓性和消耗性疾患等,或发生于多发性骨髓瘤者均称为继发性淀粉样变;如无以上病因,则为原发性淀粉样变,多与遗传有关(本研究入选病例中有7例确诊多发性骨髓瘤合并淀粉样变)[15, 16]。本研究中男性患者占80%,略高于以往研究[17]。目前公认心内膜下心肌活检是诊断CA的金标准。1975年Schroeder提出国外首个心肌活检诊断CA的报道;我国马文珠等[18]于1986年报道了使用心内膜下活检诊断CA。但是由于有创性的心内膜下心肌活检的开展受到诸多因素的影响,很难在基层医院开展,使得本病初诊时确诊率较低。在本研究中,22例(45.8%)患者被误诊为肥厚型(非梗阻性)心肌病以及冠心病,与其临床症状不典型以及常规超声心动图、心电图改变缺乏特征性有关。CMR能较好地诊断CA,本研究中所有患者均行CMR检查,结果显示CA患者的CMR提示轻度左心室肥厚,以室间隔增厚最为常见,20%患者合并胸腔或心包积液。
本研究主要评估了CA的心电学特征。胸前导联假性心肌梗死样改变、ST-T改变伴肢体导联低电压是CA患者最明显的心电学特征, 其中胸前导联假性Q波的发生率最高,这与以往的研究结果相似[19-21]。本研究通过分析合并心力衰竭、胸腔或心包积液、胸前导联假性Q波的CA患者出现肢体导联低电压的比例,结果显示合并心力衰竭对出现肢体导联低电压未见显著影响,合并胸腔或心包积液、胸前导联假性Q波的患者出现肢体导联低电压的比例明显高于不合并者,但是仍有将近一半不合并胸腔或心包积液的CA患者心电图检查出现肢体导联低电压,可能与CA影响心电传导活动有关。当患者同时出现肢体导联低电压以及胸前导联假性Q波时,CA的可能性增大。由于肢体导联低电压并不是CA患者所独有,在一些肥厚型心肌病患者亦可出现[1, 22-25],因此CA患者出现肢体导联低电压的原因尚待进一步研究。本研究以量化的指标具体分析各导联的具体电压值,结果显示aVR、Ⅰ、aVL导联电压最小,aVR导联电压均值最小负向R波电压为0.17 mV、QRS波电压为0.30 mV,肢体导联和V1-3导联R波电压平均值均<0.5 mV。结合以上定性及量化的指标,可以对CA的心电图诊断得出初步判断。
本研究从心电学角度提供了CA患者的心电图特点,对早期诊断治疗[26]和改善患者的预后[27],具有重要的临床意义。然而确诊该疾病需要相当长的时间,特别是在疾病的早期,超声心动图诊断CA敏感性不高。CMR和组织或器官活检虽然可确诊,但该技术难以在临床广泛普及应用。而心电图是最常用的心脏辅助诊断工具,方便易得。本研究的局限性为一项小样本回顾性研究,并非所有患者的诊断都基于EMB。且研究对象并不完全是早期就诊患者, 这可能造成在淀粉样变性病的心电图的诊断标准更高。
参考文献
[1] Gertz MA, Comenzo R, Falk RH, et al. Definition of organ involvement and treatment response in immunoglobulin light chainamyloidosis (AL): a consensus opinion from the 10th International Symposium on Amyloid and Amyloidosis, Tours, France, 18-22April 2004. Am J Hematol, 2005, 79: 319-328.
[2] Hess EP, White RD. Out-of-hospital cardiac arrest in patients with cardiac amyloidosis: presenting rhythms, management and outcomes infour patients. Resuscitation , 2004, 60: 105-111.
[3] Selvanayagam JB, Hawkins PN, Paul B, et al. Evaluation and management of the cardiac amyloidosis. J Am Coll Cardiol, 2007, 50:2101-2110.
[4] Shah KB, Inoue Y, Mehra MR. Amyloidosis and the heart: a comprehensive review. Arch Intern Med , 2006, 166: 1805-1813.
[5] Kim SH, Kim SO, Han S, et al. Long-term comparison of apicalversus asymmetric hypertrophic cardiomyopathy. Int Heart J, 2013, 54: 207-211.
[6] Hosoya Y, Watanabe M, Terashima M, et al. Cardiac magneticresonance imaging in a patient with amniotic fluid embolism associated with severe cardiopulmonary complications. Int Heart J,2013, 54: 119-122.
[7] Maceira AM, Joshi J, Prasad SK, et al. Cardiovascular magneticresonance in cardiac amyloidosis. Circulation , 2005, 111:186-193.
[8] Niida T, Isoda K, Sasaki M, et al. Late gadolinium enhanced high resolution magnetic resonance imaging reveals pathophysiological condition of cardiac sarcoidosis. Int Heart J , 2009, 50: 263-266.
[9] Solar M, Zizka J, Dolezal J, et al. Contrast-enhanced magneticresonance and thallium scintigraphy in the detection of myocardial viability: a prospective comparative study. Int Heart J ,2006, 47: 521-532.
[10] Ota S, Tanimoto T, Hirata K, et al. Assessment of circumferential endocardial extent of myocardial edema and infarction in patients with reperfused acute myocardial infarction: a cardiovascular magnetic resonance study. Int Heart J , 2014, 55: 234-238.
[11] Falk RH. Diagnosis and management of the cardiac amyloidoses. Circulation, 2005, 112: 2047-2060.
[12] Perkiömäki JS, Koistinen MJ, Yli-Mayry S, et al. Dispersion of QT interval in patients with and without susceptibility to ventricular tachyarrhythmias after previous myocardial infarction. J Am Coll Cardiol, 1995, 26: 174-179.
[13] Ahnve S. Correction of the QT interval for heart rate: review of different formulas and the use of Bazett’s formula in myocardial infarction. Am Heart J , 1985, 109: 568-574.
[14] Yusuf SW, Solhpour A, Banchs J, et al. Cardiac amyloidosis.Expert Rev CardiovascTher, 2014, 12: 265-277.
[15] 杨兴生, 孙静平, 余卓文, 等. 心脏淀粉样变性病及其治疗的新进展.中国医刊, 2012, 47: 9-11.
[16] 郭然, 王珂, 郑晓群, 等. 以体循环淤血为主要表现的淀粉样变性心肌病临床特点分析. 中国循环杂志, 2005, 134: 283-284.
[17] Namdar M, Steffel J, Jetzer S, et al. Value of electrocardiogram in the differentiation of hypertensive heart disease, hypertrophic cardiomyopathy, aortic stenosis, amyloidosis, and Fabry disease. Am J Cardiology, 2012, 109: 587-593.
[18] 马文珠, 吴翔, 范学模.心内膜心肌活检诊断的心脏淀粉样变.中国循环杂志, 1986, 1: 171-194.
[19] Cheng Z, Zhu K, Tian Z, et al. The findings of electrocardiography in patients with cardiac amyloidosis. Ann Noninvasive Electrocardiol,2013, 18: 157-162.
[20] Murtagh B, Hammill SC, Gertz MA, et al. Electrocardiographic findings in primary systemic amyloidosis and biopsy-proven cardiac involvement. Am J Cardiol, 2005, 95: 535-537.
[21] Rahman JE, Helou EF, Gelzer-Bell R, et al. Noninvasive diagnosis of biopsy-proven cardiac amyloidosis. J Am Coll Cardiol, 2004, 43: 410-415.
[22] Carroll JD, Gaasch WH, McAdam KP. Amyloid cardiomyopathy:characterization by a distinctive voltage/mass relation. Am J Cardiol,1982, 49: 9-13.
[23] Dubrey SW, Cha K, Anderson J, et al. The clinical features of immunoglobulin light-chain (AL) amyloidosis with heart involvement. QJM , 1998, 91: 141-157.
[24] Granstam SO, Rosengren S, Vedin O, et al. Evaluation of patients with cardiac amyloidosis using echocardiography, ECG and rightheart catheterization. Amyloid , 2013, 20: 27-33.
[25] Piper C, Butz T, Farr M, et al. How to diagnose cardiac amyloidosis early: impact of ECG, tissue Doppler echocardiography, and myocardial biopsy. Amyloid, 2010, 17: 1-9.
[26] Desai HV, Aronow WS, Peterson SJ, et al. Cardiac amyloidosis:approaches to diagnosis and management. Cardiol Rev, 2010, 18: 1-11.
[27] Kholová I, Kautzner J. Current treatment in cardiac amyloidosis. Curr Treat Options Cardiovasc Med, 2006, 8: 468-473.
(编辑: 梅平)
Corresponding Author:LU Min-jie, Email: coolkan@163.com
收稿日期:( 2016- 01-10)
基金项目:北京市自然科学基金青年项目(7154232)
作者单位:100037 北京市,中国医学科学院 北京协和医学院 国家心血管病中心 阜外医院 心肺功能检测中心(黄静涵、孙兴国),磁共振检查室(陆敏杰、赵世华)
作者简介:黄静涵 助理研究员 硕士 主要从事心血管疾病临床与科研工作 Email: huangjinghan@sohu. com 通讯作者: 陆敏杰 Email: coolkan@163.com
中图分类号:R541. 4
文献标识码:A
文章编号:1000-3614(2016)06-0596-05
doi:10. 3969/j. issn. 1000-3614. 2016. 06. 017
Electrocardiographic Characteristics in Patients With Cardiac Amyloidosis
HUANG Jing-han, LU Min-jie, SUN Xing-guo, ZHAO Shi-hua.
Cardiopulmonary Function Testing Center, Cardiovascular Institute and Fu Wai Hospital, CAMS and PUMC, Beijing (100037),China
Abstract

