1岁以下先天性心脏病患儿体外循环下心脏术后甲状腺激素水平与延迟恢复的关系
陈思行,李霞,鲁中原, 王旭
1岁以下先天性心脏病患儿体外循环下心脏术后甲状腺激素水平与延迟恢复的关系
陈思行,李霞,鲁中原, 王旭
摘要
目的:探索1岁以下先天性心脏病患儿体外循环下心脏术后甲状腺激素水平与延迟恢复的关系。
方法:回顾性分析2014-01至2015-01期间,在我院行体外循环心脏手术的186例1岁以下患儿资料,将术后小儿重症恢复室(PICU)停留时间≥5天定义为延迟恢复,据此将186例患儿分成两组,PICU停留时间≥5天的为延迟恢复组(n=39),PICU停留时间<5天的为非延迟恢复组(n=147)。对患儿术后的24 h甲状腺激素水平与延迟恢复情况进行统计分析。
结果:与非延续恢复组比较,延迟恢复组术后24 h游离三碘甲状腺原氨酸[FT3,(2.02±0.48) pg/ml vs (2.27±0.46)pg/ml]、总三碘甲状腺原氨酸[TT3, (0.59±0.30 )ng/dl vs (0.71±0.24)ng/dl]、总甲状腺素[TT4,( 5.39±2.58)μg/ml vs (6.49±2.20)μg/ml]水平显著降低,差异均有统计学意义(P<0.05)。但是两组间游离甲状腺素水平及促甲状腺激素水平差异无统计学意义(P >0.05)。多因素Logistic回归分析结果显示,术后24 h内的低水平的FT3(比值比= 0.32;95%可信区间:0.12~0.84; P <0.05)是延迟恢复的独立危险因素。线性回归分析结果显示,术后低水平的FT3与患儿的体重线性相关(r=0.11,P<0.001)。
结论:1岁以下患儿体重越轻,术后24 h内的FT3水平越低;低水平FT3是患儿术后延迟恢复的独立危险因素。
关键词 甲状腺激素;心脏缺损,先天性;延迟恢复
Objective: To explore the relationship between thyroid hormone levels and prolonged recovery after cardiac surgery with cardiopulmonary bypass (CPB) in congenital heart disease (CHD) children younger than 1 year of age.
Methods: A total of 186 CHD children younger than 1 year treated in our hospital from 2014-01 to 2015-01 were retrospectively summarized. According to the pediatric intensive care unit (PICU) stay time, the patients were divided into 2 groups: Prolonged recovery group, the patients stated in PICU≥5 days, n=39 and Non-prolonged recovery group, the patients stayed in PICU<5 days, n=147. Thyroid hormone levels within 24 hours of operation with prolonged recovery conditions were studied.
Results: Compared with Non-prolonged recovery group, the patients in Prolonged recovery group showed decreased levels of FT3 (2.02 ± 0.48) pg/ml vs (2.27 ± 0.46) pg/ml, TT3 (0.59 ± 0.30) ng/dl vs (0.71 ± 0.24) ng/dl and TT4 (5.39 ± 2.58)μg/ml vs (6.49 ± 2.20) μg/ml, all P<0.05; while the levels of free thyroid hormone and thyrotropin were similar between 2 groups, P>0.05. Multivariable logistical regression analysis presented that low level of FT3 within 24 hours of operation was the independent risk factor for prolonged recovery (OR= 0.32, 95% CI 0.12-0.84, P=0.02); linear regression analysis indicated that post-operative reduction of thyroid hormone was related to low body weight of the patients (r=0.11, P<0.001).
Conclusion: Lower body weight was usually having lower level of FT3 within 24 hours of operation, which was the independent predictor for prolonged recovery in CHD children younger than 1 year after cardiac surgery.
Key words Thyroid hormone; Heart defects, congenital; Prolonged recovery
(Chinese Circulation Journal, 2016,31:588.)
随着先天性心脏病外科技术、体外循环技术、麻醉技术以及术后监护技术的不断提升。越来越多的专家提出早期给予有指征的患儿手术治疗[1, 2]。但是低龄患儿器官组织发育不成熟,对体外循环、麻醉及手术反应大,依然有部分患儿预后不良甚至死亡。其中延迟恢复就是预后不良的一个重要指标[3]。所以探索延迟恢复的危险因素一直是人们关注的热点话题。近年来有研究提示,即使患者没有原发性甲状腺疾病,体外循环下心脏术后甲状腺激素水平也会降低,即出现正常甲状腺病态功能综合征(SES)[4, 5]。虽然甲状腺激素水平通常会在术后5~7天内恢复正常水平[6],但是SES往往预示着患儿术后心脏功能差,延迟恢复,预后不良[7]。并有学者提出通过术后补充甲状腺激素增加患儿心排出量,改善预后[8]。目前鲜有针对1岁以下患儿延迟恢复和SES发生情况的研究。本研究回顾性分析1岁以下患儿术后甲状腺激素水平对延迟恢复的影响,为进一步的干预提供证据。
1 资料与方法
一般资料:选取2014-06至2015-01期间,186 例1岁以下、在我院行体外循环心脏手术的患儿资料,其中男107例,平均年龄( 6.33±2.78)个月,平均体重( 6.82±1.89) kg。排除合并有原发性甲状腺疾病、21三体综合征等可能影响术后甲状腺激素水平的患儿。186例先天性心脏病手患儿RACHS-1风险评估[9]分级、手术方式选择情况详见表1。
手术过程及术后处理:186例患儿均在全身麻醉低温体外循环下行手术,体外循环用全程超滤,术中温度28~32℃。手术方式由主刀医师根据患儿病情及自身经验决定。所有手术由本中心的外科医师,麻醉师、体外循环师、护士配合完成。所有患儿均在术后转入小儿重症恢复室(PICU),由专业PICU医师和护士决定并给予患儿强心、利尿、机械通气等治疗。
实验室设备及检查方法:转入PICU后24 h早晨抽取静脉血样本 2 ml,送检验科分离血清,采用美国ADVIA全自动免疫分析仪,应用微粒子酶联免疫法,测定促甲状腺激素(TSH)、游离三碘甲状腺原氨酸(FT3)、总三碘甲状腺原氨酸(TT3)、总甲状腺素(TT4)、游离甲状腺素(FT4)。
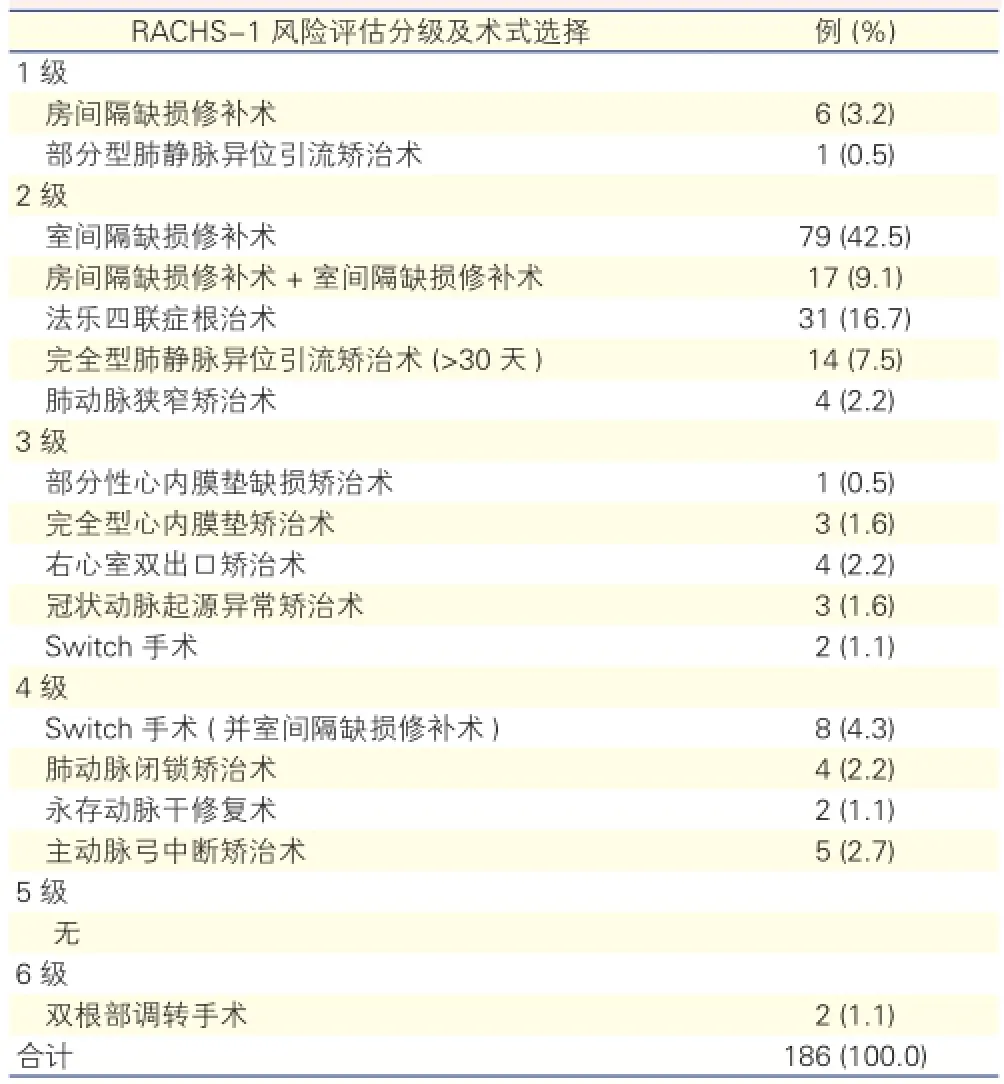
表1 186例先天性心脏病患儿RACHS-1风险评估分级及手术方式选择情况
方法:参考国外文献[10, 11],我们将PICU停留时间≥5天定义为延迟恢复。同时收集其他可能与患儿延迟康复相关的资料,包括:术后容量平衡情况、血管活性药物评分、术后并发症(包括呼吸功能不全、肾功能不全及低心排综合征),以及术后死亡情况。根据患儿术后PICU停留时间将186例患儿分成两组,PICU停留时间≥5天者为延迟恢复组(n=39),PICU停留时间<5天者为非延迟恢复组(n=147)。
统计学方法:采用SPSS 22.0统计软件。计量资料依据其是否符合正太分布,用均数±标准差(±s)或者中位数(P25,P75)表示。单因素分析中,符合正太分布的计量资料比较用t检验,不符合正态分布的计量资料用秩和检验分析比较;计数资料以率或百分比表示,组间比较采用卡方检验;等级资料采用秩和检验;同时采用多因素Logistic回归分析影响延迟恢复的危险因素,用线性回归分析FT3与体重的关系,以P<0.05为差异有统计学意义。
2 结果
两组患儿临床资料的比较(表2):与非延迟恢复组比较,延迟恢复组年龄更小,体重更低;而RACHS-1风险评估平均秩次值较高,体外循环时间、主动脉阻断时间和术后累计机械通气时间更长,并发症的发生率以及死亡率较高(分别于术后18天,21天,35天死亡),差异均有统计学意义(P<0.05);术后24 h所需的血管活性药物评分虽较高,但差异无统计学意义(P>0.05)。两组之间的性别及24 h的液体平衡量差别无统计学意义(P>0.05),非延迟恢复组无死亡发生。
表2 两组患儿临床资料比较(±s)
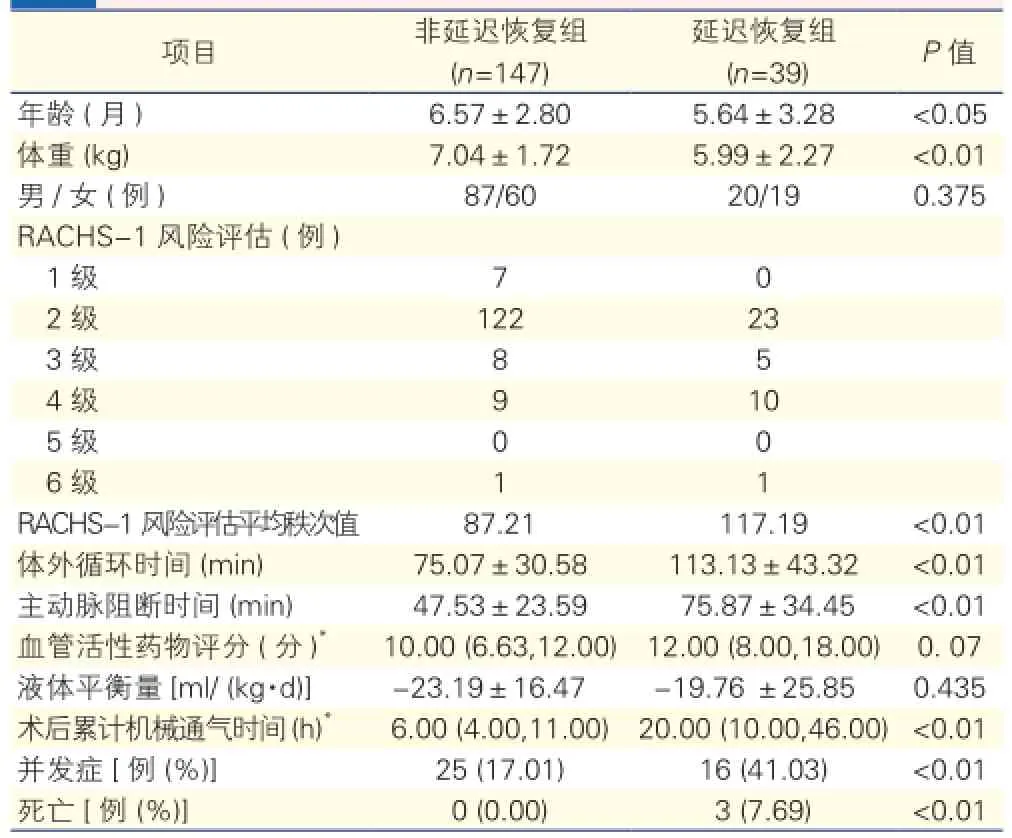
表2 两组患儿临床资料比较(±s)
注:*:为中位数(P25,P75)
项目 非延迟恢复组(n=147)延迟恢复组(n=39) P值年龄 (月) 6.57±2.80 5.64±3.28 <0.05体重 (kg) 7.04±1.72 5.99±2.27 <0.01 男/女 (例) 87/60 20/19 0.375 RACHS-1风险评估 (例)1级 7 0 2级 122 23 3级 8 5 4级 9 10 5级 0 0 6级 1 1 RACHS-1风险评估平均秩次值 87.21 117.19 <0.01体外循环时间 (min) 75.07±30.58 113.13±43.32 <0.01主动脉阻断时间 (min) 47.53±23.59 75.87±34.45 <0.01血管活性药物评分 (分)*10.00 (6.63,12.00)12.00 (8.00,18.00) 0. 07液体平衡量[ml/ (kg·d)] -23.19±16.47 -19.76 ±25.85 0.435术后累计机械通气时间 (h)*6.00 (4.00,11.00)20.00 (10.00,46.00)<0.01并发症[例 (%)] 25 (17.01) 16 (41.03) <0.01死亡 [例 (%)] 0 (0.00) 3 (7.69) <0.01
两组患儿术后24 h甲状腺激素水平的比较(表3):与非延迟恢复组比较,延迟恢复组术后24 h FT3、TT3、TT4水平显著降低,差异均有统计学意义(P<0.05)。但是两组术后FT4 水平及TSH水平差异无统计学意义(P>0.05)。
表3 两组患儿术后24 h甲状腺激素水平的比较(±s)
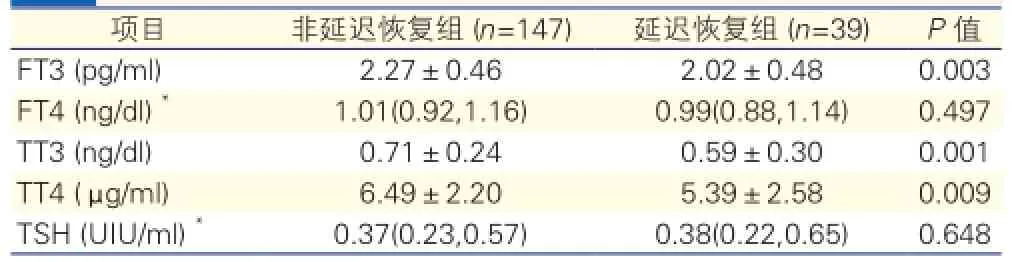
表3 两组患儿术后24 h甲状腺激素水平的比较(±s)
注:*:中位数(P25,P75)。FT3:游离三碘甲状腺原氨酸;FT4:游离甲状腺素;TT3:总三碘甲状腺原氨酸;TT4:总甲状腺素;TSH:促甲状腺激素
项目 非延迟恢复组 (n=147) 延迟恢复组 (n=39) P值FT3 (pg/ml) 2.27±0.46 2.02±0.48 0.003 FT4 (ng/dl)*1.01(0.92,1.16) 0.99(0.88,1.14) 0.497 TT3 (ng/dl) 0.71±0.24 0.59±0.30 0.001 TT4 (μ g/ml) 6.49±2.20 5.39±2.58 0.009 TSH (UIU/ml)*0.37(0.23,0.57) 0.38(0.22,0.65) 0.648
多因素Logistic回归分析(表4):将两组之间有统计学的临床变量放入多因素Logistic回归模型中,包括:年龄、体重、RACHS-1风险评估、体外循环时间、主动脉阻断时间、机械通气时间、并发症例数以及术后FT3、TT3、TT4。结果显示主动脉阻断时间[比值比(OR)= 1.03; 95%可信区间(IC):1.01~1.05; P<0.001]、机械通气时间(OR= 1.06;95%CI:1.03~1.10; P<0.001)及24 hFT3 水平(OR= 0.32; 95%CI:0.12~0.84; P=0.02)是术后延迟恢复的独立危险因素。

表4 多因素Logistic回归分析
线性回归分析结果(图1):回归方程为FT3=0.11×患儿体重(kg)+1.46,结果显示患儿体重是与术后24 h FT3水平呈线性相关 (r=0.11,P<0.001),而与年龄、体重、性别、RACHS-1风险评估、体外循环时间及主动脉阻断时间不相关。

3 讨论
1岁以下患儿术后24 h低水平的FT3预示着延迟恢复,而体重和术后24 h FT3水平相关。随着心外科、体外循环、麻醉科及术后重症监护技术的不断提高,越来越多低龄先天性心脏病患儿可以在早期接受手术治疗[1]。由于低龄患儿的组织器官发育不良,对手术、麻醉、体外循环反应较大,部分患儿术后依然会延迟恢复。有文献报道,术后延迟恢复的患儿一年内的生存率仅64%,而且所有患儿都伴有明显的运动能力下降[10]。因此探索低龄患儿术后延迟恢复的危险因素已经成为热门话题。
SES是指患儿没有原发性甲状腺疾病,但是在一些应激状态下,甲状腺激素水平也会降低,常见于感染、炎症、手术、创伤等[4, 5, 12]。体外循环下心脏手术引起全身炎症反应,易导致患儿术后SES[13-16]。有文献报道,术后甲状腺激素水平呈一过性的降低,虽然大部分会在1周之内恢复到正常水平,但是甲状腺激素水平的大幅度的降低预示着患儿预后不良[17, 18],甚至死亡[19]。Plikat等[20]的研究发现,术后甲状腺激素水平低的患者需要更多的机械通气支持。Kumar等[21]则认为T3水平低预示病死率高。有研究发现术后甲状腺激素水平被认为能够比急性生理与慢性健康评分-Ⅱ(APACHE- Ⅱ)能够更好地预测患儿预后[22]。然而SES的机制尚未明确,有学者认为患者在应激状态下存在着不同程度的缺血、缺氧及能量摄入不足,SES是机体降低自身基础代谢的保护机制[23]。应激状态下,机体存在着不同程度的缺氧、酸中毒、营养失衡,以及机体分泌的儿茶酚胺、糖皮质激素等,都可以导致5'-脱碘酶活性降低,T4向T3转化减少,术后FT3水平降低最明显[24, 25]。有研究提出用术后FT3水平低是术后机械通气时间长、病死率高的独立预测因子[16, 17]。本研究发现延迟恢复组术后24 hFT3、TT3及TT4水平更低,而低水平术后FT3是患儿延迟恢复的独立危险因素,与其他研究结果相符合。
RACHS-1 风险评估是先天性心脏病手术复杂程度及手术风险的评估系统,共分为1~6级,等级越高,手术越复杂,风险越大[9]。有研究发现,RACHS-1 风险评估高的患儿与术后PICU的停留时间更长,病死率更高[26]。本研究中,单因素分析发现延迟恢复组患儿RACHS-1风险评估值比非延迟恢复组更高,但是多因素分析显示RACHS-1 风险评估值并不是患儿延迟恢复的独立危险因素。这与之前一些研究结果不符[27]。但是也有学者认为,RACHS-1 风险评估的不足之处在于缺乏个体化,并不能完全反映患儿的全部情况,因此需要与其他因素相结合[26]。而术后甲状腺激素水平是否能比RACHS-1风险评估更好的预测延迟恢复还需进一步研究。
术后甲状腺激素水平受多种因素影响。有研究报道,年龄低、低体重、长时间体外循环,甲状腺激素水平似乎下降更明显[28]。新生儿术后刚转入PICU时FT3水平与体外循环时间、体重相关,回归系数分别为-0.68和0.4[29]。本研究提示1岁以下患儿术后24 h甲状腺激素水平与体重相关,与以上结论基本相符。原因可能是低体重患儿营养状况更差,难以耐受手术、体外循环的刺激,术后全身炎症反应更重,导致甲状腺激素水平更低。
有不少学者提出术后给予甲状腺激素水平降低的患儿补充甲状腺激素,以增强心脏收缩力,加快心率,从而增加心输出量,可以减少血管活性药物的用量,促进患儿尽快恢复[30]。一项随机双盲对照试验提示,给予心脏术后患儿补充甲状腺激素,术后FT3水平明显上升,心排指数增加20.4%,而安慰剂组仅增加10%[31]。TRICC研究表明,给予5个月以下患儿口服甲状腺激素治疗可以改善近期预后[32]。本研究提示,术后FT3水平降低预示着患儿延迟恢复,我们推测术后给予1岁以下患儿补充甲状腺激素可以缩短PICU停留时间,促进患儿早日康复。但是也有学者认为术后低水平甲状腺激素,能够降低机体代谢水平,降低患儿心肌氧耗,起到保护心肌的作用,所以不推荐术后补充甲状腺激素[26]。
本研究样本量较小,且是单中心研究,所以研究结果可能无法代表所有患儿的情况。因此研究结果还需要进一步临床试验来验证。
综上所述,我们得出结论:体外循环下心脏术后24 h低水平FT3是1岁以下患儿延迟恢复的独立危险因素,而术后24 h的FT3水平和患儿体重线性相关。
参考文献
[1] Van Arsdell GS, Maharaj GS, Tom J, et al. What is the optimal age for repair of tetralogy of Fallot? Circulation, 2000, 102: 123-129.
[2] 曾嘉航, 陈欣欣, 崔虎军, 等. 婴儿期不同月龄段对法洛四联症根治术手术效果的影响. 岭南心血管病杂志, 2012, 18: 371-374.
[3] 王旭, 李守军, 李霞, 等. 全腔静脉肺动脉连接术后ICU延迟恢复患儿风险分层管理. 中国胸心血管外科临床杂志, 2013, 20: 256-259.
[4] Liu ML, Xu G, Huang ZY, et al. Euthyroid sick syndrome and nutritional status are correlated with hyposelenemia in hemodialysis patients. Int J Artif Organs, 2011, 34: 577-583.
[5] Hu YY, Li GM, Wang W. Euthyroid sick syndrome in children with diabetic ketoacidosis. Saudi Med J, 2015, 36: 243-247.
[6] Talwar S, Khadgawat R, Sandeep JA, et al. Cardiopulmonary bypass and serum thyroid hormone profile in pediatric patients with congenital heart disease. Congenit Heart Dis, 2012, 7: 433-440.
[7] Martinez-Quintana E, Rodriguez-Gonzalez F. Follow-up of congenital heart disease patients with subclinical hypothyroidism. Cardiol Young,2015, 25: 1111-1118.
[8] Marwali EM, Boom CE, Sakidjan I, et al. Oral triiodothyronine normalizes triiodothyronine levels after surgery for pediatric congenital heart disease. Pediatr Crit Care Med, 2013, 14: 701-708.
[9] Jenkins KJ, Gauvreau K, Newburger JW, et al. Consensus-based method for risk adjustment for surgery for congenital heart disease. J Thorac Cardiovasc Surg, 2002, 123: 110-118.
[10] Bapat V, Allen D, Young C, et al. Survival and quality of life after cardiac surgery complicated by prolonged intensive care. J Card Surg,2005, 20: 212-217.
[11] Manji RA, Arora RC, Singal RK, et al. Long-Term Outcome and Predictors of Noninstitutionalized Survival Subsequent to Prolonged Intensive Care Unit Stay After Cardiac Surgical Procedures. Ann Thorac Surg, 2016, 101: 56-63.
[12] Ozcem B. Nonthyroidal illness syndrome in off-pump coronary artery bypass surgery. Anatol J Cardiol, 2016, 16: 69.
[13] Akcevin A, Alkan-Bozkaya T, Qiu F, et al. Evaluation of perfusion modes on vital organ recovery and thyroid hormone homeostasis in pediatric patients undergoing cardiopulmonary bypass. Artif Organs,2010, 34: 879-884.
[14] Marks SD, Haines C, Rebeyka IM, et al. Hypothalamic-pituitarythyroid axis changes in children after cardiac surgery. J Clin Endocrinol Metab, 2009, 94: 2781-2786.
[15] Lynch BA, Brown DM, Herrington C, et al. Thyroid dysfunction after pediatric cardiac surgery. J Thorac Cardiovasc Surg, 2004, 127:1509-1511.
[16] Eggum R, Ueland T, Mollnes TE, et al. Perfusion temperature, thyroid hormones and inflammation during pediatric cardiac surgery. Interact Cardiovasc Thorac Surg, 2010, 10: 76-80.
[17] Cerillo AG, Storti S, Kallushi E, et al. The low triiodothyronine syndrome: a strong predictor of low cardiac output and death in patients undergoing coronary artery bypass grafting. Ann Thorac Surg,2014, 97: 2089-2095.
[18] Gil-Gomez R, Blasco-Alonso J, Castillo-Martin R, et al. Prognostic indicators after cardiac surgery in children and their relationship with the oxidative stress response. Rev EspAnestesiol Reanim, 2016, 63:3-12.
[19] Wang F, Pan W, Wang H, et al. Relationship between thyroid function and ICU mortality: a prospective observation study. Crit Care, 2012, 16: R11.
[20] Plikat K, Langgartner J, Buettner R, et al. Frequency and outcome of patients with nonthyroidal illness syndrome in a medical intensive care unit. Metabolism, 2007, 56: 239-244.
[21] Kumar KV, Kapoor U, Kalia R, et al. Low triiodothyronine predicts mortality in critically ill patients. Indian J Endocrinol Metab, 2013, 17:285-288.
[22] Rothwell PM, Udwadia ZF, Lawler PG. Thyrotropin concentration predicts outcome in critical illness. Anaesthesia, 1993, 48: 373-376.
[23] Adler SM, Wartofsky L. The nonthyroidal illness syndrome. Endocrinol Metab Clin North Am, 2007, 36: 657-672.
[24] Economidou F, Douka E, Tzanela M, et al. Thyroid function during critical illness. Hormones (Athens), 2011, 10: 117-124.
[25] 宋秀霞, 姜涛, 姚晓爱, 等. 急性心肌梗死患者甲状腺激素水平与冠状动脉病变严重程度相关性研究. 中国循环杂志, 2012, 27: 21-24.
[26] 曾敏, 李守军, 王旭, 等. 复杂先天性心脏病矫治术后的快速康复研究. 岭南心血管病杂志, 2012, 18: 117-121.
[27] 黄继红, 蔡及明, 张海波, 等. 小于3月龄婴儿先天性心脏病手术死亡危险度分析. 临床心血管病杂志, 2014, 30: 792-796.
[28] 罗俊, 薛玉良. 小儿体外循环心脏手术对甲状腺激素代谢的影响.中国煤炭工业医学杂志, 2009, 12: 1840-1841.
[29] Plumpton K, Haas NA. Identifying infants at risk of marked thyroid suppression post-cardiopulmonary bypass. Intensive Care Med, 2005,31: 581-587.
[30] Bettendorf M, Schmidt KG, Tiefenbacher U, et al. Transient secondary hypothyroidism in children after cardiac surgery. Pediatr Res, 1997,41: 375-379.
[31] Bettendorf M, Schmidt KG, Grulich-Henn J, et al. Tri-iodothyronine treatment in children after cardiac surgery: a double-blind, randomised,placebo-controlled study. The Lancet, 2000, 356: 529-534.
[32] Portman MA, Fearneyhough C, Karl TR, et al. The Triiodothyronine for Infants and Children Undergoing Cardiopulmonary Bypass (TRICC)study: design and rationale. Am Heart J, 2004, 148: 393-398.
(编辑:曹洪红)
Corresponding Author:WANG Xu, Email: fwpicu@163.com
收稿日期:(2016-02-25)
作者单位:100037 北京市,北京协和医学院 中国医学科学院 国家心血管病中心 阜外医院 小儿外科中心 小儿重症恢复室
作者简介:陈思行 硕士研究生 研究方向为小儿心脏手术围术期医学 Email:csxkaka22@163.com 通讯作者:王旭 Email:fwpicu@163.com
中图分类号:R541
文献标识码:A
文章编号:1000-3614(2016)06-0588-05
doi:10.3969/j.issn.1000-3614.2016. 06.015
Relationship Between Thyroid Hormone Levels and Prolonged Recovery After Cardiac Surgery With Cardiopulmonary Bypass in Congenital Heart Disease Children Younger Than 1 Year of Age
CHEN Si-xing, LI Xia, LU Zhong-yuan, WANG Xu.
Pediatric Intensive Care Unit, Cardiovascular Institute and Fu Wai Hospital, CAMS and PUMC, Beijing (100037), China
Abstract

