小胶质细胞在颅脑外伤后胶质瘢痕形成中的实验研究
危晴天 孙道法 许 刚
湖北仙桃市第一人民医院神经外科 仙桃 433000
小胶质细胞在颅脑外伤后胶质瘢痕形成中的实验研究
危晴天孙道法许刚
湖北仙桃市第一人民医院神经外科仙桃433000
【摘要】目的研究小胶质细胞在颅脑外伤后胶质瘢痕形成中的作用。方法选取8~10周龄SD大鼠48只,雌雄各半。按体质量相近原则,随机分为观察组和对照组,观察组建立大鼠颅脑外伤模型,对照组不作任何处理,正常饲养。分别在造模后1 d和7 d收集各组大鼠的血液,检测血清中TNF-α、IL-1β、IL-6、IL-4以及IL-10表达量,并进行统计分析,并于2组造模后1 d、7 d分别取每组12只大鼠大脑组织进行病理检查,观察颅脑外伤后胶质瘢痕的形态学。结果观察组造模1 d血清中TNF-α、IL-1β、IL-6、IL-4以及IL-10的表达量分别为79.8±8.7、83.6±8.3、83.3±10.2、83.3±7.8以及82.7±6.8。对照组饲养1 d血清中TNF-α、IL-1β、IL-6、IL-4以及IL-10的表达量分别为69.3±7.2、68.6±7.4、71.4±7.3、69.5±7.6以及65.4±8.6。观察组造模7 d后血清中TNF-α、IL-1β、IL-6、IL-4以及IL-10的表达量分别为96.8±12.4、92.6±11.2、96.8±12.2、95.8±12.5以及90.4±12.2。对照组饲养7 d后,血清中TNF-α、IL-1β、IL-6、IL-4以及IL-10的表达量分别为82.1±9.5、70.3±6.8、82.2±12.6、82.2±8.6以及67.1±6.4。观察组TNF-α、IL-1β、IL-6、IL-4以及IL-10的表达量明显高于对照组,差异有统计学意义(P<0.05)。结论小胶质细胞在颅脑外伤后胶质瘢痕形成中具有双重作用,小胶质细胞激发后可产生TNF-α、IL-1β、IL-6、等炎症因子,又同时可以释放L-4以及IL-10等抑制炎症反应的因子。干预小胶质细胞的活化,抑制炎症反应因子的释放,可有效预防颅脑外伤后胶质瘢痕形成,同时,也能指导临床治疗颅脑外伤后胶质瘢痕形成。
【关键词】小胶质细胞;颅脑外伤;胶质瘢痕
近年来,颅脑外伤的发病率呈逐年增高趋势,我国脑损伤患者每年高达20 000人,严重影响病人的生活质量,同时也加重了家庭和社会的负担[1]。传统观念认为,神经系统损伤后,难以再生。目前随着对小胶质细胞的研究,发现小胶质细胞在颅脑外伤后胶质瘢痕形成中起重要作用。同时,小胶质细胞在在颅脑外伤后胶质瘢痕形成中的作用存在很大争议[2]。本文研究小胶质细胞在颅脑外伤后胶质瘢痕形成中的作用,现报告如下。
1材料与方法
1.1材料选取8~10周龄SD大鼠48只,雌雄各半,体质量180~220 g。按体质量相近原则,随机分为观察组和对照组,观察组建立大鼠颅脑外伤模型,对照组不作任何处理,正常饲养。2组移植大鼠周龄、性别构成比及体质量方面比较差异无统计学意义(P>0.05),具有可比性。
1.2方法
1.2.1建立大鼠颅脑外伤模型:采用自由落体法制作大鼠颅脑外伤模型。具体步骤:用水合氯醛将大鼠麻醉,剂量为0.3 mL/100 g。沿头皮中线切开皮肤,分离骨膜,出现颅骨。使用重20 g的撞击锤,下落高度为25 cm。撞击位置为大脑皮质后肢运动区域。撞击后止血、缝合。
1.2.2检测血清中IL-17、IL-12、IL-15、IL-4、IL-10的表达量:分别于术后1 d、3 d、5 d以及7 d收集供体大鼠的血液离心,3 500 r/min。血清样本IL-17、IL-12、IL-15、IL-4、IL-10的表达量检测采用ELISA法,仪器使用酶标仪,实验操作步骤严格按照试剂盒说明进行。
1.2.3大鼠颅脑外伤后胶质瘢痕的形态学确认:取大脑组织标本,采用石蜡包埋,做病理检查。操作流程:采集大脑组织标本-脱水-透明-石蜡包埋-苏木精-切片-脱蜡-苏木精-苏红染色。
1.3观察指标观察大鼠颅脑外伤造模后1 d和7 d,胶质瘢痕的形态学。记录2组大鼠3 d、7 d及14 d血清中IL-17、IL-12、IL-15、IL-4、IL-10的表达量,以及肝脏移植手术后2组大鼠的存活时间,并进行统计分析。
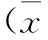
2结果
2.12组大鼠TNF-α、IL-1β表达量比较1 d、7 d后,观察组血清中TNF-α、IL-1β表达量均明显高于对照组,差异有统计学意义(P<0.05)。见表1。
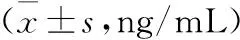
表1 2组大鼠造模后1 d、7 d血清中TNF-α、
2.22组大鼠IL-6表达量比较 造模1 d、7 d后观察组血清中 IL-6表达量均明显高于对照组,差异有统计学意义(P<0.05)。见表2。
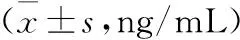
表2 2组大鼠造模后1 d、7 d血清中IL-6
2.32组大鼠IL-4、IL-10表达量比较观察组均明显高于对照组,差异有统计学意义(P<0.05)。见表3。
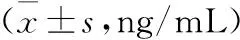
表3 2组大鼠造模后1d、7d血清中IL-4、IL-10
2.4鼠颅脑外伤后胶质瘢痕的形态学确认大鼠颅脑外伤造模后1 d和7 d,每组分别取12只大鼠大脑组织进行病理检查,观察颅脑外伤后胶质瘢痕的形态学。观察组造模1 d后,皮质含有大量胶质细胞异常聚集所形成的胶质瘢痕,7 d后胶质瘢痕有所改善。对照组1 d、7 d皮质结构完整,层次清晰,无病变。见图1~4。
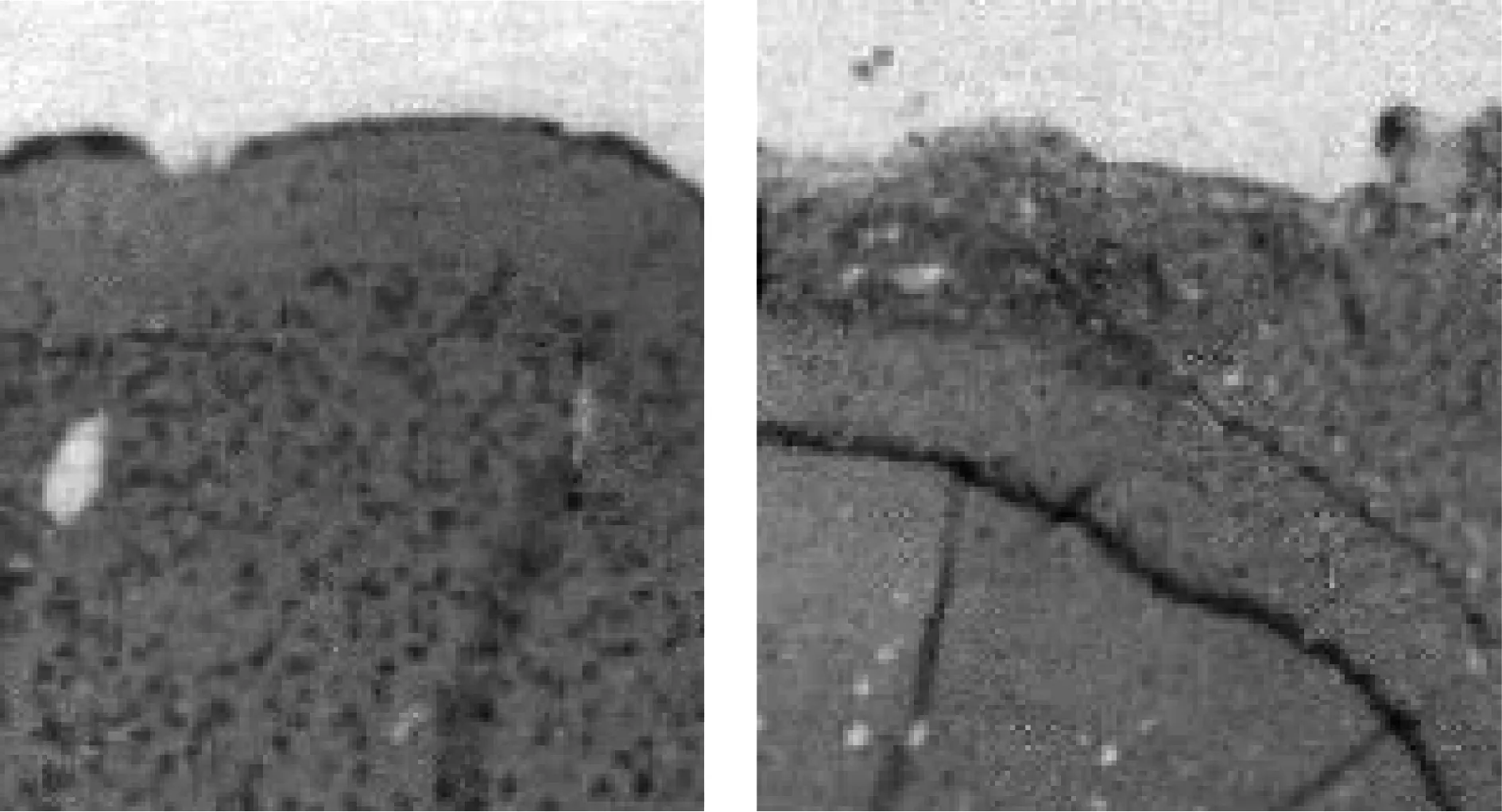
图1正常组1 d大脑组织形态学图2模型组1 d大脑组织形态学
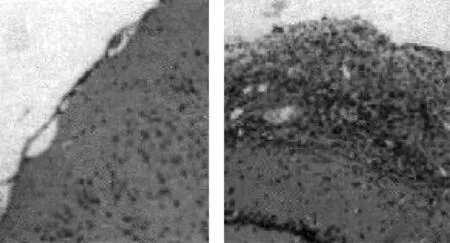
图3正常组7 d大脑组织形态学图4模型组7 d大脑组织形态学
3讨论
在生理状态下,小胶质细胞在神经元的生理活动中起着支持、营养、保护及修复等重要功能。同时在免疫功能上也起到重要作用,具有抗原提呈、分泌细胞因子、吞噬作用等[3]。小胶能合成和分泌多种细胞因子维持神经元的正常功能。在中枢神经系统炎症反应过程中发挥着重要的作用[4]。小胶质细胞释放细胞因子对损伤的神经进行修复,同时还有消化损伤神经元的作用。研究发现,小胶质细胞在颅脑外伤后胶质瘢痕形成中起到双重作用。颅脑外伤后小胶质细胞被激活,释放TNF-α、IL-1β、IL-6等炎症因子可刺激损伤病灶周围炎症反应,诱导星形胶质细胞 、小胶质细胞等炎性细胞募集活化增殖,促进胶质瘢痕形成,加重损伤神经元损伤[5]。IL-6具有神经营养作用,对中枢神经系统发挥着神经营养保护及神经毒性双重作用,可介导中枢神经系统的免疫和炎症反应。同时也会释放IL-4、IL-10炎症抑制因子及神经营养因子具有降低局部炎症反应,促进神经修复,间接抑制胶质瘢痕形成。IL-4具有很强抑炎作用[6]。IL-10具有促进受损神经组织修复功能,减少小胶质细胞增生,同时还能抑制 TNF-α、IL-1β、IL-6等炎症因子的产生[7]。本研究也可得到同样的结论,观察组造模1 d、7 d后,血清中 IL-17、IL-12、IL-15、IL-4、IL-10表达量均明显高于对照组(P<0.05)。观察组造模1 d后,皮质含有大量胶质细胞异常聚集所形成的胶质瘢痕,7 d后,胶质瘢痕有所改善。对照组1 d、7 d皮质结构完整,层次清晰,无病变。
综上所述,小胶质细胞在颅脑外伤后胶质瘢痕形成中起双重作用,既能促进颅脑外伤后胶质瘢痕形成,又间接抑制颅脑外伤后胶质瘢痕形成。许多研究均发现,活化的小胶质细胞在胶质瘢痕形成起始及进程中都有所参与。因此,干预小胶质细胞的活化,抑制炎症反应因子的释放,可有效预防颅脑外伤后胶质瘢痕形成,也能指导临床治疗颅脑外伤后胶质瘢痕形成。早期抑制小胶质细胞的过度活化增殖能够有效控制颅脑外伤后胶质瘢痕的形成,改善神经功能恢复[8]。该动物实验研究证实了小胶质细胞在颅脑外伤后胶质瘢痕形成中的作用,为临床治疗颅脑外伤后胶质瘢痕形成提供部分理论依据和重要参考。
4参考文献
[1]Rivera-Mancía S,Ríos C,Montes S.Manganese accumulation in the CNS and associated pathologies[J].Bio Metals,2011,24(5):811-825.
[2]Ramos HJ,Lanteri MC,Blahnik G,et al.IL-1β Signaling Promotes CNS-Intrinsic Immune Control of West Nile Virus Infection[J].PLoS Pathog,2012,8(11):e1 003 039.
[3]Ghosh M,Garcia-Castillo D,Aguirre V,et al.Proinflammatory cytokine regulation of cyclic AMP-phosphodiesterase 4 signaling in microglia in vitro and following CNS injury[J].Glia,2012,60(12):1 839-1 859.
[4]Murta V,Pitossi FJ,Ferrari CC.CNS response to a second pro-inflammatory event depends on whether the primary demyelinating lesion is active or resolved[J].Brain Behavior Immun,2012,26(7):1 102-1 115.
[5]Pesce M,Speranza L,Franceschelli S,et al.Positive Correlation Between Serum Interleukin-1β and State Anger in Rugby Athletes[J].Aggress Behav,2013,39(2):141-148.
[6]Soares DM,Figueiredo MJ,Manvailer JM,et al.A crucial role for IL-6 in the CNS of rats during fever induced by the injection of live E.coli[J].Med Microbiol Immunol,2012,201(1):47-60.
[7]Jang H,Boltz D,McClaren J,et al.Inflammatory effects of highly pathogenic H5N1 influenza virus infection in the CNS of mice[J].J Neurosci,2012,32(5):1 545-1 559.
[8]van Strien ME,Mercier D,Drukarch B,et al.Anti-inflammatory effect by lentiviral-mediated overexpression of IL-10 or IL-1 receptor antagonist in rat glial cells and macrophages[J].Gene Ther,2010,17(5):662-671.
(收稿2015-06-17)
Experimental study of microglia cells in the formation of glial scar after traumatic brain injury
WeiQingtian,SunDaofa,XuGang
DepartmentofNeurosurgery,theFirstPeople’sHospitalofXiantaoCity,Xiantao433000,China
【Abstract】Objective To study the role of microglia cells in the formation of glial scar after traumatic brain injury.Methods According to the principle of similar body weight,48 SD rats,half males and half females,were randomly divided into study group in which traumatic brain injury model was established and control group in which no administration was performed.Then the expression levels of serum TNF-α,IL-1β,IL-6,IL-4 and IL-10 from rats’ blood in each group at the 1 and 7 days after successful model were detected and statistical analysis were carried out.Last,in order to do pathological examination,we recruited 12 rats of each group to acquire cerebral tissues and observed the morphology of the formation of glial scar after traumatic brain injury.Results By comparative analysis,at the one day,the expression levels of TNF-α,IL-1β,IL-6,IL-4 and IL-10 were 79.8±8.7,83.6±8.3,83.3±10.2,83.3±7.8,82.7±6.8 in the study group and were 69.3±7.2,68.6±7.4,71.4±7.3,69.5±7.6,65.4±8.6 in the control group,and at the seven days,which were 96.8±12.4,92.6±11.2,96.8±12.2,95.8±12.5,90.4±12.2 in the study group and were 82.1±9.5,70.3±6.8,82.2±12.6,82.2±8.6,67.1±6.4 in the control group.All the above-mentioned data showed statistical differences when compared the study group with the control group (P<0.05).Conclusion Microglia cells play double role in the formation of glial scar formation that they not only activate the inflammation factors,such as TNF-α,IL-1β,IL-6,but also release anti-inflammation factors,such as IL-4 and IL-10.Therefore,we can interfere in activation of microglia cells to effectively prevent the formation of glial scar as well as guiding clinical treatment.
【Key word】Microglia cells;Traumatic brain injury;Glial scar
【中图分类号】R-332
【文献标识码】A
【文章编号】1673-5110(2016)12-0013-03

