雷贝拉唑钠肠溶胶囊处方研究及稳定性考察
陈丹秋
(广州海军舰艇岸勤部医院药剂科,广东 广州 510320)
雷贝拉唑钠肠溶胶囊处方研究及稳定性考察
陈丹秋
(广州海军舰艇岸勤部医院药剂科,广东 广州510320)
摘要:目的筛选雷贝拉唑钠肠溶胶囊处方并考察其稳定性。方法采用挤出滚圆和流化床包衣工艺制备雷贝拉唑钠肠溶微丸,采用L9(34)正交试验设计进行载药微丸处方优化,按选定的处方制备微丸,进行隔离层和肠溶层包衣,包衣后将微丸灌装胶囊,制成10 mg规格,对制备的胶囊进行加速试验确定其稳定性。结果制备的雷贝拉唑钠肠溶胶囊批间重现性好,加速条件下质量稳定,稳定性较好。 结论该工艺简单可行,样品稳定性良好,可作为雷贝拉唑钠肠溶胶囊的制备工艺。
关键词:胶囊,肠溶;药物稳定性;雷贝拉唑
雷贝拉唑为第三代拉唑类质子泵抑制剂[1],作用时间持久,疗效显著,在临床上应用广泛[2],雷贝拉唑钠在酸性环境中非常不稳定[3-4],一般临床使用的剂型为肠溶制剂,包括肠溶片和肠溶胶囊,雷贝拉唑钠肠溶胶囊主要用于治疗胃溃疡,十二指肠溃疡,反流性食管炎和卓-艾(Zollingger-Ellison)综合征等[5-7]。
雷贝拉唑钠稳定性差,尤其在中性和酸性条件下,降解迅速。挤出滚圆法制备微丸具有微丸硬度高、圆整度好、连续性好、产量和效率高的优点,本试验采用挤出滚圆和流化床包衣工艺制备了雷贝拉唑钠肠溶胶囊,既简化了工艺,又增加了稳定性。
1仪器与试药
1.1仪器KN1-20型挤出滚圆机(深圳信宜特制药设备有限公司);LBL-1流化床制粒包衣机(重庆市科旭制药机械设备制造有限公司);RC806D药物释放度仪(天津市天大天发科技有限公司);SIL-20A型高效液相色谱仪(日本岛津)。
1.2试药雷贝拉唑钠对照品(中国药品生物制品检定所,批号WS-1401-1001);雷贝拉唑钠(珠海润都制药股份有限公司,批号8881403204 );羟丙基纤维素(HPC-L,日本曹达株式会社);微晶纤维素(101,安徽山河药用辅料股份有限公司);低取代羟丙基纤维素(LH-11,信越化学工业株式会社);甘露醇(法国罗盖特);氧化镁(河北佰斯特化工有限公司);Opadry 03K(上海卡乐康包衣有限公司);Eudragit L30D-55(上海罗母公司)。
2方法与结果
2.1雷贝拉唑钠肠溶胶囊含量、有关物质和释放度测定
2.1.1含量测定色谱柱Kromasil-C18柱(250 mm×4.6 mm,5 μm) ;流动相0.05 mol·L-1磷酸盐缓冲液(用磷酸调节pH 至7.0)-甲醇(60∶40);流速1 mL·min-1;检测波长290 nm;进样量20 μL,理论板数按雷贝拉唑钠峰计不低于5 000,雷贝拉唑钠峰与相邻杂质峰的分离度>2.0。取雷贝拉唑钠肠溶胶囊10粒,将内容物转移至100 mL量瓶中,加0.5 mol·L-1氢氧化钠溶液60 mL,超声使溶解,放冷,用乙腈稀释至刻度,摇匀,离心,取上清液作为供试品溶液,精密量取10 μL,注入液相色谱仪,记录色谱图,同法称取雷贝拉唑钠对照品20 mg,配置成浓度为1 g·L-1对照品溶液,按外标法以峰面积计算含量。
2.1.2有关物质测定取肠溶胶囊内容物适量(约相当于雷贝拉唑钠100 mg) ,精密称定置100 mL 量瓶中,加 0.05 mol·L-1的氢氧化钠溶液60 mL,超声使溶解,放冷,用乙腈稀释至刻度,摇匀,离心,取上清液作为供试品溶液;精密量取供试品溶液1 mL, 置100 mL量瓶中,加0.05 mol·L-1的氢氧化钠-乙腈(60∶40)稀释至刻度,摇匀,作为对照品溶液,分别取上述两种溶液10μL照含量项下色谱条件测定, 记录色谱图至主成分峰保留时间的5倍,单个杂质峰面积不得大于对照品溶液的主峰面积(1.0%) ,各杂质峰面积的和不得大于对照溶液峰面积的2倍(2.0%)。
2.1.3释放度测定测定法参照释放度测定法(《中国药典》2010年版二部附录Ⅹ D 第二法)测定,采用释放度测定法(《中国药典》2010 年版二部附录Ⅹ C 第二法)的装置,以0.1 mol·L-1的盐酸溶液700 mL为释放介质,转速为100 r·min-1,依法操作,经120 min时,随即在操作容器中加入37 ℃的0.6 mol·L-1三羟甲基氨基甲烷溶液300 mL,用2 mol·L-1盐酸溶液或2 mol·L-1氢氧化钠溶液调节pH至8.0,转速不变,继续依法操作,经30 min后,取溶液滤过,精密量取续滤液3 mL,立即精密加0.5 mol·L-1氢氧化钠溶液1 mL,摇匀,作为供试品溶液,取雷贝拉唑钠对照品50 mg,精密称定,置于50 mL量瓶中,加0.5 mol·L-1氢氧化钠溶液适量使溶解,用0.5 mol·L-1氢氧化钠溶液稀释至刻度,摇匀,精密量取3 mL,置100 mL量瓶中,用0.5 mol·L-1氢氧化钠溶液稀释至刻度,摇匀,精密量取1 mL,精密加入pH=8.0三羟甲基氨基甲烷溶液3 mL,摇匀,作为对照品溶液。取对照品溶液和供试品溶液,照含量测定方法测定,计算释放量。
2.2雷贝拉唑钠肠溶胶囊制备
2.2.1载药微丸辅料种类和用量筛选将雷贝拉唑钠原料与待选用辅料按一定的比例混合,置于60 ℃烘箱内,于5、10 d进行有关物质检测,根据试验结果,选用微晶纤维素和甘露醇为填充剂,羟丙基纤维素为黏合剂,低取代羟丙基纤维素为崩解剂,碱稳定剂为氧化镁。
2.2.2载药微丸制备工艺按处方比例称取雷贝拉唑钠,微晶纤维素,低取代羟丙基纤维素,氧化镁和甘露醇,分别过80目筛网,将过筛后物料混合均匀,加5%羟丙基纤维素80%乙醇溶液制成软材,将制备的软材加入挤出机内,设置转速20 r·min-1,过0.3 mm孔板挤出得挤出物,将挤出物置于离心滚圆机中以600~800 r·min-1切断,滚圆5 min,取出微丸,置于热风循环烘箱中,40 ℃干燥2 h,筛分,取24~30目微丸作为目标大小的微丸。
2.2.3载药微丸的隔离包衣增重考察按照卡乐康公司提供的产品说明书配制欧巴代03K的包衣液,取载药后微丸适量置于流化床制粒包衣机中进行包衣,控制物料温度35~40 ℃,雾化压力0.1~0.2 MPa,喷液速度10~20 mL·min-1,包衣增重分别为6%、8%、10%、12%。然后取包完隔离层的微丸适量置于流化床制粒包衣机中,使用Eudragit L30D-55包衣液包肠溶衣,控制物料温度30~35 ℃,雾化压力0.1~0.2 MPa,喷液速度10~20 mL·min-1,包衣增重控制在28%~30%,考察不同隔离层包衣增重对药物释放曲线的影响,结果见图1。由考察结果表明隔离层包衣增重在6%和12%时自制胶囊与原研品释放曲线不相似,隔离层包衣增重为8%~10%时,自制胶囊与原研品释放曲线相似,因此确定隔离层包衣增重为8%~10%。

图1 雷贝拉唑钠肠溶胶囊隔离层包衣增重考察
2.2.4载药微丸的肠溶包衣增重考察按照“2.2.2”项下确定的隔离层包衣增重范围和包衣参数进行隔离包衣,使用Eudragit L30D-55包衣液包肠溶衣,控制物料温度30~35 ℃,雾化压力0.1~0.2 MPa,喷液速度10~20 mL·min-1,包衣增重分别为25%、28%、30%、32%,考察不同肠溶包衣增重对药物释放曲线的影响,结果见图2。由考察结果表明肠溶层包衣增重在25%和32%时自制胶囊与原研品释放曲线不相似,肠溶层包衣增重为28%~30%时,自制胶囊与原研品释放曲线相似,因此确定肠溶层包衣增重为28%~30%。

图2 雷贝拉唑钠肠溶胶囊肠溶层包衣增重考察
2.2.5微丸处方优化以载药后微丸制备的自制胶囊与原研品释放曲线的相似因子为考察指标,选择碱稳定剂氧化镁用量(A),填充剂甘露醇和微晶纤维素比例(B),崩解剂低取代羟丙基纤维素用量(C)和粘合剂羟丙基纤维素用量(D)进行4因素3水平正交试验设计,因素水平见表1,正交试验安排及结果见表2和表3。

表1 载药微丸辅料用量筛选正交试验因素水平表
经minitab16.0软件分析结果表明,以自制胶囊与原研品释放曲线相似因子作为指标,各因素对释放曲线相似因子的影响程度依次为C>B>A>D,因素C的影响最为显著,由此得出最佳处方组成为A3B2C3D2,即碱稳定剂氧化镁用量15%,填充剂甘露醇和微晶纤维素比例1∶1,崩解剂低取代羟丙基纤维素用量10%,黏合剂羟丙基纤维素用量2%,优化得载药微丸处方即每个处方单位含雷贝拉唑钠10 mg,甘露醇93.55 mg,微晶纤维素93.55 mg,氧化镁40.5 mg,低取代羟丙基纤维素27.0 mg,羟丙基纤维素5.4 mg,按优化处方制备载药微丸三批,测定微丸粉体学性质结果表明微丸圆整度好,目标粒度微丸收率>80%。优化处方后制备的三批自制微丸的粉体学性质结果见表4。
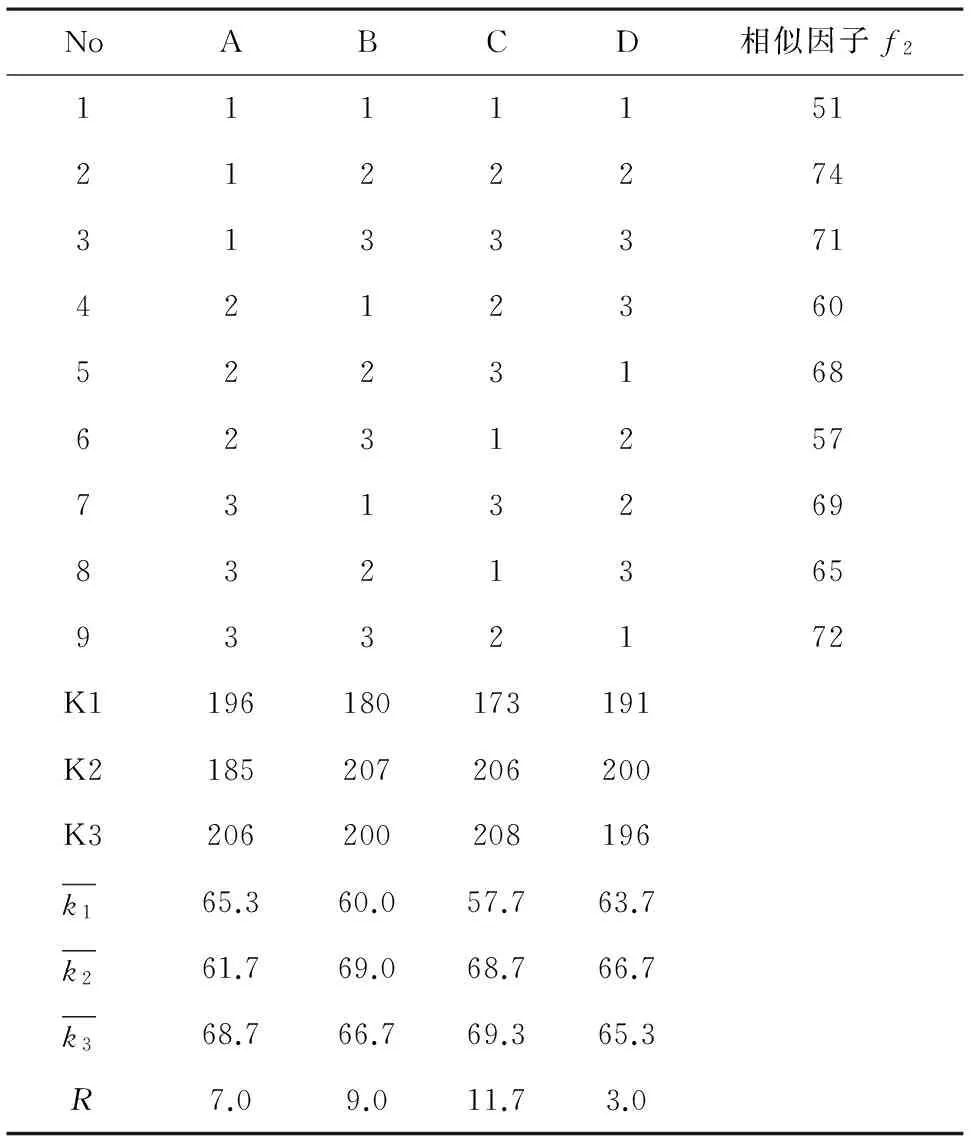
表2 载药微丸辅料用量筛选正交试验L9(34)表

表4 雷贝拉唑钠肠溶微丸粉体学性质考察结果
2.2.6雷贝拉唑钠肠溶胶囊的制备及质量研究按照确定的载药微丸处方和工艺制备载药微丸,然后进行隔离层包衣, 使其包衣增重8%~10%,最后进行肠溶层包衣,使其包衣增重28%~30%。测定包衣微丸中雷贝拉唑钠的含量,根据含量确定每粒胶囊的微丸灌装量,并将肠溶微丸灌入普通胶囊中(每粒含雷贝拉唑钠10 mg),即得。同法制备3批,批号分别为140601,140602和140603。
按“2.1” 项下雷贝拉唑钠肠胶囊含量、有关物质和释放度测定方法对自制三批雷贝拉唑钠肠溶胶囊进行质量考察,结果见表5。

表3 载药微丸与原研品释放曲线相似因子方差分析表

表5 雷贝拉唑钠肠溶胶囊质量考察结果
对三批自制雷贝拉唑钠肠溶胶囊与原研制剂进行释放曲线对比,结果表明3批自制胶囊与原研胶囊的相似因子分别为74、71、61,说明二者释放行为一致,释放曲线见图3。

图3 三批自制胶囊与原研品的释放曲线对比
2.3稳定性考察参照《中国药典》2010版附录XIXC 原料药与药物制剂稳定性试验指导原则,对自制雷贝拉唑钠肠溶胶囊(批号140601)进行加速试验,加速试验条件为(40±2) ℃,相对湿度75%±5%,于0、1、2、3、6月检测样品含量、有关物质和释放度,结果见表6。
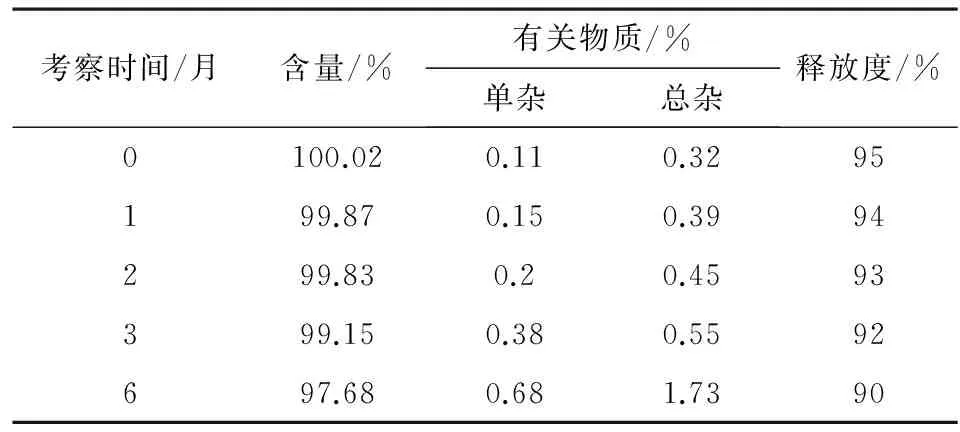
表6 雷贝拉唑钠肠溶胶囊加速试验检查结果
3讨论
雷贝拉唑钠分子结构中具有亚磺酰基,在湿、热、光照,中性和酸性条件下稳定性差[8-9],处方中需要加入碱性调节剂以增加稳定性,拉唑类药物常用的碱性调节剂有无水碳酸钠,氢氧化钠,碳酸镁,氢氧化镁,氢氧化钙,氧化镁等[10-12],本研究中选用氧化镁作为碱稳定剂,氧化镁具有较低的吸湿性,不结合水分,避免药物因高湿环境的降解,并且氧化镁呈碱性,均匀分布于微丸中,可以增加稳定性。
本试验研究初期考察了离心造粒法和底喷流化床包衣法制备微丸,发现采用离心造粒法制备微丸收率低,微丸均一性和成型性差;采用底喷流化床包衣法,喷液时间长,并且药物受温度影响容易降解;采用挤出滚圆法,造粒容易,效率高,所造微丸圆整度好,硬度高,粒度分布狭窄,适于进一步包衣,因此最终选用挤出滚圆法。
本研究制备的三批样品经(40±2) ℃,相对湿度75%±5%加速条件下6个月,样品稳定性好,充分验证了本文所采用的制备处方、工艺具有良好的可行性。
参考文献
[1] 陈明,于扬,马为.雷贝拉唑预防心血管病患者阿司匹林引起的消化性溃疡[J].中国循证心血管医学杂志,2013,5(3):281-282.
[2]邱劲松,余婷婷.雷贝拉唑与奥美拉唑治疗胃溃疡临床观察[J].四川医学,2011,32(2):236-238.
[3]袁利艳,杨瑞玲,赵建军.离心造粒法制备雷贝拉唑钠肠溶微丸工艺研究[J].中国医学创新,2012,9(24):153-154.
[4]唐建华,叶东,王长斌,等.雷贝拉唑钠肠溶片的制备及释放度考察[J].中国药业,2012,21(16):57-58.
[5]于丽秀,周莹,陈文,等.肠溶微丸雷贝拉唑钠胶囊的人体生物利用度及生物等效性评价[J].中国药师,2015,18(5):725-729.
[6]陈敏纯,周伦,李雪晴,等.注射用雷贝拉唑钠在中国健康受试者的单、多剂量药动学[J].中国药师,2012,15(4):483-486.
[7]傅雪猛,庄让笑,黄海中.雷贝拉唑钠肠溶(微粒)胶囊的制备工艺研究[J].制剂技术,2009,18(18):44-46.
[8]肖杨帆,张娜.雷贝拉唑钠肠微丸片的研究[D].济南:山东大学,2011.
[9]金欣,王玉丽,单利,等.微环境pH调控技术改善雷贝拉唑钠稳定性研究[J].中国新药杂志,2013,22(3):279-283.
[10] 张倩,张晶,周欣,等.兰索拉唑肠溶微丸胶囊的制备[J].中国药房,2010,21(5):433-435.
[11] 郭增光,郭洪涛.雷贝拉唑钠肠溶片处方工艺研究[J].药学研究,2013,32(6):345-347.
[12] 张霞,任萃文.雷贝拉唑钠肠溶微丸的处方工艺研究[J].药品鉴定,2011,18(24):46-47.
Preparation and stability of sodium rabeprazole enteric-coated capsules
CHEN Dan-qiu
(DepartmentofPharmacy,HospitalofNavalShoreGround,Guangzhou,Guangdong510320,China)
Abstract:ObjectiveTo study the preparation and stability of sodium rabeprazole enteric-coated capsules.MethodsThe extrusion-spheronization method and fluid-bed coating technology were used to prepare the sodium rabeprazole enteric-coated capsules.The L9(34)orthogonal experimental design method was used to optimize the preparation of the sodium rabeprazole pellets. The pellets were coated by an isolation layer and an enteric coating layer,and then capsuled as10 mgformulation. The accelerated test was used to establish the stability of the capsules. ResultsThe prepared capsules showed good reproducibility between batches and good stability after the accelerated test.ConclusionsThe prepared capsules were feasible in technology,reproducible and reliable in quality and the method can be used for the preparation of sodium rabeprazole enteric-coated capsules.
Key words:Capsules,enteric-coated;Drug stability;Rabeprazol
doi:10.3969/j.issn.1009-6469.2016.06.009
(收稿日期:2016-01-06,修回日期:2016-02-25)

