miRNA-31-5p在过量维甲酸抑制C2C12细胞增殖中的调控机制研究
唐 燚,刘 波,李 楠,丛 蔚,肖 晶
(大连医科大学 口腔医学院 口腔基础教研室,辽宁 大连 116044)
miRNA-31-5p在过量维甲酸抑制C2C12细胞增殖中的调控机制研究
唐燚,刘波,李楠,丛蔚,肖晶
(大连医科大学 口腔医学院 口腔基础教研室,辽宁 大连 116044)
[摘要]目的探讨miRNA-31-5p在过量维甲酸(Retinoic acid,RA)抑制小鼠肌原细胞系C2C12增殖中的作用机制。 方法在10 μmol/L RA及无RA条件下,qPCR检测C2C12细胞增殖过程中miRNA-31-5p及抗肌营养不良蛋白(dystrophine,Dmd)表达的水平;分别转染miRNA-31-5p mimics(miRNA-31-5p mimics组)、miRNA-31-5p inhibitor(miRNA-31-5p inhibitor组)、Duplex N.C(Duplex N.C组)及N.C inhibitor(N.C inhibitor组)。用细胞增殖/毒性检测实验(CCK-8)检测0 h,24 h,36 h及48 h的OD值, 5-溴脱氧尿嘧啶核苷掺入实验(BrdU)检测48 h细胞中BrdU阳性细胞比率。在10 μmol/L RA条件下,qPCR检测C2C12细胞在下调miRNA-31-5p后,Dmd表达水平变化。 结果在10 μmol/L RA条件下,细胞中miRNA-31-5p在36 h及48 h的表达水平均明显高于相同时间点正常条件下的表达水平,P<0.01;Dmd在36 h及48 h的表达水平均明显低于相同时间点正常条件下的表达水平,P<0.01。CCK-8结果显示在0 μmol/L RA条件下,miRNA-31-5p过表达抑制C2C12细胞增殖, 10 μmol/L RA条件下,细胞的增殖活性进一步降低;0 μmol/L RA条件下,miRNA-31-5p低表达促进C2C12细胞增殖,10 μmol/L RA作用下, miRNA-31-5p inhibitor组细胞增殖活性在第48 h显著高于N.C inhibitor组,P<0.01。10 μmol/L RA的作用下,miRNA-31-5p mimics组细胞BrdU阳性率与Duplex N.C组比降低27.6%,P<0.05;miRNA-31-5p inhibitor组细胞BrdU阳性率与N.C inhibitor组相比升高24.1%,P<0.05。转染48 h后,miRNA-31-5p inhibitor组Dmd的相对表达量较N.C inhibitor组明显上调,P<0.01;在10 μmol/L RA作用下,miRNA-31-5p inhibitor组细胞Dmd的表达升高,与N.C inhibitor组相比差异具有显著性意义。结论 miRNA-31-5p可参与10 μmol/L RA导致的C2C12细胞增殖抑制,而其可能的分子机制是通过对Dmd靶向作用实现的。
[关键词]miRNA-31-5p;维甲酸; C2C12细胞;细胞增殖
[引用本文]唐燚,刘波,李楠,等.miRNA-31-5p在过量维甲酸抑制C2C12细胞增殖中的调控机制研究[J].大连医科大学学报,2016,38(1):6-11.
维甲酸(retinoic acid,RA)是维生素A的活性代谢产物之一,在脊椎动物的胚胎发育和器官形成中起重要作用。但在个体发育过程中,10 μmol/L RA能够导致器官的畸形。本课题组前期研究结果显示,对孕鼠进行RA灌胃可诱发胎鼠腭裂并伴发舌肌发育异常,舌肌细胞的增殖活性及肌向分化水平均受到抑制[1]。本研究前期结果表明:10 μmol/L RA能够抑制小鼠肌原细胞系C2C12的增殖活性[2],但具体作用机制尚缺乏系统研究。
microRNA作为新的调控因子,已显示出在参与调控骨骼肌细胞增殖和分化中发挥着重要作用。已有报道miRNA-31-5p过表达会使人肺腺癌细胞周期阻滞在S期[3]。而miRNA-31-5p在骨骼肌细胞增殖过程中的调控作用鲜见报道。杜氏型肌营养不良症(Duchenne muscular dystrophy,DMD)是由于Dmd基因缺失所导致的一种致命的遗传性疾病。在DMD病人和DMD模型小鼠的骨骼肌中均可检测到miRNA-31-5p的高表达[4]。本文拟探讨miRNA-31-5p在过量维甲酸抑制小鼠肌原细胞系C2C12增殖中的作用机制。
1材料和方法
1.1主要试剂
RA购于Sigma公司;miRNA-31-5p mimics和miRNA-31-5p inhibitor构建并合成于上海吉玛制药技术有限公司;引物合成及PCR反转录试剂盒PrimeScript®RT reagent Kit Perfect Real Time(DRR037A)、SYBR®Premix Ex TaqTM II(DRR081A),购于宝生物(大连)公司;Lipofectamine 3000试剂购于Life Technologies公司;Opti-MEM I培养液购于美国Invitrogen公司;细胞增殖/毒性检测试剂(Cell Counting Kit,CCK-8)购于北京同仁化学研究所;5-溴脱氧尿嘧啶核苷(BrdU)购于Sigma 公司;Anti-BrdU(mouse)抗体购于Sigma公司;DAPI染料购于Sigma 公司;IgG荧光二抗购于Abbkine公司。
1.2细胞接种与培养
将C2C12细胞(购于中国科学院上海细胞库)接种于完全培养基(含10% 胎牛血清,1%双抗的H-DMEM)的培养瓶中,置于含5%CO2饱和湿度、37 ℃培养箱内培养,每48 h换液。将处在对数生长期的C2C12细胞接种于24孔板或96孔板内,换生长培养基(含10% 胎牛血清的H-DMEM),培养条件同上。
1.3实验分组及处理
1.3.110 μmol/L RA组C2C12细胞的处理
RA组称取适量RA粉末,用二甲基亚砜(DMSO)溶解,至RA浓度为100 mol/L,再将此溶液用生长培养基稀释,使RA最终的浓度为10 μmol/L;对照组取与RA组等量的DMSO溶解于相同体积的生长培养基中。
1.3.2miRNA转染组C2C12细胞的处理
以转染miRNA-31-5p mimics的C2C12细胞为miRNA-31-5p mimics组,以转染类似物空载(Duplex N.C)的C2C12细胞为Duplex N.C组;以转染miRNA-31-5p inhibitor的C2C12细胞为miRNA-31-5p inhibitor组,以转染抑制物空载(N.C inhibitor)的C2C12细胞为N.C inhibitor组。用Opti-MEMI培养基分别稀释Lipofectamine 3000试剂和microRNA试剂并充分混匀(miRNA-31-5p mimics基因正向序列AGGCAAGAUGCUGGCAUAGCUG,反向序列GCUAUGCCAGCAUCUUGCCUUU;miRNA-31-5p inhibitor基因序列CAGCUAUGCCAGCAUCUUGCCU;Duplex N.C基因正向序列UUCUCCGAACGUGUCACGUTT,反向序列ACGUGACACGUUCGGAGAATT;N.C inhibitor基因序列ACGUGACACGUUCGGAGAATT),按1∶1比例将已稀释的Lipofectamine 3000试剂加入稀释后的microRNA试剂,室温孵育5 min。将预混液加至孔板内,37 ℃孵育。
1.4CCK-8法检测细胞增殖活性
取处于对数生长期的C2C12细胞制成单细胞悬液,按 1×103个/孔接种于96 孔板(100 μL/孔),细胞贴壁生长后,在10 μmol/L或无RA条件下,每组分别转染miRNA-31-5p mimics、miRNA-31-5p inhibitor、Duplex N.C或N.C inhibitor。分别在0 h、24 h、36 h及48h时间点,加入CCK-8试剂,在5%CO2、37 ℃培养箱内继续培养50 min后,用酶标仪检测每孔细胞在450 nm 处的光密度OD值。实验每个样本采用3个复孔,结果重复3次。
1.5BrdU掺入法检测细胞增殖率
取对数生长期的C2C12细胞制成单细胞悬液,按1×104个/孔接种于24 孔板,待细胞贴壁生长后,在10 μmol/L或无RA条件下,每组分别加入miRNA-31-5p mimics、miRNA-31-5p inhibitor、Duplex N.C或N.C inhibitor。按sigma公司操作说明加入BrdU标记试剂,并将孔板置于5%CO2、37 ℃培养箱内培养;连续培养细胞共48 h后,按sigma公司BrdU抗体操作说明进行细胞免疫荧光染色。显微镜下随机选取并计算3个视野下的阳性细胞数及DAPI阳性细胞总数,细胞增殖率= BrdU阳性细胞数/DAPI阳性细胞数,取3个视野细胞增殖率的平均值为细胞的增殖率。
1.6细胞总RNA提取及实时定量qPCR检测基因的表达水平
C2C12细胞接种至12孔板,待细胞贴壁生长后,分别在10 μmol/L及RA条件下培养,0 h、24 h、36 h及48 h时分别收集细胞(每个时期3个复孔)。分别在10 μmol/L及无RA条件下转染miRNA-31-5p mimics、miRNA-31-5p inhibtor、Duplex N.C或N.C inhibitor转染24 h或48 h后收集细胞。硫氰酸胍法(Trizol法)提取细胞中总RNA,按PrimeScript®RT reagent Kit 反转录试剂盒说明书及SYBR®Premix Ex TaqTM II说明书分别进行反转录和实时定量荧光PCR反应。检测miRNA-31-5p及Dmd的表达水平(miRNA-31-5p引物正向序列GGAGAGGAGGCAAGATGCTG,反向序列GGAAAGATGGCAATATGTTG;U6引物正向序列TCGCTTCGGCAGCACATA,反向序列GGGCCATGCTAATCTTCTCTG;Dmd引物正向序列CTTCCATAGTGAGATCAGGCC,反向序列TTCGGAGCCTTTCCCCATGC;GAPDH引物正向序列TGTGTCCGTCGTGGATCTGA,反向序列TTGCTGTTGAAGTCGCAGGAG)。实验每个样本采用3个复孔,结果重复3次。
1.7统计学方法
采用SPSS17.0软件进行统计学分析,用独立样本t检验比较组间差异。P<0.05表示差异具有统计学意义。
2结果
2.1在正常及10 μmol/L RA条件下C2C12细胞增殖过程中miRNA-31-5p及Dmd的表达
在C2C12细胞增殖过程中,miRNA-31-5p的表达在24 h上升到峰值,随后在36 h及48 h持续下调。而在10 μmol/L RA条件下的细胞增殖过程中,miRNA-31-5p在24 h、36 h及48 h均保持高水平的表达,并且在36 h及48 h的表达水平均明显高于相同时间点正常细胞增殖状态下的表达水平,其中在48 h的差异最显著(图1A,P<0.01)。在C2C12细胞增殖过程中,Dmd的相对表达量在24 h上升到峰值,随后在36 h及48 h均保持高水平表达(图1B)。而在10 μmol/L RA条件下的C2C12细胞增殖过程中,Dmd的表达在24 h上升到峰值后,于36 h下降到最低值,与细胞正常增殖状态中的表达量相比明显降低,并且此时差异最为显著(图1B,P<0.01);虽然随后Dmd的相对表达量在48 h有上升趋势,但其仍明显低于细胞正常增殖过程中相同时间点的表达水平(图1B,P<0.01)。
2.2miRNA-31-5p对C2C12细胞增殖的作用
C2C12细胞转染24 h后,miRNA-31-5p mimics组中miRNA-31-5p的相对表达量与Duplex N.C组相比上调了27.6倍(图2A,P<0.01)。CCK-8结果显示在0 μmol/L RA条件下,miRNA-31-5p过表达抑制C2C12细胞增殖,miRNA-31-5p mimics组与Duplex N.C组相比,转染24 h、36 h、48 h时细胞增殖活性均有下降趋势,在48 h有明显差异(图2B,P<0.01);而在10 μmol/L RA条件下,miRNA-31-5p mimics组能使受10 μmol/L RA抑制的C2C12细胞的增殖活性在第48 h进一步降低(图2B,P<0.01)。
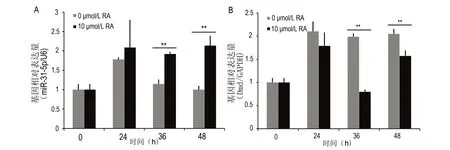
图1 C2C12细胞增殖过程中miRNA-31-5p和Dmd mRNA表达水平的变化Fig 1 Differential expression of miRNA-31-5p and Dmd in C2C12 cellsA: miRNA-31-5p mRNA表达水平;B: Dmd mRNA表达水平。**与0 μmol/L RA组比较,P<0.01
miRNA-31-5p inhibitor组转染24 h后, miRNA-31-5p表达水平与N.C inhibitor组相比下降92.4%(图2C,P<0.01)。CCK-8结果显示在0 μmol/L RA条件下,miRNA-31-5p inhibitor组细胞增殖活性在第24 h、36 h及48 h与N.C inhibitor组相比明显上升,在第36 h和48 h差异均有显著性意义(图2D,P<0.01)。而在10 μmol/L RA作用下, miRNA-31-5p inhibitor组使受到10 μmol/L RA抑制的细胞增殖活性在第48 h显著高于N.C inhibitor组(图2D,P<0.01)。
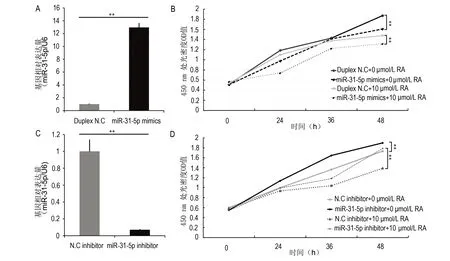
图2 miRNA-31-5p转染后C2C12细胞增殖活性的变化Fig 2 After miRNA-31-5p transfection, proliferation of C2C12 cells was measuredA: 过表达miRNA-31-5p 24 h后的转染效率; B: CCK-8检测C2C12细胞的增殖活性; C: miRNA-31-5p下调24 h的转染效率; D: CCK-8检测C2C12细胞的增殖活性。**与各自N.C(+10 μmol/L RA)组比较,P<0.01
2.310 μmol/L RA条件下miRNA-31-5p对C2C12细胞增殖的影响
C2C12细胞转染48 h后, 10 μmol/L RA的作用下,miRNA-31-5p mimics组细胞BrdU阳性率与Duplex N.C组比降低27.6%(图3A、3B,P<0.05)。miRNA-31-5p inhibitor组细胞BrdU阳性率与N.C inhibitor组相比升高24.1%(图3A、3B,P<0.05)。
2.4在正常及10 μmol/L RA作用下的C2C12细胞增殖过程中,下调miRNA-31-5p对Dmd表达的影响转染48 h,miRNA-31-5p inhibitor组细胞中Dmd的相对表达量与N.C inhibitor组相比明显上调(图4A,P<0.01)。在10 μmol/L RA作用下,miRNA-31-5p inhibitor组细胞Dmd的表达升高,与N.C inhibitor组相比差异具有显著性意义(图4B,P<0.05)。
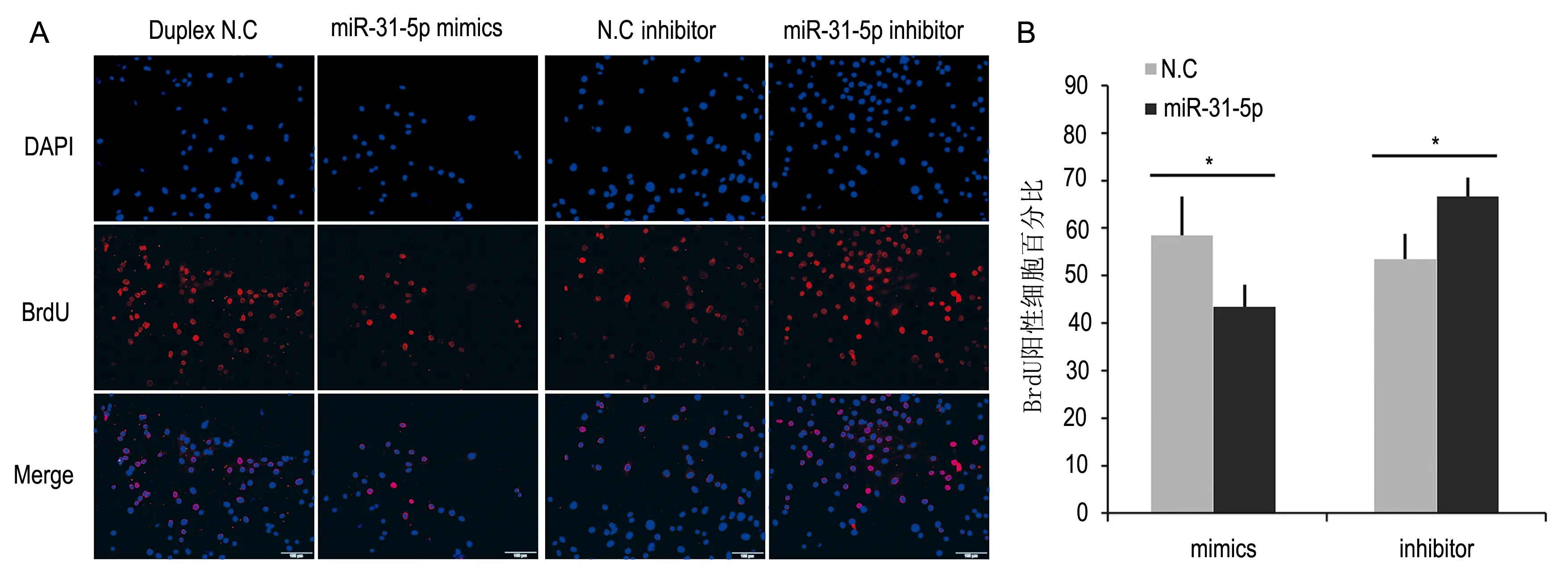
图3 10 μmol/L RA作用下miRNA-31-5p对C2C12细胞增殖的作用Fig 3 After miRNA-31-5p transfection, the identification of excess RA-induced cell proliferation was measuredA: BrdU检测转染48 h C2C12细胞的增殖活性; B: BrdU阳性细胞百分比。*与N.C组比较,P<0.05
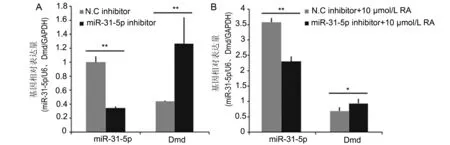
图4 下调miRNA-31-5p 48 h后Dmd mRNA水平的表达变化Fig 4 The expression level of Dmd was detected by qPCR after miRNA-31-5p inhibitor was transfected after 48 hA: miRNA-31-5p和Dmd mRNA的表达;B:过量RA条件下miRNA-31-5p和Dmd mRNA的表达。与N.C inhibitor(+10 μmol/L RA)组比较,*P<0.05,**P<0.01
3讨论
生理剂量的RA(0.01 μmol/L)在脊椎动物的胚胎发育、维持机体组织内平衡及器官形成方面发挥着不可替代的作用,常被用作皮肤病的治疗药物及日常生活中化妆品的添加剂等。因其具有促肿瘤细胞分化及维持机体正常生理功能的作用,在临床上被应用为宫颈癌和白血病等肿瘤的化疗药物。RA主要通过与其受体(RARs)的结合来发挥其生物学效应,被RA结合蛋白(CRABP)从细胞浆运输到核内染色体上的受体部位,形成二聚体后与某些特异的DNA序列结合,进而调控靶基因的表达[5]。但高浓度的RA 会导致脊椎动物和人类各种胚胎畸形的发生[6]。
经研究证实,孕鼠在孕10 d按1000 mg/kg体重进行RA灌胃,胎鼠腭间充质细胞的增殖活性受到抑制从而导致胎鼠发生腭裂,并同时伴发舌畸形[7]。研究已证实体外培养小鼠胚胎腭突间充质细胞(mouse embryonic palatal mesenchyme,MEPM),过量RA使MEPM 的细胞周期停滞在G0/G1期[8]。随后本课题组前期研究结果显示,过量RA能够显著抑制小鼠胚胎发育第14.5天颏舌肌细胞的增殖活性[1]。
microRNAs(miRNAs)是一类十分保守的内源性非编码单链RNA,长度约19~25 bp。microRNA序列通过与相应靶基因mRNA的3′UTR区完全互补,在转录后水平调控基因的表达,其在胚胎发育和组织的发展等生理过程中发挥了重要作用[9]。近年来的研究表明,许多肌相关miRNA(myomiRs),其中包括miR-1、miR-133和miR-206[10],和非肌特异性miRNA,如miR-27、miR-181和miR-214,已显示出在参与调控骨骼肌发育中,特别是在肌细胞增殖和分化调节中发挥重要作用。这些miRNA通过与各自的转录因子相互作用,与其他信号分子一起,共同参与调控骨骼肌发育。
为了明确miRNA-31-5p在过量RA诱导C2C12细胞增殖异常中的调控机制,本研究建立了小鼠肌原细胞系C2C12增殖实验模型,利用CCK-8法、BrdU掺入法及实时定量qPCR法分析C2C12细胞通过加入过量 RA以及上下调miRNA-31-5p,探查miRNA-31-5p在10 μmol/L RA导致细胞增殖抑制中的分子机制。结果显示:在C2C12细胞增殖过程中,miRNA-31-5p的表达先有一个短暂的上升随后持续下降;而在10 μmol/L RA作用下,miRNA-31-5p从24 h起一直维持较高的表达水平,并且在第36 h及48 h的表达水平分别明显高于正常细胞增殖状态下相同时间点的表达水平,其中第48 h的差异最显著。因此本研究选取第48 h为时间点检测miRNA-31-5p对细胞增殖活性的调控作用。随后通过CCK-8实验及BrdU掺入实验得知:在细胞正常增殖过程中或在10 μmol/L RA条件下,miRNA-31-5p过表达使细胞增殖活性在第48 h受到明显抑制;下调miRNA-31-5p的表达使10 μmol/L RA引起的细胞增殖抑制作用减弱。可由实验结果得出结论:过量RA可引起miRNA-31-5p表达水平的升高;在过量RA作用的细胞中,下调miRNA-31-5p可挽救过量RA引起的细胞增殖抑制作用。由此可见miRNA-31-5p参与了过量RA对C2C12细胞增殖的调控。
miRNA-31-5p对肌发育及肌相关类疾病的研究近年来主要集中于肌营养不良症上。在DMD病人和DMD模型小鼠的骨骼肌中均可检测到miRNA-31-5p的高表达。Dmd基因敲除鼠病理表现为肌细胞膜无法保持完整性,出现异常的蛋白和钙内流;肌细胞在离心力收缩时被机械力破坏,对机械力敏感的离子通道失调,导致肌细胞变性坏死,炎性细胞浸润。萤光素酶报告实验已证实miRNA-31-5p对Dmd基因有直接靶向作用[4]。miRNA-31-5p与Dmd基因之间的靶向作用关系揭示了miRNA-31-5p对骨骼肌发育的重要作用。为了进一步探究miRNA-31-5p靶向Dmd基因是否参与了过量RA作用下的细胞增殖异常,本研究检测了10 μmol/L RA作用下Dmd的表达动态变化。结果发现在C2C12细胞正常增殖过程中,Dmd呈高水平表达;而10 μmol/L RA作用下的C2C12细胞中Dmd表达显著下降,提示10 μmol/L RA可抑制Dmd的表达水平。在生理状态下或10 μmol/L RA条件下的C2C12细胞增殖过程中,随着miRNA-31-5p表达受抑制,Dmd表达水平均发生明显上调,与细胞增殖活性上升的趋势一致,因此得出结论:miRNA-31-5p参与10 μmol/L RA导致的C2C12细胞增殖抑制,而其可能的分子机制是通过对Dmd靶向作用实现的。
参考文献:
[1] Cong W, Liu B, Liu S, et al. Implications of the Wnt5a/CaMK II Pathway in Retinoic Acid-Induced Myogenic Tongue Abnormalities of Developing Mice[J]. Sci Rep,2014,4:6082-6088.
[2] 刘波,丛蔚,肖晶. 维甲酸在体外对C2C12细胞系的增殖和肌向分化的影响[EB/OL].北京:中国科技论文在线[2013-01-18].http://www.paper.edu.cn/releasepaper/content/201301-832.
[3] Zhiwei Z, Zhuo D, Lihua Y, et al. MicroRNA-31-5p modulates cell cycle by targeting human mutL homolog 1 in human cancer cells[J]. Tumor Biol,2013,34(3):1959-1965.
[4] Cacchiarelli D, Incitti T, Martone J, et al. miR-31 modulates dystrophin expression: new implications for Duchenne muscular dystrophy therapy[J]. EMBO Rep,2011,12(2):136-141.
[5] Kam RKT, Deng Y, Chen YL, et al. Retinoic acid synthesis and functions in early embryonic development[J]. Cell Biosci,2012,2:11-24.
[6] Okano J, Udagawa J, Shiota K. Roles of retinoic acid signaling in normal and abnormal development of the palate and tongue[J]. Congenit Anom,2014,54(2):69-76.
[7] Xiao J, Zhu EX, Nagai N, et al. Expression of Wnt5a gene in mouse embryonic orofacial development[J]. Dev Biol, 2005,283(2):612.
[8] Yu Z, Xing Y. All-trans retinoic acid inhibited chondrogenesis of mouse embryonic palate mesenchymal cells by down-regulation of TGF-beta/Smad signaling[J]. Biochem Biophys Res Commun,2006,340(3):929-934.
[9] Güller I, Russell AP. MicroRNAs in skeletal muscle: their role and regulation in development, disease and function[J]. J Physiol,2010,588(21):4075-4087.
[10] Kim HK, Lee YS, Sivaprasad U,et al. Muscle-specific microRNA miR-206 promotes muscle differentiation[J]. J Cell Biol,2006,174(5):677-687.
Regulatory mechanisms of miRNA-31-5p in excess retinoic acid-induced abnormal C2C12 cell proliferation
TANG Yi, LIU Bo, LI Nan, CONG Wei, XIAO Jing
(DepartmentofOralPathology,CollegeofStomatology,DalianMedicalUniversity,Dalian116044,China)
[Abstract]Objective To investigate miRNA-31-5p regulation mechanism in decreased proliferation of C2C12 myoblast cell line which was caused by excess retinoic acid (RA). Methods Establish proliferation assay model of C2C12 cell lines in vitro. The expression level of miRNA-31-5p and dystrophine (Dmd) in C2C12 cells without RA or added with 10 μmol/L RA were detected using qPCR. Liposome of the miRNA-31-5p analogues (miRNA-31-5p mimics) or inhibitors (miRNA-31-5p inhibitor) were transfected into C2C12 cells, with the corresponding load (Duplex N.C or N.C inhibitor) measured as the control group. The absorbance value (OD index) of cells was monitored by cell proliferation / cytotoxicity detection reagent (Cell Counting Kit-8, CCK-8) in 0 h, 24 h, 36 h and 48 h. Using 5-bromodeoxyuridine incorporation assay (BrdU assay), BrdU-positive cells rate in 48h was detected. After miRNA-31-5p was down-regulated, the expression level of Dmd was analyzed by qPCR under the condition of 10 μmol/L RA. Results In the state of 10 μmol/L RA, expression levels of miRNA-31-5p had an increase tendency in 36 h and 48 h (P<0.01), and 10 μmol/L RA inhibited the expression of Dmd, with the significant differences in 36 h and 48 h (P<0.01). CCK-8 showed that miRNA-31-5p inhibitor was shown to reduce C2C12 cells proliferation activity, which was also suppressed by 10 μmol/L RA to a lower degree. In contrast, down-regulation of miRNA-31-5p significantly promoted cell proliferation (P<0.01). miRNA-31-5p inhibitor was shown to promote proliferation of C2C12 cells at 48 h comparing to N.C inhibitor under the stimulation of 10 μmol/L RA. Under the effect of 10 μmol/L RA, BrdU-positive cells rate of miRNA-31-5p mimics group was 27.6% lower than Duplex N.C group (P<0.05), and BrdU-positive cells rate of miRNA-31-5p inhibitor group was elevated by 24.1% compared to N.C inhibitor group (P<0.05). After 48 h of miRNA-31-5p inhibitor transfection, the relative expression of Dmd was significantly increased compared to N.C inhibitor group,P<0.01. Under the stimulation of 10 μmol/L RA, Dmd was measured the same increased tendency by the transfection of miRNA-31-5p inhibitor. Conclusion miRNA-31-5p participated in C2C12 cell proliferation decrescence induced by 10 μmol/L RA, which possible related molecular mechanism was achieved through targeting Dmd.
[Key words]miRNA-31-5p;retinoic acid;C2C12;cell proliferation
基金项目:国家自然科学基金项目(81271120,815709627); 教育部博士学科专项基金项目(20132105110001);辽宁省博士科研启动基金项目(20141117)
作者简介:唐 燚(1989-),女,安徽宿州人,硕士研究生。E-mail:dentisttang@gmail.com 通信作者:肖 晶,教授。 E-mail: xiaoj@dlmedu.edu.cn
doi:论著10.11724/jdmu.2016.01.02
[中图分类号]R780.2
[文献标志码]A
文章编号:1671-7295(2016)01-0006-06
(收稿日期:2015-11-03;修回日期:2015-12-27)

