WT1特异性CD8+T细胞治疗乳腺癌的实验研究
王新超,郝素红,高英堂,邱丽君,赵爽,韩璐
WT1特异性CD8+T细胞治疗乳腺癌的实验研究
王新超1,郝素红1,高英堂2,邱丽君1,赵爽1,韩璐1
摘要:目的通过检测Wilms'肿瘤基因1(WT1)特异性CD8+T细胞对乳腺癌细胞的杀伤活性,探讨正常外周血中提取的WT1特异性CD8+T细胞用于治疗乳腺癌的可行性。方法运用流式细胞仪检测20例人白细胞抗原(HLA)-A2血清阳性健康志愿者外周血中WT1特异性CD8+T细胞的浓度,通过WT1/主要组织相容性复合体(MHC)连锁状多聚体磁珠分选WT1特异性CD8+T细胞并进行培养,细胞毒性实验检测WT1特异性CD8+T细胞的功能。结果20例HLA-A2血清阳性健康志愿者外周血中均可检测到WT1特异性CD8+T细胞,12例健康外周血中WT1特异性CD8+T细胞的浓度>0.5%,其中4例>1%。WT1/MHC连锁状多聚体磁珠分选后,其浓度明显增加至80%左右。WT1特异性CD8+T细胞可特异性杀伤WT1多肽负载的乳腺癌细胞株。结论健康志愿者外周血中可检测到WT1特异性CD8+T细胞,该细胞可能对乳腺癌细胞具有特异性杀伤作用,提示WT1特异性CD8+T细胞用于乳腺癌过继性免疫治疗的可能性。
关键词:乳腺肿瘤;免疫疗法,过继;CD8阳性T淋巴细胞;WT1;细胞免疫治疗
乳腺癌是女性最常见的恶性肿瘤之一,其发病率在我国呈逐年上升趋势,部分大城市报告乳腺癌占女性恶性肿瘤之首。在美国,2015年乳腺癌在女性新发癌症病例中约占29%[1]。免疫治疗是肿瘤治疗的重要模式之一,其中肿瘤抗原特异性细胞毒性T细胞过继性免疫治疗备受关注。纯化的肿瘤抗原特异性细胞毒性T细胞不但可以特异性杀伤肿瘤细胞,而且可以避免移植物抗宿主反应,因此,成为目前研究的焦点[2-3]。如何获得高纯度的肿瘤抗原特异性细胞毒性T细胞成为治疗的关键。
Wilms'肿瘤基因1(WT1)是一个重要的肿瘤相关基因,在成人正常组织中含量非常低,但在急、慢性白血病和一些实体瘤中高表达,包括肺癌、乳腺癌、前列腺癌等,其在90%的乳腺癌中高表达[4-5]。WT1与恶性肿瘤的表型有关,应用反义寡聚脱氧核苷酸治疗乳腺癌,可直接作用于翻译位点,故肿瘤细胞不易逃避WT1导向的免疫治疗[6]。因此,WT1特异性细胞毒性T细胞的研究和应用受到广泛的关注。本研究从健康志愿者外周血中纯化WT1特异性CD8+T细胞进行培养和增殖,通过体外实验检测WT1特异性CD8+T细胞杀伤乳腺癌细胞的效应。
1 材料与方法
1.1主要试剂连锁状多聚体试剂:包括IS缓冲液、WT1连锁状多聚体藻红蛋白(phycoerythrin,PE)和主要组织相容性复合体(major histocompatibility complex,MHC)等购自德国IBA公司;抗CD8*异硫氰酸荧光素(fluorescein isothiocyanate,FITC)等抗体、BD FACS冲洗液、清理液、浸润液以及FACS Calibur流式细胞仪均购自美国BD公司,分别储存于4℃、-20℃和-80℃冰箱;Ficoll-Biocoll和RPMI 1640分离液购自德国生物化学AG公司;人AB白蛋白购自德国DRK公司;青霉素和链霉素购自天津灏洋公司。
1.2血标本外周血标本由20例人白细胞抗原(human leukocyte antigen,HLA)-A2血清阳性健康志愿者提供。外周血单核细胞由Ficoll-Biocoll分离液从血标本中分离获得,经过台盼蓝实验证实其存活率>95%。外周血单核细胞可以直接用于进一步实验,或冷冻后储存于-80℃超低温冷冻箱中备用。
1.3WT1特异性CD8+T细胞的检测外周血单核细胞标本中的WT1特异性CD8+T细胞的百分比由流式细胞仪检测,采用抗CD3*甲藻叶绿素蛋白(Peridinin-Chlorophyll-Protein,PerCP)抗体检测T细胞,抗CD8*FITC抗体检测CD8+T细胞,WT1连锁状多聚体PE检测WT1特异性T细胞。首先,将0.75 μg连锁状多聚体PE和1 μg WT1/MHC加入42 μL IS缓冲液中孵育45 min,取外周血单核细胞标本,获取细胞1×107/管,将上述将WT1/MHC准备液10 μL加入细胞中,在4℃、避光的条件下孵育45 min。其次,将抗CD3*PerCP抗体、抗CD8*FITC抗体和上述标本在4℃、避光的条件下孵育20 min。用PBS洗涤后上流式细胞仪检测,所有标本至少收集1×106个细胞进行流式细胞分析,每一个标本都行对照实验来定义所染细胞的属性。为了避免死亡细胞和细胞碎片影响实验结果,仅对淋巴细胞进行分析。
1.4WT1特异性CD8+T细胞的分选共分为3部分:准备WT1连锁状多聚体磁珠复合物;标记WT1特异性CD8+T细胞并运用MS磁柱将已标记的细胞和未标记的非特异性细胞分离;最后用D-Biotin试剂将连锁状多聚体试剂和WT1特异性CD8+T细胞分离,获得WT1特异性CD8+T细胞。
第1部分,将50 μL连锁状多聚体磁珠、2 μg WT1/MHC 和90 μL IS缓冲液,在4℃和避光条件下孵育45 min后加入1 mL IS缓冲液。将MS磁柱置于磁场中,用2 mL IS缓冲液冲洗,将上述孵育后的液体注入磁柱分选,未与WT1磁珠结合的连锁状多聚体MHC被洗脱,WT1连锁状多聚体MHC-磁珠复合物滞留于MS磁柱。接着,将MS磁柱移离磁场,加入250 μL IS缓冲液洗脱并收集WT1连锁状多聚体磁珠复合物。将上述WT1连锁状多聚体磁珠复合物与2×107的单核细胞在4℃和避光条件下外周血孵育45 min,洗涤细胞,加入1 mL IS缓冲液,准备分选。
第2部分,将MS磁柱放入磁场,用3 mL IS缓冲液冲洗,将上述细胞悬液注入磁柱。然后,用1 mL IS缓冲液冲洗3次,未与WT1连锁状多聚体磁珠结合的细胞可通过磁柱。将磁柱移离磁场,用1 mL IS缓冲液冲洗3次,洗出已经标记的特异性细胞,收集备用。
第3部分,将上述与磁珠结合的细胞离心、混悬于2 mL IS缓冲液中,加入2 mmol/L D-Biotin在4℃和避光条件下孵育20 min后洗涤。重复上述步骤1次,之后用5 mL IS缓冲液洗涤4次,收集所得细胞。
1.5混合淋巴细胞培养将纯化WT1特异性CD8+T细胞时收集的阴性细胞部分照射后,将20 μg WT1肽和2.5 mg/L β2-微球蛋白加入经过照射的1 mL含10%AB培养液的阴性细胞悬液中,在37℃孵育箱中孵化2 h,将WT1特异性CD8+T细胞与之共培养。于第1天加入2.5 mg/L白细胞介素(IL)-2和20 μg/L IL-7。第8天,将细胞取出,取2 mL IS缓冲液洗涤,然后加入200 μL IS缓冲液。如培养时间延长,可每周重复第1天的操作。
1.6细胞毒性试验WT1特异性CD8+T细胞特异性杀伤负载WT1多肽的乳腺癌细胞毒性试验采用羧基荧光素二醋酸盐琥珀酰亚胺酯(carboxyfluorescein succinimidyl amino ester,CFSE)/碘化丙啶(Propidium Iodide,PI)试验测定。具体方法是:计量4T1细胞,分对照组(A组)、未加载WT1多肽的试验组(B组)和加载WT1多肽的试验组(C组)3组,C组加入WT1多肽共培养2 h,之后分别加入CFSE,使CFSE终浓度达到2 μmol/L,37℃染色30 min,PBS洗3次。再与WT1特异性CD8+T细胞混合培养,37℃作用4~6 h,E∶T分别为1∶1、5∶1、10∶1、20∶1。然后,洗涤2次,PI工作液5 μL,避光30 min后上流式细胞仪检测。CFSE、PI双阳性的细胞为被杀伤的靶细胞,除以靶细胞总数,即为杀伤率。
2 结果
2.1正常外周血中WT1特异性CD8+T细胞的含量20例HLA-A2血清阳性健康志愿者外周血中均可检测到WT1特异性CD8+T细胞,>0.5%的有12例,>1.0%的有4例,见图1、2。
2.2混合淋巴细胞培养和WT1特异性CD8+T细胞的纯化WT1多肽可以有效地促进WT1特异性CD8+T细胞增殖。流式细胞分析了混合淋巴细胞培养后第1、8、14天WT1特异性CD8+T细胞的增殖情况,结果显示,健康志愿者的外周血中经过WT1多肽刺激后,WT1特异性CD8+T细胞的增殖最高可达10倍左右。同时,经过提纯,WT1特异性CD8+T细胞的纯度可从1.61%增至80.18%,最大纯度增加近50倍,见图3。

Fig.1 Frequency of WT1-specific CD8+T cells in the peripheral blood of healthy donors图1 健康志愿者外周血中WT1特异性CD8+T细胞的含量
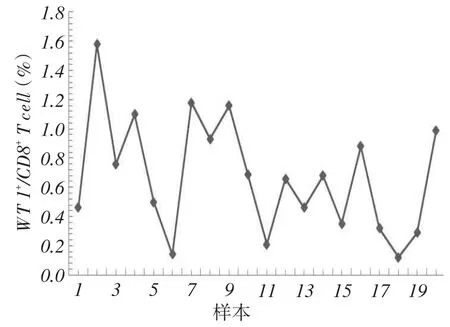
Fig.2 Frequency of WT1-specific CD8+T cells in the peripheral blood of 20 samples from HLA-A2 seropositive healthy donors图2 20例HLA-A2血清阳性健康志愿者外周血中WT1特异性CD8+T细胞的含量

Fig.3 Purification of WT1-specific CD8+T cells from HLA-A2 seropositive healthy donors图3 WT1特异性CD8+T细胞的纯化
2.3WT1特异性CD8+T细胞杀伤乳腺癌细胞株的细胞毒性试验纯化的WT1特异性CD8+T细胞分别作用于加载WT1多肽的乳腺癌细胞株4T1和未加载WT1多肽的乳腺癌细胞株4T1。结果显示,WT1特异性CD8+T细胞对WT1多肽加载的乳腺癌细胞株4T1产生明显的杀伤效应,而对WT1多肽未加载的乳腺癌细胞株4T1的细胞毒效应不明显,见图4。

Fig.4 The cytotoxicity analysis of WT1-specific CD8+T cells on breast cancer cells with WT1 peptide图4 WT1特异性CD8+T细胞对WT1多肽负载的乳腺癌细胞株4T1的细胞毒试验
3 讨论
过继性免疫治疗已经成为乳腺癌治疗的重要方法之一[7-8],其机制是移植物抗肿瘤细胞反应。获得纯化的肿瘤抗原特异性细胞毒性T细胞是提高治疗效果的关键,同时可以减少或避免过继性免疫治疗的严重并发症即移植物抗宿主反应。WT1既是目前非常被重视的靶抗原,又在乳腺癌中高表达,因此在乳腺癌的免疫治疗中有重要价值[4-5,9]。因此,WT1特异性CD8+T细胞备受关注。
直接从外周血中提纯抗原特异性CD8+T细胞的方法简单、方便。Gillmore等[10]报道,通过将递呈有WT1肽的抗原提呈细胞在体外刺激由乳腺癌转移性淋巴结分离出的CD8细胞,能够检测到WT1特异性CD8+T细胞。Weber等[11]却从患者和健康志愿者外周血中,经过体外WT1肽的刺激、混合淋巴细胞培养和细胞克隆得到了WT1特异性CD8+T细胞。但WT1抗原特异性CD8+T细胞在外周血中含量很低,其检测和纯化方法的选择尤为重要。
本研究结果显示,所有健康者外周血中均可检测到WT1特异性CD8+T细胞,12例健康外周血中WT1特异性CD8+T细胞的含量>0.5%,其中4例含量>1%。本研究运用了连锁状多聚体技术,其检测抗原特异性CD8+T细胞已经达到药品生产质量管理规范(GMP)水平[12],其优势是不但可以检测抗原特异性的T细胞,而且可将试剂从抗原特异性T细胞分离,保持了特异性T细胞原有的功能特性[13]。连锁状多聚体技术纯化的WT1特异性CD8+T细胞的功能状态也得到了检验,其纯化的WT1特异性CD8+T细胞的免疫表型为CD45RA+CCR7-,证实了其为效应T细胞的功能状态[14],对肿瘤细胞具有潜在的杀伤效应。
为了获得高纯度的WT1特异性CD8+T细胞,本研究进行了细胞增殖培养和纯化,结果显示,健康志愿者的外周血中经过WT1多肽刺激后,WT1特异性CD8+T细胞的增殖最高可达10倍左右。同时,提纯后WT1特异性CD8+T细胞的纯度可从1.61%增至80.18%,最大纯度增加近50倍,这为肿瘤抗原特异性T细胞的免疫治疗提供了保障。
WT1特异性CD8+T细胞的免疫表型证实了其对肿瘤细胞具有潜在的杀伤效应[14]。为了进一步检测其细胞毒性,本研究进行了CFSE/PI试验,结果显示,WT1特异性CD8+T细胞对WT1多肽加载的乳腺癌细胞株4T1产生明显的杀伤效应,而对WT1多肽未加载的乳腺癌细胞株4T1的细胞毒效应不明显,提示这些杀伤乳腺癌细胞的毒性效应是通过HLA-A2提呈肿瘤细胞内源性WT1多肽,被T细胞表面的WT1特异性T细胞受体特异性识别来完成的。
综上所述,本研究从健康志愿者外周血中检测、培养并纯化了WT1特异性CD8+T细胞,通过细胞毒性试验探讨了其对乳腺癌细胞的杀伤效应,这将为乳腺癌过继性免疫治疗提供依据。当然这还需要临床试验来验证,其安全性也有待于进一步研究验证。
参考文献
[1]Siegel RL,Miller KD,Jemal A.Cancer statistics,2015[J].CA Cancer JClin,2015,65(1):5-29.doi:10.3322/caac.21254.
[2]Kapp M,Stevanović S,Fick K,et al.CD8+T-cell responses to tumor-associated antigens correlate with superior relapse-free survival after allo-SCT[J].Bone Marrow Transplant,2009,43(5):399-410.doi:10.1038/bmt.2008.426.
[3]Al Qudaihi G,Lehe C,Negash M,et al.Enhancement of lytic activity of leukemic cells by CD8+cytotoxic T lymphocytes generated against a WT1 peptide analogue[J].Leuk Lymphoma,2009,50 (2):260-269.doi:10.1080/10428190802578478.
[4]Loeb DM,Evron E,Patel CB,et al.Wilms'tumor suppressor gene (WT1)is expressed in primary breast tumors despite tumor-specific promoter methylation[J].Cancer Res,2001,61(3):921-925.
[5]Oji Y,Miyoshi Y,Kiyotoh E,et al.Absence of mutations in the Wilms'tumor gene WT1 in primary breast cancer[J].Jpn J Clin Oncol,2004,34(2):74-77.
[6]Zapata-Benavides P,Tuna M,Lopez-Berestein G,et al.Down regulation of Wilms'tumor 1 protein inhibits breast cancer proliferation [J].Biochem Biophys Res Commun,2002,295(4):784-790.
[7]Zhao Y,Hu J,Li R,et al.Enhanced NK cell adoptive antitumor effects against breast cancer in vitro via blockade of the transforming growth factor-β signaling pathway[J].Onco Targets Ther,2015,22 (8):1553-1559.doi:10.2147/OTT.S82616.
[8]Mao Q,Li L,ZhangC,et al.Clinical effects of immunotherapy of DCCIK combined with chemotherapy in treating patients with metastaticbreast cancer[J].Pak JPharm Sci,2015,28(3 Suppl):1055-1058.
[9]Cheever MA,Allison JP,Ferris AS,et al.The prioritization of cancer antigens:a national cancer institute pilot project for the acceleration of translational research[J].Clin Cancer Res,2009,15(17):5323-5337.doi:10.1158/1078-0432.CCR-09-0737.
[10]Gillmore R,Xue SA,Holler A,et al.Detection of Wilms'tumor antigen-specific CTL in tumor-draining lymph nodes of patients with early breast cancer[J].Clin Cancer Res,2006,12(1):34-42.
[11]Weber G,Karbach J,Kuci S,et al.WT1 peptide-specific T cells generated from peripheral blood of healthy donors:possible implications for adoptive immunotherapy after allogeneic stem cell transplantation[J].Leukemia,2009,23(9):1634-1642.
[12]Yao J,Bechter C,Wiesneth M,et al.Multimer staining of cytomegalovirus phosphoprotein 65-specific T cells for diagnosis and therapeutic purposes:a comparative study[J].Clin Infect Dis,2008,46 (10):e96-105.doi:10.1086/587749.
[13]Knabel M,Franz TJ,Schiemann M,et al.Reversible MHC multimer staining for functional isolation of T-cell populations and effective adoptive transfer[J].Nat Med,2002,8(6):631-637.
[14]Wang X,Schmitt A,Chen B,et al.Streptamer-based selection of WT1-specific CD8+T cells for specific donor lymphocyte infusions [J].Exp Hematol,2010,38(11):1066-1073.doi:10.1016/j.exphem.2010.07.002.
(2015-11-26收稿2016-01-14修回)
(本文编辑陈丽洁)
Experimental study of WT1 specific CD8+T cells in the treatment of breast cancer
WANG Xinchao1,HAO Suhong1,GAO Yingtang2,QIU Lijun1,ZHAO Shuang1,HAN Lu1
1 Department of Breast and Thyroid,the Fourth Central Hospital of Tianjin,Tianjin 300140,China;2 The Third Central Hospital of Tianjin Corresponding AuthorE-mail:xin-c@hotmail.com
Abstract:ObjectiveTo investigate the feasibility of Wilms'tumor gene 1(WT1)-specific CD8+T cells from peripheral blood for the treatment of breast cancer by detecting the killing activity of WT1 specific CD8+T cells on breast cancer cells.MethodsFlow cytometry was used to detect WT1-specific CD8+T cells in the peripheral blood of 20 samples from HLA-A2 seropositive healthy donors,which were isolated by WT1/MHC streptamer magnetic beads and cultured.The function of WT1-specific CD8+T cells were analysis by cytotoxicity assay.ResultsTwelve of 20 healthy donors had naive WT1-specific CD8+T-cell frequencies of>0.5%,and 4 of 20 even>1.0%of all CD8+T cells.After positive selection by magnetic cell separation,a purity of up to 80%can be achieved.WT1 specific CD8+T cells can specifically kill breast cancer cell line with WT1 polypeptide.ConclusionWT1 specific CD8+T cells can be detected in peripheral blood of healthy volunteers.WT1 specific CD8+T cells have killing effect on breast cancer cells,suggesting the feasibility of adoptive immunotherapy for breast cancer.
Key words:breast neoplasms;immunotherapy,adoptive;CD8-positive T-lymphocytes;Wilms'tumor gene 1;cell immunotherapy
中图分类号:R737.9
文献标志码:A
DOI:10.11958/20150353
基金项目:天津市卫生行业重点攻关项目(12KG109)
作者单位:1天津市第四中心医院(邮编300140);2天津市第三中心医院
作者简介:王新超(1969),男,主任医师,医学博士,主要从事甲状腺、乳腺疾病和肿瘤免疫治疗方面的研究
通讯作者E-mail:xin-c@hotmail.com

