miR-100表达与乳腺癌患者淋巴结转移及FZD-8表达的相关性研究
于兆进,江茜,韩丽,关舒,颜媛媛,魏敏杰,何苗△
miR-100表达与乳腺癌患者淋巴结转移及FZD-8表达的相关性研究
于兆进1,江茜1,韩丽1,关舒2,颜媛媛1,魏敏杰1,何苗1△
摘要:目的考察临床乳腺癌病理组织中miR-100和Wnt通路关键因子卷曲蛋白(FZD)-8表达之间的关系,并分析miR-100表达与乳腺癌患者淋巴结转移的关系。方法选取中国医科大学附属第一医院乳腺外科术后的50例乳腺癌患者,通过原位杂交检测乳腺癌患者病理组织及其配对的癌旁组织中miR-100的表达;免疫组化检测2种组织中FZD-8的表达;比较有无淋巴结转移患者癌组织中miR-100表达情况,分析乳腺癌组织miR-100与FZD-8表达的相关性。结果miR-100在乳腺癌组织中的表达明显低于其配对的癌旁组织[2.00(1.00,3.00)vs.6.00(3.50,8.00)];有淋巴结转移者癌组织中miR-100低表达[1.50(1.00,2.75)vs.3.00(2.00,4.00)];与癌旁组织相比,FZD-8在乳腺癌组织中高表达[8.00(6.00,9.00)vs.6.00(3.75,9.00)],且其表达水平与miR-100的表达呈负相关(rs=-0.592,P<0.001)。结论miR-100作为抑癌miRNA参与乳腺癌转移的调节,可能与其调控FZD-8的表达有关。
关键词:乳腺肿瘤;淋巴转移;Wnt蛋白质类;微RNAs;miR-100;Wnt通路;卷曲蛋白8
△通讯作者E-mail:hemiao_cmu@126.com
Wnt信号通路是一条高度保守的通路,参与细胞增殖、分化、生存、凋亡等细胞生物过程的调节[1]。卷曲蛋白(Frizzled,FZD)-8是Frizzled受体家族主要成员之一,在Wnt信号通路介导的肿瘤发生发展中发挥重要作用[2]。已有研究证实miR-100靶向抑制同源基因(HOX)A1,可进而抑制肿瘤的增殖、侵袭及转移[3]。但是,关于miR-100与乳腺癌侵袭转移的关系有待深入研究。本研究检测了临床乳腺癌患者病理组织中miR-100和FZD-8的表达,分析两者的相关性,以及miR-100表达与乳腺癌患者淋巴结转移的关系,旨在探讨miR-100介导乳腺癌转移的机制。
1 材料与方法
1.1实验材料50例乳腺癌组织及其配对的癌旁组织,来自中国医科大学附属第一医院乳腺外科病房2011年1月—2012年12月间实施手术的女性乳腺癌患者,年龄34~72岁,平均(47.6±11.8)岁;收集经病理诊断明确的淋巴结转移情况,其中乳腺癌发生淋巴结转移者32例,未发生淋巴结转移者18例;患者术前均未接受放疗或化疗。抗体FZD-8购自美国Abcam公司;SP超敏浓缩试剂盒购自福州迈新生物技术开发有限公司;DAB显色试剂盒购自北京中杉金桥生物技术有限公司;地高辛标记的miR-100寡核苷酸探针由上海生工生物工程股份有限公司合成;原位杂交检测试剂盒(Enhanced Sensitive ISH Detection KitⅡ)购自武汉博士德公司。
1.2方法
1.2.1免疫组织化学染色乳腺癌组织微阵列芯片经二甲苯脱蜡,降梯度乙醇脱苯、水化。将芯片浸入柠檬酸盐缓冲液(pH 6.0),高压修复8~10 min。3%过氧化氢灭活内源性过氧化物酶;正常山羊血清封闭;PBS稀释的一抗FZD-8(1∶200)4℃孵育过夜。次日芯片经生物素标记的二抗(1∶200)37℃孵育30 min;链霉素抗生物素-辣根过氧化物酶(1∶200)37℃孵育30 min;滴加新鲜配制的DAB溶液显色。苏木素复染。脱水,二甲苯透明,中性树胶封片后观察。同步操作阴性对照,即癌旁组织,采用PBS液代替一抗。
1.2.2原位杂交组织切片经二甲苯脱蜡,梯度乙醇脱苯、水化;3%过氧化氢处理10 min;蛋白酶K(20 mg/L)37℃孵育15 min;预杂交液中37℃预杂交2 h;杂交液中37℃杂交过夜。10%正常山羊血清37℃孵育30 min;生物素标记的鼠抗地高辛37℃孵育60 min;SABC-AP 37℃孵育30 min。苏木素复染等步骤同上。
1.2.3结果判定miR-100及FZD-8表达均按着色细胞百分率与染色强度两者记分乘积计分。着色细胞百分率:<5%染色记为0,5%~25%染色记为1,26%~50%染色记为2,51%~75%染色记为3,>75%染色记为4。染色强度:无染色记为0,弱阳性记为1,中等强度记为2,强阳性记为3。
1.3统计学方法采用SPSS 16.0统计软件包分析数据,因miR-100及FZD-8表达评分为非正态分布的连续变量,采用中位数和四分位数[M(P25,P75)]表示,两组间miR-100及FZD-8表达水平比较采用Mann-Whitney U test分析;采用Spearman相关系数来描述miR-100及FZD-8表达的相关性。以P<0.05为差异有统计学意义。
2 结果
2.1miR-100在乳腺癌组织中的表达原位杂交结果显示,miR-100在癌组织中染色程度与癌旁组织相比明显减弱,见图1。癌组织中miR-100表达水平显著低于癌旁组织[2.00(1.00,3.00)vs.6.00 (3.50,8.00),Z=5.235,P<0.001]。
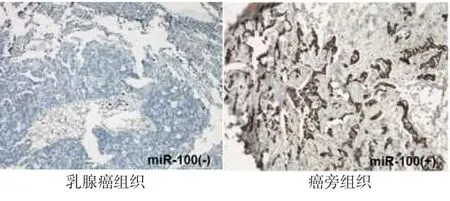
Fig.1 Figures showingmiR-100 expression in breast cancer tissues and adjacent normal tissues measured by in situ hybridization(ISH,×200)图1 乳腺癌患者癌组织及癌旁组织中miR-100的表达(原位杂交,×200)
2.2乳腺癌组织中miR-100表达与淋巴结转移的关系有淋巴结转移肿瘤组织中miR-100表达水平显著低于无淋巴结转移肿瘤组织[1.50(1.00,2.75)vs.3.00(2.00,4.00),Z=3.041,P=0.002]。
2.3乳腺癌组织中FZD-8与miR-100的相关性免疫组化结果显示,FZD-8在乳腺癌组织中的表达显著高于癌旁组织[8.00(6.00,9.00)vs.6.00(3.75,9.00),Z=3.201,P=0.001],见图2。相关分析显示FZD-8与miR-100表达呈负相关(rs=-0.592,P<0.001)。

Fig.2 Figures showingthe expression of FZD-8 in human breast cancer tissues and adjacent normal tissues analyzed by immunohistochemistry(IHC,×200)图2 乳腺癌患者癌组织及癌旁组织中FZD-8的表达(免疫组化,×200)
3 讨论
3.1miR-100与乳腺癌转移的关系侵袭转移是乳腺癌患者预后不良、引起死亡的最主要原因,因此寻找抑制乳腺癌转移的新靶点势在必行。miRNA是一类长度约为21~23个核苷酸的小分子非编码RNA,在多种生物学过程中起着重要的调控作用。一些miRNAs已被发现作为抑癌基因在抑制肿瘤的转移中发挥重要作用。Nishikawa等[4]报道miR-29可直接靶向laminin信号在前列腺癌中抑制肿瘤细胞的侵袭和迁移。有研究报道miR-100在口腔癌、肾上腺皮质癌、肝细胞癌、卵巢癌和膀胱癌中低表达[5-7]。Gebeshuber等[8]报道miR-100能靶向抑制胰岛素样生长因子2的表达,从而抑制乳腺癌的进展。最近,Chen等[9]也报道了miR-100通过转录后调节polo样激酶1(PLK1)表达,进而抑制卵巢癌上皮细胞的生长。Petrelli等[10]也证实了miR-100通过抑制PLK1抑制了乳腺癌干细胞干性的维持。本研究通过原位杂交检测发现miR-100在乳腺癌组织中的表达明显低于癌旁组织,且在有淋巴结转移患者中低表达,提示其可能作为抑癌miRNAs抑制乳腺癌的转移。
3.2miR-100与FZD-8表达的关系肿瘤细胞所处微环境中复杂的信号通路,如Wnt、转化生长因子(TGF)-β、Notch等信号通路的相互作用介导了肿瘤侵袭转移的过程[11]。当Wnt在细胞膜表面与FZD和低密度脂蛋白受体相关蛋白(LRP)5/6结合后,激活经典或非经典的Wnt通路,抑制β-连环蛋白(β-catenin)-轴蛋白(AXIN)-腺瘤状结肠息肉蛋白(APC)-糖原合成酶激酶(GSK)3β复合物的形成,增加β-catenin的稳定性与入核,促进下游靶基因的转录,促进肿瘤的发生发展[12],可见Wnt信号通路的激活在肿瘤的发展转移中发挥重要作用。一些miRNAs被证实能够靶向调节Wnt通路的关键因子,从而参与肿瘤细胞生物学功能的调控。研究发现miR-612可通过抑制Wnt信号通路来抑制肝癌细胞的干性、侵袭和迁移[13]。Subramanian等[14]研究显示miR-29通过下调β-catenin的共激活子的表达,抑制肠癌细胞Wnt信号通路的功能。FZD-8为Wnt信号通路受体卷曲蛋白家族中的一员,在Wnt通路活性调控中发挥重要作用。已有研究发现FZD-8在三阴性乳腺癌细胞中高表达,抑制FZD-8的表达能够抑制Wnt通路的活性,并明显增加三阴性乳腺癌细胞的药物敏感性[15]。而本研究是在乳腺癌病理组织中进行FZD-8表达水平检测,且未考虑乳腺癌三阴性分子表型,亦发现FZD-8在乳腺癌中高表达,这提示乳腺癌中FZD-8并非三阴性表型者独有的标志分子,这可在更大样本的组织标本中进行FZD-8检测予以进一步确认。本研究通过免疫组化检测发现FZD-8在临床乳腺癌患者病理组织中的表达明显高于癌旁组织,且其表达与miR-100的表达呈负相关,提示miR-100和FZD-8有望成为评价乳腺癌患者预后的重要指标,靶向FZD-8可能为临床乳腺癌的治疗提供重要线索。
参考文献
[1]Clevers H.Wnt/beta-catenin signaling in development and disease [J].Cell,2006,127(3):469-480.
[2]Wang HQ,Xu ML,Ma J,et al.Frizzled-8 as a putative therapeutic target in human lung cancer[J].Biochem Biophys Res Commun,2012,417(1):62-66.doi:10.1016/j.bbrc.2011.11.055.
[3]Chen D,Sun Y,Yuan Y,et al.miR-100 induces epithelial-mesenchymal transition but suppresses tumorigenesis,migration and invasion[J].PLoS Genet,2014,10(2):e1004177.doi:10.1371/journal. pgen.1004177.
[4]Nishikawa R,Goto Y,Kojima S,et al.Tumor-suppressive microRNA-29s inhibit cancer cell migration and invasion via targeting LAMC1 in prostate cancer[J].Int J Oncol,2014,45(1):401-410. doi:10.3892/ijo.2014.2437.
[5]Christodoulou F,Raible F,Tomer R,et al.Ancient animal microRNAs and the evolution of tissue identity[J].Nature,2010,463 (7284):1084-1088.doi:10.1038/nature08744.
[6]Zheng YS,Zhang H,Zhang XJ,et al.MiR-100 regulates cell differentiation and survival by targeting RBSP3,a phosphatase-like tumor suppressor in acute myeloid leukemia[J].Oncogene,2012,31 (1):80-92.doi:10.1038/onc.2011.208.
[7]Li Z,Li X,Yu C,et al.MicroRNA-100 regulates pancreatic cancer cells growth and sensitivity to chemotherapy through targeting FGFR3[J].Tumour Biol,2014,35(12):11751-11759.doi:10.1007/ s13277-014-2271-8.
[8]Gebeshuber CA,Martinez J.miR-100 suppresses IGF2 and inhibits breast tumorigenesis by interfering with proliferation and survival signaling[J].Oncogene,2013,32(27):3306-3310.doi:10.1038/onc.2012.372.
[9]Chen P,Zhao X,Ma L.Downregulation of microRNA-100 correlates with tumor progression and poor prognosis in hepatocellular carcinoma[J].Mol Cell Biochem,2013,383(1/2):49-58.doi:10.1007/s11010-013-1753-0.
[10]Petrelli A,Carollo R,Cargnelutti M,et al.By promoting cell differentiation,miR-100 sensitizes basal-like breast cancer stem cells to hormonal therapy[J].Oncotarget,2015,6(4):2315-2330.
[11]Klemm F,Bleckmann A,Siam L,et al.β-catenin-independent WNT signaling in basal-like breast cancer and brain metastasis[J].Carcinogenesis,2011,32(3):434-442.doi:10.1093/carcin/bgq269.
[12]MacDonald BT,Tamai K,He X.Wnt/beta-catenin signaling:components,mechanisms,and diseases[J].Dev Cell,2009,17(1):9-26.
[13]TangJ,Tao ZH,Wen D,et al.MiR-612 suppresses the stemness of liver cancer viaWnt/β-catenin signaling[J].Biochem Biophys Res Commun,2014,447(1):210-215.doi:10.1016/j.bbrc.2014.03.135.
[14]Subramanian M,Rao SR,Thacker P,et al.MiR-29b downregulates canonical Wnt signaling by suppressing coactivators of β-catenin in human colorectal cancer cells[J].J Cell Biochem,2014,115 (11):1974-1984.doi:10.1002/jcb.24869.
[15]Yin S,Xu L,Bonfil RD,et al.Tumor-initiating cells and FZD8 play a major role in drug resistance in triple-negative breast cancer[J]. Mol Cancer Ther,2013,12(4):491-498.doi:10.1158/1535-7163.MCT-12-1090.
(2015-11-25收稿2016-03-02修回)
(本文编辑李鹏)
The correlation of miR-100 expression with lymph node metastasis and FZD-8 protein expression in patients with breast cancer
YU Zhaojin1,JIANG Qian1,HAN Li1,GUAN Shu2,YAN Yuanyuan1,WEI Minjie1,HE Miao1
1 Department of Pharmacology,School of Pharmacy,China Medical University,Shenyang 110122,China;2 Department of Breast Surgery,The First Affiliated Hospital of China Medical University Corresponding AuthorE-mail:hemiao_cmu@126.com
Abstract:ObjectiveTo evaluate the expression and relationship of miR-100 and FZD-8,one of the major components of Wnt signaling pathway,and the correlation of their expressions with lymph node metastasis in patients with breast cancer.MethodsThe expression of miR-100 was determined in 50 samples of human breast cancer tissues and adjacent normal tissues by in situ hybridization.The correlation of miR-100 expression with lymph node metastasis was analyzed by Mann-Whitney U test.The expression of FZD-8 was measured in 50 samples of human breast cancer tissues and adjacent normal tissues by immunohistochemistry.The correlation of the miR-100 expression with the protein expression of FZD-8 was evaluated by Pearson rank analysis.ResultsThe expression of miR-100 was significantly lower in human breast cancer tissues than that in adjacent normal breast tissues[2.00(1.00,3.00)vs.6.00(3.50,8.00)].The miR-100 expression was lower in patients with lymph node metastasis than that in patients without lymph node metastasis[1.50(1.00,2.75)vs.3.00 (2.00,4.00)].The expression of FZD-8 was significantly higher in human breast cancer tissues than that in adjacent normal breast tissues[8.00(6.00,9.00)vs.6.00(3.75,9.00)].The miR-100 expression was negatively correlated with the FZD-8 protein expression in human breast cancer tissues(rs=-0.592,P<0.001).ConclusionThe miR-100,as an anti-metastasismiRNA,may involve in the metastasis of breast cancer,which may be related with the regulation of the expression of FZD-8.
Key words:breast neoplasms;lymphatic metastasis;Wnt proteins;microRNAs;miR-100;Wnt pathway;FZD-8
中图分类号:R737.9
文献标志码:A
DOI:10.11958/20150333
基金项目:辽宁省高校创新团队支持计划资助项目(LT2014016);沈阳市科技计划项目(F14-232-6-05)
作者单位:1中国医科大学药学院药理教研室(邮编110122);2中国医科大学附属第一临床医院乳腺外科
作者简介:于兆进(1983),男,讲师,硕士,主要从事分子肿瘤药理学研究

