Notch和Wnt信号通路在自体骨髓间充质干细胞复合富血小板纤维蛋白修复兔牙槽骨缺损中的表达
周春梅 李淑慧 温齐古丽·乃库力 于莉 袁萍 赵璐 吴佩玲 尼加提·吐尔逊新疆医科大学第二附属医院口腔科,乌鲁木齐 830063
Notch和Wnt信号通路在自体骨髓间充质干细胞复合富血小板纤维蛋白修复兔牙槽骨缺损中的表达
周春梅 李淑慧 温齐古丽·乃库力 于莉 袁萍 赵璐 吴佩玲 尼加提·吐尔逊
新疆医科大学第二附属医院口腔科,乌鲁木齐 830063
[摘要]目的 通过建立自体骨髓间充质干细胞(BMSCs)复合富血小板纤维蛋白(PRF)修复兔拔牙窝骨缺损的动物模型,探讨Notch和Wnt信号通路在牙槽骨缺损修复过程中的表达及意义。方法 选用36只健康雄性2月龄新西兰兔,随机分为4组,均于全身麻醉下微创拔除下颌左侧中切牙。A组植入BMSCs-PRF复合物,B、C组分别植入单一PRF和BMSCs,D组未植入任何材料作为空白对照。术后4、8、12周(每个时间点3只动物)处死动物,立即在骨缺损同一部位取材,制作骨标本,利用免疫组织化学和免疫荧光染色检测骨缺损修复过程中Notch1和Wnt3a的表达情况。结果 免疫组织化学染色结果显示:第4、8周,A、B、C组Notch1和Wnt3a表达均高于D组(P<0.05);第12周,D组Notch1和Wnt3a表达高于其他3组(P<0.05)。免疫荧光染色显示:第4周,骨缺损区新生骨细胞Notch1和Wnt3a的表达最多,随着时间的延长,骨缺损修复完成,表达逐渐降低。结论 Notch1和Wnt3a信号分子在BMSCs复合PRF促进骨缺损修复过程中均有表达,可以通过调控BMSCs的增殖与分化加速牙槽骨缺损修复的愈合过程;二者表达情况相似,有可能存在串话机制。
[关键词]Notch1; Wnt3a; 牙槽骨缺损; 骨髓间充质干细胞; 富血小板纤维蛋白
拔牙后不可避免的牙槽骨吸收会导致牙槽嵴高度和宽度降低以及骨密度减小,会对后期活动和种植义齿修复的临床效果产生不利影响[1-2],因此牙槽骨缺损的修复是目前临床上亟待解决的问题。在特定微环境中,骨髓间充质干细胞(bone marrow stem cells,BMSCs)在适宜细胞因子作用下可以分化成多种组织细胞,如成骨细胞、软骨细胞以及脂肪细胞等[3]。研究[4-5]证实,BMSCs与富血小板纤维蛋白(platelet-rich fibrin,PRF)形成的骨组织工程复合材料可以促进牙槽骨的再生与修复,但如何促进细胞生成的调控机制目前尚不清楚。目前发现,Notch 和Wnt信号通路几乎涉及所有已知动物的胚胎发育和组织损伤修复中细胞的增殖和分化活动,其中,Notch1和Wnt3a在口腔组织中的表达具有细胞特异性[6],二者调控骨形成的机制是近年来的研究热点。
本实验采用BMSCs和PRF复合物BMSCs-PRF修复兔牙槽骨缺损,通过免疫组织化学和免疫荧光染色检测不同时间段Notch1和Wnt3a信号蛋白在牙槽骨缺损前后的表达情况,分析Notch和Wnt双信号通路在骨组织工程材料修复牙槽骨缺损中的作用。
1 材料和方法
1.1 主要试剂和仪器
大鼠抗兔一抗Notch1(北京博奥森生物技术有限公司),大鼠抗兔一抗Wnt3a(Ana Spec公司,美国),Envision两步法免疫组织化学试剂盒(DAKO公司,丹麦);二氨基联苯胺(diaminobenzidine,DAB)、抗体稀释液、封闭用正常羊血清(北京中杉金桥生物技术有限公司);4’,6-二脒基-2-苯基吲哚二盐酸盐(4’,6-diamidino-2-phenylindole dihydrochloride,DAPI)(北京高科恒辉技术发展有限公司);免疫荧光二抗试剂盒(Abbkine公司,美国)。C2型激光扫描共聚焦显微镜(Nikon公司,日本);DM5000型正置荧光显微镜(Leica公司,德国);生物组织包埋机(金华益迪医疗设备有限公司);Microm HM 315型病理切片机(GMI 公司,德国)。
1.2 实验方法
1.2.1 动物模型建立方法 健康雄性2月龄新西兰大白兔36只(质量2.5~3.5 kg,新疆医科大学动物实验中心),随机分为4组,即实验组(A、B、C)和空白组(D),均于全身麻醉下微创拔除下颌左侧中切牙。A组植入自体BMSCs与PRF复合物BMSCs-PRF,B、C组分别植入PRF和BMSCs,D组拔牙窝内未植入任何材料。分别于术后4、8和12周(每个时间点每组有3只动物)处死动物并立即在骨缺损部位取材,0.9%氯化钠溶液冲洗下颌骨缺损部位标本,放入固定液(4%多聚甲醛)中固定48 h。标本经过脱钙、包埋,切片(厚度4 μm)后部分用于组织学观察,部分进行免疫荧光和免疫组织化学染色。
1.2.2 BMSCs的体外培养 A和C组的每只新西兰大白兔均采用3%戊巴比妥钠(1 mL·kg-1)通过耳缘静脉注射麻醉后,选股骨第3转子稍下方为进针点,持16号骨髓穿刺针与股骨轴线垂直刺入骨髓腔,抽取5 mL骨髓,采用细胞密度梯度离心法在超级工作台内分离并收集细胞。在37 ℃、体积分数5% CO2的饱和湿度孵育条件下,采用DMEM液(含体积分数10%胎牛血清、100 U·L-1青霉素、100 mg·L-1链霉素)培养细胞,首次换液48 h后,每间隔2~3 d换液1次。待显微镜下显示细胞生长融合达90%以上后,用0.25%胰酶消化细胞2 min,离心5 min(1 200 r·min-1)。按照常规1∶2的比例传代、扩增,取第3代细胞用于实验。
1.2.3 PRF的制备 从A和B组的每只新西兰大白兔耳缘抽取10 mL动脉血,放置于无菌采血管中,以3 000 r·min-1离心15 min后,管内出现分层,由下至上依次为红细胞层、白色凝胶状PRF层、血清层。采用中间PRF层进行实验。
1.2.4 BMSCs与PRF的复合及培养 无菌条件下将PRF层制备成4 mm×6 mm大小后置于24孔板内,用DMEM预湿后,紫外线消毒45 min。调整细胞密度至每毫升6×107个细胞,将BMSCs接种至24孔板内,每块接种20 μL,加培养液2 mL,在37 ℃、体积分数5%的饱和湿度条件下孵育,间隔1 d换液,在倒置相差显微镜下每日观察,培养至第3天时用于实验。1.3 免疫荧光染色
切片经二甲苯脱蜡和梯度乙醇脱水后,使用柠檬酸钠缓冲液阻断内源性过氧化物酶。待抗原修复后,依次使用PBS清洗和10%正常山羊血清封闭。37 ℃避光孵育1 h后,加入Notch1单克隆抗体(1∶100)及Wnt3a多克隆抗体(1∶100),置于4 ℃冰箱内孵育过夜。PBS清洗3次,加入二抗进行荧光标记(1∶1 000),常温下避光孵育2 h,再次经PBS冲洗后,加入稀释后的DAPI(DAPI与甲醇体积比为1∶1 000)染色5~10 min,PBS清洗3次,最后封片,置于荧光显微镜下观察。
1.4 免疫组织化学染色
切片常规脱蜡,室温下置于3%H2O2溶液中15 min以消除内源性过氧化物酶活性,然后利用枸橼酸缓冲溶液行抗原热修复12 min,随即于40 min~1 h内冷却至室温,滴加羊封闭血清30~50 μL,置于37 ℃恒温箱内孵育30 min后,滴加一抗Notch1(1∶500),4 ℃条件下湿盒内孵育过夜。室温放置1 h,滴加二抗后于湿盒内37 ℃恒温孵育25 min,DAB显色,苏木素5 min均匀染色,脱水、透明、封片。Wnt3a(1∶300)染色实验步骤同上。选取各时间点各组骨缺损部位的15个高倍镜视野(放大400倍),拍摄图片,利用Image Pro Plus软件(Media Cybernetics公司,美国)测量各组Notch1和Wnt3a平均光密度(average optical density,AOD)值。测量步骤如下:1)光密度校正,即本底修正;2)设置测量参数;3)描绘测量区域;4)设置色彩选择,本研究采用色调、饱和度、亮度模式;5)测量描绘区域面积;6)测量积分光密度;7)计算出比值即为AOD。
1.5 统计学分析
采用SPSS 17.0软件对Notch1和Wnt3a的表达进行统计学分析,统计方法采用方差分析,检验水准为双侧α=0.05。
2 结果
2.1 组织学切片观察
术后4周,A组见骨细胞和少量哈弗系统以及粗大密集的骨小梁;B、C组表现出不典型的骨组织结构和哈弗系统,骨小梁较稀疏,排列较为紊乱;D组为纤维组织,罕见成骨细胞。术后8周,A组新生骨及骨小梁逐渐增加,B、C组有少量新生骨形成,D组多为纤维结缔组织。术后12周,A组缺损区新生的编织骨及板层骨里可见成熟的哈弗系统;B组可见较稀疏的骨小梁,新生的编织骨及板层骨充填少于A组;C组骨组织排列欠规则,成熟的哈弗系统少见;D组主要为纤维结缔组织,可见少量骨样组织生成(图1)。
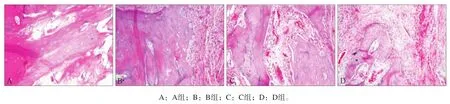
图 1 第12周4组的组织学切片观察 苏木精-伊红染色 × 20Fig 1 Typical histological sections of specimens harvested from the four groups 12 weeks after operation hematoxylin-eosin staining × 20
2.2 Notch1和Wnt3a的表达
2.2.1 免疫荧光染色 4周时,Notch1和Wnt3a在各组骨缺损区新生牙槽骨内均有表达,主要定位于细胞外基质,新生组织血管周均可见Notch1强表达,而细胞核未见Notch1和Wnt3a的表达(图2、3);随着时间延长,各组Notch1和Wnt3a的表达均逐渐下降,到12周时,除D组有少量表达外,其他组已无明显表达。
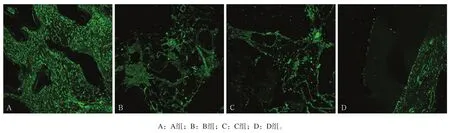
图 2 第4周Notch1表达情况 免疫荧光染色 × 40Fig 2 The expression of Notch1 four weeks after surgery immunofluorescence staining × 40
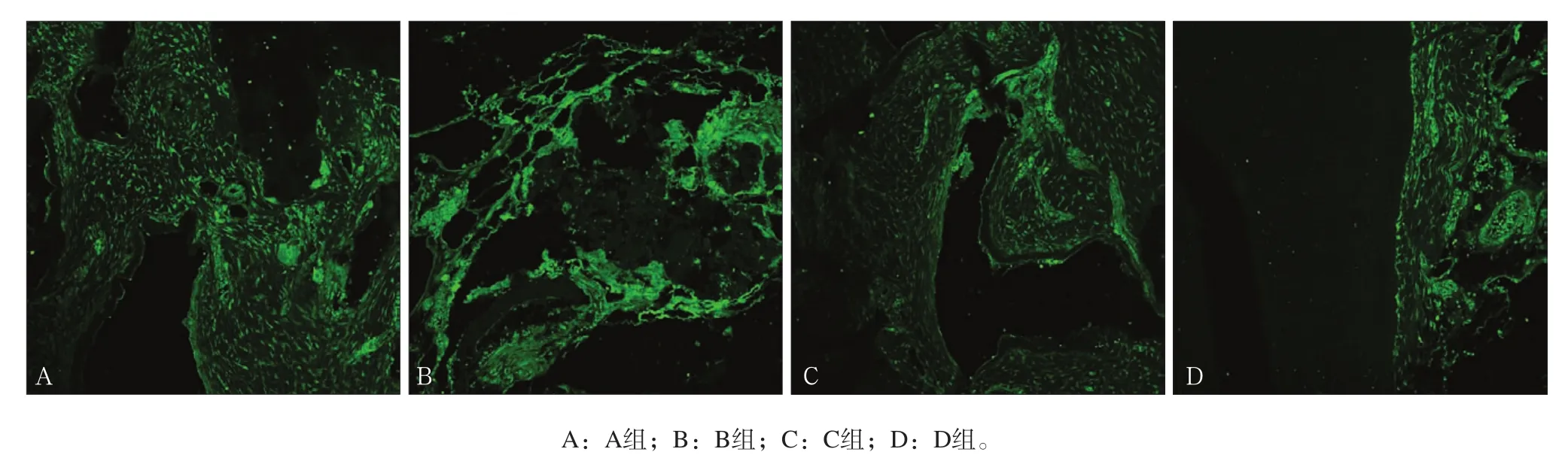
图 3 第4周Wnt3a表达情况 免疫荧光染色 × 40Fig 3 The expression of Wnt3a four weeks after surgery immunofluorescence staining × 40
2.2.2 免疫组织化学染色 Notch1和Wnt3a阳性表达呈棕色,表达在骨小梁周围、牙槽骨的成骨细胞和骨髓基质细胞中。实验4、8周时,4组均有阳性表达,A组表达最高,B、C组次之,D组最低(图4、 5);12周时,随着骨形成时间的增加,A、B、C组的阳性表达水平低于D组。4组在不同时间点的AOD值见图6。
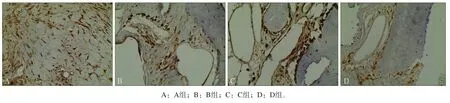
图 4 第4周Notch1表达情况 免疫组织化学染色 × 40Fig 4 The expression of Notch1 four weeks after surgery immunohistochemical staining × 40
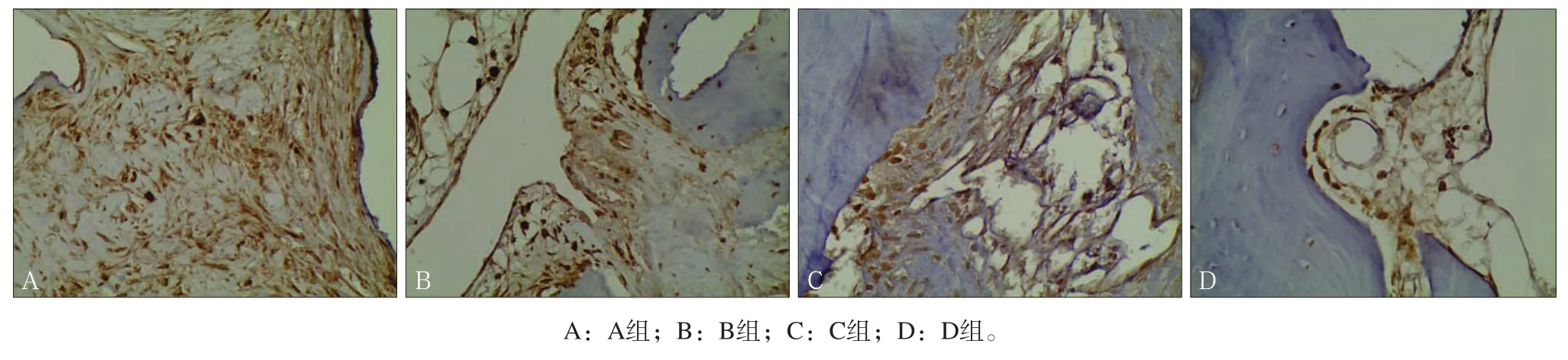
图 5 第4周Wnt3a表达情况 免疫组织化学染色 × 40Fig 5 The expression of Wnt3a four weeks after surgery immunohistochemical staining × 40
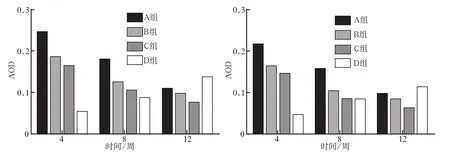
图 6 4组Notch1(左)和Wnt3a(右)表达的AOD值Fig 6 The AOD of Notch1 (left) and Wnt3a (right) in four groups
由图6可见,4周时,A组Notch1和Wnt3a表达量最高,高于其他各组(P<0.05),B、C组表达量较A组降低,但高于D组(P<0.05);随干预时间的延长,8、12周时A、B、C组表达量均逐渐降低,但8周时A组表达量仍高于其他各组,12周时A组表达量高于B、C组;D组则随干预时间的延长,表达量逐渐升高,12周时,D组Notch1和Wnt3a表达量最高,高于其他3组(P<0.05)。
3 讨论
牙槽骨缺损修复是一个持续的骨组织吸收和骨形成的过程[7]。Notch和Wnt信号对调控干细胞的增殖、分化、凋亡、黏附及维持均具有十分重要的作用[8]。两者在成骨细胞的发生及骨形成中的作用是近年来的研究焦点。
Notch信号通路是一类穿膜受体蛋白[7],其激活是通过位于细胞膜上的Notch受体与配体和细胞核内的DNA结合蛋白间相互作用,释放出胞内段[9-11],将原来的协同抑制复合物转换为协同活化复合物,传到细胞核,激活相关转录因子的表达,调节与细胞增殖和分化相关的基因转录。Wnt3a信号蛋白是Wnt信号通路家族的成员之一,是一种富含半胱氨酸的分泌型糖蛋白,通过旁分泌或自分泌作用与相邻细胞膜上的受体相结合,激活细胞内各级信号,调控相关基因的表达和目标细胞的增殖和分化[12]。
骨组织工程技术是由种子细胞、细胞因子和支架材料组成。BMSCs取材容易,在体外连续传代多达30次,仍具有很强的成骨潜能。骨形态发生蛋白、维生素C、β-甘油磷酸钠和碱性成纤维细胞生长因子等诱导物可促进其向成骨方向分化。与其他成骨种子细胞相比,BMSCs有着无可比拟的优势[13-14]。PRF为新一代血小板浓缩物,呈立体网状,可提供细胞生存的三维空间,对骨组织修复的促进作用有赖于浓缩血小板被激活后α颗粒缓慢释放出高浓度的各类生长因子和自身的纤维蛋白支架作用[15-16]。
本实验通过建立兔牙槽骨缺损的动物模型,向牙槽窝回植不同的骨组织工程材料,结果显示:4周时各组均表达Notch1和Wnt3a,其中A组表达最高,B、C组次之,D组最低。提示Notch1和Wnt3a不同程度参与调控骨髓干细胞向成骨细胞增殖和分化以及新骨形成,A组新骨形成量优于B、C组。8周时,A、B、C组的Notch1和Wnt3a表达量下降,D组逐渐升高。12周时,各组表达量与4周时相比均有明显下降,且A、B、C组Notch1和Wnt3a表达量均低于D组。可能是随着骨缺损区新生骨增多并逐渐成熟,Notch1和Wnt3a不参与调控成熟的成骨细胞;而空白组(D组)的成骨细胞仍处于增殖分化状态,骨形成正在进行,成骨效果较其他3组滞后,致使Notch1和Wnt3a的表达量增加。
本研究结果提示,在促进骨组织缺损的修复过程中,骨组织工程材料通过Notch和Wnt信号通道参与调控骨髓间充质干细胞向成骨细胞增殖与分化,加速新骨形成。在生物材料逐步降解的同时,由于PRF有促细胞增殖与迁徙的立体网状结构,易于种子细胞的附着并在预制形态的三维支架上生长,同时获得营养物质并进行气体交换和排除废料,BMSCs-PRF复合物能促进成骨细胞的不断增殖,增加新骨形成量[15]。
与BMSCs-PRF复合物相比,单纯使用PRF组的成骨效果略差;BMSCs组缺乏由PRF形成的细胞外基质,使其植入的BMSCs失去依托,影响新骨形成的微环境,不能形成优势成骨细胞群,而使生长能力强的成纤维细胞入侵骨缺损修复区,形成纤维结缔组织,阻碍新骨的形成[17]。空白组(D组)中缺乏细胞因子及具有定向分化能力的BMSCs,骨缺损区新骨形成的量明显低于3个实验组。
综上所述,自体BMSCs复合PRF修复兔牙槽骨缺损的过程中,Notch1和Wnt3a信号分子在新骨形成区均存在表达。两者在表达顺序及调控作用上具有协同作用,共同调控BMSCs-PRF向成骨细胞的增殖与分化。在此过程中,两者表达相似,两条通路可能存在串话。
[参考文献]
[1] 于博涵, 邓春富, 赵宝红, 等. 前牙区拔牙位点即刻保存的动物实验研究[J]. 现代口腔医学杂志, 2011, 25(2):111-114. Yu BH, Deng FC, Zhao BH, et al. Experimental study on instant site preservation techniques in fresh anterior extraction sockets[J]. J Modern Stomatol, 2011, 25(2):111-114.
[2] 施斌, 赖红昌, 陈卓凡, 等. 关于即刻种植的思考[J]. 国际口腔医学杂志, 2014, 41(3):255-261. Shi B, Lai HC, Chen ZF, et al. Thought about immediate implantation[J]. Int J Stomatol, 2014, 41(3):255-261.
[3] Canullo L, Pace F, Coelho P, et al. The influence of platform switching on the biomechanical aspects of the implantabutment system. A three dimensional finite element study [J]. Med Oral Patol Oral Cir Bucal, 2011, 16(6):e852-e856.
[4] 张文丽, 陈诚, 李淑慧, 等. BMSCs复合PRF修复牙槽骨缺损中OPG和RANKL的表达及意义[J]. 临床口腔医学杂志, 2015, 31(3):131-133. Zhang WL, Cheng C, Li SH, et al. Expression and significance of OPG and RANKL protein in repairing alveolar bone defect with bone marrowstem cells(BMSCs) compounded with platelet-rich fibrin(PRF)[J]. J Clin Stomatol, 2015, 31 (3):131-133.
[5] 张文丽, 李淑慧, 陈诚, 等. PRF复合自体骨髓间充质干细胞修复兔牙槽骨缺损的研究[J]. 口腔医学研究, 2015, 31 (4):336-339. Zhang WL, Li SH, Cheng C, et al. Study of PRF combined with autogenous bone marrow stem cells on alveolar bone defect[J]. J Oral Sci Res, 2015, 31(4):336-339.
[6] Tien AC, Rajan A, Bellen HJ. A Notch updated[J]. J Cell Biol, 2009, 184(5):621-629.
[7] Chevallier N, Anagnostou F, Zilber S, et al. Osteoblastic differentiation of human mesenchymal stem cells with platelet lysate[J]. Biomaterials, 2010, 31(2):270-278.
[8] Minear S, Leucht P, Miller S, et al. rBMP represses Wnt signaling and influences skeletal progenitor cell fate specification during bone repair[J]. J Bone Miner Res, 2010, 25 (6):1196-1207.
[9] Matsuno Y, Coelho AL, Jarai G, et al. Notch signaling mediates TGF-β1-induced epithelial-mesenchymal transition through the induction of Snai1[J]. Int J Biochem Cell Biol, 2012, 44(5):776-789.
[10] 王亚茜, 周诺. Notch信号通道在间充质干细胞诱导分化中的作用[J]. 广东医学, 2015, 36(4):638-640. Wang YQ, Zhou N. The role of notch signaling during the differentiation of mesenchymal stem cells[J]. Guangdong Med J, 2015, 36(4):638-640.
[11] Fortini ME. Gamma-secretase-mediated proteolysis in cellsurface-receptor signalling[J]. Nat Rev Mol Cell Biol, 2002, 3(9):673-684.
[12] Katoh M, Katoh M. WNT signaling pathway and stem cell signaling network[J]. Clin Cancer Res, 2007, 13(14):4042-4045.
[13] 牛萍, 赵月强, 罗定安, 等. Notch信号在骨髓间充质干细胞分化为成骨细胞过程中的表达[J]. 中国美容整形外科杂志, 2012, 23(10):631-634. Niu P, Zhao YQ, Luo DA, et al. The expression of Notch signaling protein in the differentiation of bone mesenchymal stem cells into osteoblasts[J]. Chin J Aesth Plast Surg, 2012, 23(10):631-634.
[14] Choi YH, Kurtz A, Stamm C. Mesenchymal stem cells for cardiac cell therapy[J]. Hum Gene Ther, 2011, 22(1):3-17.
[15] 郭天奇, 周延民, 赵静辉, 等. 富血小板血纤蛋白与其他生物材料联合用于牙周组织修复[J]. 国际口腔医学杂志, 2015, 42(2):231-236. Guo TQ, Zhou YM, Zhao JH, et al. Platelet-rich fibrin and other biological materials used jointly for periodontal tissue repair[J]. Int J Stomatol, 2015, 42(2):231-236.
[16] 李艳秋, 周延民, 孙晓琳, 等. 富血小板纤维蛋白体外释放TGF-β和PDGF-AB影响因素的探讨[J]. 现代口腔医学杂志, 2012, 26(6):404-407. Li YQ, Zhou YM, Sun XL, et al. Investigation of effect factors of TGF-β and PDGF-AB levels in platelet -rich fibrin releasing in vitro[J]. J Modern Stomatol, 2012, 26(6):404-407.
[17] Moutsatsos IK, Turgeman G, Zhou S, et al. Exogenously regulated stem cell-mediated gene therapy for bone regeneration[J]. Mol Ther, 2001, 3(4):449-461.
(本文采编 王晴)
[中图分类号]R 782
[文献标志码]A [doi] 10.7518/hxkq.2016.02.005
[收稿日期]2015-10-30; [修回日期] 2015-12-21
[基金项目]国家自然科学基金(81460103);新疆维吾尔自治区青年科学基金(2013211B53)
[作者简介]周春梅,硕士,E-mail:zcm420@126.com
[通信作者]尼加提·吐尔逊,副主任医师,硕士,E-mail:kqnijate@ 126.com
The expressions of the Notch and Wnt signaling pathways and their significance in the repair process of alveolar bone defects in rabbits with bone marrow stem cells compounded with platelet-rich fibrin
Zhou Chunmei, Li Shuhui, Wen- qiguli·Naikuli, Yu Li, Yuan Ping, Zhao Lu, Wu Peiling, Nijiati·Tuerxun. (Dept. of Stomatology, The Second Affiliated Hospital of Xinjiang Medical University,Urumqi 830063, China)
Supported by: Natural Science Foundation of China (81460103); Youth Science Foundation of Xinjiang Uygur Autonomous Region (2013211B53). Correspondence: Nijiati·Tuerxun, E-mail: kqnijate@126.com.
[Abstract]Objective We explored the expressions of the Notch and Wnt signaling pathways and their significance in the repair process of alveolar bone defects by establishing animal models with a composite of autologous bone marrow mesenchymal stem cells (BMSCs) and platelet-rich fibrin (PRF) to repair bone defects in the extraction sockets of rabbits. Methods A total of 36 two-month-old male New Zealand white rabbits were randomly divided into four groups, and the left mandibular incisors of all the rabbits were subjected to minimally invasive removalunder general anesthesia. BMSC-PRF compounds, single PRF, and single BMSC were implanted in Groups A, B, and C. No material was implanted in Group D (blank control). The animals were sacrificed at 4, 8 and 12 weeks after surgery, the bone defect was immediately drawn, and the bone specimens underwent surgery after four, eight, and twelve weeks, with three rabbits per time point. The expressions of Notch1 and Wnt3a in the repair process of the bone defect were measured via immunohistochemical and immunofluorescence detection. Results Immunohistochemistry showed that the expressions of Notch1 and Wnt3a in Groups A, B, and C were higher than that in Group D at the fourth and eighth week after operation (P<0.05). By contrast, the expressions of Notch1 and Wnt3a in Group D were higher than those in Groups A, B, and C at the twelfth week (P< 0.05). Immunofluorescence showed that the expressions of both Notch1 and Wnt3a reached their peaks in the new bone cells of the bone defect after four weeks following surgery and gradually disappeared when the bone was repaired com-pletely. Conclusion Notch1 and Wnt3a signaling molecules are expressed in the process of repairing bone defects using BMSC-PRF composites and can accelerate the healing by regulating the proliferation and differentiation of BMSCs. Moreover, the expressions of Notch and Wnt are similar, and a crosstalk between them may exist.
[Key words]Notch1; Wnt3a; alveolar bone defect; bone marrow stem cells; platelet-rich fibrin

