口腔扁平苔藓患者血清中白细胞介素-12和白细胞介素-27表达与免疫功能的相关性
黄韵颖 周塑 蔡扬贵州医科大学附属医院口腔内科,贵阳 550004
·临床研究·
口腔扁平苔藓患者血清中白细胞介素-12和白细胞介素-27表达与免疫功能的相关性
黄韵颖 周塑 蔡扬
贵州医科大学附属医院口腔内科,贵阳 550004
[摘要]目的 了解口腔扁平苔藓(OLP)患者血清中白细胞介素(IL)-12和IL-27的表达与患者免疫功能状况的相关性,探讨IL-12和IL-27在OLP免疫发病机制中的作用及意义。方法 选取对照组健康者20例和OLP组患者30例(其中网纹型15例,糜烂型15例),通过流式细胞术分析OLP患者外周血淋巴细胞亚群CD3+、CD4+、CD8+、CD19+、CD16+56[自然杀伤细胞(NK)]的表达情况,散射比浊法检测患者体液免疫指标免疫球蛋白(Ig)G、IgA、IgM、C3、C4的表达情况。采用酶联免疫吸附试验(ELISA)方法检测血清中IL-12和IL-27的表达水平,分析IL-12和IL-27的表达与OLP患者免疫功能状况及临床特征的相关性。结果 与实验室标准值相比,OLP患者细胞免疫中CD3+、CD4+、CD8+水平降低,CD19+水平增高(P<0.05);体液免疫中IgM水平增高,C4水平降低(P<0.05)。OLP患者血清中IL-12与IL-27表达水平均高于对照组(P<0.05)。同时相关分析显示,OLP患者血清中IL-12和IL-27的表达水平呈正相关关系(r=0.912,P<0.01)。但是IL-12及IL-27表达水平与OLP体征计分、病程计分等临床特征无相关性(P>0.05)。OLP患者中IL-12和IL-27的表达与CD16+56(NK)存在负相关关系(r1=-0.416,P1=0.022;r2=-0.392,P2=0.032),与IgG存在正相关关系(r1=0.445,P1=0.014;r2=0.549,P2=0.002)。结论 OLP患者主要以细胞免疫功能低下为主,同时伴有一定程度的体液免疫功能的紊乱。IL-12和IL-27的异常高表达可能协同引起且促进了OLP的炎症发生发展,并且通过机体代偿性负反馈作用参与了对炎症性免疫应答的调节,在OLP的发病机制中起到了一定作用。
[关键词]口腔扁平苔藓; 白细胞介素-12; 白细胞介素-27; 免疫; 酶联免疫吸附试验
口腔扁平苔藓(oral lichen planus,OLP)是一种较常见、好发于口腔黏膜的慢性炎症性非感染性疾病,其发病机制复杂,大量研究[1]已证实T细胞介导的细胞免疫反应在其免疫发病机制中起着重要作用。机体在受到大量抗原刺激后会分泌促炎细胞因子白细胞介素(interleukin,IL)-12和IL-27,它们不仅参与机体的细胞免疫应答[2-3],还会引起机体的炎症反应。
本研究拟通过检测OLP患者血清中IL-12和IL-27的表达水平,分析其与患者免疫功能状况的相关性,初步探讨IL-12和IL-27在OLP免疫发病机制中的作用及意义。
1 材料和方法
1.1 研究对象
选择2012年6月—2014年4月就诊于贵州医科大学附属医院口腔内科的初诊患者30名,其中男性11名,女性19名,年龄22~72岁。病例经临床和病理确诊为OLP(诊断标准及分型标准见参考文献[4]),所有患者均不伴有皮损,无系统性疾病及免疫性疾病,近3个月内未接受任何局部或全身的免疫制剂治疗;其中网纹型(包括网状型、条纹型、斑块型以及丘疹型等)15例,糜烂型(包括红斑型、萎缩型)l5例。20例对照组健康人来自贵州医科大学附属医院体检中心。
本研究经贵州医科大学附属医院伦理学委员会审核批准,所有纳入研究对象在研究前均知情同意。实验组和对照组的年龄、性别差异均无统计学意义(P>0.05)。
对患者临床症状及病损体征分别评分[5-6]。由同一检查者在患者初诊时观察并记录损害部位和最大范围(最大直径×最小直径),如有多处相同类型的损害,则累计计算。1)0分:无病损,正常黏膜;2)1分:轻微白色条纹,无充血、萎缩或糜烂面;3)2分:白色条纹伴充血或萎缩面小于1 cm2;4)3分:白色条纹伴充血或萎缩面大于1 cm2;5)4分:白色条纹伴糜烂面小于1 cm2;6)5分:白色条纹伴糜烂面大于1 cm2。采用视觉模拟评分法(visual analogue scale,VAS)记录患者的疼痛程度,评分标准如下。1)0分:无疼痛;2)1~3分:有轻微的疼痛,能忍受;3)4~6分:患者中度疼痛并影响睡眠,但尚能忍受;4)7~10分:患者有渐强烈的疼痛,疼痛难忍,影响食欲,影响睡眠;让患者根据自我感觉进行评分。
1.2 主要仪器和试剂
恒温水浴箱(天津市泰斯特仪器有限公司),Model 680酶标仪(BIO-RAD公司,美国),超低温冰箱(合肥中科美菱低温科技责任有限公司),酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)试剂盒(上海研辉生物科技有限公司),流式细胞仪、6色TBNK检测试剂盒(BD公司,美国),特定蛋白分析系统(Beckman Coulter公司,美国),免疫球蛋白(immunoglobulin,Ig)G/M/A检测试剂盒、补体C3/C4检测试剂盒(贝克曼库尔特实验系统苏州有限公司)。
1.3 标本采集及方法
采集患者清晨9点以前空腹外周静脉血,对照组健康人则在体检时空腹抽取,3 000 r·min-1离心10 min后取血清,贮存于-80 ℃冰箱,按照ELISA试剂盒说明书进行集中测定,利用酶标仪读取450 nm吸光度值,根据绘制的标准曲线计算待测血清IL-12和IL-27的浓度。流式细胞术检测患者细胞免疫指标,包括CD3+、CD4+、CD8+、CD19+、CD16+56[自然杀伤细胞(natural killer cell,NK)];散射比浊法检测患者体液免疫指标,包括IgG、IgA、IgM、C3、C4。该操作分别由贵州医科大学附属医院中心实验室及微生物免疫实验室完成,并以实验室标准值为正常对照。
1.4 统计学处理
所有实验数据均采用SPSS 16.0统计学软件进行分析。组间采用两独立样本t检验和秩和检验;各因素间相关性分析采用Spearman相关分析。P<0.05认为差异具有统计学意义。
2 结果
2.1 OLP患者相关免疫检测结果
2.1.1 OLP患者细胞免疫检测结果 采用流式细胞术对30例OLP患者的细胞亚群免疫进行检测,OLP患者CD3+、CD4+、CD8+低于实验室标准值,CD19+高于实验室标准值,差异有统计学意义(P<0.05)(表1)。
表 1 OLP患者细胞免疫检测结果Tab 1 Cellular immune test results in patients with OLP %,±s

表 1 OLP患者细胞免疫检测结果Tab 1 Cellular immune test results in patients with OLP %,±s
注:*与实验室标准值比较P<0.05。
组别 CD3+ CD4+ CD8+ CD19+ CD16+56(NK)实验室标准值 70.85±8.81 38.46±8.16 30.40±7.91 9.42±4.30 22.37±11.17 OLP组 63.17±9.96* 33.59±7.88* 26.14±8.73* 10.98±3.63* 20.30±8.46
2.1.2 OLP患者体液免疫检测结果 采用散射比浊法对30例OLP患者进行体液免疫检测,OLP患者IgM高于实验室标准值,C4低于实验室标准值,差异有统计学意义(P<0.05)(表2)。
表 2 OLP患者体液免疫检测结果Tab 2 Humoral immune test results in patients with OLP mg·L-1,±s

表 2 OLP患者体液免疫检测结果Tab 2 Humoral immune test results in patients with OLP mg·L-1,±s
注:*与实验室标准值比较P<0.05。
组别 IgG IgA IgM C3 C4实验室标准值 12 870±1 909 2 350±480 1 080±339 1 140±381 250±212 OLP组 14 203±4 882 3 133±5 484 1 565±722* 1 081±208 222±45*
2.2 OLP患者外周血中IL-12和IL-27的表达水平
采用ELISA方法对20例对照组健康人和30例OLP组患者血清中IL-12和IL-27进行检测,经秩和检验结果显示,OLP患者血清中IL-12和IL-27的表达水平与对照组相比表达均升高,差异具有统计学意义(P<0.05)(表3,图1)。相关分析显示,OLP患者血清中IL-12和IL-27的表达水平呈正相关关系,差异具有统计学意义(r=0.912,P<0.01)。但IL-12 和IL-27表达水平与OLP体征计分(r1=-0.100,P1= 0.598;r2=-0.036,P2=0.852)、病程计分(r1=-0.181,P1=0.338;r2=-0.060,P2=0.754)等临床特征没有相关性。
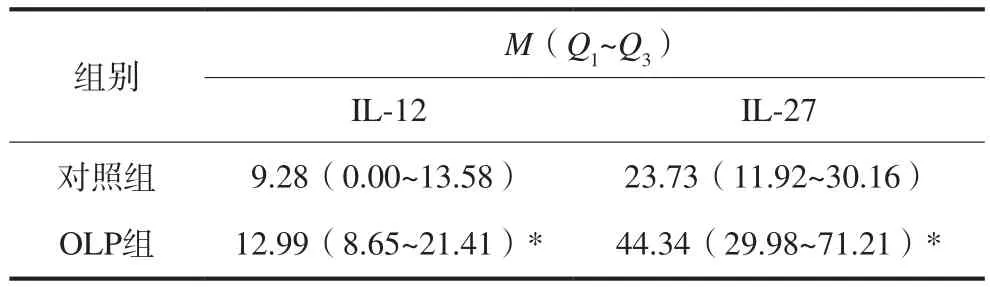
表 3 OLP患者和对照组健康人血清中IL-12和IL-27的表达水平Tab 3 Serum level of IL-12 and IL-27 in OLP patients and normal controls pg·mL-1

图 1 IL-12和IL-27在对照组健康人和OLP患者血清中的表达Fig 1 Serum levels of IL-12 and IL-27 in OLP patients and normal controls
2.3 OLP患者血清中IL-12和IL-27的表达水平与免疫相关性分析
采用Spearman相关分析法分析OLP外周血中IL-12和IL-27的表达与免疫功能指标的相关性,实验结果见表4。由表4可见,OLP患者IL-12和IL-27的表达水平与CD16+56(NK)存在负相关关系(r1=-0.416,P1=0.022;r2=-0.392,P2=0.032),与IgG存在正相关关系(r1=0.445,P1=0.014;r2=0.549,P2=0.002),均有统计学意义。
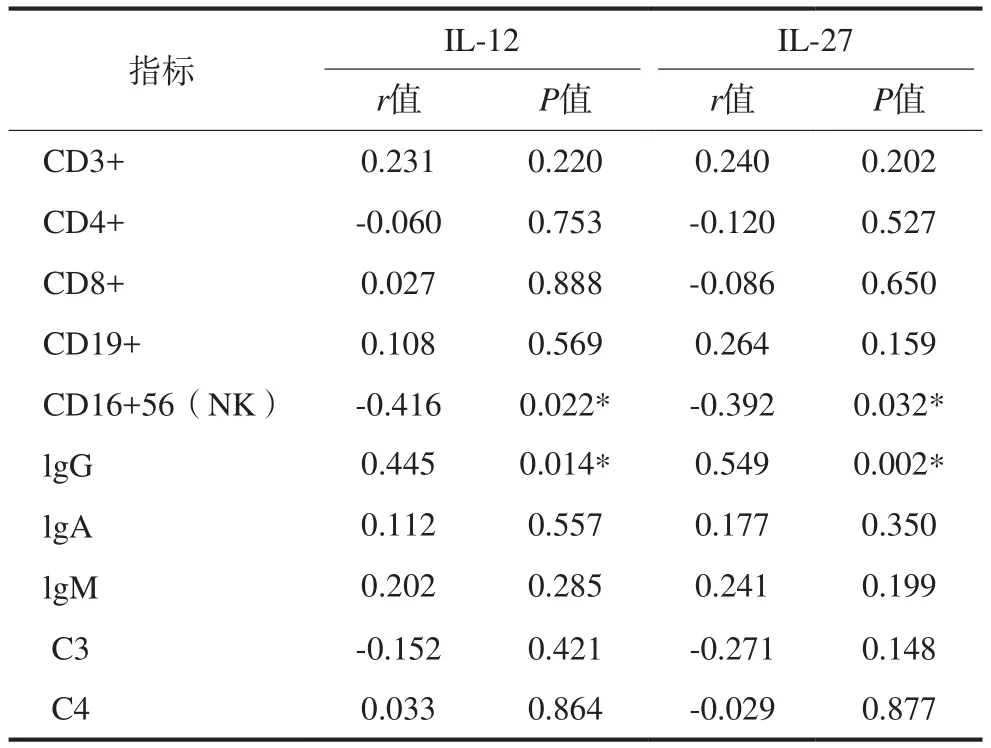
表 4 OLP患者血清中IL-12和IL-27的表达与免疫相关性分析Tab 4 The correlate analysis between the expression of IL-12, IL-27 and the immune system
3 讨论
OLP是一种比较常见的口腔黏膜病,研究[1]表明T淋巴细胞介导的免疫反应在其发病过程中起着重要的作用。在适应性免疫应答过程中,细胞免疫和体液免疫之间相互调节,保持机体内环境的相对稳定[7]。
本研究细胞免疫检测结果可见,OLP患者CD3+、CD4+、CD8+均明显低于实验室标准值(P<0.05)。NK作为一类可以反映T细胞功能的重要淋巴细胞,其数量的减少会导致机体的细胞免疫功能下降[8],本研究同时发现NK细胞低于实验室标准值,但差异无统计学意义(P>0.05)。以上结果均提示OLP患者处于细胞免疫功能低下的状态,这与目前的其他研究[1,9-12]结果一致。
CD19+的表达代表B细胞水平,主要是通过抗原刺激B细胞合成和分泌Ig来介导机体的体液免疫,IgG作为应答的主要抗体,集中参与了机体免疫稳态的建立与维护[13]。C3、C4是补体系统中含量最多、最重要的一个组分。本研究中,相较于实验室标准值,OLP患者CD19+、IgM均升高,C4降低,差异有统计学意义(P<0.05)。由于机体处于炎症期,推测C4通过经典途径或旁路途径激活抗原抗体免疫复合物而使得补体成分被消耗[14]。提示机体体液免疫功能出现紊乱或亢进[7]。
机体中的病原体在受到大量抗原持续刺激后,转变为抗原递呈细胞(antigen presenting cell,APC),APC可同时分泌IL-12和IL-27,刺激产生多种细胞因子,从而引起机体的炎症反应。且IL-27与IL-12同源,两者的受体均存在于CD4+T细胞表面[15],所以二者可以协同诱导T细胞的分化,参与机体的细胞免疫应答[2]。本实验研究结果显示,OLP组患者血清中IL-12和IL-27的表达水平均显著高于对照组,相关性分析显示,IL-12与IL-27的表达呈正相关。由于OLP主要表现为一个慢性炎症的过程,推测IL-12可能在OLP的发病机制中协同IL-27引起且促进机体炎症的发生发展。
IL-12是已知的最强激活NK细胞生物学活性的细胞因子,在机体早期的非特异性免疫和随后的抗原特异性免疫过程中发挥相应的作用;IL-12能促进NK细胞生成干扰素γ(interferon-gamma,IFN-γ),同时IL-27也能促进NK细胞的增殖,IL-12和IL-27在体内持续高表达,则会超过机体的固有免疫应答,推测二者协同使NK细胞产生INF-γ的作用也是其促进及加重免疫炎症发生的机制之一[16]。上述免疫结果已经显示,OLP组IL-12和IL-27的高表达与OLP细胞免疫中NK细胞呈负相关关系,与体液免疫中IgG呈正相关关系(P<0.05)。即在OLP细胞免疫中NK细胞减少,相应的分泌IFN-γ也降低,提示OLP患者处于细胞免疫功能低下状态。但是CD19+细胞、IgG增高,在特异性免疫应答过程中,推测其可能正向通过刺激B细胞的分泌来增加Ig含量从而调节机体的体液免疫,负向调节细胞免疫,通过负反馈调节的方式代偿性增强机体的保护能力[7]。同时IL-27能够限制过度的T细胞免疫应答强度[3],由此推测IL-27的高表达也可能同时通过负反馈的方式增进体液免疫应答,从而导致机体出现体液免疫功能亢进或紊乱。本研究结果中IL-12和IL-27的表达水平与OLP临床特征均无相关性(P>0.05),提示IL-12和IL-27的表达在不同临床类型的OLP中可能是共同的免疫发病因素。
综上所述,IL-12和IL-27的高表达引起且共同促进了OLP的炎症发生发展,同时IL-12和IL-27的异常高表达通过抑制OLP的细胞免疫,同时诱发OLP的体液免疫紊乱,在OLP中参与了机体对炎症性免疫应答的调节作用,IL-12和IL-27的表达水平在一定程度上也可以反映出OLP患者机体的免疫功能状况,但是具体的调节机制尚需要进一步的研究阐述。
[参考文献]
[1] Tarasenko SV, Shatokhin AI, Umbetova KT, et al. T-cells immunity in oral lichen planus pathogenesis[J]. Stomatologiia: Mosk, 2014, 93(1):60-63.
[2] Vignali DA, Kuchroo VK. IL-12 family cytokines: immunological playmakers[J]. Nat Immunol, 2012, 13(8):722-728.
[3] Iwasaki Y, Fujio K, Okamura T, et al. Interleukin-27 in T cell immunity[J]. Int J Mol Sci, 2015, 16(2):2851-2863.
[4] 陈谦明. 口腔黏膜病学[M]. 4版. 北京: 人民卫生出版社, 2012:105-107.Chen QM. Oral medicine[M]. 4th ed. Beijing: People’s Medical Publishing House, 2012:105-107.
[5] 中华口腔医学会口腔黏膜病专业委员会. 口腔扁平苔藓(萎缩型、糜烂型)疗效评价标准(试行)[J]. 中华口腔医学杂志, 2005, 40(2):92-93. Chinese Stomatological Association Professional Committee of Oral Mucosa Disease. The standard of the therapeutic effect evaluation in oral lichen planus (atrophy type, erosive type)(trial)[J]. Chin J Stomatol, 2005, 40(2):92-93.
[6] 尚书, 唐国瑶. 口腔扁平苔藓疗效评价体系的标准化问题[J]. 临床口腔医学杂志, 2006, 22(9):570-571. Shang S, Tang GY. The standardized question of the therapeutic effect evaluation system in oral lichen planus[J]. Clin J Stomatol, 2006, 22(9):570-571.
[7] 金伯泉. 医学免疫学[M]. 5版. 北京: 人民卫生出版社, 2010:162. Jin BQ. Medical immunology[M]. 5th ed. Beijing: People’s Medical Publishing House, 2010:162.
[8] Moretta L, Montaldo E, Vacca P, et al. Human natural killer cells: origin, receptors, function, and clinical applications [J]. Int Arch Allergy Immunol, 2014, 164(4):253-264.
[9] Ding M, Zeng J, Sroussi H, et al. Interactions between Golli-MBP and Th1/Th2 cytokines in patients with oral lichen planus[J]. Oral Dis, 2014, 20(2):205-211.
[10] Liu WZ, He MJ, Long L, et al. Interferon-γ and interleukin-4 detected in serum and saliva from patients with oral lichen planus[J]. Int J Oral Sci, 2014, 6(1):22-26.
[11] 周刚, 樊明文, 刘君炎. 糖皮质激素对口腔扁平苔藓辅助性T细胞平衡的影响[J]. 中华口腔医学杂志, 2005, 40(2): 98-101. Zhou G, Fan MW, Liu JY. Effects of glucocorticoids on T helper cells balance in oral lichen planus[J]. Chin J Stomatol, 2005, 40(2):98-101.
[12] 刘雅菁, 王文梅. 口腔扁平苔藓中T淋巴细胞亚群的研究进展[J]. 国际口腔医学杂志, 2011, 38(4):433-435. Liu YJ, Wang WM. Research progress on T lymphocyte subsets of oral lichen planus[J]. Int J Stomatol, 2011, 38(4): 433-435.
[13] Böhm S, Kao D, Nimmerjahn F. Sweet and sour: the role of glycosylation for the anti-inflammatory activity of immunoglobulin G[J]. Curr Top Microbiol Immunol, 2014, 382:393-417.
[14] 徐红先, 罗贵有, 何林, 等. 抗核小体抗体、免疫球蛋白及补体与系统性红斑狼疮活动性的相关性研究[J]. 实用医学杂志, 2005, 21(9):932-933. Xu HX, Luo GY, He L, et al. The correlation research between the antibody of nucleosome, immunoglobulin and complement with systemic lupus erythematosus activities [J]. J Pract Med, 2005, 21(9):932-933.
[15] Gafa V, Lande R, Gagliardi MC, et al. Human dendritic cells following Aspergillus fumigatus infection express the CCR7 receptor and a differential pattern of interleukin-12 (IL-12), IL-23, and IL-27 cytokines, which lead to a Th1 response [J]. Infect Immun, 2006, 74(3):1480-1489.
[16] Zwirner NW, Domaica CI. Cytokine regulation of natural killer cell effector functions[J]. Biofactors, 2010, 36(4):274-288.
(本文编辑 杜冰)
[中图分类号]R 781.5
[文献标志码]A [doi] 10.7518/hxkq.2016.02.007
[收稿日期]2015-07-21; [修回日期] 2016-01-18
[基金项目]国家自然科学基金(81460104)
[作者简介]黄韵颖,硕士,E-mail:305014272@qq.com
[通信作者]蔡扬,教授,博士,E-mail:caiyang85@163.com
Expression of interleukin-12 and interleukin-27 proteins and immune status in serum of patients with oral lichen planus
Huang Yunying, Zhou Su, Cai Yang. (Dept. of Stomatology, The Affiliated Hospital of Guizhou Medical University, Guiyang 550004, China)
Supported by: Natural Science Foundation of China (81460104). Correspondence: Cai Yang, E-mail: caiyang85@163.com.
[Abstract]Objective This study aimed to conduct a preliminary study on the possible role and significance of interleukin (IL)-12 and IL-27 in the pathogeneses of oral lichen planus (OLP). Methods Thirty cases of patients with OLP (fifteen cases of reticular OLP and fifteen cases of erosive OLP) were enrolled in this study, and twenty cases of healthy people served as controls. Lymphocyte subsets CD3+, CD4+, CD8+, CD19+, and CD16+56[natural killer cell (NK)] were tested using flow cytometry, and humoral immunity [immunoglobulin (Ig)G, IgA, IgM, C3, C4] were examined using nephelometry assays. IL-12 and IL-27 contents in serum of patients with OLP and normal controls were detected through enzyme linked immunosorbent assay. The correlations between the levels of IL-12, IL-27, immune status, and clinical characteristics of patients with OLP were analyzed, respectively. Results CD3+, CD4+, and CD8+in patients with OLP were markedly lower than the normal value, whereas CD19+of OLP in patients was significantly higher than the normal value (P<0.05). IgM in patients with OLP was increased, whereas C4 was declined (P<0.05). IL-12 and IL-27 levels showed significant upregulation of OLP patients compared with control groups (P<0.05). Meanwhile, positive correlations existed between IL-12 and IL-27 levels in the serum of patients with OLP (r=0.912, P<0.01). No significant correlations of IL-12 and IL-27 expressions with clinical characteristics of OLP were found (P>0.05). Negative correlations of IL-12 and IL-27 levels with CD16+56(NK) cells were observed (r1=-0.416, P1=0.022; r2=-0.392, P2=0.032, respectively), whereas a positive correlation existed for IgG (r1=0.445, P1=0.014; r2=0.549, P2=0.002, respectively). Conclusion A cellular immune dysfunction mainly dominate in patients with OLP, accompanied by some degree of humoral-immunity-function disorder. The abnormally high expressions of IL-12 and IL-27 are possibly synergized and promoted inflammation development in OLP. Its promotion takes place through the negative feedback regulation of humoral immune responses, which are involved in the regulation of immune mechanisms of OLP.
[Key words]oral lichen planus; interleukin-12; interleukin-27; immune; enzyme linked immunosorbent assay

