不同频率微振动对血管内皮细胞生长因子表达及通透性的影响
朱卓立 马瑞阳 杨扬 甘雪琦口腔疾病研究国家重点实验室 华西口腔医院修复科(四川大学),成都 610041
不同频率微振动对血管内皮细胞生长因子表达及通透性的影响
朱卓立 马瑞阳 杨扬 甘雪琦
口腔疾病研究国家重点实验室 华西口腔医院修复科(四川大学),成都 610041
[摘要]目的 研究微振动对血管内皮细胞分泌血管内皮细胞生长因子(VEGF)及通透性的影响。方法 培养人脐静脉血管内皮细胞(HUVEC),每日施加0.2、0.5、2、5 Hz 4种低频率微振动30 min,通过Tagman探针实时荧光定量聚合酶链反应(PCR)及蛋白质印迹法检测VEGF的表达,并检测内皮细胞的通透性。结果 加载0.2 Hz和0.5 Hz微振动可使血管内皮细胞VEGF mRNA及蛋白表达上调(P<0.05),加载2 Hz和5 Hz振动后VEGF mRNA及蛋白表达下调(P<0.01);加载0.2 Hz和0.5 Hz微振动可使血管内皮细胞通透性增强(P<0.01),2 Hz和5 Hz微振动则使内皮细胞通透性降低(P<0.01)。结论 0.2~0.5 Hz的微振动可使血管内皮细胞分泌VEGF增高,并提高血管内皮细胞的通透性。
[关键词]低频微振动; 内皮细胞; 血管内皮细胞生长因子; 通透性
近年来,骨组织工程技术成为骨缺损修复的研究重点,其过程包括血管化、骨再生、骨端融合3个基本环节,其中血管化是骨愈合过程中最基本的环节,它能将参与骨发生与修复的相关细胞、信号分子、营养物质携带入微环境并带走新陈代谢废物及坏死分解产物以维持局部动态微环境。目前,组织工程骨血管化的主要方法包括利用血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)、血管生成素(angiopoietin,Ang)等与生物材料复合促进血管生长,但因其在体内迅速降解,故很难达到理想的效应浓度[1]。因此,如何促进促血管生长因子的浓度增长成为增强骨缺损修复血管化的新的突破点。既往的实验结果表明,低幅度的高频振动能有效促进血管内皮细胞的增殖能力[2]。因此本研究拟在细胞水平研究高频率低强度的微振动对血管内皮细胞VEGF表达及通透性的影响,以期为微振动在骨组织工程血管化的应用提供分子生物学基础。
1 材料和方法
1.1 主要材料和仪器
人脐静脉血管内皮细胞(human umbilical vein endothelial cell,HUVEC)(美国标准生物品收藏中心提供),低糖培养基(L-glutamine dulbecco’s modified eagle medium,L-DMEM)(Gibco公司,美国),胎牛血清(fetal bovine serum,FBS)(Hyclone公司,美国),倒置相差显微镜(Olympus公司,日本),GJX-5型振动传感器校准仪(北京森德格科技有限公司)。
校准仪可用于校准加速度传感器、速度传感器及涡流位移传感器,并可在垂直、水平两个方向测量,它包括正弦信号源、功率放大器、振动台体、内部基准加速度传感器及测量和显示的电路。
1.2 细胞培养与传代
将HUVEC接种于25 mL培养瓶,加入含10%FBS 的L-DMEM培养基中,于37 ℃、5%CO2、饱和湿度孵箱中培养,倒置相差显微镜观察细胞形态。当贴壁细胞达90%时,以质量分数0.25%胰蛋白酶和质量分数0.1%乙二胺四乙酸(ethylenediamine tetraacetic acid,EDTA)混合物进行消化传代培养,复苏后细胞传代培养至2~3代用于实验。将HUVEC以每毫升5×104个的密度接种于6孔板,恒温培养箱内培养48 h后置于振动仪上,分别加载0.2、0.5、2、5 Hz 4种振动频率,每日30 min,连续5 d,以正常HUVEC为对照组。
1.3 检测指标
1.3.1 Tagman探针实时荧光定量聚合酶链反应(polymerase chain reaction,PCR)检测VEGF mRNA的表达 微振动处理后,静置1 h,加入1 mL Trizol试剂于每个6孔板孔中,反复吹打,常温放置5 min。加入200 μL氯仿,剧烈振荡15 s至乳胶状,室温放置15 min,4 ℃下12 000 r·min-1离心10 min。取上层水相于另一个EP管中,加入500 μL异丙醇,混合均匀,4 ℃放置10 min, 4 ℃下12 000 r·min-1离心10 min。移去上清液,加入1 mL用0.1%焦碳酸二乙酯(diethyl pyrocarbonate,DEPC)水配制的预冷的75%乙醇,混匀。4 ℃下7 500 r·min-1离心15 min,尽量去除上清液,RNA沉淀室温干燥12~15 min,加入25 μL DEPC水溶解RNA。而后检测RNA纯度及浓度,在260 nm和280 nm波长下检测吸光度值,若A260/A280为1.8~2.1,取RNA浓度为25~50 ng·μL-1进行下一步实验。逆转录后,通过配制Tagman探针实时荧光定量PCR检测体系,于ABI 7000荧光定量PCR仪(ABI)中进行反应,反应条件为:95 ℃ 3 min;95 ℃ 12 s,62 ℃ 40 s,40个循坏。
1.3.2 蛋白质印迹法检测VEGF的表达 微振动处理后,静置1 h再进行细胞裂解:4 ℃下12 000 r·min-1离心15 min,取上清,裂解液裂解细胞,收集裂解液至离心管中,在振荡器上混匀4~15 min,4 ℃下14 000 r·min-1离心15 min,弃沉淀,取上清备用。电泳分离:取15 μL上清液至10 cm×10 cm胶上电泳,转至聚偏二氟乙烯膜,5%脱脂牛奶室温封闭1 h,1∶1 000加入VEGF抗体,再加入羊抗兔二抗,37 ℃孵育45 min,缓冲液洗涤30 min,每10 min换液1次。在暗室中压片,显影、定影后进行图像分析。
1.3.3 内皮细胞通透性的检测 将HUVEC接种到24孔带滤网培养板上层小室中,培养使细胞铺满滤网表面后,施加微振动处理,而后培养基换为无酚红DMEM,在上层小室中加入FITC-dextran(相对分子质量为70 000)(2.5 μmol·L-1)。2 h后,移去滤网,下层培养板中的荧光量在494 nm激发光和521 nm发射光处定量测量。
2 结果
2.1 细胞形态学观察
培养的HUVEC具有典型的血管内皮细胞形态,体积较小,紧密排列在一起,呈铺路石样。细胞经传代培养后,细胞形态无明显变化。
2.2 施加微振动对VEGF表达的影响
不同振动频率下VEGF mRNA和蛋白表达情况见图1、2。由图1、2可见,在连续培养5 d后,施加0.2 Hz和0.5 Hz微振动的HUVEC较对照组明显上调了VEGF mRNA及蛋白质的表达(P<0.05),而施加2 Hz和5 Hz微振动可使VEGF mRNA及蛋白表达下调(P<0.01)。0.2 Hz与0.5 Hz微振动组相比,2 Hz 与5 Hz微振动组相比,差异均无统计学意义。
2.3 内皮细胞通透性
不同振动频率对内皮细胞通透性的影响见图3。由图3可见,施加0.2 Hz和0.5 Hz微振动的血管内皮细胞,其细胞通透性明显高于对照组(P<0.01),而施加2 Hz和5 Hz微振动的血管内皮细胞通透性则低于对照组(P<0.01)。0.2 Hz与0.5 Hz微振动组相比,2 Hz与5 Hz微振动组相比,差异均无统计学意义。
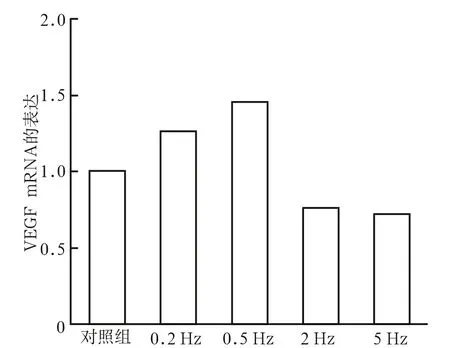
图 1 不同振动频率下VEGF mRNA的表达 Fig 1 The expression of VEGF mRNA under different frequency of microvibration
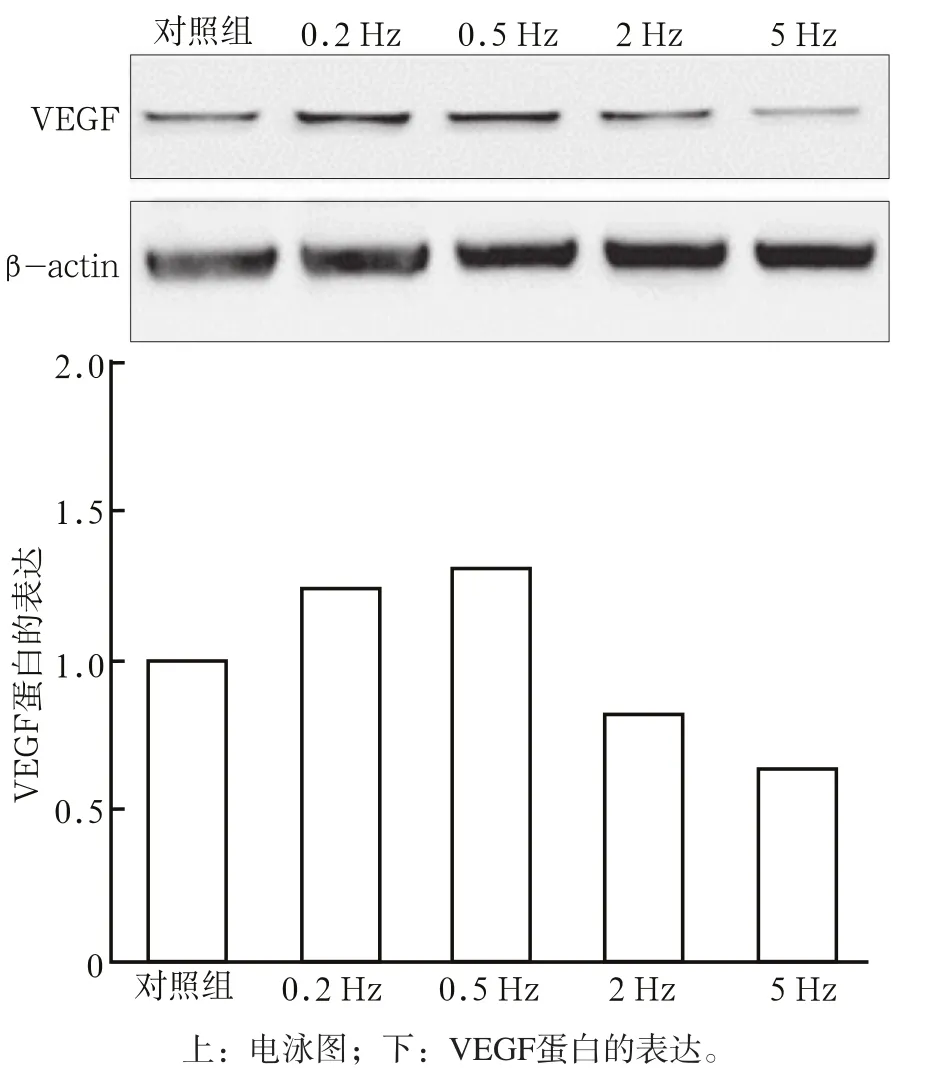
图 2 不同振动频率下VEGF蛋白的表达 Fig 2 The expression of VEGF protein under different frequency of microvibration
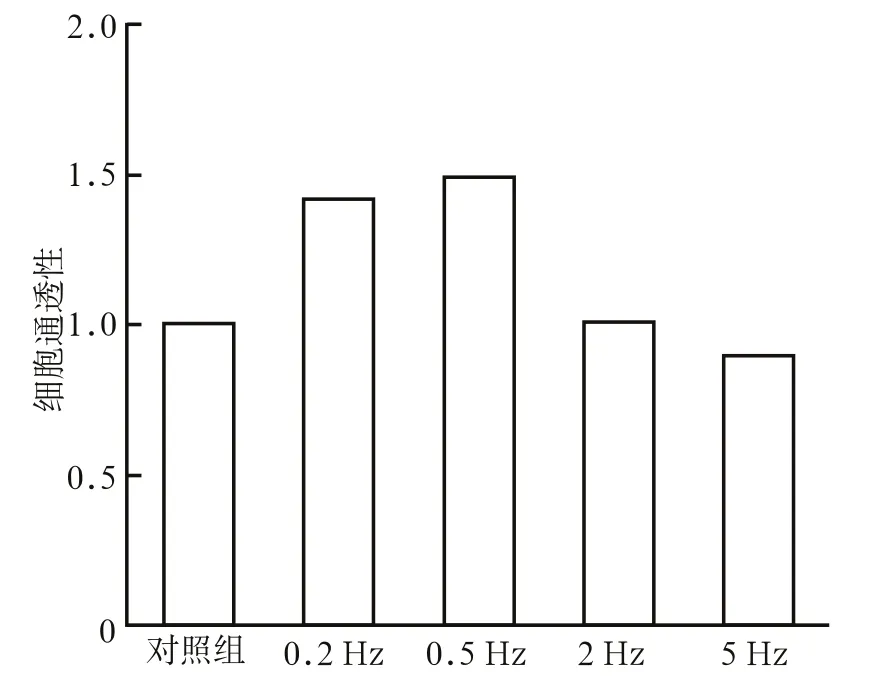
图 3 不同振动频率对内皮细胞通透性的影响 Fig 3 The permeability of endothelial cells under different frequency of microvibration
3 讨论
骨组织工程血管化是近年来的研究热点,内皮细胞是影响骨缺损修复血管化的因素之一,内皮细胞的增殖、分化和迁移能促进血管的生成[3]。VEGF是作用最强的促血管生长因子,能特异性、多途径地作用于血管内皮细胞,使其增殖及毛细血管瓣生成,从而促进新生血管生成[4-5]。
微振动是一种极低幅度低强度(low-amplitude,LA≤50 μm;low-magnitude,LM<1×g)的力学信号。近年来,许多研究[6-8]表明微振动可以促进骨的愈合。
已有实验证明,在微振动对骨愈合的实验中,微振动刺激使骨折端血流量较对照组具有显著的增加[9]。实施微振动可能是通过增加VEGF表达,使毛细血管再生增加,增进了骨痂的生长,但是其在体内的确切分子生物学机理尚不清楚,且尚未有研究涉及微振动对内皮细胞VEGF表达的影响。本研究选用HUVEC作为研究对象,因其具有一般内皮细胞的性能。本研究以其为模型来研究微振动对内皮细胞VEGF的表达以及细胞通透性的影响,具有一定意义。
本实验利用Tagman探针实时荧光定量PCR高度特异性、灵敏性和精确性的特点,检测血管内皮细胞VEGF mRNA的表达,并采用蛋白质印迹法检测血管内皮细胞VEGF蛋白的表达。结果表明,微振动能调节血管内皮细胞VEGF mRNA和蛋白的表达,其中,0.2~0.5 Hz的微振动较对照组明显上调了血管内皮细胞VEGF的表达(P<0.05),说明较低频率的微振动能促进血管内皮细胞分泌VEGF,促进新生血管的生成,这可能是微振动增进骨缺损修复血管化的机制之一;而2~5 Hz的微振动较对照组明显下调了血管内皮细胞VEGF的表达(P<0.01)。
Lal等[10]的研究结果表明,VEGF通过激活蛋白激酶B(protein kinase B,PKB/akt)通路、内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)、丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)通路来增加内皮细胞通透性。值得一提的是,参与该调控过程的细胞通路与VEGF诱导血管生成和细胞存活的通路相同,但其机制还有待阐明。Gavard等[11]发现,VEGF可通过促进血管内皮钙黏蛋白β-arrestin2依赖的细胞内吞作用来调控内皮细胞通透性。本实验对血管内皮细胞通透性的检测结果表明,0.2~0.5 Hz微振动组在提高VEGF表达的同时,明显提高了血管内皮细胞通透性;而2~5 Hz微振动组表现为VEGF表达下调,同时其血管内皮细胞通透性下降。本研究揭示了微振动所致的VEGF表达改变与其所致的内皮细胞通透性改变有所关联,提示微振动可能是通过改变内皮细胞的VEGF表达量从而调控细胞的通透性,然而其具体机制还有待进一步研究。不同频率的微振动对血管内皮细胞产生不同的影响,有研究[12]表明,微振动的频率不同,骨折愈合的结果也会不相同,但其机制尚未阐明。而大量研究[13-15]表明血管内皮细胞对不同的力学信号刺激的反应不同。
综上所述,本研究显示,加载适当频率的微振动能促进血管内皮细胞VEGF的表达进而影响内皮细胞的通透性。深入了解微振动对血管内皮细胞影响的分子机制以及如何更加有效地向有利于骨缺损修复血管化的方向调节尚有待进一步研究。
[参考文献]
[1] 何悦, 张志愿. 骨组织工程技术及其在颌骨修复重建中的应用[J]. 口腔材料器械杂志, 2005, 14(2):79-82. He Y, Zhang ZY. Tissue engineered bone technique and its application in mandible defect reconstruction[J]. Chin J Dent Materials Devices, 2005, 14(2):79-82.
[2] 王晓婧, 朱卓立, 于海洋. 微振动对血管内皮细胞增殖和分化的影响[J]. 国际口腔医学杂志, 2013, 40(3):288-290. Wang XJ, Zhu ZL, Yu HY. Proliferation and differentiation of the vascular endothelial cell under microvibration[J]. Int J Stomatol, 2013, 40(3):288-290.
[3] Goveia J, Stapor P, Carmeliet P. Principles of targeting endothelial cell metabolism to treat angiogenesis and endothelial cell dysfunction in disease[J]. EMBO Mol Med, 2014, 6(9):1105-1120.
[4] Guskuma MH, Hochuli-Vieira E, Pereira FP, et al. Evaluation of the presence of VEGF, BMP2 and CBFA1 proteins in autogenous bone graft: histometric and immunohistochemical analysis[J]. J Craniomaxillofac Surg, 2014, 42(4):333-339.
[5] Binu S, Soumya SJ, Kumar VB, et al. Poly-ADP-ribosylation of vascular endothelial growth factor and its implications on angiogenesis[J]. Adv Exp Med Biol, 2012, 749:269-278.
[6] Zhou Y, Guan X, Zhu Z, et al. Osteogenic differentiation of bone marrow-derived mesenchymal stromal cells on bonederived scaffolds: effect of microvibration and role of ERK1/2 activation[J]. Eur Cell Mater, 2011, 22:12-25.
[7] Nagaraja MP, Jo H. The role of mechanical stimulation in recovery of bone loss-high versus low magnitude and frequency of force[J]. Life: Basel, 2014, 4(2):117-130.
[8] Zhou Y, Guan X, Liu T, et al. Whole body vibration improves osseointegration by up-regulating osteoblastic activity but down-regulating osteoblast-mediated osteoclastogenesis via ERK1/2 pathway[J]. Bone, 2015, 71:17-24.
[9] 乔林, 侯树勋, 李文峰, 等. 微振动对骨折端微循环及血管内皮生长因子(VEGF)表达的影响[J]. 中华创伤骨科杂志, 2005, 7(1):52-54. Qiao L, Hou SX, Li WF, et al. Effects of micromovement on microcirculation at the fracture part and expression of vascular endothelial growth factor[J]. Chin J Orthopaedic Trauma, 2005, 7(1):52-54.
[10] Lal BK, Varma S, Pappas PJ, et al. VEGF increases permeability of the endothelial cell monolayer by activation of PKB/ akt, endothelial nitric-oxide synthase, and MAP kinase pathways[J]. Microvasc Res, 2001, 62(3):252-262.
[11] Gavard J, Gutkind JS. VEGF controls endothelial-cell permeability by promoting the beta-arrestin-dependent endocytosis of VE-cadherin[J]. Nat Cell Biol, 2006, 8(11):1223-1234.
[12] 喻鑫罡, 张先龙, 曾炳芳. 骨折段低频可控微动影响骨痂矿化与力学特性的实验研究[J]. 上海交通大学学报: 医学版, 2008, 28(12):1491-1495. Yu XG, Zhang XL, Zeng BF. Experimental study on callus calcification and mechanical property of healing bone under low frequency and controlled micromovement[J]. J Shanghai Jiaotong Uni: Med Sci, 2008, 28(12):1491-1495.
[13] Kim IS, Song YM, Lee B, et al. Human mesenchymal stromal cells are mechanosensitive to vibration stimuli[J]. J Dent Res, 2012, 91(12):1135-1140.
[14] Rotenberg MY, Ruvinov E, Armoza A, et al. A multi-shear perfusion bioreactor for investigating shear stress effects in endothelial cell constructs[J]. Lab Chip, 2012, 12(15): 2696-2703.
[15] Buchanan CF, Verbridge SS, Vlachos PP, et al. Flow shear stress regulates endothelial barrier function and expression of angiogenic factors in a 3D microfluidic tumor vascular model[J]. Cell Adh Migr, 2014, 8(5):517-524.
(本文编辑 杜冰)
[中图分类号]Q 68
[文献标志码]A [doi] 10.7518/hxkq.2016.02.006
[收稿日期]2015-08-03; [修回日期] 2016-01-16
[基金项目]高等学校博士学科点专项科研基金(20120181120007)
[作者简介]朱卓立,主治医师,博士,E-mail:zzl7507@126.com
[通信作者]甘雪琦,主治医师,博士,E-mail:xueqigan@scu.edu.cn
Effects of different frequency microvibrations in the vascular endothelial growth factor expression and permeability of vascular endothelial cell
Zhu Zhuoli, Ma Ruiyang, Yang Yang, Gan Xueqi. (State Key Laboratory of Oral Diseases, Dept. of Prosthodontics, West China Hospital of Stomatology, Sichuan University, Chengdu 610041, China)
Supported by: Specialized Research Fund for The Doctoral Program of Higher Education (20120181120007). Correspondence: Gan Xueqi, E-mail: xueqigan@scu.edu.cn.
[Abstract]Objective This study aimed to evaluate the vascular endothelial growth factor (VEGF) expression and permeability of vascular endothelial cell under microvibration. Methods Human umbilical vein endothelial cell (HUVEC) were cultured, randomly vibrated under low frequency of 0.2, 0.5, 2, 5 Hz, 30 min per day. The VEGF mRNA level was detected by Tagman probe real-time fluorescence quantitative polymerase chain reaction (PCR), and the VEGF protein expression level was detected by Western blot. The permeability of vascular endothelial cell was evaluated. Results Compared with the blank control group, the mRNA and protein expression level of VEGF were significantly increased under 0.2, 0.5 Hz microvibration (P<0.05), and decreased under 2, 5 Hz microvibration (P<0.01). The vascular endothelial permeability increased under 0.2, 0.5 Hz microvibration (P<0.01), whereas the permeability decreased under 2, 5 Hz microvibration (P<0.01). Conclusion 0.2-0.5 Hz microvibration can up-regulate the expression of VEGF mRNA and protein in vascular endothelial, and increase the permeability.
[Key words]low frequency microvibration; endothelial cell; vascular endothelial growth factor; permeability

