体外RNA干扰RhoA基因对舌癌细胞侵袭的影响
陈正岗 唐永平 童磊 王莹 周元 王奇民 韩金宏 何宗轩 廖奕翔樊兵 邹荣海 张健 孙晓峰 严国鑫.青岛大学医学院附属青岛市市立医院口腔医学中心,青岛 26607;2.上海交通大学医学院附属第九人民医院口腔颌面外科,上海 2000;.潍坊医学院口腔医学院,潍坊 2602;.无锡市第二人民医院口腔科,无锡 2002
体外RNA干扰RhoA基因对舌癌细胞侵袭的影响
陈正岗1,2唐永平1童磊1王莹3周元3王奇民1韩金宏1何宗轩1廖奕翔1樊兵4邹荣海4张健4孙晓峰4严国鑫4
1.青岛大学医学院附属青岛市市立医院口腔医学中心,青岛 266071;2.上海交通大学医学院附属第九人民医院口腔颌面外科,上海 200011;3.潍坊医学院口腔医学院,潍坊 261021;4.无锡市第二人民医院口腔科,无锡 214002
[摘要]目的 应用RNA干扰技术抑制人舌癌细胞株Tca8113和SCC-4中RhoA基因的表达,探讨RhoA基因表达下调对舌癌细胞侵袭的影响。方法 登录Genbank数据库确定人RhoA基因序列,针对RhoA的基因序列设计短链RNA,利用Lipofectamine2000介导法将RhoA-siRNA转染至舌癌Tca8113和SCC-4细胞。采用实时荧光定量聚合酶链反应检测转染后的舌癌细胞中RhoA mRNA的表达,蛋白质印迹法检测RhoA、半乳糖凝集素-3(galectin-3)和基质金属蛋白酶-9(MMP-9)蛋白的表达,Transwell小室检测细胞的侵袭能力。结果 舌癌细胞转染RhoA-siRNA后,RhoA的基因和蛋白表达下降,galectin-3和MMP-9蛋白表达下降,细胞体外侵袭能力降低。结论 RhoA-siRNA可以有效地抑制舌癌Tca8113和SCC-4细胞中RhoA的表达,通过降低galectin-3和MMP-9的表达从而降低细胞的侵袭能力。RhoA在舌癌的侵袭和转移中可能发挥重要的作用。
[关键词]RhoA基因; 半乳糖凝集素-3; 基质金属蛋白酶-9; RNA干扰; 舌癌; 侵袭
舌癌是口腔颌面部最常见的恶性肿瘤之一。发病率要远高于其他部位的口腔癌[1-4],并且近年来舌癌发病率逐渐增加,发病年龄呈年轻化的趋势[5-6]。舌癌的主要临床特点是局部呈浸润性或外生性生长,极易在病变的早期发生局部淋巴结转移[7]。由于恶性肿瘤的侵袭和转移是多步骤、多阶段、多因素和多基因综合作用的结果,因此侵袭和转移机制成为目前舌癌的研究热点。
Rho家族蛋白是小G蛋白Ras超家族成员,是一组具有三磷酸鸟苷(guanosine triphosphate,GTP)酶活性、相对分子质量为20×103~30×103的鸟苷酸结合蛋白,主要包括RhoA、RhoB、RhoC、Rac1、Rac2和Cdc42。近年来研究发现,Rho家族成员尤其是RhoA在多种肿瘤组织中如乳腺癌、前列腺癌、肺癌、肠癌等表达增加,并与肿瘤的恶性程度、发生发展、侵袭转移及临床预后有关,而对于RhoA在舌癌中的作用,目前的研究相对较少。本研究应用RNA干扰(RNA interference,RNAi)技术,以人舌癌细胞株Tca8113和SCC-4作为研究对象,利用体外合成针对RhoA基因的特异小干扰RNA(small interfering RNA,siRNA)将其转染舌癌细胞,观察siRNA对RhoA基因的抑制作用,探讨其对舌癌Tca8113和SCC-4细胞侵袭的影响及可能的作用机制,为舌癌的治疗提供新的思路。
1 材料和方法
1.1 材料
人舌癌细胞株Tca8113购自中国科学院上海生化细胞研究所,人舌癌细胞株SCC-4由山东大学口腔医学院馈赠。DMEM高糖培养基、乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)/胰蛋白酶、Trizol、阳离子脂质体试剂Lipofectamine2000 (Invitrogen公司,美国),胎牛血清、青霉素、链霉素(Gibco公司,美国),SYBR Premix Ex Taq (Perfect Real Time)试剂盒(Takara公司,日本),RhoA鼠抗人单克隆抗体(Santa Cruz公司,美国),辣根过氧化物酶(horseradish peroxidase,HRP)标记的羊抗鼠二抗(北京中杉金桥生物技术有限公司),放射免疫沉淀法(radio immunoprecipitation assay,RIPA)蛋白裂解液(江苏碧云天生物技术研究所)。siRNA序列合成及基因测序购自上海博尚生物技术有限公司。
1.2 细胞培养
Tca8113和SCC-4细胞用含10%胎牛血清、青霉素100 mg·mL-1和链霉素100 mg·mL-1的DMEM培养基在37 ℃、5%CO2培养箱培养,向培养瓶(25 cm2)内加入2 mL胰蛋白酶。消化在37 ℃环境下进行,消化2~5 min后把培养瓶放置显微镜下观察,发现胞质回缩、细胞间隙增大后,立即加入5 mL含有血清的DMEM培养基终止消化。用弯头吸管吸取瓶内培养液,反复吹打瓶壁细胞,吹打过程按顺序进行,确保所有底部均被吹到。动作轻柔,尽可能避免出现泡沫。细胞脱离瓶壁后形成细胞悬液。计数,按1︰1比例传代接种在新的培养瓶中。
1.3 RhoA siRNA的合成
登录Genbank数据库确定人RhoA基因序列,序列号为NM_001664,针对RhoA的基因序列设计2条RhoA-siRNA和1条阴性对照序列(NC-siRNA)(表1)。
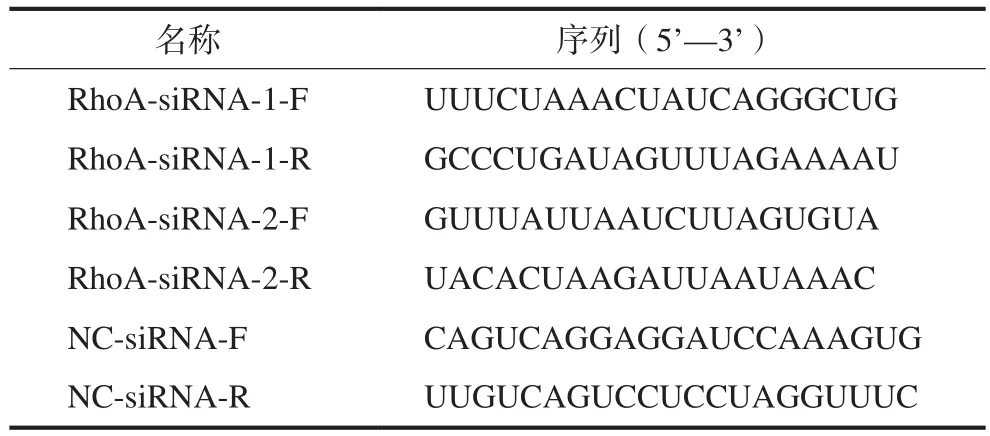
表 1 针对RhoA基因序列设计的2条RhoA-siRNA和1条阴性对照序列 Tab 1 Sequences of two RhoA-siRNA and one negative control based on RhoA gene
1.4 siRNA转染沉默RhoA基因
转染前1 d按照每孔1×105个分别将舌癌Tca8113 和SCC-4细胞接种于不同的24孔板中,每孔培养基500 μL,不含抗生素。贴壁细胞融合率达30%~50%时进行转染。用50 μL Opti-MEI低血清(或无血清)培养基稀释20 pmol siRNA(转染时siRNA终浓度为33 nmol·L-1),轻轻混匀;使用前轻轻摇匀Lipofec-tamine2000,然后取1 μL Lipofectamine2000在50 μL Opti-MEI培养基中稀释,室温孵育5 min。将前两步所稀释的siRNA和Lipofectamine2000混合(使总体积为100 μL),轻轻混匀,室温放置20 min。每孔细胞中加入100 μL转染液,轻轻摇匀。37 ℃培养48 h后检测基因表达。实验组为转染RhoA-siRNA组,脂质体转染RhoA-siRNA,其中实验1组和实验2组分别对应序列1的RhoA-siRNA和序列2的RhoA-siRNA;阴性对照组为转染NC-siRNA组,脂质体转染NC-siRNA;空白对照组为转染脂质体Lipo组,仅加入转染混合液,不转染任何的siRNA。
1.5 实时定量聚合酶链反应(polymerase chain reac- tion,PCR)检测各组RhoA mRNA的表达
按照Trizol试剂盒提取细胞总RNA,紫外分光光度计测定RNA含量,取5 μL总RNA,在M-MLV反转录酶作用下合成cDNA,再取5 μL反转录产物进行PCR扩增反应,以磷酸甘油醛脱氢酶(glyceraldehyde phosphate dehydrogenase,GAPDH)为内参照。RhoA基因的引物序列,上游:5’-TTCCATCGACAGCCCTGATAGTTTA-3’,下游:5’-CACGTTGGGACAGAAATGCTTG-3’;GAPDH基因的引物序列,上游:5’-GCACCGTCAAGGCTGAGAAC-3’,下游:5’-TGGTGAAGACGCCAGTGGA-3’。PCR反应条件:95 ℃ 30 s;然后95 ℃ 5 s,60 ℃ 34 s,40个循环。荧光信号实时监测和数据分析由Stratagene荧光定量PCR仪自动完成,采用2-∆∆Ct公式计算RhoA mRNA的相对表达水平,其中Ct值为循环阈值。
1.6 蛋白质印迹法(Western blot)检测目的蛋白的表达
弃培养液后PBS冲洗细胞3次,用RIPA蛋白裂解液裂解,操作于冰上进行,4 ℃下10 000 r·min-1(离心半径为4 cm)离心5 min取上清液,聚氰基丙烯酸正丁酯(bicinchoninic acid,BCA)法测蛋白浓度后,100 ℃变性10 min。用12%聚丙烯酰胺凝胶分离,再电转至硝酸纤维素膜上,5%脱脂奶粉封闭2 h后,单克隆抗体RhoA(1︰200)、半乳糖凝集素-3 (galectin-3)(1︰500)、基质金属蛋白酶(matrix metalloproteinase,MMP)-9(1︰1 000)、β-actin (1︰1 000)4 ℃孵育过夜,三羟甲基氨基甲烷缓冲盐水(triethanolamine buffered saline,TBS-T)洗涤,辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗小鼠二抗(1︰5 000)室温孵育2 h,PBS洗涤,加入电化学发光(electrochemiluminesce nce,ECL)溶液显色曝光。
1.7 细胞体外侵袭能力的检测
将质量浓度为0.5 g·L-1的Matrigel人工基质胶20 μL铺于Transwell侵袭小室聚碳酯微孔膜(孔径8 μm)的上表面,置37 ℃ 30 min使其聚成凝胶。Transwell上室中分别加入已消化重悬的各组细胞100 μL(1× 108个·mL-1),下室中分别加入对应的条件培养上清液,每孔600 μL。每个孔重复3次。37 ℃、5%CO2孵育48 h后取出,PBS清洗,棉签去除滤膜上层细胞,将已经侵入并贴附于微孔膜下层的细胞固定并采用瑞氏染色法(Wright’s stain)对贴附在聚酯膜上的侵袭细胞进行染色,显微镜下观察穿过膜的细胞数。随机选择5个视野,计数每个视野内穿过8 μm微孔的细胞数。以侵袭细胞的相对数目来表示肿瘤细胞的侵袭能力。
1.8 统计学分析
采用SPSS 12.0软件进行统计分析,组间比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 实时荧光定量PCR检测RNAi转染后各组RhoA基因的表达
实时荧光定量PCR检测结果显示,与阴性对照组和空白对照组相比,实验组Tca8113和SCC-4细胞转染RhoA-siRNA后,RhoA mRNA表达明显下降(P<0.05,图1)。
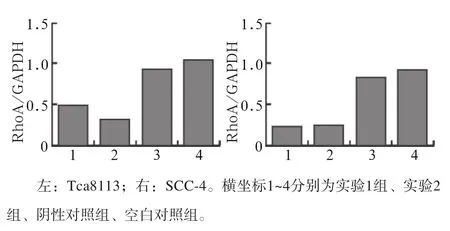
图 1 转染RhoA-siRNA后RhoA mRNA的表达Fig 1 Expression of RhoA mRNA after RhoA-siRNA transfection
2.2 Western blot检测RNAi转染后各组RhoA、gale- ctin-3和MMP-9的蛋白表达
Western blot检测结果表明,与阴性对照组和空白对照组相比,实验组Tca8113和SCC-4细胞转染RhoA-siRNA后,RhoA、galectin-3和MMP-9蛋白的表达均明显下降(P<0.05,图2、3)。
2.3 RhoA siRNA对舌癌细胞体外侵袭能力的影响
与阴性对照组和空白对照组相比,实验组Tca8113 和SCC-4细胞转染RhoA-siRNA后,穿膜细胞的数量明显减少(P<0.05,表2,图4),表明转染RhoA-siRNA后降低了舌癌Tca8113和SCC-4细胞的体外侵袭能力。
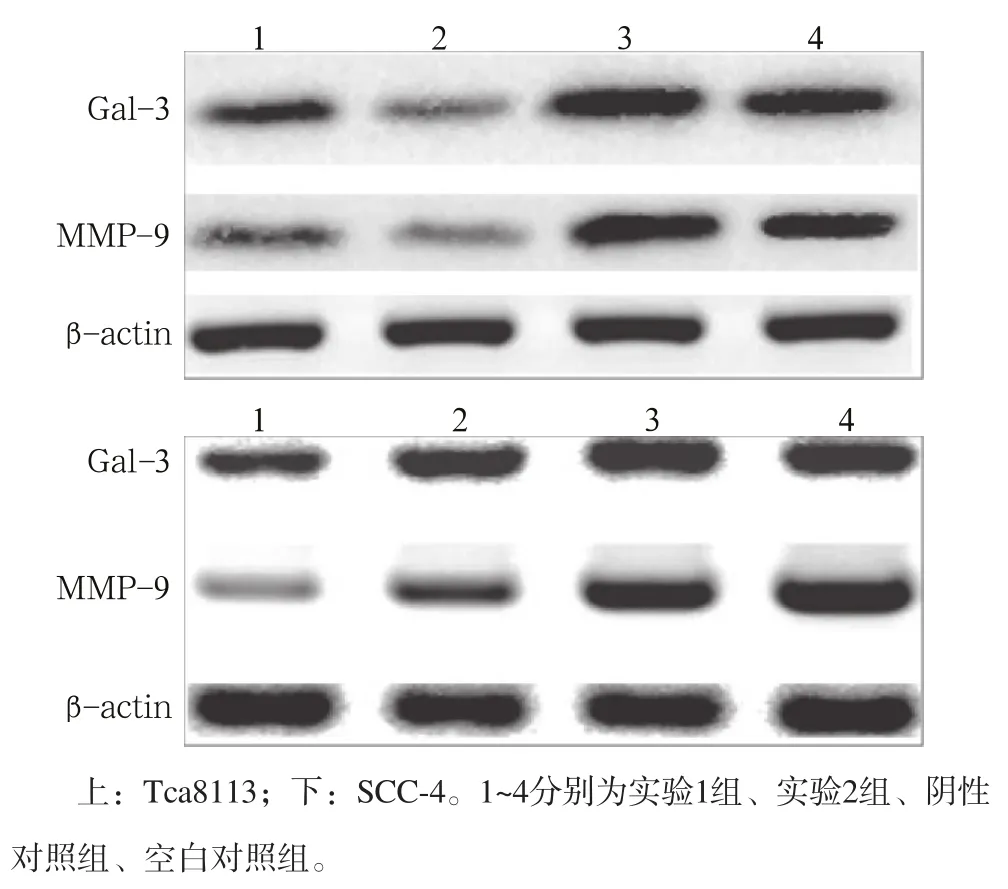
图 2 转染RhoA-siRNA后galectin-3和MMP-9蛋白的表达 Fig 2 Expression of galectin-3 and MMP-9 protein after RhoA- siRNA transfection
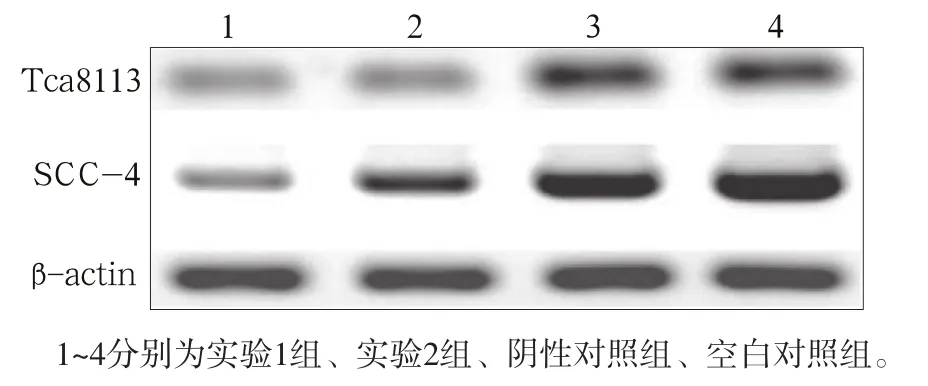
图 3 转染RhoA-siRNA后RhoA蛋白的表达Fig 3 Expression of RhoA protein after RhoA-siRNA transfection
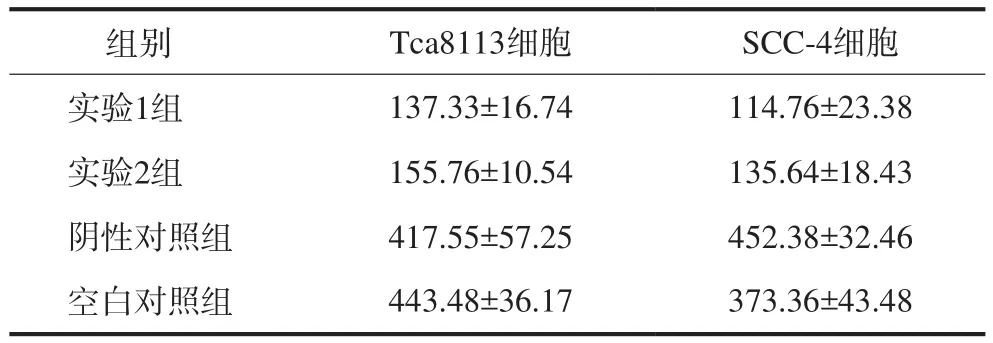
表 2 转染RhoA-siRNA后各组的穿膜细胞数 Tab 2 Cells number of transmembrane after RhoA-siRNA transfection
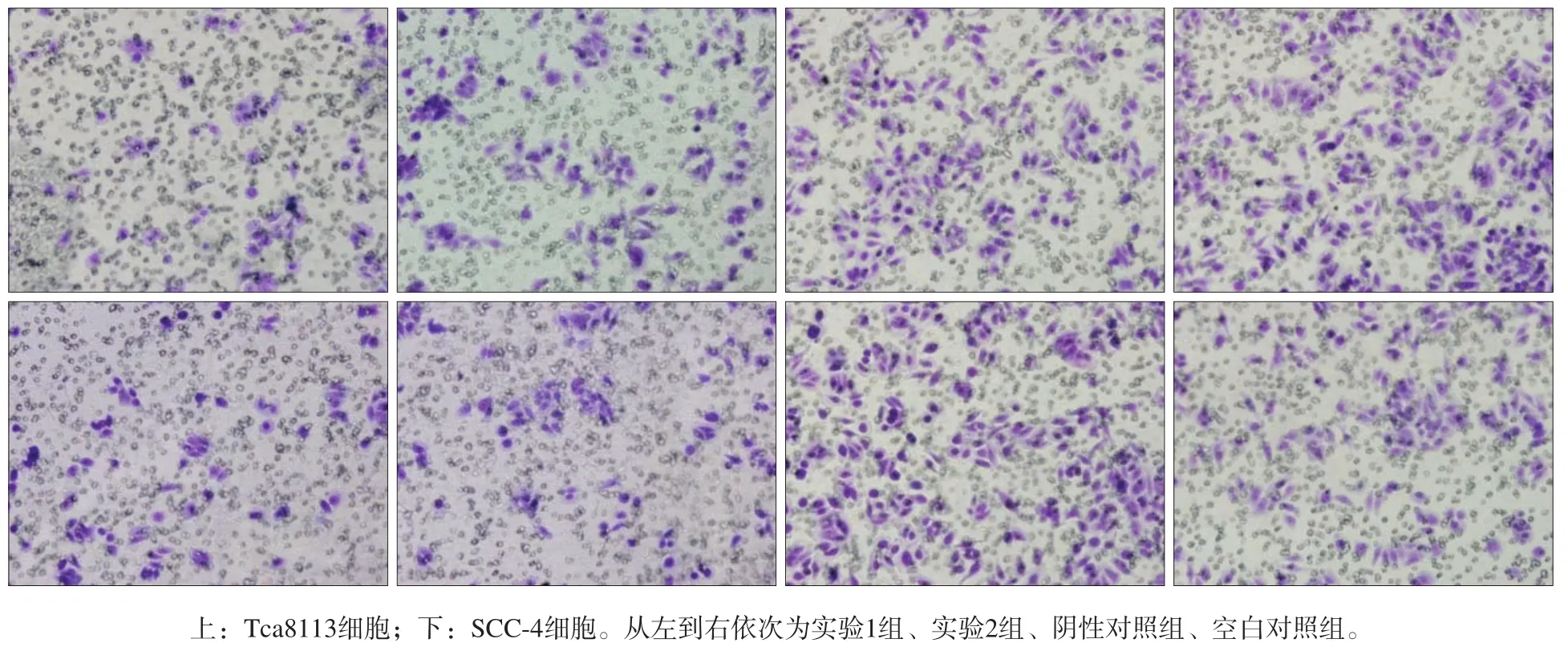
图 4 转染RhoA-siRNA后细胞侵袭能力的检测 倒置相差显微镜 × 100Fig 4 Evaluation of cell invasion after RhoA-siRNA transfection inverted phase contrast microscope × 100
3 讨论
侵袭和转移是恶性肿瘤最为显著的生物学特征。舌癌浸润和转移的程度是影响其临床预后的主要因素,也是临床上患者死亡的主要原因,但舌癌发生浸润转移的具体分子机制目前尚未完全阐明。Rho蛋白的激活可引起一系列的效应器反应,如细胞黏附和细胞运动的变化、肌动蛋白细胞骨架结构改变、基因转录的调控变化、细胞周期的调控变化等[8],而细胞骨架在细胞之间以及细胞与细胞外基质之间的黏附中发挥着重要的作用,细胞骨架、细胞间黏附以及细胞与基质黏附的改变是肿瘤细胞发生侵袭和转移的先决和重要条件。
本实验以舌癌细胞系Tca8113和SCC-4为研究对象,将RhoA siRNA转染至舌癌细胞中,采用RNA干扰技术特异性沉默RhoA基因,使RhoA的基因和蛋白水平表达下调。结果显示利用siRNA可以有效地抑制RhoA基因在舌癌细胞Tca8113和SCC-4中的表达,并且可以抑制细胞的侵袭,而恶性肿瘤发生侵袭和转移包括基质降解、细胞迁移和血管生成等一系列步骤,因此推测RhoA基因与舌癌的侵袭和转移有关。本实验还证实,RhoA基因的表达下降,可以使galectin-3和MMP-9的表达下调。
gaglectin-3是一种β-半乳糖苷结合蛋白,是半乳糖凝集素(galectins)家族中的重要成员之一。galectin-3具有多种生物学功能,如促进细胞的增殖、促进肿瘤的侵袭和转移、调节细胞的黏附,参与免疫调节、参与炎症反应及血管生成等[9-10]。MMP-9是基质金属蛋白酶家族中的一员,属于Ⅳ型胶原酶,可以降解细胞外基质中的Ⅳ型胶原、纤维连接蛋白等成分。MMP-9可通过降解细胞外基质和基底膜来影响组织的重塑,从而促进肿瘤的浸润、转移和血管的生成,在肿瘤的浸润和转移过程中发挥着极为重要的作用[11]。细胞外基质和基底膜的降解以及新生血管的形成则是肿瘤发生侵袭和转移必需且又极其重要的步骤。已有研究证实[12],galectin-3与MMP-9之间可以相互发生作用,在肿瘤细胞的迁移过程中发挥重要功能。galectin-3作为MMP-9的底物,可被MMP-9选择性地进行蛋白分解,产生一个分子量为22 kU的糖识别域和一个分子量为9 kU的氨基酸残基组成的galectin-3末端片段。裂解之后的galectin-3更容易发挥作用,从而促进细胞的侵袭。galectin-3表达较低时,肿瘤细胞与细胞外基质有正常的黏附作用;而表达较高时,肿瘤细胞与细胞外基质的黏附作用减弱,肿瘤细胞极易穿过基底膜发生局部浸润和侵袭。MMP-9除了可以降解细胞外基质之外,还能促进肿瘤新生血管的生长[13-14]。血管生成是肿瘤生长、转移过程中的关键因素。其存在的机制可能是通过启动血管基底膜的蛋白降解,为内皮细胞的转移打开通路从而形成新的血管;另外可能与活化血管内皮生长因子有关。此外,MMP-9还可能通过裂解基质有利于淋巴管内皮细胞迁移从而促进淋巴管新生,而新生的毛细淋巴管仅由单层淋巴内皮细胞组成,管壁薄、基底膜不完整,因而肿瘤细胞更易于进入淋巴管道,进而产生淋巴结转移[15]。
目前已经证实RhoA与胰腺癌[16]、结直肠癌[17-18]、肝癌[19]等恶性肿瘤的侵袭、迁移能力等密切相关;在舌癌的研究中,通过激活RhoA的上游调控基因蛋白激酶A(protein kinase A,PKA)可以活化RhoA,进而发现舌癌细胞的黏附及迁移能力增强[20],因此证实了RhoA可以正性调控舌癌细胞的侵袭和迁移,但该研究并未对RhoA调控下游效应基因的分子机制进行探讨[20-21]。RhoA对舌癌细胞运动的调节可能与β-连环蛋白(β-catenin)有关[22],而β-catenin是Wnt信号通路下游的重要效应蛋白。本研究不仅证实了RhoA与舌癌细胞的侵袭和转移呈正相关,而且证实了RhoA可能通过调控galectin-3与MMP-9来发挥作用。至于galectin-3、MMP-9与β-catenin之间的相互调节机制,尚有待进一步证实。
综上,RhoA-siRNA可以有效地干扰或降低RhoA基因的表达,从而抑制舌癌Tca8113和SCC-4细胞的侵袭,这有可能成为一种新的舌癌基因治疗方法。本实验研究结果提示,RhoA可能通过galectin-3与 MMP-9来调控舌癌细胞的迁移与侵袭,推测RhoA-siRNA在一定程度上可以阻止舌癌细胞的黏附、侵袭和迁移运动,干扰细胞的浸润和转移,其作用机制有待进一步研究。
[参考文献]
[1] 德维塔. 癌—肿瘤学原理和基础[M]. 徐从高, 译. 5版. 济南: 山东科学技术出版社, 2001:688-798. DeVita VT. Cancer principled and practice of oncology[M]. Xu CG, translated. 5th ed. Jinan: Shandong Science and Technology Publishing House, 2001:688-798.
[2] 王兆元, 李俊林. 口腔内癌肿396例临床病理分析[J]. 口腔医学, 1999, 19(1):26-27. Wang ZY, Li JL. Clinical and pathological analysis of 396 cases of oral cancer[J]. Stomatology, 1999, 19(1):26-27.
[3] 于世凤. 口腔组织病理学[M]. 4版. 北京: 人民卫生出版社, 2000:198-215. Yu SF. Oral histology and pathology[M]. 4th ed. Beijing: People’s Medical Publishing House, 2000:198-215.
[4] 吴军正, 陈建元, 李峰, 等. 舌癌脑转移细胞系的Tb建立及形态和生长特性[J]. 实用口腔医学杂志, 1999, 15(6): 452-453. Wu JZ, Chen JY, Li F, et al. Establishment of a metastatic cell line from brain metastasis induced by injection of tongue cancer Tca8113 cells in nude mouse[J]. J Pract Stomatol, 1999, 15(6):452-453.
[5] Myers JN, Elkins T, Roberts D, et al. Squamous cell carcinoma of the tongue in young adults: increasing incidence and factors that predict treatment outcomes[J]. Otolaryngol Head Neck Surg, 2000, 122(1):44-51.
[6] Mathew Iype E, Pandey M, Mathew A, et al. Squamous cell carcinoma of the tongue among young Indian adults[J]. Neoplasia, 2001, 3(4):273-277.
[7] Wyganowska-Świątkowska M, Jankun J. Plasminogen activation system in oral cancer: relevance in prognosis and therapy[J]. Int J Oncol, 2015, 47(1):16-24.
[8] Rath N, Olson MF. Rho-associated kinases in tumorigenesis: re-considering ROCK inhibition for cancer therapy[J]. EMBO Rep, 2012, 13(10):900-908.
[9] Funasaka T, Raz A, Nangia-Makker P. Galectin-3 in angiogenesis and metastasis[J]. Glycobiology, 2014, 24(10):886-891.
[10] Xin M, Dong XW, Guo XL. Role of the interaction between galectin-3 and cell adhesion molecules in cancer metastasis [J]. Biomed Pharmacother, 2015, 69:179-185.
[11] Vandooren J, Van den Steen PE, Opdenakker G. Biochemistry and molecular biology of gelatinase B or matrix metalloproteinase-9 (MMP-9): the next decade[J]. Crit Rev Biochem Mol Biol, 2013, 48(3):222-272.
[12] Mauris J, Woodward AM, Cao Z, et al. Molecular basis for MMP9 induction and disruption of epithelial cell-cell contacts by galectin-3[J]. J Cell Sci, 2014, 127(Pt 14):3141-3148.
[13] Jayasooriya RG, Park SR, Choi YH, et al. Camptothecin suppresses expression of matrix metalloproteinase-9 and vascular endothelial growth factor in DU145 cells through PI3K/Akt-mediated inhibition of NF-κB activity and Nrf2-dependent induction of HO-1 expression[J]. Environ Toxicol Pharmacol, 2015, 39(3):1189-1198.
[14] Tang YL, Liu X, Gao SY, et al. WIP1 stimulates migration and invasion of salivary adenoid cystic carcinoma by inducing MMP-9 and VEGF-C[J]. Oncotarget, 2015, 6(11): 9031-9044.
[15] 黄榕权, 谢燕清, 张雅洁. MMP-2、MMP-9和VEGF-D在乳腺癌中的表达及其与肿瘤淋巴管新生的关系[J]. 广东医学, 2014, 35(13):2072-2074. Huang RQ, Xie YQ, Zhang YJ. Expression of MMP-2, MMP-9 and VEGF-D in human breast cancer and their correlation with lymphangiogenesis[J]. Guangdong Med J, 2014, 35 (13):2072-2074.
[16] 李金海, 戴华卫, 张海峰. RhoA基因在胰腺癌组织中的表达及其与肿瘤临床病理特征的关系[J]. 温州医科大学学报, 2014, 44(2):130-133. Li JH, Dai HW, Zhang HF. RhoA gene expression and clinicopathology parameters in pancreatic carcinoma[J]. J Wenzhou Med Univ, 2014, 44(2):130-133.
[17] 刘相萍, 王海波, 刘延军, 等. RhoA、RhoC基因在结直肠癌组织中的表达及其意义[J]. 中华实验外科杂志, 2008, 25(7):888-890. Liu XP, Wang HB, Liu YJ, et al. Expression and significance of RhoA and RhoC in colorectal carcinoma[J]. Chin J Exp Surg, 2008, 25(7):888-890.
[18] 杨开焰, 陈道瑾, 李小荣, 等. 靶向RhoA基因的shRNA对结直肠癌细胞黏附和迁移的影响[J]. 中国老年学杂志, 2011, 31(15):2890-2892. Yang KY, Chen DJ, Li XR, et al. Effect of shRNA targeted against RhoA on the human colonic cancer cells adhesion and migration[J]. Chin J Gerontol, 2011, 31(15):2890-2892.
[19] 董伟, 窦科峰, 杨薛康, 等. RhoA基因沉默对肝癌HepG2细胞增殖和迁移能力的影响[J]. 中华消化外科杂志, 2010, 9(3):216-219. Dong W, Dou KF, Yang XK, et al. Effect of RhoA gene silencing on proliferation and migration of HepG2 cells[J]. Chin J Dig Surg, 2010, 9(3):216-219.
[20] 周峻, 何勇, 金岩, 等. 舌癌细胞迁移过程中RhoA和蛋白激酶A的作用[J]. 中国口腔颌面外科杂志, 2007, 5(2):118-121. Zhou J, He Y, Jin Y, et al. Effects of PKA and RhoA on migration of squamous cell carcinoma of the tongue[J]. Chin J Oral Maxillofac Surg, 2007, 5(2):118-121.
[21] 周峻, 何勇, 董绍忠, 等. RhoA小干扰RNA对舌癌细胞Tca8113增殖、侵袭影响的体外实验[J]. 中华口腔医学杂志, 2010, 45(9):520-524. Zhou J, He Y, Dong SZ, et al. Effects of RhoA siRNA on the proliferation, adhesion, migration and invasion of tongue squamous cell carcinoma Tca8113 cells in vitro[J]. Chin J Stomatol, 2010, 45(9):520-524.
[22] Saito S, Yamamoto H, Mukaisho K, et al. Mechanisms underlying cancer progression caused by ezrin overexpression in tongue squamous cell carcinoma[J]. PLoS ONE, 2013, 8(1):e54881.
(本文编辑 李彩)
[中图分类号]Q 78
[文献标志码]A [doi] 10.7518/hxkq.2016.02.016
[收稿日期]2015-09-16; [修回日期] 2015-12-18
[基金项目]国家自然科学基金(81372908);南京医科大学科技发展基金重点项目(2012NJMU248);青岛市卫计委计划项目(2014-WJZD009,2013-WSZD011)
[作者简介]陈正岗,副主任医师,博士,E-mail:chenzhg1973@163. com
[通信作者]严国鑫,副主任医师,硕士,E-mail:yanguo_xin2015@ 163.com
Effects of RhoA gene silencing by RNA interference on invasion of tongue carcinoma
Chen Zhenggang1,2, Tang Yongping1, Tong Lei1, Wang Ying3, Zhou Yuan3, Wang Qimin1, Han Jinhong1, He Zongxuan1, Liao Yixiang1, Fan Bing4, Zou Ronghai4, Zhang Jian4, Sun Xiaofeng4, Yan Guoxin4. (1. Center of Stomatology, Qingdao Municipal Hospital Affiliated to Qingdao University Medical College, Qingdao 266071, China; 2. Dept. of Oral and Maxillofacial Surgery, Shanghai Ninth People’s Hospital, Shanghai Jiao Tong University School of Medicine, Shanghai 200011, China; 3. College of Stomatology, Weifang Medical University, Weifang 261021, China; 4. Dept. of Stomatology, Wuxi No 2. People’s Hospital, Wuxi 214002, China)
Supported by: Natural Science Foundation of China (81372908); Science and Technology Developing Major Project of Nanjing Medical University (2012NJMU248); Science and Technology Planning Project of Qingdao Municipal Health and Family Planning Commission (2014-WJZD009, 2013-WSZD011). Correspondence: Yan Guoxin, E-mail: yanguo_xin2015@ 163.com.
[Abstract]Objective To study the effects of RhoA down-regulation by RNA interference on the invasion of tongue carcinoma Tca8113 and SCC-4. Methods Determination of the human RhoA sequence as well as the design and construction of a short specific small interfering RNAs (siRNA) were performed. The siRNA of RhoA gene was transfected into human tongue squamous cell carcinoma Tca8113 and SCC-4 cells line by Lipofectamine 2000. Quantitative real-time polymerase chain reaction was used to examine the mRNA expression levels of RhoA. Protein expressions of mRNA, galectin-3, and matrix metalloproteinase (MMP)-9 were evaluated by Western blot. Transwell invasion assay was performed to assess the invasion ability of tongue carcinoma. Results RhoA expressions in Tca8113 and SCC-4 cells were reduced significantly after transfection of RhoA-siRNA. Protein levels of galectin-3 and MMP-9 were also down-regulated significantly. Invasion ability was inhibited as well. Conclusion RhoA-siRNA can effectively inhibit RhoA expression in Tca8113 and SCC-4 cells. The invasion ability of tongue carcinoma cells decreased with down-regulation of the protein expressions of galectin-3 and MMP-9, indicating that RhoA-siRNA can inhibit invasion of tongue carcinoma. Results show that RhoA may play an important role in the processes of invasion and metastasis of tongue carcinoma.
[Key words]RhoA gene; galectin-3; matrix metalloproteinase-9; RNA interference; tongue carcinoma; invasion

