视黄酸信号通路调控咽弓神经嵴影响斑马鱼牙齿发育的研究
刘鑫 黄兴 徐智云 杨德琴重庆医科大学附属口腔医院牙体牙髓病科·口腔疾病与生物医学重庆市重点实验室,重庆 401147
·基础研究·
视黄酸信号通路调控咽弓神经嵴影响斑马鱼牙齿发育的研究
刘鑫 黄兴 徐智云 杨德琴
重庆医科大学附属口腔医院牙体牙髓病科·口腔疾病与生物医学重庆市重点实验室,重庆 401147
[摘要]目的 研究视黄酸(RA)信号通路在斑马鱼颅神经嵴迁移至咽弓神经嵴对牙齿发育的影响。方法 将野生型斑马鱼胚胎与转基因斑马鱼胚胎各分为3组,分别采用1×10-7~6×10-7mol·L-1梯度浓度的RA(RA处理组)、1× 10-7mol·L-1的4-二乙氨基苯甲醛(DEAB)(DEAB处理组)、与RA处理组相应浓度的二甲基亚砜(DMSO对照组)处理24 hpf胚胎9 h。制备dlx2a、barx1、dlx2b基因的反义探针,运用整胚原位杂交技术检测野生型斑马鱼48~72 hpf胚胎的dlx2a、dlx2b、barx1基因表达,荧光显微镜观察转基因斑马鱼4 dpf胚胎。结果 获得3个基因的反义mRNA探针。与DMSO对照组相比,1×10-7mol·L-1RA处理组barx1、dlx2a在咽弓神经嵴的表达明显增强,并有由咽弓神经嵴向后段咽弓牙齿萌出位点迁移的趋势,绿色荧光向周边咽弓扩散;4×10-7mol·L-1RA处理组胚胎致畸率和死亡率极高,3×10-7mol·L-1RA处理组1/3胚胎发育迟缓。DEAB处理组神经嵴发育不良,barx1、dlx2a表达降低,dlx2b在牙齿位点的表达有所延迟。结论 RA能够通过调控咽弓神经嵴发育过程,进而调控牙齿发育前体细胞,最终达到调控牙齿发育的过程。
[关键词]视黄酸信号通路; 牙齿发育; 神经嵴; 斑马鱼
牙齿发育是颅神经嵴来源的间充质细胞在牙齿形态发生时与牙源性上皮细胞相互作用的结果。研究[1-2]表明,神经嵴细胞与牙本质涎磷蛋白的调控、牙周韧带的形成关系密切。人类正在发育的牙齿根尖段牙髓中可分离出神经嵴干细胞[3]。在早期发育过程中,颅神经嵴分化完成后由脑部迁徙至牙齿发生部位,参与牙齿的形成[4]。这一过程中涉及大量的生长因子及信号介导,而信号通路的微小量变就可能导致繁复多样的表型发生。在脊椎动物中,牙齿形态表现出对进化的高度敏感性,与进化程度较高的鼠类或大型哺乳类不同,由于进化程度较低,信号调控对斑马鱼牙齿的数量与形态更具多样性。此外,斑马鱼的牙齿形态及发育过程与哺乳动物相似,使其成为牙齿发育信号途径机制研究的理想模式动物。
视黄酸(retinoic acid,RA)是维生素A家族的一员,为视黄醇在体内经多次氧化合成的代谢产物,是牙齿发育过程中的信号途径之一。RA在心脏、神经、骨骼和牙齿等器官中都有参与发育和维持生理功能的作用。Ritchie等[5]证实RA信号通过对大鼠牙本质涎磷蛋白的调控对牙本质矿化具有作用。Seritrakul等[6]研究发现,增加RA的摄入量可以使斑马鱼因退化而消失的牙齿重新萌出。Gibert等[7]认为,微量改变RA的水平可以调节鱼类牙齿的进化方向。目前对于RA是否参与颅神经嵴后迁至斑马鱼咽弓分化为咽弓神经嵴、调控咽弓间充质干细胞参与牙齿的发生,还不甚清楚。
本研究利用梯度浓度外源性视黄酸RA及其视黄醛脱氢酶2(raldh2)抑制剂4-二乙氨基苯甲醛(4-diethylaminobenzaldehyde,DEAB)对野生型斑马鱼进行处理,选择颅神经嵴标记物dlx2[8]、咽弓神经嵴与咽间充质标记物barx1[9]、咽齿牙源性上皮特异性标记物dlx2b[10]制备反义探针,检测药物处理后的各组胚胎,辅以dlx2b:GFP转基因鱼的的荧光观察。本研究的目的是初步探索RA信号在神经嵴迁移过程中的作用机理,为进一步揭示RA信号在牙齿形态发生与牙列数目进化中的调控作用提供基础依据。
1 材料和方法
1.1 实验动物与饲养
实验动物为2种类型的斑马鱼:AB Go野生型斑马鱼和转基因斑马鱼Tg(dlx2b:GFP),均从西南大学分子发育实验室获得。斑马鱼饲养于28.5 ℃水温、14 h光照、10 h黑暗的标准条件下,按雌雄比例1︰1或者1︰2放入交配缸内并隔开,次日8:30拉开隔板,日光灯刺激产卵,9点收集斑马鱼受精卵并清洗,置于28.5 ℃恒温孵育箱中进行孵育和培养。用于整胚原位杂交的胚胎培养液(egg water)中添加0.04%的1-苯基-2-硫脲(phenylthiourea,PTU)孵育,控制色素形成。
1.2 主要试剂及设备
聚合酶链式反应(polymerase chain reaction,PCR)引物合成及测序由上海英骏生物技术有限公司合作完成。PCR purification Kit试剂盒(Qiagen公司,美国),Prime Star DNA合成酶(Takara公司,日本),RA试剂、DEAB(Sigma公司,美国),逆转录试剂盒(Roche公司,瑞士),RNA提取试剂盒(Life Technologies公司,美国), RNA探针纯化试剂盒(GE公司,美国),台式离心机、PCR仪(Eppendorf公司,德国)。
1.3 药物配置与分组处理
DEAB和RA分别先溶于100%二甲基亚砜(dimethyl sulfoxid,DMSO)中,然后胚胎培养液稀释成工作浓度待用。DEAB工作浓度为10-7mol·L-1,RA工作浓度梯度是1×10-7~6×10-7mol·L-1。
将野生型斑马鱼胚胎与转基因斑马鱼胚胎各分为3组:RA处理组、DEAB处理组、DMSO对照组,在胚胎24 hpf(hours post fertilization,受精后小时)按照不同方式进行药物处理,胚胎培养液中均加入0.04% PTU。RA处理组在胚胎培养液中分别加入6× 10-7、5×10-7、4×10-7、3×10-7、1×10-7mol·L-1的RA,DEAB处理组加入1×10-7mol·L-1的RA合成酶抑制剂DEAB,DMSO对照组加入与RA处理组相应浓度的DMSO,恒温孵育箱(28.5 ℃)中避光培养9 h。
药物处理后用相应浓度的DMSO 胚胎培养液分别洗3遍,保证无药剂残留后放回恒温孵育箱。收集野生型斑马鱼48~72 hpf的胚胎用于整胚原位杂交,收集转基因鱼4 dpf(days post fertilization,受精后天数)的胚胎用于荧光显微镜检测。
1.4 barx1、dlx2a、dlx2b反义探针的制备
收集野生型斑马鱼3~5 dpf的胚胎,用Trizol法提取胚胎的总RNA,利用紫外可见分光光度计及琼脂糖凝胶电泳检测其纯度及完整性,进行逆转录合成3~5 dpf胚胎的cDNA,-20 ℃储存备用。利用斑马鱼cDNA文库中barx1、dlx2a、dlx2b基因序列设计探针引物,分别为barx1正向:5’-ATGCAACATCCTT-TGGAGATTGG-3’,反向:5’-TTATTCCTCTTGGTTTGCATCAG-3’;dlx2a正向:5’-ATGACTGGAGTTTTTGACAGCCTC-3’,反向5’-TCAAAATATGGTCCCGGCGCTAA-3’;dlx2b正向:5’-CAGTGGGCTGCTCTGAAACTGT-3’,反向5’-ACTAGTGATCCTGGCACGGTGG-3’。以上述合成的cDNA为模板进行扩增。连接产物于pGEMT载体上,利用DH5α感受态菌株进行电穿孔转化,筛选AMP抗性阳性克隆质粒,通过限制性内切酶EcoRⅠ的酶切反应,验证重组质粒中克隆片段的大小,确认与目的片段一致后送上海英骏生物技术有限公司完成测序。测序结果与3种基因CDS区域一致,插入片段连接方向为barx1 和dlx2b反向,限制性内切酶SalⅠ酶切线性化质粒,dlx2a正向,限制性内切酶SphⅠ酶切线性化质粒,T7及SP6 RNA聚合酶体外转录体系加入地高辛标记的寡核苷酸进行转录,转录后用DnaseⅠ酶消化残留DNA,产物经GE Y50纯化试剂盒纯化后得到地高辛标记的dlx2a、dlx2b、barx1反义探针,2%琼脂糖凝胶电泳鉴定RNA探针质量并保存于-20 ℃冰箱。
1.5 整胚原位杂交
运用整胚原位杂交技术检测3组野生型斑马鱼胚胎的dlx2a、dlx2b、barx1基因表达。收集48~72 hpf的胚胎,4%多聚甲醛4 ℃过夜固定,甲醇梯度脱水,储存于-20 ℃、100%甲醇溶液中。按照脱水、复水、消化、终止消化、预杂交、杂交、封闭、显色、显色终止的实验方法进行原位杂交,显微镜下观察显色成功后终止染色,拍照储存并进行分析。
1.6 荧光显微镜检测
收集转基因鱼4 dpf的胚胎,麻醉剂tricaine麻醉后用荧光显微镜观察胚胎,主要观察咽弓位置是否有绿色荧光以及荧光表达范围。观察后使用胚胎培养液洗脱麻醉剂,放回恒温孵育箱。
2 结果
2.1 反义探针的制备
通过PCR扩增得到了特异性条带,片段大小分别为499 bp(dlx2b)、813 bp(barx1)、747 bp (dlx2a),结果符合预期。将PCR片段连接pGEMT载体上,EcoRⅠ酶切对重组质粒进行验证,重组质粒构建成功。通过上海英骏生物技术有限公司测序结果得知插入片段的方向,用SalⅠ和SphⅠ进行对应质粒线性化,通过T7和SP6 RNA聚合酶转录获得了dlx2b、dlx2a、barx1基因的反义mRNA探针。
2.2 整胚原位杂交
整胚原位杂交结果见图1。
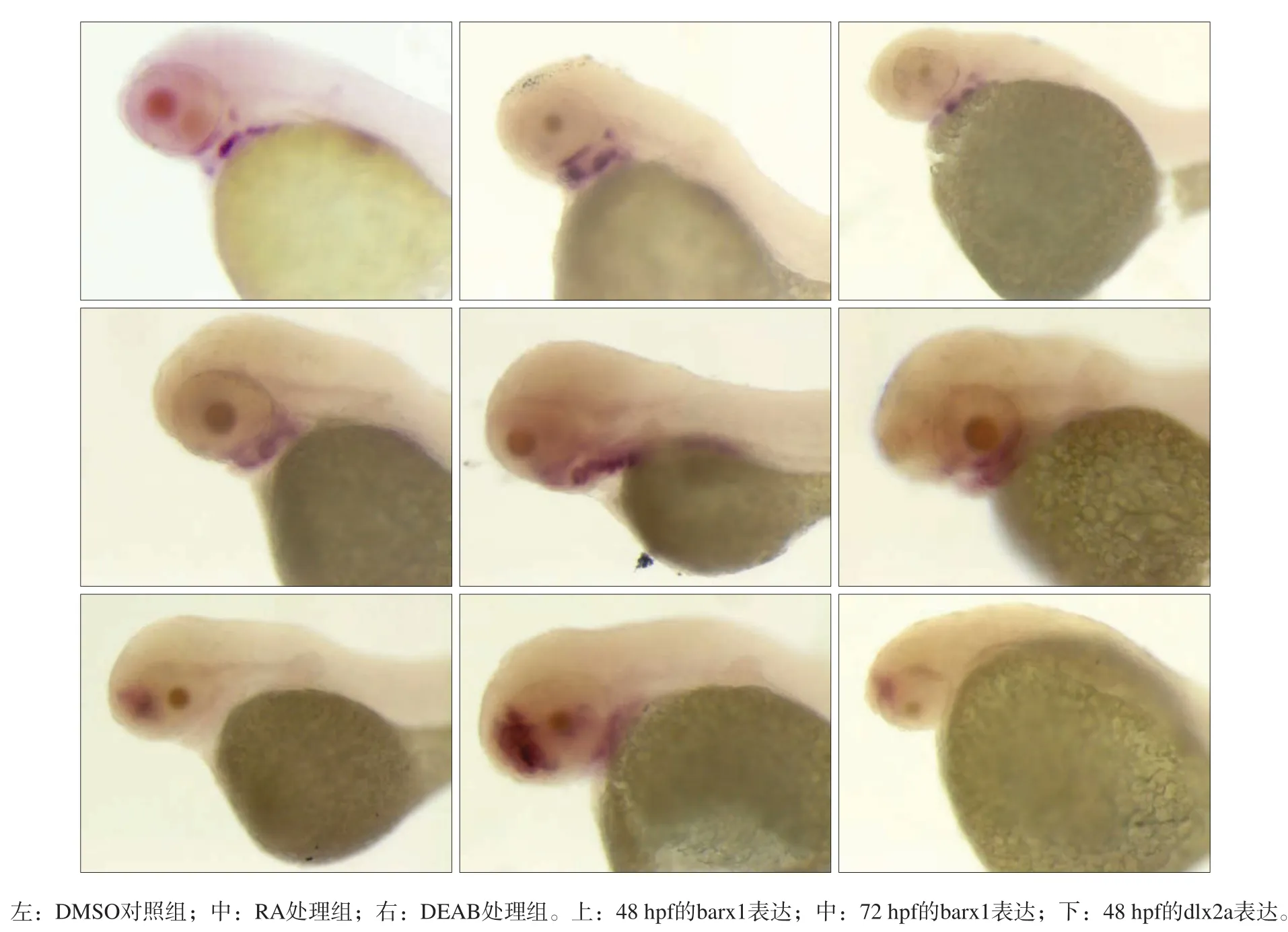
图 1 3组barx1与dlx2a的表达 整胚原位杂交 × 75Fig 1 Expression of barx1 and dlx2a genes in three groups whole in situ hybridization × 75
由图1可见,1)1×10-7mol·L-1RA处理组的胚胎,较DMSO对照组在咽弓神经嵴至咽弓牙齿部位可见到增强的褐色阳性信号,其中barx1的表达量在48 hpf胚胎明显升高,在72 hpf胚胎信号持续强烈表达,并有由咽弓神经嵴向第七咽弓的牙齿萌出位点迁移的趋势,DMSO对照组信号仍局限于咽弓前段;RA处理组胚胎在48 hpf时dlx2a的表达明显增强,除前脑部信号明显外,咽弓后段牙齿位置也出现表达。dlx2b的表达与对照组差异不明显,胚胎48 hpf均有信号位于牙齿萌出位置。2)DEAB处理组胚胎外形稍有畸形,与DMSO对照组及RA处理组相比,胚胎神经嵴发育迟缓,完整性不良;barx1在48 hpf表达明显降低,72 hpf开始逐渐消失,无向咽弓牙齿附着位点扩展的趋势;dlx2a在前脑表达量下降,咽弓牙齿处无明显表达;dlx2b在牙齿位点的表达有所延迟。
不同浓度的RA处理组原位杂交结果表明,4× 10-7mol·L-1RA处理组胚胎致畸率和死亡率极高,3× 10-7mol·L-1RA处理组胚胎约1/3出现发育迟缓的表型,主要体现在48 hpf胚胎外形与24 hpf的DMSO对照组类似,尾部呈扭曲状,头部与卵黄接近,眼部未见轮廓(图2)。经dlx2a、dlx2b、barx1探针染色后发现,48 hpf的RA处理组barx1无表达,dlx2a与dlx2b的表达均与24 hpf的DMSO对照组表达模式一致,与同期对照组形成鲜明对比(图2)。
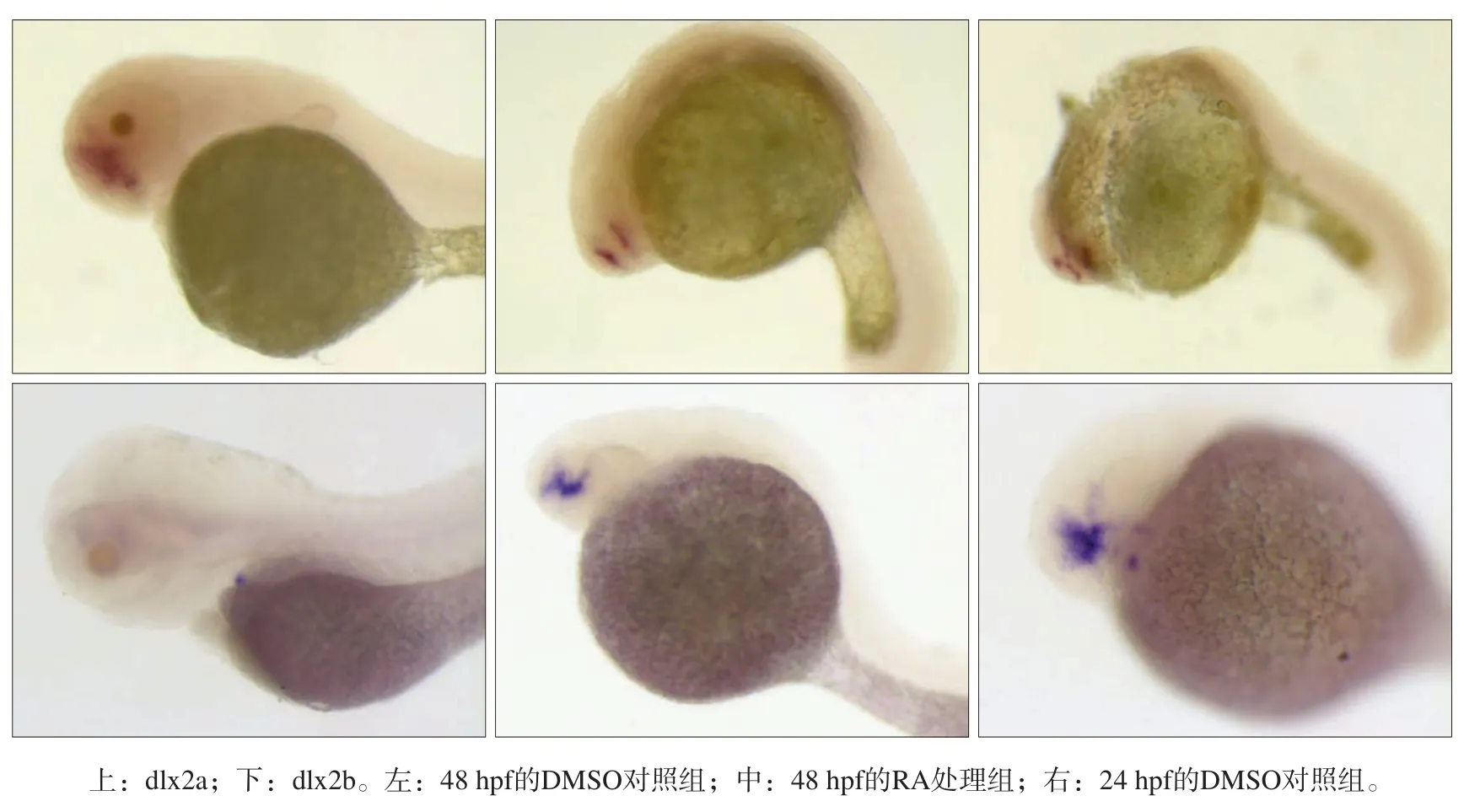
图 2 3×10-7 mol·L-1 RA处理组和DMSO对照组dlx2a、dlx2b的表达 整胚原位杂交 × 75Fig 2 Expression of dlx2a and dlx2b genes in 3×10-7 mol·L-1 RA group and DMSO group whole in situ hybridization × 75
2.3 荧光显微镜检测
3组的荧光表达见图3。RA处理组的dlx2b绿色荧光除在牙齿位点表达外,出现了向周边咽弓扩散的现象(图3中),疑似第七、第六咽弓均有dlx2b表达,DMSO对照组仅局限于牙胚上皮(图3左)。DEAB 处理组胚胎在4 dpf仍未观测到荧光表达(图3右)。
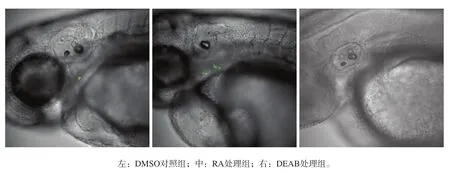
图 3 3组的荧光表达 荧光显微镜 × 80Fig 3 Expression of fluorescence in three groups fluorescence microscope × 80
3 讨论
RA信号是贯穿斑马鱼发育至成熟,乃至维护成年斑马鱼生态内环境稳定的非常重要的信号通路。视黄酸的命名源于最初发现其与视网膜内视紫红质受体相结合有关,深入研究后发现,视黄酸在整个人体的生长发育、细胞的分化成熟和功能发挥上都具有非常重要的作用,过多或缺乏均可导致不同种类的疾病。Mark等[11]在小鼠体内敲除RA受体后见小鼠胚胎发生大面积颅颌骨发育畸形、腭裂,但牙齿与牙列并未出现明显异常,猜测有两种可能,第一是在颅神经嵴迁移的过程中,该受体并无表达,即在这个期间RA信号可能有其他途径或受体代偿;第二,该受体经敲除后影响最明显的是颅神经嵴在迁移的过程中正在发育的组织,而小鼠不同于斑马鱼,其牙齿为第一咽弓发育来的口齿,从颅神经嵴迁移至颌部前已开始发育,且RAR敲除突变体小鼠第一咽弓来源的组织未见明显变化。但Lohnes等[12]的体外实验却得到小鼠的牙齿发育过程中RA是必不可少的结论。
不同于小鼠的发育模式,斑马鱼的牙齿是第七咽弓的咽上皮与颅神经嵴迁移至咽弓的咽弓神经嵴分化的间充质干细胞所形成的。国外学者Gibert等[13]做了调节斑马鱼RA表达水平的实验,证实斑马鱼的牙齿发育是需要RA信号的,其主要观点是围绕鲤形目鱼类牙齿进化方向是需要RA信号进行调控的。但牙齿的发育并不是单一信号通路所能决定的,关于RA信号与其他信号之间的相互作用也有诸多研究。Wehner等[14]研究证实RA在组织再生过程中接受来自Wnt/β-catenin的激活信号,向下传递给Fgf,并通过Wnt信号与Notch信号、HH信号相互作用。Gibert 等[7]通过分别和共抑制Fgf信号和RA信号发现二者在斑马鱼体内是独立调控牙齿发育的,但在青锵鱼和墨西哥脂鲤体内的实验结果则表明牙齿发育存在RA依赖性,Fgf处于下游,接受RA的调控,他提出不同进化程度的生物体内调节信号存在差异。
本实验发现,适量给予外源性RA信号,会导致斑马鱼的barx1在咽弓神经嵴的信号增强,增强的信号意味着细胞的活动增强,结合胚胎处于发育早期,增殖分化活动活跃,RA也可能增强神经嵴细胞的分裂和分化为牙齿前体细胞。dlx2a在咽弓神经嵴的表达因RA信号的加入而提前,其在前脑区的表达也明显增强。dlx2b的表达在RA处理下,荧光发生亮度增强,表达范围向咽弓周围扩散,本来仅为第七咽弓能够表达dlx2b的牙齿特异性基因,却出现在了周围咽弓的咽上皮,这一结果与Seritrakul等[6]的结果相一致,证实了RA能够使进化消失的咽齿再次表达牙胚上皮特异性标记物。在被DEAB阻断后无法合成RA的斑马鱼体内,barx1的表达出现了下调,dlx2a则仅在前脑表达,无明显迹象表明其在咽弓神经嵴有表达,提示颅神经嵴后迁的过程受到抑制,没有完成咽弓神经嵴的形成和间充质干细胞的分化。此外,dlx2b探针在RA处理的整胚原位杂交的结果并不显著,而在转基因鱼系中与对照组有明显差异,除dlx2b本身表达量较低外,可能与荧光蛋白的光稳定性有关。相较而言,原位杂交实验周期较长、步骤繁琐,期间mRNA可能发生不同程度降解,灵敏度较荧光蛋白有所差距。
本实验利用较高浓度RA进行了同步实验,在保证胚胎有较高的生存率的同时观察胚胎的生长发育,发现胚胎发育延迟约24 h,barx1于48 hpf的胚胎未见表达,dlx2a、dlx2b的表达则基本与24 hpf的胚胎无明显变化,均集中于斑马鱼的前脑、间脑和端脑,颅神经嵴、咽弓神经嵴及咽弓间充质无信号表达,牙齿无形成迹象。
本研究发现,适宜浓度RA可以促进斑马鱼颅神经嵴迁移至咽弓,分化为咽弓神经嵴和间充质干细胞,为进一步与牙源性上皮相互作用形成牙齿提供细胞来源。RA在脊椎动物的牙齿发育中作为信号分子的一员,发挥着稳健的推动作用,与牙列排布、牙齿形态有密切的联系,但更为深入的信号间错综复杂的调节网络以及信号与生物牙齿进化的复杂机制亟待进一步揭示。
[参考文献]
[1] Karbalaie K, Tanhaei S, Rabiei F, et al. Stem cells from human exfoliated deciduous tooth exhibit stromal-derived inducing activity and lead to generation of neural crest cells from human embryonic stem cells[J]. Cell J, 2015, 17(1): 37-48.
[2] Kaku M, Komatsu Y, Mochida Y, et al. Identification and characterization of neural crest-derived cells in adult periodontal ligament of mice[J]. Arch Oral Biol, 2012, 57(12): 1668-1675.
[3] Abe S, Hamada K, Miura M, et al. Neural crest stem cell property of apical pulp cells derived from human developing tooth[J]. Cell Biol Int, 2012, 36(10):927-936.
[4] Wen X, Liu L, Deng M, et al. In vitro cementoblast-like differentiation of postmigratory neural crest-derived p75 (+) stem cells with dental follicle cell conditioned medium[J]. Exp Cell Res, 2015, 337(1):76-86.
[5] Ritchie HH, Park H, Liu J, et al. Effects of dexamethasone, vitamin A and vitamin D3 on DSP-PP mRNA expression in rat tooth organ culture[J]. Biochim Biophys Acta, 2004, 1679(3):263-271.
[6] Seritrakul P, Samarut E, Lama TT, et al. Retinoic acid expands the evolutionarily reduced dentition of zebrafish[J]. FASEB J, 2012, 26(12):5014-5024.
[7] Gibert Y, Bernard L, Debiais-Thibaud M, et al. Formation of oral and pharyngeal dentition in teleosts depends on differential recruitment of retinoic acid signaling[J]. FASEB J, 2010, 24(9):3298-3309.
[8] Alexander C, Piloto S, Le Pabic P, et al. Wnt signaling interacts with bmp and edn1 to regulate dorsal-ventral patterning and growth of the craniofacial skeleton[J]. PLoS Genet, 2014, 10(7):e1004479.
[9] Sperber SM, Dawid IB. barx1 is necessary for ectomesenchyme proliferation and osteochondroprogenitor condensation in the zebrafish pharyngeal arches[J]. Dev Biol, 2008, 321(1):101-110.
[10] Aigler SR, Jandzik D, Hatta K, et al. Selection and constraint underlie irreversibility of tooth loss in cypriniform fishes[J]. Proc Natl Acad Sci USA, 2014, 111(21):7707-7712.
[11] Mark M, Lohnes D, Mendelsohn C, et al. Roles of retinoic acid receptors and of Hox genes in the patterning of the teeth and of the jaw skeleton[J]. Int J Dev Biol, 1995, 39(1):111-121.
[12] Lohnes D, Kastner P, Dierich A, et al. Function of retinoic acid receptor gamma in the mouse[J]. Cell, 1993, 73(4): 643-658.
[13] Gibert Y, Samarut E, Pasco-Viel E, et al. Altered retinoic acid signalling underpins dentition evolution[J]. Proc Biol Sci, 2015, 282(1802). DOI:10.1098/rspb.2014.2764.
[14] Wehner D, Weidinger G. Signaling networks organizing regenerative growth of the zebrafish fin[J]. Trends Genet, 2015, 31(6):336-343.
(本文采编 李彩)
[中图分类号]Q 78
[文献标志码]A [doi] 10.7518/hxkq.2016.02.002
[收稿日期]2015-08-12; [修回日期] 2015-10-16
[基金项目]国家自然科学基金(31571508,31371473);重庆市第七批重点学科建设项目《牙体牙髓病学》(2011)
[作者简介]刘鑫,住院医师,硕士,E-mail:tijiuwei@outlook.com
[通信作者]杨德琴,教授,博士,E-mail:yangdeqin@gmail.com
Retinoic acid signal pathway regulation of zebra fish tooth development through manipulation of the differentiation of neural crest
Liu Xin, Huang Xing, Xu Zhiyun, Yang Deqin. (Dept. of Conservative Dentistry and Endodontics, Stomatological Hospital of Chongqing Medical University, Chongqing Key Laboratory of Oral Diseases and Biomedical Sciences, Chongqing 401147, China)
Supported by: Natural Science Foundation of China (31571508, 31371473); The Seventh Batch of Key Discipline Construction Project of Chongqing—Endodontics and Operative Dentistry (2011). Correspondence: Yang Deqin, E-mail: yangdeqin @gmail.com.
[Abstract]Objective To investigate the mechanism of retinoic acid (RA) signal in dental evolution, RA is used to explore the influence of the mechanism on neural crest’s migration during the early stage of zebra fish embryos. Methods We divided embryos of wild type and transgenic line zebra fish into three groups. 1×10-7to 6×10-7mol·L-1RA and 1×10-7mol·L-14-diethylaminobenzaldehyde (DEAB) were added into egg water at 24 hpf for 9 h. Dimethyl sulfoxid (DMSO) with the concentration was used as control group. Then, antisense probes of dlx2a, dlx2b, and barx1 were formulated to perform whole-mount in situ hybridization to check the expressions of the genes in 48 hpf to 72 hpf embryos. We observed fluorescence of transgenic line in 4 dpf embryos. Results We obtained three mRNA probes successfully. Compared with DMSO control group, a low concentration (1×10-7mol·L-1) of RA could up-regulate the expression of mRNA (barx1, dlx2a) in neural crest. Obvious migration trend was observed toward the pharyngeal arch in which teeth adhered. Transgenic fish had spreading fluorescence tendency in pharyngeal arch. However, a high concentration (4×10-7mol·L-1) of RA malformed the embryos and killed them after treatment. One third of the embryos of middle concentration (3×10-7mol·L-1) exhibited delayed development. DEAB resulted in neural crest dysplasia. The expression of barx1 and dlx2a were suppressed, and the appearance of dlx2b in tooth was delayed. Conclusion RA signal pathway can regulate the progenitors of tooth by controlling the growth of the neural crest and manipulating tooth development.
[Key words]retinoic acid signal pathway; tooth development; neural crest; zebrafish

