变异链球菌耐酸毒力因子质子移位膜ATP酶在龋病进展中的动态变化
高敬 黄文明重庆医科大学附属口腔医院牙体牙髓病科·口腔疾病与生物医学重庆市重点实验室·重庆市高校市级口腔生物医学工程重点实验室,重庆 401147
变异链球菌耐酸毒力因子质子移位膜ATP酶在龋病进展中的动态变化
高敬 黄文明
重庆医科大学附属口腔医院牙体牙髓病科·口腔疾病与生物医学重庆市重点实验室·
重庆市高校市级口腔生物医学工程重点实验室,重庆 401147
[摘要]目的 研究变异链球菌耐酸毒力因子质子移位膜ATP酶(F-ATPase)在不同pH环境和龋病发生发展过程中的表达,评价F-ATPase在龋病进展中的动态变化。方法 将变异链球菌菌悬液在不同pH(pH4.0~7.0)和不同葡萄糖浓度(含5%和不含葡萄糖)的BHI液体培养基中培养,检测F-ATPase基因的表达水平。将雄性Wistar大鼠随机分成致龋组和对照组,其中致龋组喂养致龋饲料及5%葡萄糖水,对照组喂养普通饲料。每2周采集菌斑样本,检测F-ATPase基因的表达水平。第11周时取大鼠上下颌骨标本,对磨牙进行龋损评定。结果 1)5%葡萄糖浓度下变异链球菌F-ATPase基因的表达高于不含葡萄糖(P<0.05),在pH5.0时F-ATPase基因的表达最高,pH4.0时表达最低(P<0.05)。2)成功构建了龋病动物模型,在龋病发生发展过程中,致龋组和对照组F-ATPase的表达逐渐增强,致龋组表达高于对照组(P<0.05)。结论 耐酸毒力因子F-ATPase的表达变化与龋病的发生发展密切相关。
[关键词]龋病; 牙菌斑; 质子移位膜ATP酶; pH
耐酸性是细菌在致龋过程中最重要的毒力表现,细菌产酸后若不能耐酸,则细菌就不能继续生存、代谢。Bender等[1]研究发现细菌的耐酸性与细菌膜对质子的透过性有关,变异链球菌的耐酸性主要依赖于细胞膜上的质子移位膜ATP酶(membranebound proton-translocating ATPase,F-ATPase),通过F-ATPase将质子泵出胞内,使胞内pH(pHi)高于胞外pH(pHo),即维持了一个跨膜梯度ΔpH (pHi-pHo),保持胞内pH接近中性,保护胞浆中与糖酵解相关酶的活性,使菌细胞在低pH的苛刻环境中仍能产酸、生存并最终导致龋病的发生[2-3]。可见,F-ATPase是变异链球菌致龋菌耐酸的引擎和马达,与龋病的发生密切相关。
目前尚缺乏关于变异链球菌耐酸毒力因子FATPase在龋病发生发展过程中的研究,为了进一步了解F-ATPase在龋病进展中的变化,本研究建立致龋动物模型纵向研究F-ATPase基因在龋病进展中的表达变化,比较F-ATPase基因在不同pH环境的表达,以评价生物膜中耐酸毒力因子F-ATPase与龋病发生的关系。
1 材料和方法
1.1 实验菌株及动物
变异链球菌(Streptococcus mutans,S. mutans)标准株UA159由四川大学口腔疾病研究国家重点实验室提供。18 d龄的雄性Wistar大鼠购于重庆医科大学实验动物中心,许可证编号为SYXK(渝)2012-0001。
1.2 主要试剂及仪器
BHI培养基(OXOID公司,英国),YJ-875型超净工作台(苏州市华宇净化设备有限公司),FQ-聚合酶链反应(polymerase chain reaction,PCR)仪(Bio-Rad公司,美国) ,200型分光光度计(Thermo Fisher公司,美国),pH计(Mettler Toledo公司,瑞士),Bio-Rad电泳仪(Bio-Rad公司,美国)。
1.3 引物设计
根据GenBank报道的变异链球菌F-ATPase β亚基基因[4]序列及16sRNA基因序列(GenBank accession number NC_004350),采用Primer primer 5.0计算机软件设计引物。F-ATPase上游引物 5’-CGGATGCGTGTTGCTCTTACTG-3’,下游引物5’-GGCTGATAACCAACGGCTGATG-3’;16sRNA上游引物5’-TGGAACTGAGACACGGTCCA-3’,下游引物5’-CGCTTTACGCCCAGTAATTCCG-3’。引物由上海捷瑞生物工程有限公司合成。
1.4 不同pH和葡萄糖浓度下变异链球菌F-ATPase基因的表达
将变异链球菌标准株UA159复苏,培养24 h,3 000 r·min-1离心15 min,弃上清,用无菌生理盐水于紫外分光光度计540 nm处制备成吸光度为1.0的菌悬液备用。以0.5为间隔配制pH4.0~7.0系列的含5%葡萄糖和不含葡萄糖的BHI液体培养基。取变异链球菌悬液,按菌液与BHI液体培养基1∶10的体积比接种细菌,37 ℃厌氧培养至16 h指数生长期,每个样品一式3份,3 000 r·min-1离心15 min收集菌体,通过RNAiso Plus(Takara公司,日本)提取RNA,逆转录成cDNA,PCR扩增反应总体积为20 μL,含SYBR Premix Ex Taq(2x)10 μL(包括DNA Taq酶、Mg2+、dNTP、SYBR GreenⅠ荧光染料和Buffer缓冲液)、上下游引物各0.5 μL、模板cDNA 2 μL,加灭菌去离子水至20 μL。反应循环参数设置为三步法PCR扩增标准程序:95 ℃预变性3 min,95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,共40个循环。在延伸阶段收集荧光信号,循环结束后附加溶解曲线分析:95 ℃ 15 s,62 ℃ 23 s,95 ℃ 15 s。实验重复3次,取均值,收集实验数据,测定各样品的循环阈值(Ct值),通过2-ΔΔCt计算目的基因的相对表达量。
1.5 龋病动物模型的建立及变异链球菌F-ATPase基因表达检测
12只18 d龄的雄性Wistar大鼠,随机分为2组,致龋组6只,喂养致龋饲料2 000号及5%葡萄糖水;对照组6只,喂养普通饲料。从第1周开始每2周采集菌斑样本(共6次),采集样本前2 h大鼠禁食,腹腔注射10%水合氯醛麻醉,以棉拭子采集磨牙面及颊舌(颊腭)面的菌斑,置于含硫乙醇酸盐传送液的离心管中洗脱,将样本收集于离心管中,提取混合菌斑RNA,进行逆转录和实时荧光定量PCR(引物及反应体系同上)。结果取均值,通过2-ΔΔCt计算目的基因的相对表达量。
第11周时处死大鼠,取上下颌骨标本,染色,根据Keyes经典评分方法[5]对磨牙进行龋损评定,将龋损分为4级。E级:仅限于釉质;Ds级:累及釉质及牙本质外层1/4以内;Dm级:累及牙本质厚度的1/4至3/4;Dx级:累及超过牙本质厚度的3/4,甚至达牙本质全层。
1.6 数据分析
采用SPSS 17.0软件进行统计分析,所有数据均以均数±标准差表示,多组之间比较采用单因素方差分析。
2 结果
2.1 变异链球菌F-ATPase基因及16sRNA内参基因
F-ATPase基因和16sRNA内参基因经常规PCR都能得到特异性扩增,2%凝胶电泳显示各基因各实验组中的cDNA产物均为单一条带(图1、2),条带片段大小与引物预期扩增片段大小一致。
图 1 F-ATPase基因扩增产物电泳图Fig 1 Electrophoresis of products of F-ATPase gene
2.2 不同pH和葡萄糖浓度下变异链球菌F-ATPase基因的表达
不同pH和葡萄糖浓度下变异链球菌F-ATPase基因的表达见图3。实验结果显示,1)在pH5.0时FATPase基因的表达最高,然后依次是pH5.5、6.0、6.5,7.0,4.5,最低的是pH4.0(P<0.05);2)5%葡萄糖浓度下F-ATPase的表达高于不含葡萄糖(P< 0.05)。
2.3 大鼠磨牙龋病动物模型的建立
11周后处死大鼠,取磨牙进行Keyes评分,结果见图4和表1。实验成功构建了龋病动物模型,各组Wistar大鼠磨牙均有不同程度的龋损发生,但是龋损发生的严重程度、累及范围不尽相同。致龋组龋齿计分明显高于对照组,且龋坏病变的程度要高于对照组。对照组牙齿的损坏最小,仅达到牙本质中层,致龋组龋损多数达牙本质中层,其次是牙本质深层。
图 2 16sRNA基因扩增产物电泳图Fig 2 Electrophoresis of products of 16sRNA gene
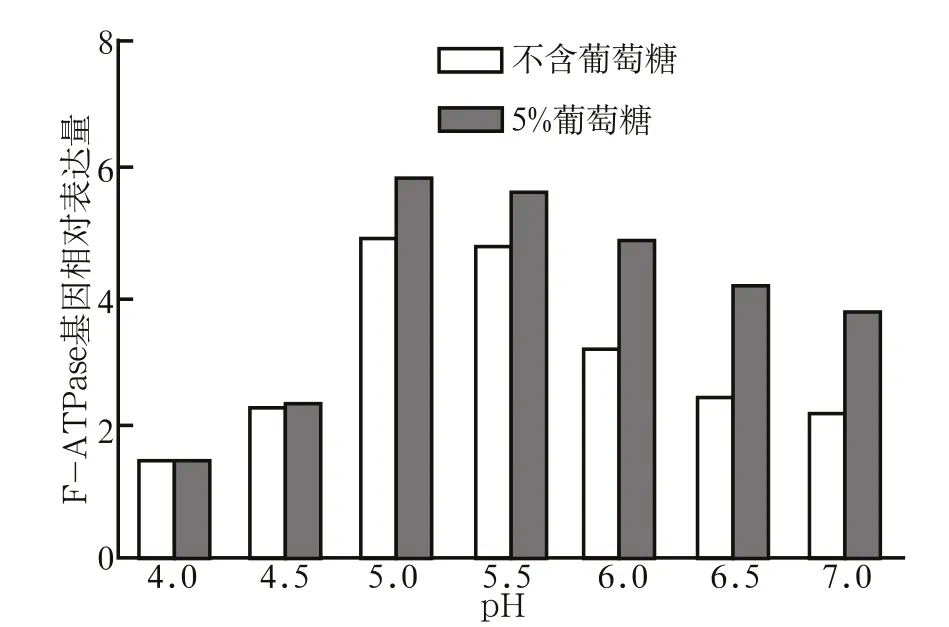
图 3 不同pH和葡萄糖浓度下变异链球菌F-ATPase基因的表达 Fig 3 F-ATPase expression under different pH and glucose con- centration
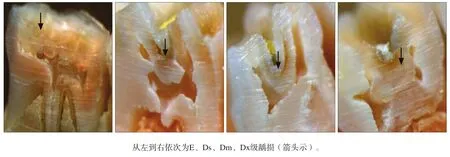
图 4 大鼠龋齿 体视显微镜 × 30Fig 4 The caries of rats stereomicroscope × 30
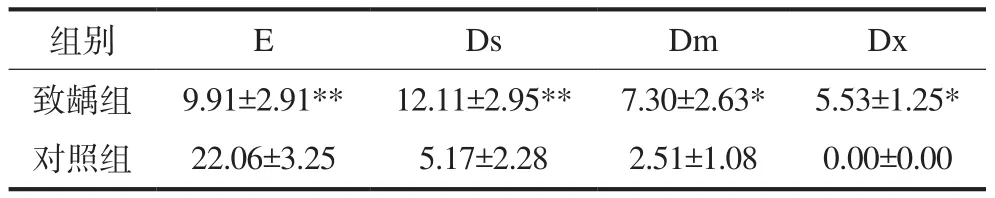
表 1 各组大鼠磨牙龋齿Keyes评分Tab 1 The Keyes score in the molar teeth of each rat group
2.4 龋病过程中F-ATPase基因的表达
龋病过程中各组F-ATPase基因的表达见表2。在龋病的发生发展过程中,随时间的推移各组F-ATPase基因的表达逐渐增强,致龋组表达高于对照组(P< 0.05),第9周后,致龋组增长程度有一定下降,对照组的表达下降。
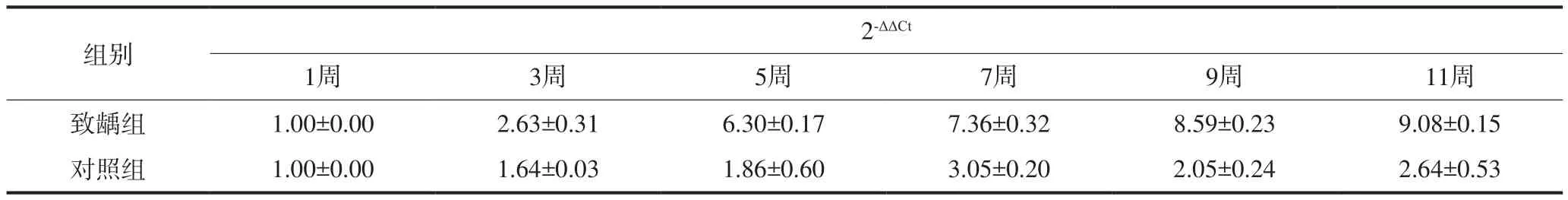
表 2 龋病过程中各组F-ATPase基因的表达Tab 2 F-ATPase expression in each group during the de velopment of caries
3 讨论
F-ATPase具有调节胞浆pH以及决定菌细胞耐酸性的生物学特性。细菌细胞的胞外质子向胞内扩散降低胞内pH,影响对酸敏感的糖酵解的活性,为了最大程度的发挥糖酵解的活性,致龋菌通过细胞膜和F-ATPase抵抗胞浆的酸化,F-ATPase将质子泵出细胞从而调节pH,使致龋菌在低pH值环境下仍能进行糖酵解[6-7]。
早期龋病研究表明,环境pH和糖在龋病的发生发展过程中起着重要的作用,而口腔原位环境是一个复杂且动态变化的环境,获取大鼠致龋过程中牙菌斑pH较困难,为了研究高糖浓度下变异链球菌FATPase基因的表达与pH之间的关系,本研究设计了体外实验,结果显示,变异链球菌在5%葡萄糖浓度下耐酸毒力因子F-ATPase表达高于不含葡萄糖环境。研究[8]表明,在高糖浓度下,变异链球菌的黏附毒力、产酸毒力、耐酸毒力及耐药毒力均高于低糖或无糖环境下,由此推测,高糖浓度下变异链球菌致龋能力上调。当外界环境中有充足的糖源时,变异链球菌能迅速合成胞外多糖,伴随着产酸耐酸能力的增强,环境中pH迅速下降,变异链球菌在酸压力状态下通过上调耐酸因子F-ATPase表达来维持生存代谢。Kuhnert等[4]对浮游状态的变异链球菌F-ATPase基因表达研究证实,在pH5.0时mRNA的表达水平大约是pH7.0时的2倍。研究[9]发现,当培养基中的pH 由8.0下降至5.0时,变异链球菌的F-ATPase活性提高4倍,从而增强了其质子泵作用。本实验研究也证实,高糖浓度下变异链球菌F-ATPase基因的表达高于无糖或低糖环境,F-ATPase的表达在pH5.0时最高,pH4.0时最低,pH5.0到7.0时F-ATPase表达缓慢降低,在pH5.0以下时F-ATPase的表达急剧减少。学者[10]研究对比了干酪乳杆菌、变异链球菌和血链球菌3种耐酸性分别为高、中、低的口腔耐酸菌膜结合F-ATPase的pH活性范围,发现其最适pH值分别为5.5、6.0和7.0,证明了细菌的相对耐酸性与F-ATPase的活性和最适pH值有关,活性越大,最适pH值越低。在酸性环境中排除胞内多余H+能力越强,因而越耐酸。可见在最适pH以内,F-ATPase的表达随pH降低而升高,而当pH降低至5.0以下时,酶活性超过最适pH使F-ATPase的表达量下降,同时强酸的环境压力可以使细菌合成ATP不足,并破坏细胞质内的蛋白结构使之死亡[11]。通过对大肠杆菌的研究,Kasimoglu等[12]发现,F-ATPase的表达量在转录和翻译水平的调控是多层次的,其中细菌的生长率在F-ATPase的产生和表达中起着比较重要的作用,大量细菌死亡也会导致生物膜中F-ATPase的表达量大大减少。同样在pH5.0以下的环境,随着变异链球菌的大量死亡,F-ATPase的基因表达在高糖和无糖环境中差异较小。
龋齿Keyes评分结果显示,致龋组龋齿计分明显高于对照组,且龋坏病变的程度要高于对照组,证明本实验龋齿模型的建立成功。实验中所使用的致龋饲料为高糖饲料,大鼠牙菌斑长期暴露在高糖的环境中,致龋菌有足够的底物产酸,造成牙菌斑内pH持续下降,在龋病发生发展过程中,致龋组和对照组F-ATPase表达均逐渐增强,致龋组表达高于对照组,第9周后,致龋组增长程度有一定下降,对照组的表达有一定下降。在实验过程中第5周时大鼠龋坏开始出现,在龋坏启动前期,变异链球菌等致龋菌大量产酸,使菌斑内pH达到脱矿临界值pH5.0~ 5.5。F-ATPase是一种应激蛋白,当外界环境pH下降时,变异链球菌F-ATPase基因表达上调,从而合成更多的F-ATPase蛋白以排除更多的氢离子维持细菌的生存,当更多的氢离子排到外环境时,环境中的pH继续下降酸蚀牙齿致龋。当龋病发展到第9周时,牙菌斑内微生物已经形成一个稳定的动态平衡状态,随着唾液蛋白等的中和缓冲作用,牙菌斑内pH值上升[13],F-ATPase表达下调。学者[14]分离临床牙菌斑中变异链球菌,结果表明高龋牙菌斑变异链球菌分离株黏附、产酸和耐酸能力高于无龋牙菌斑分离株。本实验中致龋组耐酸因子表达亦高于对照组。对照组大鼠使用的普通饲料内碳水化合物含量较低,大鼠本身的口腔自洁能力较强,唾液分泌较多,对菌斑内pH缓冲能力强,使菌斑pH维持在一个稳定的范围,F-ATPase的表达也维持在一个稳定的范围。
本文对变异链球菌耐酸毒力因子F-ATPase在不同pH中的基因表达进行了研究,并建立了大鼠致龋模型,结果显示,变异链球菌F-ATPase在pH5.0时表达最高,致龋组大鼠在龋病发展过程中F-ATPase表达上调,提示耐酸毒力因子F-ATPase在釉质脱矿及龋病的形成中发挥着重要的作用。
[参考文献]
[1] Bender GR, Sutton SV, Marquis RE. Acid tolerance, proton permeabilities, and membrane ATPases of oral streptococci [J]. Infect Immun, 1986, 53(2):331-338.
[2] Matsui R, Cvitkovitch D. Acid tolerance mechanisms utilized by Streptococcus mutans[J]. Future Microbiol, 2010, 5(3):403-417.
[3] Lemos JA, Quivey RG Jr, Koo H, et al. Streptococcus mutans: a new Gram-positive paradigm[J]. Microbiology, 2013, 159(Pt 3):436-445.
[4] Kuhnert WL, Zheng G, Faustoferri RC, et al. The F-ATPase operon promoter of Streptococcus mutans is transcriptionally regulated in response to external pH[J]. J Bacteriol, 2004, 186(24):8524-8528.
[5] Keyes PH. Dental caries in the molar teeth of rats. Ⅱ. A method for diagnosing and scoring several types of lesions simultaneously[J]. J Dent Res, 1958, 37(6):1088-1099.
[6] 杨德琴, 刘天佳, 付春华, 等. 变形链球菌F-ATPase亚基基因uncEBF基因多态性的研究[J]. 华西口腔医学杂志, 2007, 25(3):219-222. Yang DQ, Liu TJ, Fu CH, et al. Genetic diver sity of FATPase subunits gene uncEBF amplified from Streptococcus mutans clinical isolates[J]. West China J Stomatol, 2007, 25(3):219-222.
[7] Argimón S, Caufield PW. Distribution of putative virulence genes in Streptococcus mutans strains does not correlate with caries experience[J]. J Clin Microbiol, 2011, 49(3): 984-992.
[8] Sun M, Kang Q, Li T, et al. Effect of high-fructose corn syrup on Streptococcus mutans virulence gene expression and on tooth demineralization[J]. Eur J Oral Sci, 2014, 122 (3):216-222.
[9] Nakanishi-Matsui M, Sekiya M, Nakamoto RK, et al. The mechanism of rotating proton pumping ATPases[J]. Biochim Biophys Acta, 2010, 1797(8):1343-1352.
[10] Sturr MG, Marquis RE. Comparative acid tolerances and inhibitor sensitivities of isolated F-ATPases of oral lactic acid bacteria[J]. Appl Environ Microbiol, 1992, 58(7):2287-2291.
[11] MacGilvray ME, Lapek JD Jr, Friedman AE, et al. Cardiolipin biosynthesis in Streptococcus mutans is regulated in response to external pH[J]. Microbiology, 2012, 158(Pt 8): 2133-2143.
[12] Kasimoglu E, Park SJ, Malek J, et al. Transcriptional regulation of the proton-translocating ATPase (atpIBEFHAGDC) operon of Escherichia coli: control by cell growth rate[J]. J Bacteriol, 1996, 178(19):5563-5567.
[13] van Ruyven FO, Lingström P, van Houte J, et al. Relationship among mutans streptococci, “low-pH” bacteria, and lodophilic polysaccharide-producing bacteria in dental plaque and early enamel caries in humans[J]. J Dent Res, 2000, 79(2):778-784.
[14] Botelho MP, Maciel SM, Cerci Neto A, et al. Cariogenic microorganisms and oral conditions in asthmatic children[J]. Caries Res, 2011, 45(4):386-392.
(本文编辑 李彩)
[中图分类号]R 780.2
[文献标志码]A [doi] 10.7518/hxkq.2016.02.019
[收稿日期]2015-07-12; [修回日期] 2015-10-18
[基金项目]国家自然科学基金(31371473);重庆市卫生局医学科研计划(2012-2-129);重庆市卫生局医学科研计划重点项目(2011-1-062);重庆市渝北区科技项目(2011)
[作者简介]高敬,硕士,E-mail:326188065@qq.com
[通信作者]黄文明,讲师,硕士,E-mail:jxhwm@163.com
Dynamic changes of aciduric virulence factor membrane-bound proton-translocating ATPase of Streptococcus mutans in the development of dental caries
Gao Jing, Huang Wenming. (Dept. of Conservative Dentistry and Endodontics, Stomatological Hospital of Chongqing Medical University; Chongqing Key Laboratory of Oral Diseases and Biomedical Sciences; Chongqing Municipal Key Laboratory of Oral Biomedical Engineering Higher Education, Chongqing 401147, China)
Supported by: Natural Science Foundation of China (31371473); Medical Scientific Research Plan of Chongqing Municipal Health Bureau (2012-2-129); Key Program for Medical Scientific Research Plan of Chongqing Municipal Health Bureau (2011-1-062); Scientific and Technical Program of Chongqing Yubei District (2011). Correspondence: Huang Wenming, E-mail: jxhwm@163.com.
[Abstract]Objective To observe the dynamic changes of membrane-bound proton-translocating ATPase (F-ATPase) in the development of dental caries, the expression of Streptococcus mutans F-ATPase under different pH concentrations and during the development of dental caries is analyzed. Methods Streptococcus mutans cultured under different pH (pH4.0-7.0) concentrations and containing 5% glucose and no glucose containing BHI were collected. RNA was extracted. Subsequently, F-ATPase gene was detected using real-time polymerase chain reaction. Male Wistar rats were divided randomly into caries group and control group. The rats in the caries group were fed caries feed and 5% glucose water, whereas those of control group were fed normal feed. Total RNA was extracted from plaque samples, which were collected from rats’ oral cavity every two weeks. F-ATPase gene was detected by real-time PCR. In the 11th week, the upper and lower jaw bone specimens of rats were taken, and molar caries damage assessed. Results The expression of F-ATPase in the caries group was higher than that in the control group (P<0.05). In addition, the gene was expressed highest in pH5.0 and the lowest in pH4.0 (P<0.05). 2) The expression of F-ATPase progressively increased during the caries development in both groups; expression in the caries group was higher than that in control group (P<0.05). Conclusion Acid-resisting viru-lence factor F-ATPase is related closely with the incidence and development of dental caries.
[Key words]dental caries; dental plaque; membrane-bound proton-translocating ATPase; pH

