Notch1蛋白高表达抑制破骨细胞增殖和分化
平依林 娄锋 杨肖 张平口腔疾病研究国家重点实验室 华西口腔医院(四川大学),成都 610041
Notch1蛋白高表达抑制破骨细胞增殖和分化
平依林 娄锋 杨肖 张平
口腔疾病研究国家重点实验室 华西口腔医院(四川大学),成都 610041
[摘要]目的 探究体外培养条件下Notch1蛋白高表达对细胞核因子κB受体活化因子配体(RANKL)和巨噬细胞集落刺激因子(MCSF)诱导的骨髓源破骨细胞增殖分化的影响。方法 体外培养Rosa-notch1转基因小鼠骨髓间充质干细胞(BMSCs),采用RANKL和MCSF刺激BMSCs向破骨细胞方向分化。培养至第3天,实验组和对照组分别转染携带Cre重组酶和绿色荧光蛋白(GFP)的重组腺病毒(Ad-Cre-GFP)和携带GFP的重组腺病毒(Ad-GFP),启动实验组Notch1高表达,采用实时聚合酶链反应(RT-PCR)检测Notch信号通路成分(Notch1、Notch2、Notch3、Notch4、Delta1、Delta3、Delta4、Jagged1)、靶基因(Hes1)mRNA表达量以及抗酒石酸酸性磷酸酶(TRAP)在诱导后mRNA的表达量。采用TRAP染色法观察破骨细胞增殖分化情况。结果 TRAP染色显示实验组破骨细胞形成数量明显少于对照组(P<0.05)。与对照组相比,实验组Notch1、Notch3、Jagged1、Delta3、Hes1 mRNA表达量明显增高(P<0.05),TRAP的mRNA表达量明显降低(P<0.05)。结论 Notch1高表达抑制RANKL和MCSF诱导的破骨细胞增殖分化。
[关键词]Notch1; 破骨细胞; 骨髓间充质干细胞
牙槽骨吸收是各型牙周炎主要症状之一,牙槽骨吸收过程中破骨细胞的激活和功能亢进是关键环节,其增殖、分化受到Notch信号通路的调控[1-3]。研究破骨细胞增殖、分化过程中Notch信号通路调节作用,可以进一步了解牙槽骨吸收机制;抑制Notch信号通路可能成为治疗牙槽骨吸收提供新依据。已有研究[1]表明,敲除骨髓源巨噬细胞Notch1,将促使其向破骨细胞方向分化。然而,Notch1蛋白高表达对破骨细胞增殖、分化有何影响,目前仍不明确。本研究旨在探讨在体外培养条件下,Notch1蛋白高表达对破骨细胞增殖、分化的影响。
1 材料和方法
1.1 实验动物
选取8周龄SPF级雄性转基因小鼠Rosa-notch1(The Jackson Laboratory,美国)6只,体重(19±2) g。
1.2 试剂
α-MEM、胎牛血清(Hyclone公司,澳大利亚),青霉素/链霉素(Hyclone公司,美国),腺病毒(上海汉恒生物有限公司),鼠重组细胞核因子κB受体活化因子配体(receptor activator for nuclear factor-κB ligand,RANKL)、抗酒石酸酸性磷酸酶(tartrate resistant acid phosphatase,TRAP)、巨噬细胞集落刺激因子(macrophage colony-stimulating factors,MCSF)(Peprotech公司,美国),染色试剂盒(Sigma公司,美国),TRIzol提取液(Invitrogen公司,美国),QuantiTect®反转录试剂盒、实时聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)试剂盒(凯基公司,德国),ABI7300 RTPCR仪(Applied Biosystems公司,美国)。
1.3 破骨细胞培养及病毒转染
颈椎脱臼法处死8周龄雄性Rosa-notch1小鼠,75%乙醇浸泡消毒2 min,无菌条件下分离股骨及胫骨,剪断两侧骨骺端,用注射器针头插入断端,将培养基轻轻冲洗骨髓腔于50 mL无菌离心管中。采用注射器吹打骨髓间充质干细胞(bone marrow stem cells,BMSCs)呈悬浮液,过滤,计数,用α-MEM培养液将细胞密度调整至每毫升3×105个,加入10-5mol·L-1MCSF,混匀后铺盘(48孔板),每孔培养基500 μL(含10 ng·mL-1MCSF)。37 ℃、5%CO2条件下用完全培养基(含α-MEM培养基、10%胎牛血清、1%青霉素/链霉素)培养至第3天,实验组和对照组培养基中分别加入1 μL 1010pfu·mL-1携带Cre重组酶和绿色荧光蛋白(green fluorescent protein,GFP)的重组腺病毒(Ad-Cre-GFP)和携带GFP的重组腺病毒(Ad-GFP),8 h换液,并加入10-5mol·L-1RANKL,致MCSF和RANKL终浓度均为10 ng·mL-1。转染病毒36 h后观察对照组和实验组均出现绿色荧光(图1),表明病毒转染成功。培养第4天起每天全换液,加入新鲜配制的完全培养基(含10 ng·mL-1MCSF,10 ng·mL-1RANKL)。
1.4 采用RT-PCR法检测Notch信号通路成分、下游靶基因Hes1及TRAP mRNA表达量
培养至第8天时,去培养基,每6孔加入1 mL TRIzol,静置2~3 min后,将含有细胞的TRIzol转至去RNA酶1.5 mL离心管,加入200 μL氯仿,振荡,室温放置3 min,12 000 r·min-14 ℃离心15 min,转上层水相至新去RNA酶1.5 mL离心管,加入异丙醇500 μL,混合后静置10 min,12 000 r·min-14 ℃离心10 min,去上清,加入1 mL 75%乙醇,振荡混合2~ 3 min,10 000 r·min-14 ℃离心5 min,倒掉上清,室温放置20 min使RNA沉淀干燥,加20 μL经焦碳酸二乙酯处理双蒸水至EP离心管中。紫外分光光度计测定RNA260 nm/RNA280 nm光密度值以检测RNA样品的纯度和浓度。按QuantiTect®逆转录试剂盒标明的操作步骤进行逆转录,采用SYBR GREEN试剂盒进行RT-PCR分析,检测Notch信号通路成分(Notch1、Notch2、Notch3、Notch4、Delta1、Delta3、Delta4、Jagged1)、Hes1 mRNA表达量以及TRAP在诱导后mRNA的表达量。设计针对基因与β-actin内参照的引物,具体如下。Notch1正义链5’-CTGAGGCAAGGATTGGAGTC-3’,反义链5’-GAATGGAGGTAGGTGCGAAG-3’;Notch2正义链5’-TGTGCCGTTGTGGTAGGTAA-3’,反义链5’-TGCTGTGGCTCTGGCTGT-3’;Notch3正义链5’-GAATCTGGAAGACACCCTGG-3’,反义链5’-AAGCGTCTCCTGGATGCTG-3’;Notch4正义链5’-TTCTGTCCCTCATAGCCTGG-3’,反义链5’-GGATAATATGAACCCCTGCG-3’;Delta1正义链5’-CTCCCCTGGTTTGTCACAGT-3’,反义链5’-GGAGAAGATGTGCGACCCT-3’;Delta3正义链5’-GTTCCCATCACAAGGTCCAG-3’,反义链5’-TCCCTGTCTCCACCAGTAGC-3’;Delta4正义链5’-TATAACCCTTTGGCCCACTG-3’,反义链5’-ATGGGGAGGTCTGTTTTGTG-3’;Jagged1正义链5’-GGCGAAACTGAAAGGCAGTA-3’,反义链5’-GCTTCGGCTCAGGGTCTAC-3’;Hes1正义链5’-GGTATTTCCCCAACACGCT-3’,反义链5’-GGCAGACATTCTGGAAATGA-3;TRAP正义链5’-GCAAGGTCCCCAACGGCTATC-3’, 反义链5’-GCCTCGGCAGCCTGGTCT-3’。
PCR反应体系均为20 μL,反应液各成分分别为SYBR Premix Ex Taq Ⅱ10 μL,上游引物0.8 μL,下游引物0.8 μL,DNA模板2.0 μL,dH2O 6.0 μL,ROXReference Dye Ⅱ0.4 μL。每组4个复孔。其相对表达量采用ΔΔCt方法计算。
1.5 TRAP染色及TRAP阳性细胞计数
将小鼠BMSCs接种于48孔板中,按上述分组培养,培养结束后弃去培养基,PBS洗涤2次。4%多聚甲醛液固定10 min,PBS洗2次,37 ℃条件下用TRAP染色液染色30 min,双蒸水洗3次。显微镜下观察并进行破骨细胞计数,将细胞核数目3个或3个以上,且TRAP染色呈阳性的细胞视为破骨细胞。
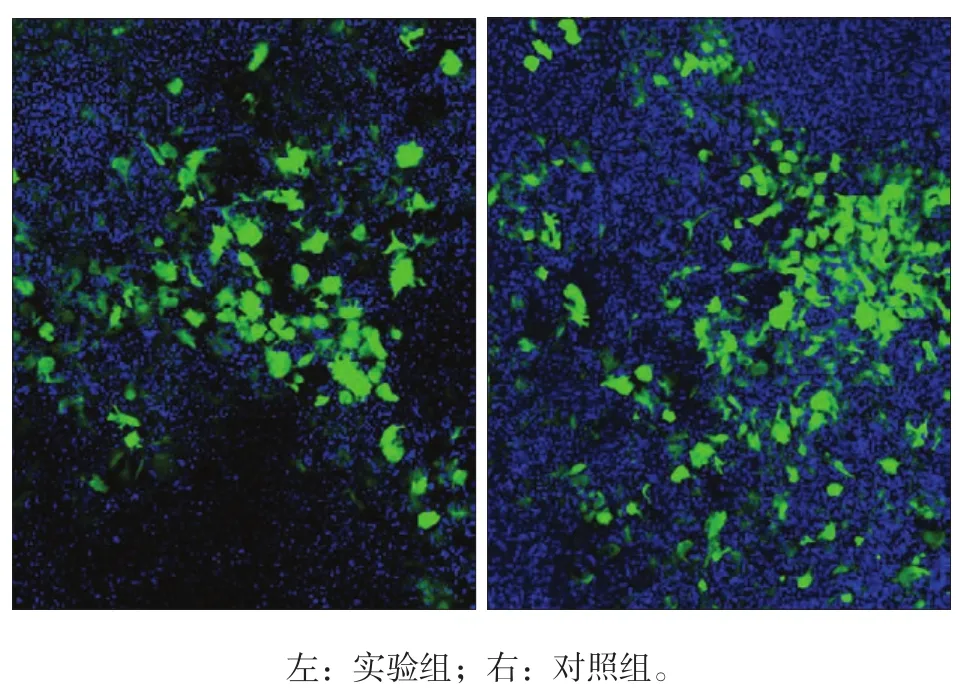
图 1 病毒转染细胞后,小鼠BMSCs细胞表达GFP 荧光显微镜 × 40 Fig 1 BMSCs those transfected successfully expressed GFP fluo- rescence microscope × 40
1.6 统计学分析
采用SPSS 18.0统计软件包进行分析,破骨细胞数目以均数±标准差表示,采用t检验分析两组破骨细胞数量是否具有统计学意义,检验水准α=0.05。
2 结果
2.1 Notch信号成分、下游靶基因Hes1及TRAP mRNA 的表达量
RANKL和MCSF诱导Rosa-notch1小鼠BMSCs向破骨方向分化至第8天,检测2组Notch信号成分、Hes1、TRAP mRNA的相对表达量,实验组和对照组Notch1、Notch2、Notch3、Notch4、Delta1、Delta3、Delta4、Jagged1、Hes1、TRAP mRNA表达量比值分别为2.546±0.435、1.784±0.342、1.980±0.188、0.876± 0.197、1.261±0.361、2.162±0.302、1.084±0.154、3.093±0.376、2.750±0.081、0.421±0.012。2组Notch1、Notch3、Delta3、Jagged1、Hes1、TRAP mRNA表达量差异具有统计学意义(P<0.05)。实验组破骨细胞中Notch1、Notch3、Jagged1、Delta3、Hes1表达量显著高于对照组(P<0.05),提示Notch信号通路参与骨髓源破骨细胞增殖分化过程。同时,实验组破骨细胞中TRAP mRNA相对表达量却明显低于对照组(P<0.05),提示Notch1高表达抑制破骨细胞增殖分化。
2.2 破骨细胞的TRAP染色
培养至8天时破骨细胞数目及大小出现明显差异,此时行TRAP染色,显微镜下观察可见,对照组破骨细胞较实验组数目多,分化成熟(图2)。实验组和对照组破骨细胞的形成数量分别为(111.5± 6.6)和(191.8±23.8)个,二者间差异有统计学意义(P<0.05)。

图 2 TRAP染色后破骨细胞的形态 体视显微镜 × 25 Fig 2 Osteoclasts morphology with TRAP staining stereomicro- scope × 25
3 讨论
在哺乳动物中,Notch信号通路成分简单,包括4种受体(Notch1、2、3、4)和5种配体(Jagged1、2,Delta 1、3、4)和DNA结合蛋白。相邻细胞膜上受配体相互作用,Notch受体胞内段(Notch intracellulardomain,NICD)从膜上释放,NICD进入细胞核后与DNA结合的抑制蛋白转化为转录激活因子,激活下游靶基因的表达,从而调控多种细胞的增殖、分化过程[4-5]。破骨细胞增殖分化受到Notch信号通路的调节[6-7]。在牙周炎中,破骨细胞分化的激活和功能亢进是牙周病牙槽骨吸收的关键环节[8],对破骨细胞分化调控机制的探讨,可进一步了解牙周病过程中牙槽骨吸收原理,为防治牙槽骨吸收提供新思路。
在本研究中,为了使Notch信号通路激活,将Rosa-notch1小鼠BMSCs由RANKL和MCSF诱导分化培养至第3天实验组和对照组细胞分别进行Ad-Cre-GFP病毒和Ad-GFP病毒转染。Ad-Cre-GFP病毒转染成功后表达Cre重组酶和GFP,Cre重组酶可由2个各含有一个lox序列的核酸序列进行位点特异性重组,使Rosa-notch1小鼠BMSCs内终止子敲除,从而启动Notch1蛋白高表达激活Notch信号通路。而Ad-GFP病毒转染后,只表达GFP,无Cre重组酶,因此不能启动Notch1高表达。细胞培养至第8天,大量破骨细胞形成,实验组破骨细胞中多种Notch信号成分及下游靶基因表达增强,TRAP mRNA表达量降低。Notch1高表达后,Delta3、Jagged1配体mRNA表达量上升,提示参与破骨细胞分化的受配体对可能是Notch1-Jagged1或Notch1-Delta3。Notch1高表达后,多核破骨细胞的数量明显减少,提示在体外培养环境下,Notch1高表达可能抑制骨髓源破骨细胞的增殖、分化过程。该研究在体外实验中通过病毒转染,成功启动Notch1蛋白高表达来刺激Notch信号通路,是本研究一大创新之处。但本研究也存在一定不足:本研究仅采用体外培养破骨细胞方式进行实验,但体外环境与体内环境存在差异,所以仍需在转基因小鼠体内进行基因敲除来进一步验证实验结果。
与本研究类似,Bai等[1]研究表明,体外敲除骨基质巨噬细胞中的Notch1可以促进破骨细胞前体的增殖与分化。王汝杰等[9]研究认为Jagged1可以抑制RAW264.7细胞的增殖,而加入DAPT阻断Notch通路后Jagged1抑制RAW264.7细胞增殖作用明显减弱。以上研究结果也提示Notch信号通路对破骨细胞有抑制作用。
Sekine等[10]研究提示Dll 1通过与Notch 2受体结合促进破骨细胞分化,并且在破骨前体细胞向破骨细胞分化过程中,Dll 1/Notch 2间的正向调控效应为主导作用。何飞等[11]研究提示,参与RAW264.7细胞向破骨细胞分化的主要受-配体对可能是Notch2-Jagged1。
目前关于Notch1蛋白对破骨细胞增殖、分化的影响仍存在差异,其原因可能是:首先,各文献中破骨细胞所处的状态有差异,众所周知,在体内实验和体外实验中细胞所处微环境迥异,可能导致细胞对外界刺激的反应有差异。其次,Notch信号通路包含多种受体配体,研究[12-13]提示Notch信号通路中不同受体配体组合在同一细胞中可能发挥不同的作用,所以不同Notch受-配体组合在破骨细胞分化作用机制是否相同仍有待研究。
总之,笔者的研究提示Notch1蛋白参与并抑制体外培养条件下骨髓源破骨细胞的增殖分化,但其具体机制仍不甚明确,值得进一步探讨。
[参考文献]
[1] Bai S, Kopan R, Zou W, et al. NOTCH1 regulates osteoclastogenesis directly in osteoclast precursors and indirectly via osteoblast lineage cells[J]. J Biol Chem, 2008, 283(10): 6509-6518.
[2] Teitelbaum SL. Bone resorption by osteoclasts[J]. Science, 2000, 289(5484):1504-1508.
[3] 沈逸, 何东仪. 调控破骨细胞分化发育的信号转导通路的研究进展[J]. 现代免疫学, 2013, 33(4):341-345, 349. Shen Y, He DY. The research progress of signaling pathways regulating osteoclasts differentiation and development[J]. Modern Immunol, 2013, 33(4):341-345, 349.
[4] Artavanis-Tsakonas S, Rand MD, Lake RJ. Notch signaling: cell fate control and signal integration in development[J]. Science, 1999, 284(5415):770-776.
[5] Chiba S. Notch signaling in stem cell systems[J]. Stem Cells, 2006, 24(11):2437-2447.
[6] Engin F, Yao Z, Yang T, et al. Dimorphic effects of Notch signaling in bone homeostasis[J]. Nat Med, 2008, 14(3):299-305.
[7] Engin F, Lee B. NOTCHing the bone: insights into multifunctionality[J]. Bone, 2010, 46(2):274-280.
[8] Racz GZ, Kadar K, Foldes A, et al. Immunomodulatory and potential therapeutic role of mesenchymal stem cells in periodontitis[J]. J Physiol Pharmacol, 2014, 65(3):327-339.
[9] 王汝杰, 刘复州, 沈伟伟, 等. Jagged1活化Notch通路促进RAW 264.7向破骨细胞分化但抑制增殖[J]. 中国免疫学杂志, 2014, 30(7):865-869. Wang RJ, Liu FZ, Shen WW, et al. Jagged1 promotes osteoclast differentiation and inhibits proliferation by activating of Notch signaling pathway induced[J]. Chin J Immunol, 2014, 30(7):865-869.
[10] Sekine C, Koyanagi A, Koyama N, et al. Differential regulation of osteoclastogenesis by Notch2/Delta-like 1 and Notch1/Jagged1 axes[J]. Arthritis Res Ther, 2012, 14(2): R45.
[11] 何飞, 吴勇, 周艳. Notch信号促进核因子κB受体活化因子配体诱导的破骨细胞分化的体外研究[J]. 华西口腔医学杂志, 2015, 33(1):25-28. He F, Wu Y, Zhou Y. Notch signaling promotes receptor activator of nuclear factor kappa B ligand-induced ostoclastogenesis of RAW264.7 cells in vitro[J]. West China J Stomatol, 2015, 33(1):25-28.
[12] Matsuo K, Irie N. Osteoclast-osteoblast communication[J]. Arch Biochem Biophys, 2008, 473(2):201-209.
[13] Jaleco AC, Neves H, Hooijberg E, et al. Differential effects of Notch ligands Delta-1 and Jagged-1 in human lymphoid differentiation[J]. J Exp Med, 2001, 194(7):991-1002.
(本文采编 石冰)
[中图分类号]Q 257
[文献标志码]A [doi] 10.7518/hxkq.2016.02.003
[收稿日期]2015-07-20; [修回日期] 2015-11-06
[作者简介]平依林,硕士,E-mail:771319243@qq.com
[通信作者]张平,教授,博士,E-mail:pingzhang68@hotmail.com
Up-regulation of Notch1 inhibits proliferation and differentiation of osteoclast in vitro
Ping Yilin, Lou Feng, Yang Xiao,Zhang Ping. (State Key Laboratory of Oral Diseases, West China Hospital of Stomatology, Sichuan University, Chengdu 610041, China)
Correspondence: Zhang Ping, E-mail; pingzhang68@hotmail.com.
[Abstract]Objective This study aimed to explore the effect of the up-regulation of Notch1 on osteoclastogenesis induced to osteoclasts by receptor activator for nuclear factor-κB ligand (RANKL) and macrophage colony-stimulating factors (MCSF) in vitro. Methods The bone marrow stem cells (BMSCs) of Rosa-notch1mice were cultured and induced to osteoclasts by RANKL and MCSF. The BMSCs were transfected with the Ad-Cre-green fluorescent protein (GFP) virus or Ad-GFP virus. Total RNA from cells was extracted, and the gene expression levels of Notch1, Notch2, Notch3, Notch4, Delta1, Delta3, Delta4, Jagged1, Hes1, and tartrate resistant acid phosphatase (TRAP) were detected at the defined stage by reverse transcriptionpolymerase chain reaction (RT-PCR). Osteoclast formation was analyzed by TRAP assay. Results The number of TRAP-positive multinuclear cells of the experimental group significantly decreased compared with that of the control group. The mRNA expression levels of Notch1, Notch3, Jagged1, Delta3, and Hes1 of the experimental group were significantly higher than those of the control group, whereas the TRAP mRNA expression of the experimental group was significantly lower than that of the control group (P<0.05). Conclusion Up-regulation of Notch1 inhibit osteoclastogenesis of BMSCs induced by RANKL and MCSF in vitro.
[Key words]Notch1; osteoclast; bone marrow stem cells

