Runt相关基因2修饰的骨髓间充质干细胞促进兔下颌骨牵张成骨的研究
冯桂娟 郑科 宋冬惠 吴森斌 祝颂松 胡静.南通大学附属医院口腔科,南通 600;.口腔疾病研究国家重点实验室 华西口腔医院正颌与关节外科(四川大学),成都 6004
Runt相关基因2修饰的骨髓间充质干细胞促进兔下颌骨牵张成骨的研究
冯桂娟1郑科1宋冬惠1吴森斌1祝颂松2胡静2
1.南通大学附属医院口腔科,南通 226001;2.口腔疾病研究国家重点实验室 华西口腔医院正颌与关节外科(四川大学),成都 610041
[摘要]目的 探讨Runt相关基因2(Runx2)修饰的自体骨髓间充质干细胞(MSCs)促进兔下颌牵张成骨新骨形成的可行性。方法 将48只成年雄性新西兰大白兔随机分为3组:A组为Runx2重组质粒组,B组为不含Runx2重组质粒组,C组为生理盐水对照组。建立兔下颌牵张成骨模型;于牵张的第5天,A组兔牵张间隙内注射转染重组质粒adv-hRunx2-gfp的自体骨髓MSCs;B组注射转染adv-gfp质粒的自体骨髓MSCs;C组注射同体积生理盐水。在牵张结束后第8周处死所有动物,进行大体、影像学、组织学观察和三点弯曲测试。结果 CT平扫及组织学结果表明,A组牵张间隙内新骨形成和骨痂密度均明显高于B、C组;双能X线及三点弯曲测试表明,A组牵张间隙内新生骨组织密度、新生骨矿物质含量及最大载荷均高于B、C组(P<0.01)。结论 基于MSCs的Runx2体外基因治疗可有效地促进牵张成骨新骨形成,从而缩短固定期,为临床颅颌面骨缺损的重建提供一个极具价值的修复策略。
[关键词]Runt相关基因2; 间充质干细胞; 下颌骨; 牵张成骨
内源性骨组织工程的牵张成骨最初在矫正肢体长度差异的矫形手术中得到广泛应用,随后被用于治疗颅面短小症和颌骨缺损。牵张成骨术是利用骨的自身愈合来增加新骨的一种方法。该技术通过牵张装置,使骨切开处的骨组织受到缓慢而稳定的牵引和张力,从而达到增长或伸直骨骼的目的。与传统骨移植方法相比,牵张成骨能够避免植骨区骨吸收以及供骨区功能障碍等一系列并发症,且这种技术能够实现周围软组织的三维空间生长并行延长。疗程长以及可能的纤维性愈合或不愈合是阻碍牵张成骨广泛应用于临床的主要因素[1]。Runt相关基因2 (Runt-related transcription factor 2,Runx2)编码的核蛋白在成骨细胞分化和骨形成过程中起重要作用,并参与骨骼基因的表达和调控。研究[2]表明,Runx2在体内可以有效诱导成骨细胞的增殖分化和促进新骨生成的质量和数量。因此,促进Runx2的表达可能是一个有效促进骨形成的治疗途径。骨髓间充质干细胞(mesenchymal stem cells,MSCs)能在体外分化为成骨细胞和软骨细胞,在体内促进骨形成,已成为骨组织工程的主要细胞来源[3]。本研究拟采用Runx2基因修饰的MSCs来促进下颌骨牵张成骨过程中的新骨生成,缩短治疗周期,从而为临床运用Runx2体外基因治疗促进牵张成骨新骨形成的可行性提供实验依据。
1 材料和方法
1.1 材料
48只成年雄性新西兰白色家兔,体重2.6~3.0 kg。实验动物的喂养与使用遵守南通大学动物伦理委员会的有关规定。48枚单边纯钛钉、外固定牵张器由本课题组与四川大学华西口腔医院共同设计和研制。牵张器最大牵张距离为20 mm,螺距1.0 mm,使用长35 mm、直径1.8 mm的纯钛螺钉穿皮质骨固定。CT机(μ CT-80型,Scanco Medical AG公司,瑞士);双能X线(dual energy X ray,DXA)骨密度检测仪(FR216Ⅲ1438型,DMS公司,法国,由四川大学华西医院提供);INSTRON 5565型生物力学测试系统(Instron公司,美国,由四川大学口腔疾病研究国家重点实验室提供);重组腺病毒(由北京本元正阳基因技术股份有限公司构建);兔Runx2抗体(上海博研生物工程研究中心);兔Runx2引物(上海斯信生物科技有限公司,正向引物5’-GGAATGCCTCTGCTGTTATG-3’;反向引物5’-GGATTTGTGAAGACGGTTATGG-3’)。
1.2 MSCs分离、培养与基因转染
采用密度梯度离心法从兔胫骨中分离出骨髓MSCs进行培养,取第3代的MSCs用于体外基因转染和体内基因移植。构建携带有人Runx2基因和绿色荧光蛋白(green fluorescent protein,GFP)复制缺陷型E1-/E3-腺病毒(adv-hRunx2-gfp),构建只含有GFP复制缺陷型E1-/E3-腺病毒(adv-gfp)。当骨髓MSCs生长至80%融合时,分别转染adv-hRunx2-gfp和adv-gfp。转染后GFP和Runx2的表达分别经荧光显微镜和Western blot及实时定量PCR检测证实。
1.3 制备兔下颌骨牵张成骨模型
所有的白兔均行右侧下颌骨牵张成骨。以自制的纯钛口外牵张装置,截开下颌骨后固定。3 d的延迟期后以每天2 mm的速度逐渐牵张5 d。将48只兔子随机分为3组,A组为Runx2重组质粒组,B组为不含Runx2重组质粒组,C组为生理盐水对照组。术后2周内喂予软质饲料,并每日肌注青霉素预防感染。
1.4 基因治疗
在牵张的第5天,A组在牵张间隙内注射含有1× 107个adv-hRunx2-gfp转染的MSCs(重悬于0.15 mL生理盐水中),B组注射含有相同剂量的adv-gfp转染的MSCs(重悬于0.15 mL生理盐水中),C组仅注射0.15 mL生理盐水。
1.5 标本获取及检测
在牵张结束后第8周动物均被处死,解剖并获取牵张侧的下颌骨。
1.5.1 大体观察 观察实验动物的一般表现、伤口愈合情况、下颌骨牵张区域新骨形成及新生骨与原宿主骨交界情况。
1.5.2 影像学观察 各组动物分别行牵张成骨区CT平扫、DXA检测,并测量下颌骨牵张间隙内的骨密度(bone mineral density,BMD)及骨矿物质含量(bone mineral content,BMC),观察延长区新生骨生长状况。
1.5.3 三点弯曲测试 每组随机选取8个标本,在生物力学测试机上采用三点弯曲实验测定牵张区成骨标本力学性能直到标本破坏,记录标本破坏时的最大载荷。
1.5.4 组织学观察 取牵张间隙内新生骨样本,放置在4%多聚甲醛溶液内固定24 h,EDTA脱钙4周,经石蜡包埋后切取组织学切片并行苏木精-伊红(hema-
toxylin eosin,HE)染色分析。观察各组牵张成骨区骨形成、钙盐沉积及骨细胞生长情况。
1.6 统计学分析
采用SPSS 16.0软件进行统计分析。计量资料以均数±标准差表示,组间比较采用t检验。
2 结果
2.1 CT平扫
CT平扫表明,A组牵张间隙内新骨形成量明显高于B组和C组,B组新骨形成量高于C组。A组的新生骨形态规则,与两端自体皮质骨开始连续且与原生骨难以区分(图1)。
2.2 组织学观察
3组标本的组织学观察见图2。3组均可见新生的骨小梁。A组新生骨粗大、密集且排列规律,基本与原生骨一致;B组虽然新生骨良好,但骨小梁相对较纤细、大小不一且未能完全充满牵张区;C组牵张间隙内零星可见纤维组织以及小而无序的骨小梁。
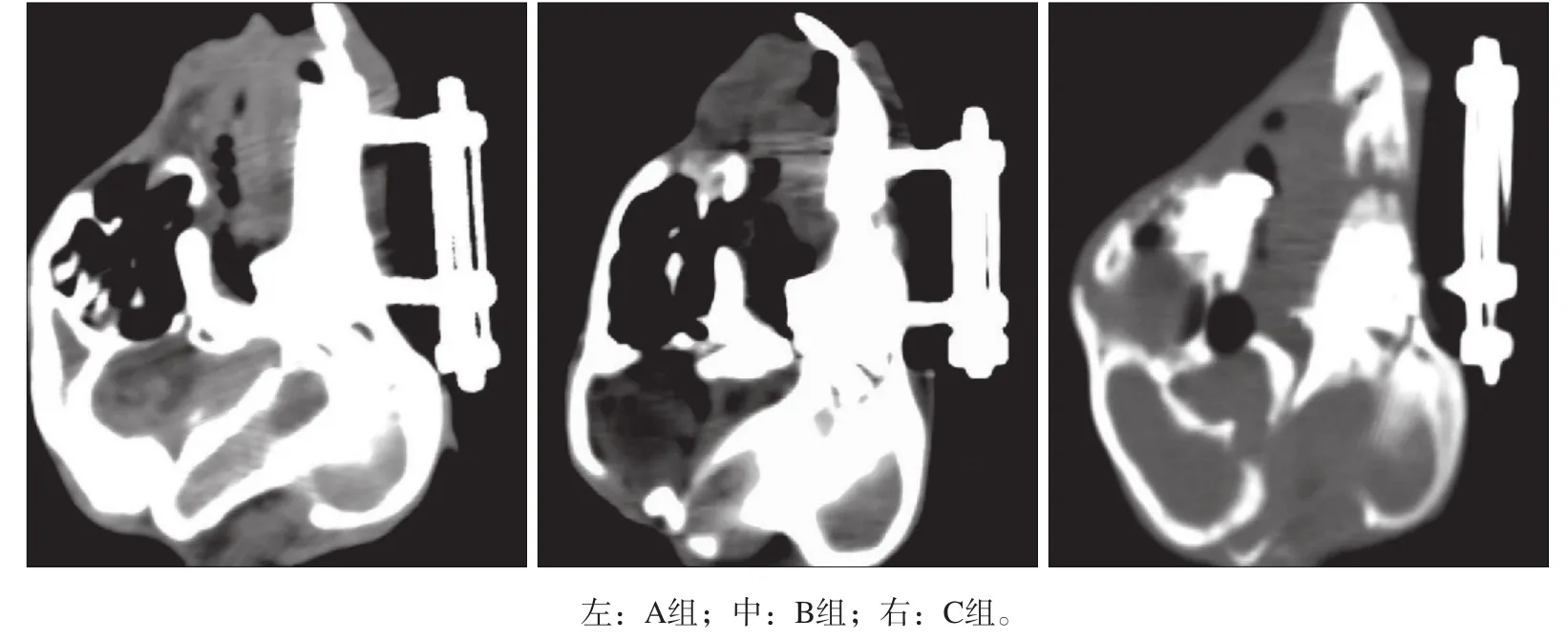
图 1 3组的CT检查Fig 1 CT examination of three groups
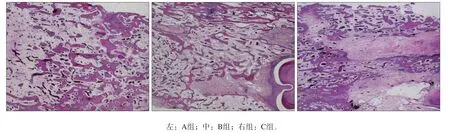
图 2 3组的组织学观察 HE × 40Fig 2 Histological observation of three groups HE × 40
2.3 DXA检测
3组的DXA检测结果见表1。A组的BMD是C组的1.86倍,是B组的1.47倍;A组的BMC是C组的1.97倍,是B组的1.52倍。A组的BMD及BMC均高于B、C组(P<0. 01)。
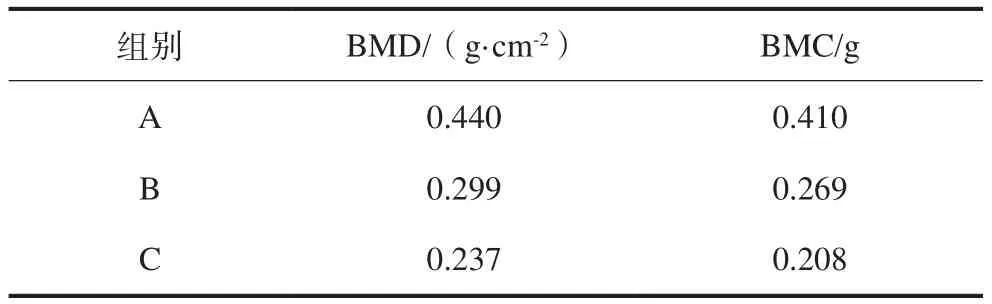
表 1 3组的DXA检测Tab 1 DXA tests of three groups
2.4 三点弯曲测试结果
A、B、C组的新生骨最大载荷分别为384、328、254 N。A组新生骨最大载荷是C组的1.51倍,是B组的1.29倍。A组新生骨的最大载荷高于B、C组(P< 0.01)。
3 讨论
本实验通过兔下颌骨快速牵张成骨动物模型的建立,评估了Runx2修饰的MSCs对骨形成和骨矿化的影响,结果表明MSCs移植可促进牵张期的骨形成,且Runx2基因修饰的MSCs的增强效果更显著。兔下颌牵张成骨过程中,5~7 d的延迟期和0.9~1.0 mm·d-1的牵张频率被推荐为最佳牵张方法[4]。本实验采用快速牵张(短延迟期3 d和快速牵张率2 mm·d-1)以模拟一个匮乏的成骨情况,在牵张结束后8周牵张间隙内可见较差的或不成熟的骨再生[5]。牵张过程中在适当的机械刺激下,原始间充质细胞聚集、定型和增殖并分化为成骨细胞是牵张间隙新骨再生的关键步骤[5]。牵张间隙骨再生贫乏,要么是原始成骨细胞聚集和增殖的问题,要么是原始成骨细胞的分化问题。临床中尤其在原始细胞缺乏或外伤及放疗后组织受损严重的患者中会出现这些问题[6-7]。因此,在上述情况下需要更多的骨生成时,自体骨髓MSCs补充成骨细胞似乎是保证牵张区理想骨再生的一个合理方法。Kitoh等[8-9]报道,在牵张成骨的临床试验中骨髓MSCs的移植能缩短疗程加速新骨形成以减少并发症的发生。本研究表明,与注射生理盐水的兔相比,将自体骨髓MSCs注入下颌牵张间隙可有更多的新骨形成,牵张间隙骨痂组织钙化更快。局部移植骨髓MSCs能将更多的循环干/祖细胞向损伤区域聚集并有助于愈合[10]。此外,MSCs有保持成骨细胞表型谱系和分化成活跃成骨细胞的潜能,可能会直接分化为成骨细胞。MSCs较容易从骨髓中隔离和在体外培养。除了直接治疗的潜力外,MSCs也被广泛用作基因转移的载体。
Runx2是一种可有效上调成骨细胞的基因表达并促进成骨的骨转录因子[4,11-12]。研究[13-15]显示,Runx2的表达能促进骨膜的骨祖细胞增殖,并且促进MSCs的成骨向分化,Runx2是膜内成骨和软骨内成骨过程中所需的生长因子,在成骨细胞分化和骨形成过程中扮演着重要的角色。局部应用Runx2基因疗法可以促进新骨形成的质量[16]。本研究通过影像学、DXA、组织学检查及生物力学测试表明,Runx2基因治疗应用于下颌骨快速牵张成骨中可促进新骨生成的骨诱导效应。Runx2基因传递到牵张间隙的时间是本实验的关键点,固定早期阶段是成骨最活跃的时期,在此时大量的骨源细胞和内源性生长因子在牵张间隙内积聚[17]。另一项研究[18]表明,在早期阶段Runx2可促进成骨细胞增殖,但在后期会抑制成骨细胞的分化和成熟从而导致骨质疏松。因此外源Runx2基因传递到牵张间隙内的最佳时间应为牵张期结束。
复制缺陷型重组腺病毒是最有效的基因转移载体,并且被广泛应用于传递外来基因到细胞内[19-21]。缺陷型腺病毒载体具有高效转导效率和对宿主细胞的低致病性。此外,这些载体无能力整合到宿主基因组,从而保证了病毒的整组基因无法复制到宿主细胞内。治疗基因的表达水平在传递后逐渐下降,而骨诱导作用最终消失。这些特性规避了可能激活致瘤基因和通过无限制的转基因表达引起的不利影响[22]。研究[23-24]表明,含有目的基因的腺病毒能被直接送入再生点,但其可能诱导异位成骨的生长,这尚需要进一步的评估。因此本研究选择使用注射骨髓间充质干细胞为Runx2基因载体而不是直接的基因传递,结果表明基因转染效率和基因治疗策略是满意的。
通过细胞治疗和基因技术的手段,本研究在兔下颌骨牵张成骨过程中应用了一种局部Runx2基因促进骨再生的输送系统,这种方法可能是缩短牵张疗程和简化整个牵张成骨过程的有效方法。该方法为临床应用颅颌面骨缺损的重建尤其是对于那些成骨潜能退化、骨质疏松症及接受放射治疗的患者提供了一个极具价值的修复策略。
[参考文献]
[1] 胡静, 戚孟春, 韩立赤, 等. BMP-7基因促进大鼠下颌牵张成骨的研究[J]. 实用口腔医学杂志, 2006, 22(5):635-638. Hu J, Qi MC, Han LC, et al. Bone regeneration accelerated by bmp-7 gene in rat mandibular distraction osteogenesis[J]. J Pract Stomatol, 2006, 22(5):635-638.
[2] Bhat BM, Robinson JA, Coleburn VE, et al. Evidence of in vivo osteoinduction in adult rat bone by adeno-Runx2 intra-femoral delivery[J]. J Cell Biochem, 2008, 103(6): 1912-1924.
[3] 周诺, 黄旋平, 江献芳, 等. 骨形态发生蛋白-2基因修饰骨髓间充质干细胞复合对氧化聚乙烯和聚丙烯共聚物移植促进兔下颌骨牵张成骨的实验研究[J]. 华西口腔医学杂志, 2013, 31(3):247-252. Zhou N, Huang XP, Jiang XF, et al. Experimental study on transplantation of bone morphogenetic protein-2 gene transfected bone mesenchymal stem cells compounded with Pluronic F-127 for promoting bone regeneration in rabbit mandibular distraction osteogenesis[J]. West China J Stomatol, 2013, 31(3):247-252.
[4] Tee BC, Sun Z. Mandibular distraction osteogenesis assisted by cell-based tissue engineering: a systematic review[J]. Orthod Craniofac Res, 2015, 18(Suppl 1):39-49.
[5] Jiang X, Zou S, Ye B, et al. bFGF-Modified BMMSCs enhance bone regeneration following distraction osteogenesis in rabbits[J]. Bone, 2010, 46(4):1156-1161.
[6] Nolte JW, Jansma J, Becking AG. Distraction osteogenesis of maxilla and midface in postradiotherapy patients[J]. J Oral Maxillofac Surg, 2012, 70(5):1145-1151.
[7] Deshpande SS, Gallagher KK, Donneys A, et al. Stem cell therapy remediates reconstruction of the craniofacial skeleton after radiation therapy[J]. Stem Cells Dev, 2013, 22 (11):1625-1632.
[8] Kitoh H, Kitakoji T, Tsuchiya H, et al. Transplantation of marrow-derived mesenchymal stem cells and platelet-rich plasma during distraction osteogenesis—a preliminary result of three cases[J]. Bone, 2004, 35(4):892-898.
[9] Kitoh H, Kitakoji T, Tsuchiya H, et al. Transplantation of culture expanded bone marrow cells and platelet rich plasma in distraction osteogenesis of the long bones[J]. Bone, 2007, 40(2):522-528.
[10] Kinnaird T, Stabile E, Burnett MS, et al. Local delivery of marrow-derived stromal cells augments collateral perfusion through paracrine mechanisms.[J]. Circulation, 2004, 109 (12):1543-1549.
[11] Sun JJ, Zheng XH, Wang LY, et al. New bone formation enhanced by ADSCs overexpressing hRunx2 during mandibular distraction osteogenesis in osteoporotic rabbits[J]. J Orthop Res, 2014, 32(5):709-720.
[12] 王立媛, 刘大勇, 贾智. 人脱落乳牙干细胞骨向分化相关分子Runx2的动态表达[J]. 中国组织工程研究, 2014, 18 (15):2345-2350. Wang LY, Liu DY, Jia Z. Dynamic expression of Runx2 gene profile during osteogenesis in stem cells from human exfoliated deciduous teeth[J]. Chin J Tissue Eng Res, 2014, 18(15):2345-2350.
[13] Stein GS, Lian JB, Stein JL, et al. Temporal and spatial parameters of skeletal gene expression: targeting RUNX factors and their coregulatory proteins to subnuclear domains [J]. Connect Tissue Res, 2003, 44(Suppl 1):149-153.
[14] Chen CG, Thuillier D, Chin EN, et al. Chondrocyte-intrinsic Smad3 represses Runx2-inducible matrix metalloproteinase 13 expression to maintain articular cartilage and prevent osteoarthritis[J]. Arthritis Rheum, 2012, 64(10):3278-3289.
[15] 马慧, 赵红斌. Runx2蛋白与成骨细胞分化信号[J]. 医学综述, 2007, 13(24):1959-1962. Ma H, Zhao HB. Runx2 and signal transduction of osteoblast differentiation[J]. Med Recapitulate, 2007, 13(24):1959-1962.
[16] Zhao Z, Wang Z, Ge C, et al. Healing cranial defects with AdRunx2-transduced marrow stromal cells[J]. J Dent Res, 2007, 86(12):1207-1211.
[17] Kim IS, Song YM, Hwang SJ. Osteogenic responses of human mesenchymal stromal cells to static stretch[J]. J Dent Res, 2010, 89(10):1129-1134.
[18] Liu W, Toyosawa S, Furuichi T, et al. Overexpression of Cbfa1 in osteoblasts inhibits osteoblast maturation and causes osteopenia with multiple fractures[J]. J Cell Biol, 2001, 155 (1):157-166.
[19] Li C, Ding J, Jiang L, et al. Potential of mesenchymal stem cells by adenovirus-mediated erythropoietin gene therapy approaches for bone defect[J]. Cell Biochem Biophys, 2014, 70(2):1199-1204.
[20] Zhao C, Wu N, Deng F, et al. Adenovirus-mediated gene transfer in mesenchymal stem cells can be significantly enhanced by the cationic polymer polybrene[J]. PLoS ONE, 2014, 9(3):e92908.
[21] Sun M, Tan W, Wang K, et al. Effects of allogenous periostealderived cells transfected with adenovirus-mediated BMP-2 on repairing defects of the mandible in rabbits[J]. J Oral Maxillofac Surg, 2013, 71(10):1789-1799.
[22] Kay MA, Glorioso JC, Naldini L. Viral vectors for gene therapy: the art of turning infectious agents into vehicles of therapeutics[J]. Nat Med, 2001, 7(1):33-40.
[23] Zhang Y, Cheng N, Miron R, et al. Delivery of PDGF-B and BMP-7 by mesoporous bioglass/silk fibrin scaffolds for the repair of osteoporotic defects[J]. Biomaterials, 2012, 33(28):6698-6708.
[24] Sheyn D, Kallai I, Tawackoli W, et al. Gene-modified adult stem cells regenerate vertebral bone defect in a rat model[J]. Mol Pharm, 2011, 8(5):1592-1601.
(本文采编 李彩)
[中图分类号]R 782.2
[文献标志码]A [doi] 10.7518/hxkq.2016.02.004
[收稿日期]2015-06-16; [修回日期] 2015-09-18
[基金项目]江苏省 “ 六大人才高峰 ” 基金(2013-WSW-048)
[作者简介]冯桂娟,住院医师,硕士,E-mail:fengguijuan2013@126. com
[通信作者]宋冬惠,副教授,博士,E-mail:sdh527@163.com
Mesenchymal stem cells modified with Runt-related transcription factor 2 promote bone regeneration in rabbit man-dibular distraction osteogenesis
Feng Guijuan1, Zheng Ke1, Song Donghui1, Wu Senbin1, Zhu Songsong2, Hu Jing2. (1. Dept. of Stomatology, The Affiliated Hospital of Nantong University, Nantong 226001, China; 2. State Key Laboratory of Oral Diseases, Dept. of Orthognathic and Temporomandibular Joint Surgery, West China Hospital of Stomatology, Sichuan University, Chengdu 610041, China)
Supported by: “Top Six Types of Talents” Financial Assistance Jiangsu Province Grant (2013-WSW-048). Correspondence: Song Donghui, E-mail: sdh527@163.com.
[Abstract]Objective This work investigated mesenchymal stem cells (MSCs) modified with Runt-related transcription factor 2 (Runx2) therapy for bone regeneration in rabbit mandibular distraction osteogenesis. Methods Forty-eight New Zealand mature white rabbits were randomly divided into three groups after the rabbit model of mandibular distraction osteogenesis was established: reconstruction plasmid modified with Runx2 (group A), plasmid without Runx2 (group B), and the same dose of saline as control (group C). At the fifth day of distraction phase, MSCs with reconstruction plasmid modified with adv-hRunx2-gfp were injected into the distraction gap of group A. MSCs with reconstruction plasmid modified with adv-gfp was injected into the distraction gap of group B, whereas group C was injected with the same dose of saline. At 8 weeks after injection, all animals were sacrificed, and the distracted mandibles were harvested. The general imaging histological observation and three-point bending test were used for evaluation. Results CT plain scan and histological analysis confirmed that the amount of new bone forming in the distraction gap of group A was significantly higher than those in groups B and C. Dual-energy X ray and three-point bending test results also showed that the bone mineral density, bone mineral content, and maximum load of the distraction gap of group A were significantly higher than those of groups B and C (P<0.01). Conclusion Runx2-ex vivo gene therapy based on MSCs can effectively promote the bone regeneration in rabbit mandibular distraction osteogenesis and shorten the stationary phase. Therefore, reconstruction of craniofacial fracture would be a valuable strategy.
[Key words]Runt-related transcription factor 2; mesenchymal stem cells; mandibular; distraction osteogenesis

