间充质干细胞与未成熟树突细胞联合胰岛细胞移植治疗小鼠糖尿病
王婷婷 王红灿 路玉蓉等


摘要为建立一种有效的胰岛移植免疫耐受的新方案,利用流式细胞术鉴定未成熟树突细胞(immature dendritic cells, imDCs),成骨诱导鉴定间充质干细胞(mesenchymal stem cells, MSCs),双硫腙(Dithizone, DTZ)染色鉴定胰岛细胞.胰岛细胞与间充质干细胞联合移植治疗小鼠糖尿病,测定移植后糖尿病小鼠血糖及糖化血红蛋白变化,结果发现200个胰岛细胞与2×105个未成熟树突细胞共同移植虽然未能显著延长移植物的存活时间(7±2.65 d),但能显著降低糖尿病小鼠血糖水平;200个胰岛细胞与2×105个间充质干细胞共移植,可使血糖下降到较低水平,并维持移植物存活时间达8±2.31天;200个胰岛细胞与2×105个间充质干细胞及2×105个未成熟树突细胞共同移植于糖尿病小鼠,可使糖尿病鼠血糖下降并显著延长移植物的存活时间(12.6±3.48 d).结果说明联合移植在一定程度上可延长移植物的存活时间并使血糖维持在较低的水平,有效控制糖化血红蛋白浓度,较单独移植胰岛细胞治疗小鼠糖尿病有积极的作用.
关键词树突细胞;间充质干细胞;胰岛细胞移植;糖尿病;糖化血红蛋白
20世纪70年代以来,胰岛移植成为治疗糖尿病的主要选择之一 [13],胰岛移植细胞的质量与数量是决定移植效果的关键,除了如何获得高纯度、高产量及高成活率的胰岛细胞,胰岛移植后无血管期以及后期的血管形成不良导致胰岛丢失和胰岛移植后效率低和免疫排斥也是目前亟需解决的问题[4].有研究表明,间充质干细胞(mesenchymal stem cells, MSCs)不仅可以产生促组织再生和修复的细胞因子和生长因子,防止糖尿病动物体内损伤的胰腺β细胞凋亡[5],而且可以通过形成胰岛细胞分泌胰岛素并稳定血糖水平 [68].体外研究则发现,MSCs可抑制T细胞的活化和各种刺激引起的T细胞增殖,并表明MSCs异体移植不会引起免疫排斥反应,还可诱导产生非特异性免疫耐受[9].未成熟树突细胞(immature dendritic cell, imDCs)不表达共刺激分子,当imDCs携带自身抗原移行至外周淋巴组织后不能使T细胞活化,从而诱导产生自身耐受,相应延长异种胰岛细胞在糖尿病小鼠体内的存活时间[1011].在本研究中作者考察间充质干细胞(MSCs)、未成熟树突细胞(imDCss)与胰岛细胞3种细胞不同移植方式在治疗糖尿病鼠中的治疗效果,建立一种胰岛移植治疗糖尿病鼠免疫耐受的新方案,为临床开展胰岛移植治疗糖尿病提供有益的探索.
1材料与方法
1.1材料
BALB/c小鼠(6周龄),SD大鼠(270 g)均购自广东医学实验动物中心;胎牛血清(GIBCO);RPMI1640,DMEM/F12培养基,HBSS,青霉素和链霉素均购自HYCLONE;MTT及DMSO均购自上海生物工程有限公司;淋巴细胞分离液(Histopaque1.077 g/mL),胶原酶V,链脲佐菌素(STZ),双硫腙(DTZ)及吖啶橙/碘化丙啶(AO/PI)均购自SIGMA;Rat INS (Insulin) ELISA Kit 购自Elabscience;小鼠糖化血红蛋白(HbA1c)ELISA Kit购自上海研谨生物科技有限公司;AntiMouse CD11c FITC,AntiMouse CD86 FITC,AntiMouse CD80 FITC,AntiMouse MHCⅡ FITC,Rat IgG2b K Isolype Control FITC,Armenian Hamster IgG Isotype Control FITC,Rat IgG2a K Isotype Control FITC均购自EBIOSCIENCE;重组小鼠粒细胞巨噬细胞集落刺激因子(recombinant mice granulocyte macrophage colony stimulating factor,rmGMCSF和重组小鼠白介素4 (recombinant mice interleukin4,rmIL4) 购自PEPROTECH;血糖仪及血糖试纸为罗氏ACCUCHEK Performa.流式细胞仪为BD;酶标仪为BioTek.
1.2方法
1.2.1间充质干细胞(MSCs)的分离培养和成骨诱导取6~8周龄的雄性BALB/c小鼠断颈处死,无菌取出双侧的股骨和胫骨,剔净周围组织,后用DMEM/F12培养基(含1%青霉素/链霉素)冲洗.剪掉两端膨大关节,用DMEM/F12完全培养基冲洗髓腔,至髓腔变白.冲洗液经74 μm滤网过滤,收集滤液并离心,重悬细胞,调整细胞密度为2~5×106 /mL,用6孔板培养.将培养板放入37 ℃,5%CO2的培养箱中,3 h后,换液,去除不贴壁的细胞.此后,每8 h换液一次,弃去未贴壁细胞,直至72 h(从初始培养算起).以后每3 d换液一次,待细胞达到90%融合时,用0.25%胰酶消化并传代,继续放入37 ℃,5%CO2的培养箱中培养,取纯化的第3代MSC接種于24孔板,细胞生长融合至80%~90%时,换成成骨诱导培养基,每3 d换液一次,以含10%FBS的DMEM/F12为对照.37 ℃,5%CO2培养箱培养.诱导2周后,ALP钙钴法染色,诱导3周的细胞,Von kossas矿化染色.
1.2.2未成熟树突细胞(imDCss)的分离培养和鉴定取6~8周龄的雄性BALB/c小鼠断颈处死,无菌取出双侧的股骨和胫骨,剔净周围组织,用RPMI1640 培养基冲洗,减掉两端膨大关节,用培养基冲洗髓腔,至髓腔变白,冲洗液经74 μm滤网过滤,收集滤液离心,收集细胞.加入1mL细胞裂解液,轻轻拍打30~60 s后立即加入50 mL冷的PBS稀释裂解液,离心后细胞计数,调整细胞浓度至2×106 /mL.
收集的细胞用含10%FBS的RMPI1640培养基(含1%青霉素/链霉素),37 ℃,5%CO2培养箱培养.同时培养基中加入20 μg/L Recombinant Mouse GMCSF,10 μg/L Recombinant Mouse IL4;第3天和第5天半量换液,补充GMCSF和IL4至全量,培养到第7天,进行流式鉴定,鉴定的抗体表型分别为CD11c,MHCⅡ,CD86,CD80.
1.2.3大鼠胰岛细胞的分离纯化及活力检测将成年SD大鼠(8~10周龄,体重250~300 g)用戊巴比妥钠麻醉;打开腹腔,结扎胰管;经胆总管向胰腺注入胶原酶V溶液(1 g/L) 8~10 mL,摘取胰腺,37.5℃水浴20 min后终止消化,通过045 mm筛网过滤细胞.洗涤后用Histopaque@1077纯化获得胰岛细胞;收集细胞,再洗涤,取5 mL胰岛悬液双硫腙(DTZ)染色,普通光学显微镜下观察拍照,并进行胰岛当量计数和纯度分析.重复3次,分别镜检计数双硫腙(DTZ)阳性细胞团.胰岛当量=(3次阳性胰岛数值之和/3)×[样本总量(mL) / 50 μL],胰岛的纯度=DTZ染色阳性的胰岛个数/细胞团总数×100%,此实验中胰岛的纯度=红色 / (红色+黄色)×100%.
以无酚红Hanks液配置AO储存液及PI储存液,避光4 ℃保存.使用前,稀释成规定的浓度,活的胰岛细胞经AO/PI染色呈绿色,死亡的胰岛细胞经AO/PI染色呈红色.拍照并用ImagePro plus软件分析胰岛细胞活力.胰岛的活力=绿色/(红色+绿色)×100%.
1.2.4葡萄糖刺激胰岛细胞胰岛素释放浓度的测定用含2.8 mmol/L葡萄糖和16.8 mmol/L葡萄糖的无血清RPMI1640培养基,将分离纯化后的胰岛细胞接种于24孔板,每孔约100 IEQs胰岛细胞,37 ℃各孵育2 h,分别收集培养液保存,ELISA法测定培养液中胰岛素的含量.刺激指数(Stimulation Index,SI)=16.8 mmol/L葡萄糖刺激下的胰岛素浓度/2.8 mmol/L葡萄糖刺激下的胰岛素浓度.
1.2.5体外混合淋巴细胞反应(MLR)及MTT法检测淋巴细胞增殖影响以SD大鼠外周血T淋巴细胞为反应细胞(R),分别将丝裂霉素C(40 mg/L)处理的 MSCs,imDCs,imDCs+MSCs作为刺激细胞,调整细胞密度,将一定浓度的反应细胞与相应浓度的刺激细胞(S)(S与R数目比为1∶〖KG-2mm〗10)加入到96孔细胞培养板中,每孔200 μL 10%FBS RPMI 1640培养基,每组3个复孔, 37 ℃,5%CO2培养箱培养3天.终止反应前4 h,每孔加入MTT(5 g/L)20 μL,4 h后,离心弃上清,每孔加入100 μL DMSO,振荡10 min,使结晶充分溶解,酶标仪(BIOTEK)570 nm处测定吸光度.并计算其刺激指数(SI)=实验组OD570吸光度/对照组OD570吸光度.
1.2.6小鼠糖尿病模型的建立以pH 4.5的0.1 mol/L柠檬酸柠檬酸钠缓冲液配置12 g/L链脲佐菌素(STZ)溶液,0.22 μm滤膜过滤除菌后置冰上备用.BALB/c小鼠,雄性,8~10周龄,75%酒精常规消毒腹部皮肤,150 mg/kg体重腹腔注射链脲佐菌素(STZ)溶液.注射72 h后开始测定血糖,连续测定5 d,每天血糖都维持16.7 mmol/L以上为造模成功.
1.2.7实验分组及术后血糖、糖化血红蛋白检测将8~10周龄的糖尿病雄性BALB/c小鼠随机分为5组,接受胰岛与同源未成熟树突细胞(imDCs)或间充质干细胞(MSCs)的移植.糖尿病小鼠用戊巴比妥钠麻醉后,在背部肋下皮肤处做一小切口,以无菌棉签挤压暴露左肾.A组(n=5):糖尿病模型对照组,未移植细胞;B组(n=6):200个胰岛移植于糖尿病小鼠左肾被膜下;C组(n=6):200个胰岛与2×105个间充质干细胞(MSCs)移植于糖尿病小鼠左肾被膜下;D组(n=6):200个胰岛及2×105个未成熟树突细胞(imDCs)移植于糖尿病小鼠左肾被膜下;E组(n=5):将200个胰岛、2×105个间充质干细胞(MSCs)及2×105个未成熟树突细胞(imDCs)共同移植于糖尿病小鼠左肾被膜下.移植后,尾静脉采血检测血糖值,移植后连续两次血糖水平>11.1 mmol/L定义为发生移植排斥反应,连续两次血糖水平>16.7 mmol/L定义为移植物失功.
移植后,每4 d小鼠眼眶取血ELISA法测定糖化血红蛋白(HbA1c)浓度.糖化血红蛋白的浓度:HBA1C%=HbA1c(g/dl)/Hb(g/dl) ×100%.糖化血红蛋白为4%~6%时定义为血糖控制正常;6%~7%为血糖控制比较理想;7%~8%定义为血糖控制一般;8%~9%定义为控制不理想;糖化血红蛋白>9%定义为血糖控制很差. ADA(美国糖尿病学会)建议糖化血红蛋白控制在小于7%,IDF(国际糖尿病联盟)建议糖化血红蛋白控制标准为小于6.5%,目前我国将糖尿病患者糖化血红蛋白的控制标准定为6.5%以下.采用〖HJ1.5mm〗SPSS 13.0统计软件分析,组间比较采用单因素方差分析,数据采用均数±标准差表示.P<0.05表示差异有统计意义.
2结果与分析
2.1MSCs形态观察及成骨诱导培养鉴定
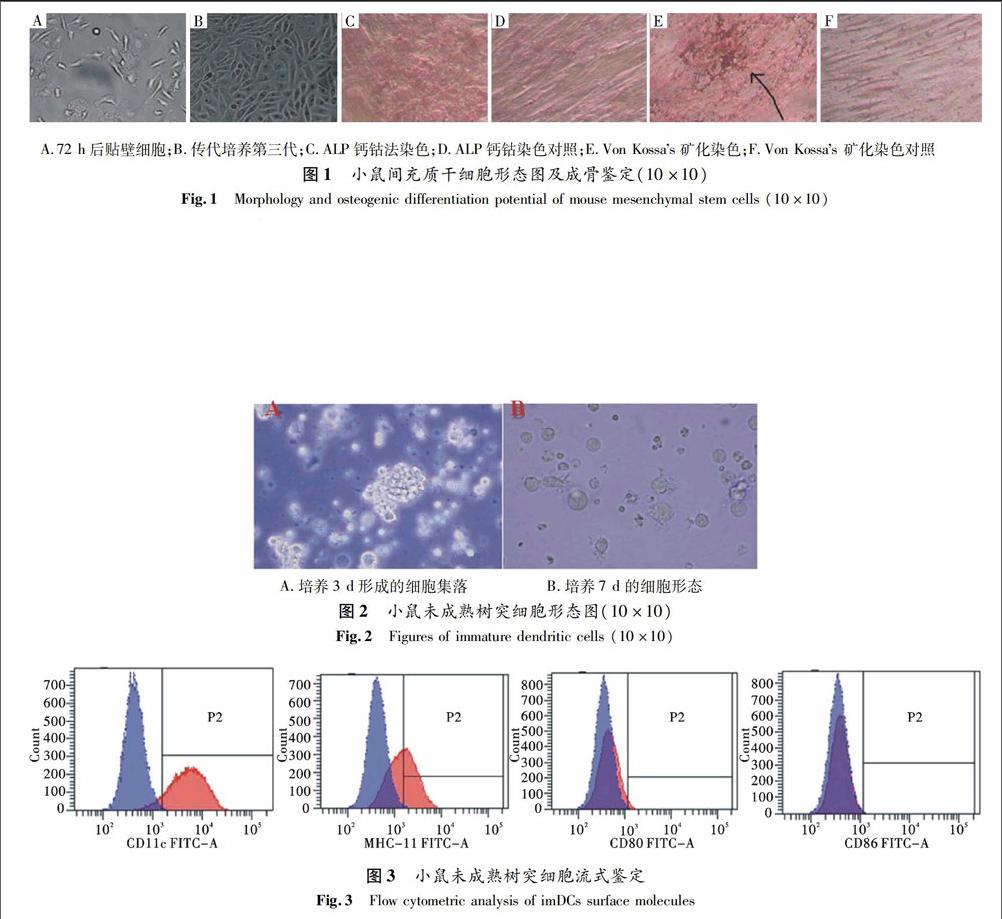
骨髓细胞贴壁法培养72 h后,在显微镜下观察,发现贴壁细胞形态不均一,有成纤维样细胞,也有小的圆形细胞等[图1A(彩图见封三)].一周后主要以梭样细胞为主,经多次传代培养后细胞形态均一(图1B,第三代),表现出典型的间充质干细胞(MSCs)形态.对传代培养第三代细胞进行成骨诱导实验,鉴定所分离细胞为MSCs,显微镜下可见:钙钴法染色可见细胞质有大量褐色沉淀, ALP呈阳性表达(见图1C);Von kossas矿化染色可见细胞聚集处有黑色骨块,岛状分布(见图1D).
2.2imDCs形态观察及表面标志测定
利用BALB/c小鼠骨髓诱导培养树突状细胞,3 h后只保留贴壁细胞,培养3 d即可见大量集落形成[图2A(彩图见封三)],随着培养时间的延长,细胞体积、形态变化,培养7 d后细胞形态不规则,细胞表面产生不规则的毛刺状突起(图2B).经流式细胞仪分析鉴定,结果发現小鼠骨髓未成熟树突细胞高表达CD11c(89.9%),中度表达MHCⅡ(36.61%),低表达CD80 (5.03%)和CD86 (1.5%)(见图3),符合imDCs表面标志物的特征.
2.3大鼠胰岛细胞的形态观察及活性检测
显微镜下观察纯化后的胰岛细胞形态如图4A(彩图见封三);胰岛细胞经DTZ染色见图4B,胰岛细胞呈猩红色,外分泌细胞不会被DTZ染色而呈黄色,结果分析发现纯化前分离的大鼠胰腺胰岛纯度为4.5%±15%,纯化后为67%±9.85%;纯化后胰岛细胞AO/PI染色结果见图4C,其中活细胞被染成绿色,而死亡的胰岛细胞呈红色,选择4个不同的视野进行拍照,Imagepro plus 6.0分析胰岛纯化后的细胞存活百分比,即胰岛的活力,本研究中作者共分析了4例大鼠胰腺分离纯化后活力,结果如图4D所示,纯化后获得的胰岛存活率平均为(91±3)%.
2.4葡萄糖刺激分离的胰岛细胞胰岛素释放浓度
ELISA法检测不同浓度葡萄糖刺激胰岛细胞后胰岛素释放水平,结果如图5所示,分离的大鼠胰岛细胞在体外培养条件下对葡萄糖的刺激仍具有良好的胰岛素释放能力,SI为2.53±0.29.
2.5imDCs与MSCs对MLR中T淋巴细胞抑制作用
分别比较imDCsT细胞共培养组和MSCsT细胞共培养组以及imDCs+MSCsT细胞共培养组中T细胞增殖能力,结果发现imDCs+MSCsT细胞共培养组对T细胞刺激显著低于其他各组,MTT检测分析表明imDCs+MSCs对T细胞刺激能力低,并能显著抑制T细胞的增殖(SI=1.15±0.12,P<0.05),结果如图6所示,与对照组(mDCsT细胞共培养组)相比,imDCsT细胞(SI=1.58±0.18),MSCsT细胞(SI=1.66±013),说明imDCs与MSCs均对T细胞增殖有抑制作用,而imDCs+MSCs对T细胞的抑制效果更明显.
2.6移植后血糖水平检测
移植后各组小鼠血糖检测结果如图7所示,与对照组相比,仅200个胰岛细胞移植后小鼠血糖很快降低,在较低水平维持5 d后开始升高,移植7 d后血糖水平高于11.1 mmol/L,且呈持续上升趋势,10 d后血糖值高于16.7 mmol/L;200个胰岛细胞与2×105个间充质干细胞共移植组中,移植后第三天小鼠血糖降至5.4±1.25 mmol/L,并维持在较低水平,直至移植14 d后,血糖值高于16.7 mmol/L,但其血糖维持在降低水平的时间相较于胰岛移植组略长(8±2.31 d); 200个胰岛同2×105个未成熟树突细胞共同移植于糖尿病鼠可使糖尿病鼠血糖下降,并较长时间地维持血糖于较低水平(7±2.65 d),第11天血糖水平(12.48 mmol/L)低于胰岛细胞和间充质干细胞移植的血糖水平(15.63 mmol/L),具有显著差异(P﹤0.05),且从第8天起血糖水平整体低于间充质干细胞和胰岛细胞移植组.200个胰岛细胞与2×105个间充质干细胞、2×105个未成熟树突细胞共同移植,可以更长时间地维持血糖处于较低水平(12.6±3.48 d),且从第7天开始其血糖水平均低于其他各组,综上说明联合移植可以延长移植物的存活时间.
2.7移植后糖化血红蛋白检测
糖化血红蛋白(HbA1c)是血液中红细胞内的血红蛋白与血糖结合的产物,血糖和血红蛋白的结合生成糖化血红蛋白是不可逆反应,并与血糖浓度成正比,检测糖化血红蛋白能更好地监控血糖的控制情况,本实验运用ELISA法检测血液中糖化血红蛋白(HbA1c),结果如图8所示,与对照组相比,各移植组在移植后12天内糖化血红蛋白水平都控制良好,差别具有统计学意义(P<0.05),说明胰岛移植能有效控制糖尿病小鼠血糖水平;但随着时间的推移,小鼠HbA1c水平呈上升趋势,血糖控制效果日益减低,移植后第16天的檢测结果显示,B,C,D实验组HbA1c均大于7%,第20天仅胰岛移植组HbA1c为(8.1±0.56)%,血糖控制效果不理想;而D组移植后第16天((7.3±0.43)%,P<0.05)和第20天((7.0±0.43)%,P<0.05)的检测结果表明,D组控制血糖效果较B,C组均好;E组自移植后16天糖化血红蛋白一直控制在6.5%以下(P<001),且HbA1c值稳定,直至第20天,为(6.6±0.41)%,说明胰岛细胞与间充质干细胞、未成熟树突细胞联合移植血糖控制效果较好,且明显优于其他组.
3讨论
糖尿病模型鼠移植同种异体胰岛细胞可以达到降低血糖的目的,但由于移植后的免疫排斥致使治疗效果不能长久维持,移植不久血糖就会升高.树突细胞因其在机体免疫耐受及免疫调节中诸多的特殊作用而受人们关注.其中,未成熟树突细胞诱导免疫耐受能使移植器官在不使用免疫抑制剂的情况下长期存活被认为是一种防治移植排斥反应的有效方法[1213].本文将胰岛细胞与未成熟树突细胞(imDCs)混合移植于糖尿病小鼠,发现移植物的存活时间明显延长并维持血糖在较低水平,糖化血红蛋白控制效果良好,证实了未成熟树突细胞的免疫耐受功能,但在移植一段时间后,血糖水平升高并恢复高血糖状态,移植物功能减退,其可能原因是未成熟树突细胞体内刺激成熟,因此体内如何长期维持树突细胞的未成熟或耐受状态仍是一个难题.有研究发现移植间充质干细胞(MSC)可以降低I型及Ⅱ糖尿病的血糖值,并推测其降低血糖的机制可能是促进胰岛细胞再生、免疫调节以及提高胰岛的敏感性[1415].许多研究证实,骨髓间充质干细胞(BMSCs)分泌的细胞因子EGF和HGF对β细胞的增加和凋亡至关重要,还分泌VEGF等促进移植物新生血管形成,增加细胞间的血管密度[1618].Gao 发现移植的MSCs在糖尿病动物体内可以转移到胰腺,促进β细胞再生和修复,在体内间充质干细胞可以使胰岛细胞增加PAkt和PErk的表达.在体外,胰岛细胞和间充质干细胞共培养也可使PAkt和PErk的表达量增加,而Akt和Erk又是β细胞增值的主要调节者[19].本文也证实胰岛与骨髓来源的间充质干细胞(MSCs)混合移植可以延长移植物的存活时间并使血糖维持在较低的水平,但其具体的作用机制尚待深入研究,作者推测β细胞的再生可能是通过复制先前存在的β细胞或通过间充质干细胞(MSC)在胰腺细胞的组织再生.
研究報道间充质干细胞不仅可抑制单核细胞向树突细胞的分化,抑制树突细胞的成熟,还能产生多种具有免疫调节功能的细胞因子包括抑制未成熟树突细胞成熟的细胞因子.如骨髓间充质干细胞分泌的TSG6可抑制骨髓来源的树突细胞成熟[20],分泌IL6参与调控未成熟树突细胞保持不成熟的细胞表型[21],此外,还分泌PGE2参与调控单核细胞分化成未成熟树突细胞[22].间充质干细胞还可减少成熟树突细胞表面标志物的表达,减少IL12的产生,减少T细胞的激活[20].另有研究表明MSCDC发挥抑制作用是通过细胞直接接触作用而非通过分泌可溶因子[23],而PDL1(programmeddeath ligands 1)是表达于树突细胞上的B7家族分子,可通过诱导T细胞表达其受体PD1并与其结合引发下游反应而诱导T细胞分化或失能等,而且imDCs对T细胞活化的影响与imDCs上表达的PDL1有关[2425].本实验利用混合淋巴细胞反应(MLR)及MTT检测法分析体外imDCs与MSCs对同源异体T细胞刺激活化影响,发现imDCs与MSCs均能有效抑制T细胞增殖,而且imDCs与MSCs联合对T细胞的抑制效果最为明显, MSCs,imDCs,imDCs+MSCs联合胰岛移植治疗糖尿病能够有效维持血糖低水平的可能机制是这些细胞影响了T细胞的活化及增殖,而imDCs+MSCs更加强了对T细胞的抑制效果,而imDCs+MSCs与T细胞的抑制效果是否与PDL1分子相关尚需进一步研究.
作者通过建立的高质量、高数量胰岛细胞的分离系统,将骨髓间充质干细胞(BMSCs)、未成熟树突细胞(imDCs)与胰岛细胞一起移植于糖尿病小鼠,结果发现胰岛移植物的存活时间相较于胰岛细胞与imDCs或胰岛细胞与MSCs混合移植均延长,且其降低血糖的效果显著改善,糖化血红蛋白控制效果最为理想,对胰岛功能重建、血糖长期稳定控制以及免疫耐受均有一定借鉴意义.
参考文献:
[1]范亚平, 刘开甄. 1型糖尿病的免疫耐受治疗[J]. 国际内分泌代谢杂志, 2011,31(5):337339.
[2]简优强, 周汉新, 李富荣.免疫抑制或免疫耐受在胰岛移植中的作用[J]. 中国免疫学杂志, 2012,28(2):1923.
[3]蔡寒青. 胰岛移植治疗糖尿病的临床前研究[D]. 北京: 中国协和医科大学, 2008.
[4]傅艺凌. 异种胰岛移植中巨噬细胞免疫排斥及调节的研究[D]. 济南: 山东大学, 2007.
[5]COURI C E. Stem cell transplantation for type 1 diabetes mellitus [J]. Diabetol Metab Sypdr, 2009,1(1):14.
[6]GAO X D, SONG L J, SHEN K T, et al. Bone marrow mesenchymal stem cells promote the repair of islets from diabetic mice through paracrine actions [J]. Mol Cel Endocrinol, 2014, 388(1/2): 4150.
[7]OH S H, MUZZONIGRO T M, BAE S H, et al. Adult bone marrowderived cells trans differentiating into insulinproducing cells for the treatment of type I diabetes [J]. Lab Invest, 2004,84(5):607617.
[8]CHEN L B, JIANG X B, YANG L. Differentiation of rat marrow mesenchymal stem cells into pancreatic islet betacells [J].World J Gastroenterol, 2004,10(20):30163020.
[9]SIMS E, EVANSMOLINA C. Stem cells as a tool to improve outcomes of islet transplantation [J]. J Transplant, 2012,2012:736491.
[10]YAO V, PLATELL C, HALL J C. Dendritic cells [J]. ANZ J Sung, 2002,72(7):501506.
[11]THOMSON A W, OCONNELL P J, STEPTOE R J, et al. Immunobiology of liver dendritic cells [J]. Immunol Cell Biol, 2002,80(1):6573.
[12]XIAO L, JOO KI, LIM M, et al. Dendritic celldirected vaccination with a lentivector encoding PSCA for prostate cancer in mice [J]. PLOS One, 2012,7(11):e48866.
[13]LOTT D G, DAN O, LU L, et al. Decoy NFkappa B fortified immature dendritic cells maintain laryngeal allograft integrity and provide enhancement of regulatory T cells [J]. Laryngoscope, 2010,120(1):4452.
[14]FIGLIUZZI M, CORNOLTI R, PERICO N, et al. Bone marrowdrived mesenchymal stem cells improve islet function in diabetic rats [J].Transplant Proc, 2009,41(5):17971800.
[15]高峰, 李國良, 林雨佳, 等. 骨髓间充质干细胞移植途径对胰岛移植物免疫排斥反应的影响[J]. 中国普通外科杂志, 2012,9(12):10801085.
[16]SAKATA N, CHAN N K, CHRISLER J, et al. Bone marrow cell cotransplantation with islets improves their vascularization and function [J]. Transplantion, 2010,89(6):686693.
[17]DING Y, XU D, FENG G, et al. Mesenchymal stem cells prevent the rejection of fully allogenic islet grafts by the immunosuppressive activity of matrix metalloproteinase-2 and -9 [J]. Diabetes, 2009,58(8):17971806.
[18]周华, 王默, 金星, 等. 间充质干细胞联合肝细胞生长因子基因治疗兔肢体缺血[J]. 中国普通外科杂志, 2011,20(12):13421346.
[19]GAO X D, SONG L J, SHEN K T, et al. Bone marrow mensenchymal stem cells promote the repair of islets from diabetic mice though paracrine actions [J]. Mol Cell Endocrinol, 2014,388(1/2):4150.
[20]LIU Y, YIN Z L, ZHANG R, et al. MSCs inhibit bone marrowderived DC maturation and function through the release of TSG6 [J]. Biochem Biophys Res Commun, 2014,450(4):14091415.
[21]DJOUAD F, CHARBONNIER L M, BOUFFI C. Mesenchymal stem cells inhibit the differentiation of dendritic cells through an interleukin6dependent mechanism [J]. Stem Cells, 2007,25(8):20252032.
[22]SPAGGIARI G M, ABDELRAZIK H, BECCHETTI F, et al. MSCs inhibit monocytederived DC maturation and function by selectively interfering with the generation of immature DCs: central role of MSCderived prostaglandin E2 [J]. Blood, 2009,113(26):65766583.
[23]ZHANG B, LIU R, SHI D, et al. Mesenchymal stem cells induce mature dendritic cells into a novel Jagged2dependent regulatory dendritic cell population [J]. Blood, 2009,113(1):4657.
[24]CHEN C, QU Q X, ZHANG X G, et al. Expression of programmeddeath receptor ligands 1 and 2 may contribute to the poor stimulatory potential of murine immature dendritic cells [J]. Immunobiology, 2007,212(3):159165.
[25]BROWN J A, DORFMAN D M, MA F R. Blockade of programmed death1 ligands on dendritic cells enhances T cell activation and cytokine production [J]. J Immunol, 2003,170(3):12571266.

