四倍体彩色马铃薯花青素含量及产量性状的QTL定位
崔阔澍,于肖夏,于卓,姜超,石悦(内蒙古农业大学农学院,内蒙古 呼和浩特 010019)
四倍体彩色马铃薯花青素含量及产量性状的QTL定位
崔阔澍,于肖夏,于卓*,姜超,石悦
(内蒙古农业大学农学院,内蒙古 呼和浩特 010019)
为确定彩色马铃薯薯块花青素含量、单株产量和商品薯率3个重要性状的Q T L位点,以四倍体彩色马铃薯‘黑美人’בM IN-021’杂种F1代分离群体的210个单株无性株系及其亲本为材料,通过对这3个重要性状进行两年一点的观测试验,以及亲本间和杂种株系间的差异显著性分析,用Tetraploid M ap软件在已构建出的2张双亲的高密度彩色马铃薯分子遗传连锁图谱上分别定位其Q T L。结果显示,这3个性状在亲本间和杂种株系间差异显著,且F1群体单株株系间各性状观测值均呈正态分布,适合Q T L分析。在母本‘黑美人’的遗传连锁图谱上检测到13个Q T L,其中控制花青素含量的有5个、单株产量和商品薯率各有4个,遗传贡献率变幅为7.98%~19.62%。在父本‘M IN-021’的遗传连锁图谱上检测到11个Q T L,其中花青素含量和单株产量各有4个、商品薯率有3个,遗传贡献率范围在8.70%~21.62%之间。
彩色马铃薯;杂种F1分离群体;花青素含量;单株产量;商品薯率;Q T L定位
http://cyxb.lzu.edu.cn
崔阔澍,于肖夏,于卓,姜超,石悦.四倍体彩色马铃薯花青素含量及产量性状的Q T L定位.草业学报,2016,25(5):116-124.
C UI K uo-Shu,Y U Xiao-Xia,Y U Zhuo,JIA N G Chao,S HI Y ue.Q T L location of anthocyanin content and yield in tetraploid pig m ented potato.Acta Prataculturae Sinica,2016,25(5):116-124.
彩色马铃薯(pig m ented potato)是块茎薯肉为紫色、红色、黑色等色彩的马铃薯,与薯肉为白色、黄色的普通马铃薯相比,因其富含天然抗氧化物质花青素,对人体具有更重要的生理保健作用[1-3]。近年来,国内外学者主要从彩色马铃薯的形态特征、花青素生理活性及组分鉴定、抗氧化物质作用机制、遗传多样性、杂交育种等方面进行了研究[4-6]。目前,对普通马铃薯Q T L定位研究报道较多,如抗晚疫病、枯萎病、黄萎病等抗病性状以及淀粉、糖类及干物质含量等品质性状的Q T L定位研究等[7-10]。而关于彩色马铃薯花青素含量及产量等重要性状的Q T L定位研究至今还未见有报道。近几年,为创制彩色马铃薯种质(新品系)和构建彩薯高密度分子遗传连锁图谱,我们依据优缺点互补、生态型差异大的亲本组配原则,以国内育成的花青素含量较高、产量中等、薯肉深紫色的彩色马铃薯品种‘黑美人’(2n=4 X=48)作母本,以引自美国的花青素含量中等、产量较高、薯肉红色的彩色马铃薯材料‘M IN-021’(2n=4 X=48)作父本,通过人工去雄杂交成功获得其杂种F1代种子,并经温室种植得到该杂种F1分离群体的210个单株的无性株系。进而以这210个株系为作图群体,利用SS R(sim ple sequence repeats)和A F L P(a m plified frag m ent length poly m orphis m)两种分子标记技术构建了彩色马铃薯双亲的高密度分子遗传连锁图谱(标记间平均距离<5 c M)[11]。本试验拟利用Tetraploid M ap软件,在已构建的双亲高密度遗传图谱上对块茎花青素含量、单株产量和商品薯率这3个重要性状进行Q T L定位研究,以期为深入开展彩色马铃薯分子标记辅助育种、重要性状基因图位克隆及精细定位研究等奠定基础。
1 材料与方法
1.1 供试材料及试验地概况
材料为四倍体(2n=4 X=48)彩色马铃薯‘黑美人’בM IN-021’杂种F1的210个单株无性株系及其亲本,由内蒙古农业大学农学院马铃薯遗传育种研究中心提供。试验于2013-2014年在内蒙古农业大学农场进行,地理位置111°42′E、45°57′N,海拔1063 m,年降水量400 m m左右,无霜期145 d,土壤为砂壤质地暗栗钙土,p H 7.8~8.2,肥力中等,具有优良的灌溉条件[12]。
1.2 农艺性状观测
各单株无性株系和亲本均播种30株,株距25 c m,行距90 cm 。在收获期对F1代分离群体的210个单株无性株系和其双亲的块茎花青素含量、单株产量、商品薯率这3个重要性状进行了两年一点的观测试验。具体观测方法如下。
1.2.1 花青素含量测定及计算 采用溶剂浸提法测定薯块中花青素含量。块茎收获后,选取薯块大小适中的各分离株系材料,称取1 g薯肉加入提取液(0.1 m ol/L H Cl和95%乙醇,体积比为1∶1混合)15 m L,60℃水浴1.5 h,然后将浸提液移入另一试管中,再加15 m L提取液于滤渣中,60℃水浴1.5 h,进行二次提取。混合两次所得浸提液并倒入离心管中,7000 r/min离心10 min,取上清,将p H分别调为1.0和4.5,然后用1 c m比色管分别在530和700 n m下进行比色[13],重复3次。采用p H示差法对供试彩薯中的花青素进行定量分析。根据花青素在p H为1.0和4.5时化学结构不同的原理,结合朗伯-比尔定律可得出,在两个不同的p H值下,花青素溶液的吸光度的差值与花青素的含量呈比例[14]。花青素计算公式为:
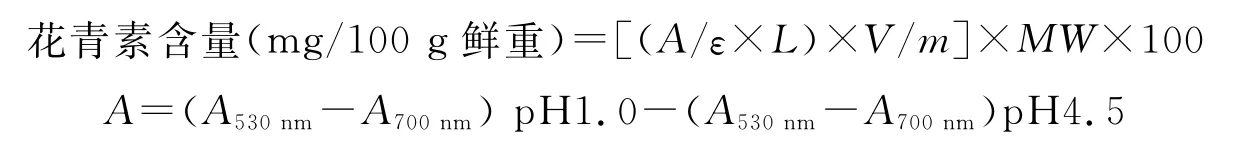
式中,A为吸光度;ε为参考消光系数,ε=31600 L/(m ol·c m);L为光程,1 c m;V为提取液体积,30 m L;m为供试彩薯的取样鲜重;M W为花青素的分子量,449.2 g/m ol[14]。
1.2.2 单株产量及商品薯率测定 收获时,每个F1无性株系及其亲本均取30株测定块茎产量和商品薯率,求出平均值。统计各分离株系的单株结薯数和大、中、小薯数(≥100 g记为大薯,99~50 g记为中薯,<50 g记为小薯),商品薯率=大、中薯数/单株结薯数×100%[15]。
1.3 数据统计与分析方法
用SPSS 17.0软件对块茎花青素含量、单株产量和商品薯率的观测值进行统计分析,输出正态分布图,并分析亲本间及杂种株系间的差异显著性。在我们已构建的四倍体彩色马铃薯双亲的遗传连锁图谱上,用Tetra-ploid M ap作图软件进行3个性状的Q T L定位分析[16]。主要步骤:打开Tetraploid软件将连锁图数据导入,点击‘cluster’选项,系统默认选项分类为12个连锁群;点击order选项确定各标记在连锁群上的位置,用m apping选项输出连锁图;点击‘m akers’菜单中的‘associate with trait data’选项,输入3个目标数量性状数据,采用I M作图法,在L O D临界值大于2.5时软件自动运行搜寻与分子标记相关联的Q T L,用软件M ap Chart 2.2绘制出Q T L图谱[17-18]。
2 结果与分析
2.1 彩色马铃薯亲本主要性状分析
对彩色马铃薯双亲的花青素含量、单株产量、商品薯率3个重要性状的观测值进行t检验结果显示,各性状在亲本间差异极显著(P<0.01),符合Q T L作图对亲本的要求(表1、图1)。

表1 彩色马铃薯双亲3个性状的方差分析Table 1 Analysis of significant differences of 3 traits between parentallines

图1 母本黑美人(左)及父本M IN-021(右)的薯块表型差异Fig.1 Tuber traits differences between female parent ‘heimeiren’and male parent‘M IN-021’
2.2 F1群体主要性状分析
由表2和图2可知,在彩色马铃薯F1分离群体中,花青素含量、单株产量、商品薯率3个性状的平均值均介于双亲之间,分布范围均在双亲范围之外,经t检验表明各单株株系间差异显著。另外,各性状测量值呈倒钟状连续分布,偏度和峰度的绝对值都小于1,这是由等效多基因控制数量性状的典型分布,即呈正态分布,表明这3个性状测量值均适用于Q T L定位分析[19]。
2.3 花青素含量、商品薯率及单株产量性状的Q T L定位分析
使用Tetraploid软件的Q T L定位功能,以L O D>2.5作为Q T L入选临界值,对彩色马铃薯花青素含量、单株产量、商品薯率3个主要农艺性状进行定位分析显示,控制3个性状的Q T L位点共有24个,其中在母本黑美人的连锁群上共检测到13个Q T L,分布在母本的10个连锁群上;在父本M IN-021的连锁群上共检测到11个Q T L,这些Q T L分布于父本的9个连锁群上(表3、图3、图4、表4)。
2.3.1 母本黑美人各性状的Q T L特征 花青素含量:检测到5个与花青素含量相关的Q T L,分别位于连锁群L G Fe2、L G Fe5、L G Fe7、L G Fe8和L G Fe12,在连锁群上的位置分别为162,56,38,16和32 c M处,其遗传贡献率分别为18.548%,15.897%,19.624%,9.731%和12.103%。检测到与Q T L共分离位点2个,即E13/M 62-150*和C57-7。
单株产量:检测到4个与单株产量相关的Q T L,分别位于连锁群L G Fe1、L G Fe3、L G Fe5和L G Fe10,在连锁群上的位置分别为118,162,116和168 c M处,其遗传贡献率分别为15.708%,14.245%,13.246%,18.355%。检测到Q T L共分离位点3个,分别是E11/M 61-220*,E11/M 61-240和E12/M 59-100。
商品薯率:检测到4个与商品薯率相关的Q T L,分别位于连锁群L G Fe1、L G Fe9、L G Fe11和L G Fe12,在连锁群上的相应位置为22,184,122和44 c M处,其遗传贡献率分别为12.999%,18.334%,15.495%和7.976%。检测到Q T L共分离位点2个,即E16/M 56-870和E12/M 49-155。
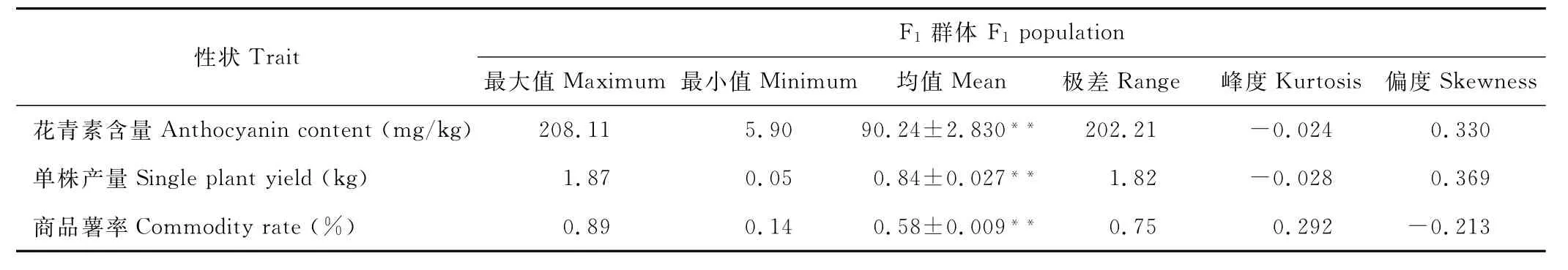
表2 马铃薯F1群体3个性状的正态性检验Table 2 Normal test of 3 traits in pigmented potato hybrid F1populations
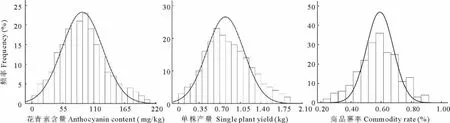
图2 彩色马铃薯F1群体中花青素含量、单株产量及商品薯率的分布情况Fig.2 Frequency distribution of phenotypes for anthocyanin content,single plant yield and com modity rate in pigmented potato F1population
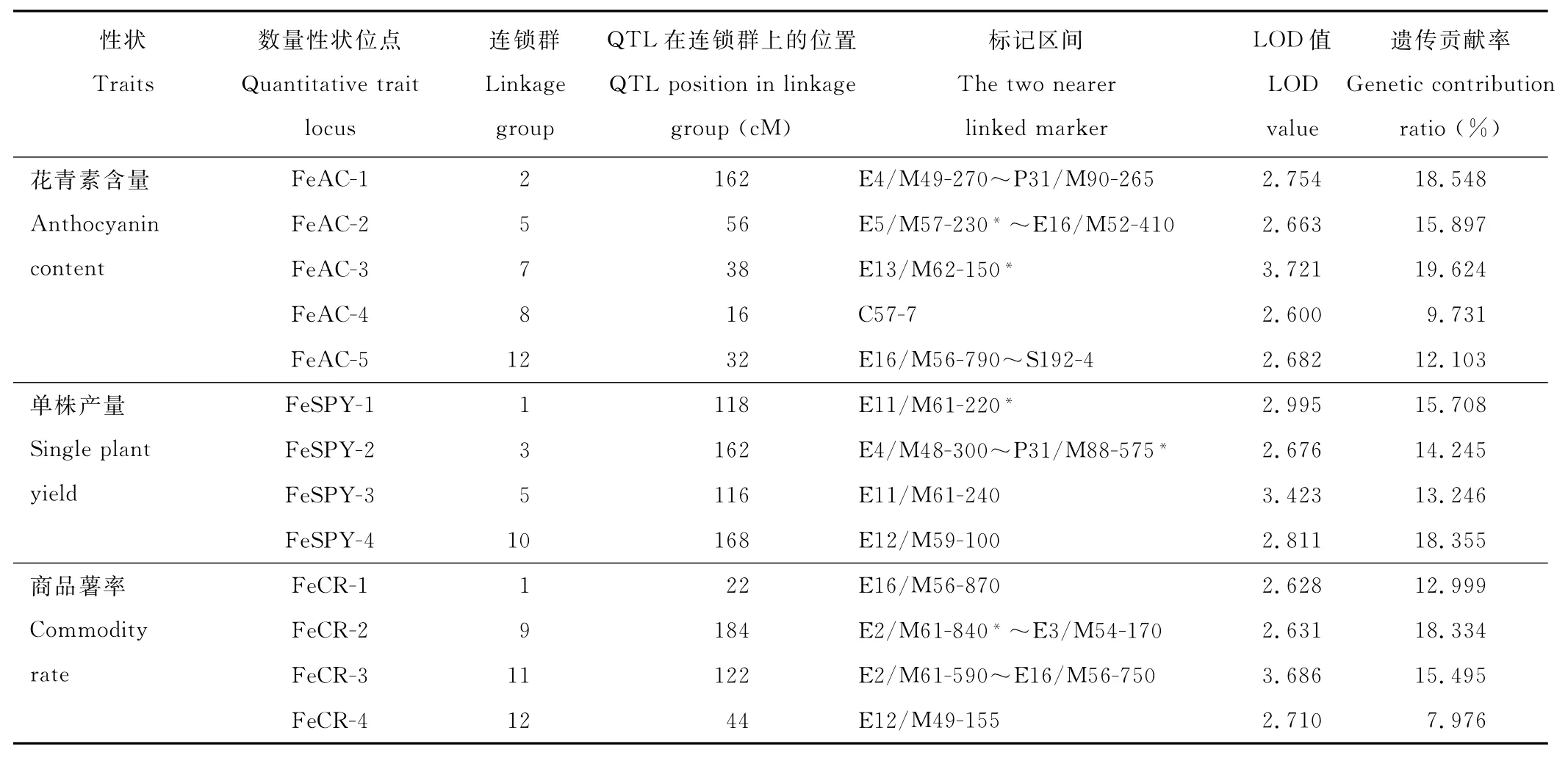
表3 彩色马铃薯母本黑美人的QTL及其效应Table 3 QTL controlling agronomic traits and its effect in female parent‘Heimeiren’

图3 彩色马铃薯母本黑美人分子遗传连锁图谱及QTL位置Fig.3 Genetic linkage map and QTL position of female parent‘heimeiren’

图4 彩色马铃薯父本M IN-021分子遗传连锁图谱及QTL位置Fig.4 Genetic linkage map and QTL position of male parent‘M IN-021’
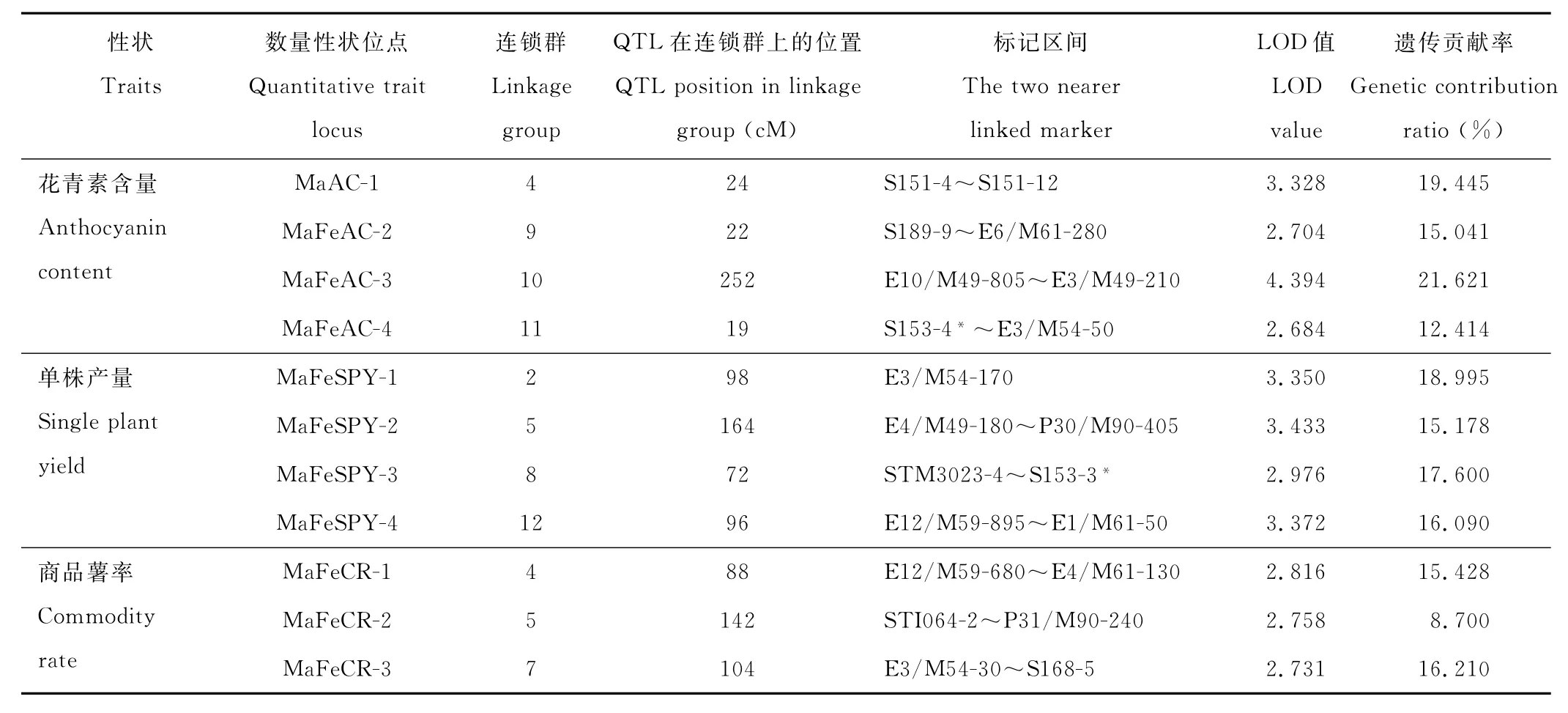
表4 彩色马铃薯父本M IN-021的QTL及其效应Table 4 QTL controlling agronomic traits and its effect in male parent‘M IN-021’
2.3.2 父本M IN-021各性状的Q T L特征 花青素含量:检测到4个与花青素含量相关的Q T L,分别位于连锁群L G M a4、L G M a9、L G M a10和L G M a11,在连锁群上的相应位置分别为24,22,252和19 c M处,其遗传贡献率分别为19.445%,15.041%,21.621%和12.414%。
单株产量:检测到4个与单株产量有关的Q T L,分别位于连锁群L G M a2、L G M a5、L G M a8和L G M a12,在连锁群上的相应位置分别为98,164,72和96 c M处,其遗传贡献率分别为18.995%,15.178%,17.600%和16.090%。检测到E3/M 54-170共分离位点1个。
商品薯率:检测到3个与商品薯率相关的Q T L,分别位于连锁群L G M a4、L G M a5和L G M a7,在连锁群上相应位置分别为88,142和104 c M处,其遗传贡献率分别为15.428%,8.700%和16.210%。
3 讨论
Schafer等[20]对马铃薯品质性状的研究发现,块茎淀粉含量Q T L可能与产量Q T L在部分连锁群存在共区域现象,如K31群体中淀粉含量与产量相关Q T L位点在连锁群Ⅲ、Ⅳ、Ⅸ和Ⅺ上位于不同区段,而控制两性状的Q T L位点在除Ⅰ、Ⅶ连锁群外的余下连锁群位于同一基因区段。本试验在对花青素含量的Q T L定位中也发现了类似的现象,如在母本‘黑美人’图谱上检测到控制花青素含量Q T L与商品薯率Q T L在3个连锁群上位于不同区段,在连锁群L G Fe12上与控制商品薯率的Q T L位点仅距离8 c M,很可能在同一基因区段,说明花青素含量的Q T L在部分连锁群可能也存在着与产量性状Q T L相关的特征,此点有待深入研究。虽然花青素含量与商品薯率Q T L存在共区域现象,但与Schafer等[20]的研究结果相比其共区域位点较少,其原因可能是由于块茎产量的组成因子是干物质和水分,一些影响干物质的基因会影响块茎产量[21]。
在小麦(Triticum aestivum)等多倍体作物的研究中通常只作一张图,这会导致连锁群信息的不明确。如,检测到的Q T L位点仅在一方亲本存在,由于未区分亲本来源,其连锁标记还是有可能混杂在同一连锁群[22-23]。马铃薯栽培种为同源四倍体,其基因型高度杂合,不同亲本杂交后F1代即出现明显分离现象,通常利用F1代单株无性株系群体及亲本构建双亲的遗传图谱,因此更易找到重要性状Q T L位点的来源。Bradshaw等[24]的研究发现,对马铃薯产量、成熟度及质量性状进行定位分析,双亲图谱上检测到的Q T L数目、位置均有不同,并以此推断出双亲中目标性状对子代的影响也不同。本试验在彩色马铃薯父母本各自的遗传图谱上进行花青素含量、单株产量及商品薯率这3个重要性状的Q T L定位分析也发现了上述现象,即在母本图谱上共检测到控制这些性状的Q T L 13个,而父本图谱上共检测到Q T L 11个,且发现这些性状Q T L在双亲中连锁群的位置和分布均不同,这反映了依据双亲的遗传信息可分析子代的Q T L等位基因组合来自双亲哪一方更有优势。
试验中还发现,虽然单株产量和花青素含量性状的Q T L位点在双亲图谱中分布不同,但双亲检测到的Q T L均存在一定的相似性。从单株产量看,在双亲图谱上共检测到8个Q T L,母本和父本均有4个Q T L,它们在双亲图谱中的分布虽然不同,但在连锁群上的位置比较接近,均位于连锁群的中下部,说明控制这些双亲性状的Q T L很可能位于连锁群中下部的同一数量性状基因座位附近。另外,双亲检测到的单株产量Q T L遗传贡献率较接近,范围均在13.0%~19.0%之间,没有贡献率低于10.0%或者大于20.0%的Q T L,表明双亲对子代的贡献率较为平衡。从花青素含量看,在母本图谱检测到的5个Q T L和父本图谱检测到的4个Q T L中,双亲遗传贡献率相近的Q T L有3个,它们分别位于母本连锁群L G Fe5、L G Fe7和L G Fe12上,其贡献率分别为15.897%,19.624%和12.103%,而位于父本连锁群L G M a9、L G M a4和L G M a11上的3个Q T L其遗传贡献率分别为15.041%,19.445%和12.414%,二者非常接近,这说明控制彩色马铃薯花青素含量性状相关Q T L中,父母本的这3个Q T L座位对子代的贡献较均衡;而在母本连锁群L G Fe2、L G Fe8和父本连锁群L G M a10上的Q T L座位对子代产生的影响不同,这一点还有待深入研究。
4 结论
首次分别在四倍体彩色马铃薯双亲的高密度分子遗传连锁图谱上定位了花青素含量、单株产量和商品薯率3个重要性状的Q T L共24个。在母本‘黑美人’的连锁图谱上检测到Q T L 13个,花青素含量5个、单株产量和商品薯率各4个;在父本‘M IN-021’的连锁图谱上检测到Q T L 11个,花青素含量和单株产量各4个、商品薯率3个。
References:
[1]Pietta P G.Flavonoids as antioxidants.Journal of Natural Products,2000,63:1035-1042.
[2]Potapovich A I,Kostyuk V A.Co m parative study of antioxidant properties and cytoprotective activity of flavonoids.Bioche mistry,2003,68:514-519.
[3]Middleton E,Kandaswa mi C,Theoharides T C.The effects of plant flavonoids on m a m m alian cells:Im plications for infla mm ation,heart disease and cancer.Pharm acological Reviews,2000,52:673-751.
[4]Shi S C,Gao Y K,Zhang X M,etal.Progress on plant genes involved in biosynthetic path way of anthocyanins.Bulletin of Botanical Research,2011,31(5):633-640.
[5]Luis E R,M onica M,Ronald E W,etal.A nthocyanin pig m ent co m position of red-fleshed potatoes.Journal of Food Science,1998,63(3):458-465.
[6]Brow n C R,W rolstad R,Durst R,etal.Breeding studies in potatoes containing high concentrations of anthocyanins.M olecular Geno mic Secular Breeding,2003,80:241-250.
[7]Visker M,H eilersig H,Kodde L P,etal.Genetic linkage of Q T Ls for late blight resistance and foliage m aturity type in six related potato progenies.Euphytica,2005,143(1-2):189-199.
[8]Costanzo S,Sim ko I,Christ B J,etal.Q T L analysis oflate blight resistance in a diploid potato fa mily of Solanum phureja× S.stenotomum.Theoretical A pplied Genetics,2005,111:609-617.
[9]Chakrabarti S K,Singh B P,Garim a Thakur,etal.Q T L analysis of late blight resistance in a diploid potato fa mily of Solanum spegazzinii×S.chacoense.Potato Research,2014,57:1-11.
[10]Gao G,Jin L P,Q u D Y,etal.Identification of co m m on A FL P m arkers linked with resistance to bacterial wilt in potato.Acta Botanica Boreali-Occidentalia Sinica,2005,25(2):269-274.
[11]Cui K S.Construction of High-density M olecular Genetic Linkage M aps and M apping Q T Ls for Im portant Traits such as A nthocyanin Content in Colored Potato[D].H ohhot:Inner M ongolia A gricultural U niversity,2015.
[12]Zhang Z Q,Y u X X,Ju T H,etal.Identification of two cross co m binations of F1Solanum tuberosum by SSR m olecular m arker.Chinese Journal of Eco-A griculture,2013,21(11):1411-1415.
[13]Yang X H,Ge Y Y,W ang L.Study on the optimization of extraction technique and stability of proanthocyanidins fro m‘H eim eiren’potatoes.Journal of A nhui A gricultural Sciences,2011,39(29):18256-18257,18314.
[14]Zhang X M.Breeding and SSR A nalysis of Excellent Clones of Color Potato H ybrids F1[D].H ohhot:Inner M ongolia A griculture U niversity,2013.
[15]Li C Q.Identification of Potato H ybirds by SSR M arkers and Research on Breeding of Excellent New Strain with Black ScrufResistance[D].H ohhot:Inner M ongolia A griculture U niversity,2012.
[16]H ackett C A,Pande B,Bryan G J.Constructing linkage m aps in autotetraploid species using sim ulated annealing.Theoretical A pplied Genetics,2003,106(6):1107-1115.
[17]Luo Z W,Zhang Z,Leach L,etal.Constructing genetic linkage m aps under a tetraso mic m odel.Genetics,2006,172(4):2635-2645.
[18]Voorrips R E.M ap Chart:Software for the graphical presentation of linkage m aps and Q T Ls.Journal of H eredity,2006,93(1):77-78.
[19]Y u X X.Develop m ent of A High-density Genetic Linkage M ap and M apping of Q T Ls for Dry-m atter Contentin S weet Potato,Ipomoea batatas(L.)La m[D].Beijing:China A gricultural U niversity,2013.
[20]Schafer P R,Ritter E,Concilio L,etal.A nalysis of quantitative trait loci(Q T Ls)and quantitative trait alleles(Q T As)for potato tuber yield and starch content.Theoretical A pplied Genetics,1998,97:834-846.
[21]Lander E S,Botstein D.M apping m endelian factors underlying quantitative traits using R FL P linkage m aps.Genetics Society of A m erica,1989,121(1):185-199.
[22]W ang Z L,Liu S D,Liu H Y,etal.Genetic linkage map in‘Bainong 64’בJingshuang 16’of wheat.Acta Botanica Boreali-Occidentalia Sinica,2006,26(5):886-892.
[23]H u L L,Ye Y Q,Lv T T,etal.Q T L m apping and genetic analysis for grain weightin w heat under different water environm ents.Acta Prataculturae Sinica,2015,24(8):118-129.
[24]Bradshaw J E,H ackett C A,Pande B,etal.Q T L m apping of yield,agrono mic and quality traits in tetraploid potato(Solanum tuberosum subsp.tuberosum).Theoretical A pplied Genetics,2008,116(2):193-211.
[4]石少穿,高亦珂,张秀梅,等.植物花青素生物合成相关基因的研究及应用.植物研究,2011,31(5):633-640.
[10]郜刚,金黎平,屈冬玉,等.马铃薯青枯病抗性的共性A FL P标记的初步定位.西北植物学报,2005,35(2):269-274.
[11]崔阔澍.彩色马铃薯高密度分子遗传连锁图谱构建及花青素等重要性状Q T L定位[D].呼和浩特:内蒙古农业大学,2015.
[12]张自强,于肖夏,鞠天华,等.2个马铃薯杂交组合F1的SSR鉴定.中国生态农业学报,2013,21(11):1411-1415.
[13]杨晓辉,葛云叶,汪岭.‘黑美人’马铃薯中原花青素的提取工艺优化及稳定性分析.安徽农业科学,2011,39(29):18256-18257,18314.
[14]张晓萌.彩色马铃薯杂种F1优良无性株系选育及SSR分析[D].呼和浩特:内蒙古农业大学,2013.
[15]李长青.马铃薯高产优质抗病优良株系的选育及SSR分析[D].呼和浩特:内蒙古农业大学,2012.
[19]于肖夏.甘薯高密度分子连锁图谱的构建和干物质含量的Q T L定位[D].北京:中国农业大学,2013.
[22]王竹林,刘曙东,刘惠远,等.‘百农64’ב京双16’小麦遗传连锁图谱构建.西北植物学报,2006,26(5):886-892.
[23]胡亮亮,叶亚琼,吕婷婷,等.不同水分环境下小麦粒重Q T L定位及遗传分析.草业学报,2015,24(8):118-129.
QTL location of anthocyanin content and yield in tetraploid pigmented potato
C UI K uo-Shu,Y U Xiao-Xia,Y U Zhuo*,JIA N G Chao,S HI Y ue
Collegeof Agronomy,Inner Mongolia Agricultural University,Hohhot 010019,China
To identify Q T Ls for three im portant traits,anthocyanin content,single plant yield and co m m odity rate in a pig m ented potatoes,210 plants fro m a F1segregated population resulting fro m a cross of‘heim eiren’בM IN-021’and their parents,anthocyanin content,single plant yield and co m m odity potato rate were m easured over tw o consecutive years.Differences between parents and the F1population were assessed using variance analysis and the Q T Ls of each trait were constructed using high density genetic linkage m aps with Tetraploid M ap software.T he result de m onstrated that the frequency distribution of allthree traits was norm alin the F1population and therefore suitable for Q T L analysis.A total of 13 Q T Ls were detected on a m aternallinkage m ap of‘heim eiren’,including 5 Q T Ls controlling anthocyanin content,4 Q T Ls controlling single plant yield and 4 Q T Ls controlling co m m odity potato rate.T he genetic contribution ratio ranged fro m 7.98%to 19.62%;a total of 11 Q T Ls were detected on a paternallinkage m ap of‘M IN-021’,including 4 Q T Ls controlling anthocyanin content,4 Q T Ls controlling single plant yield and 3 Q T Ls controlling co m m odity potato rate.T he genetic contribution ratio ranged fro m 8.70%to 21.62%.
pig m ented potato;hybrid F1population;anthocyanin content;single plant yield;co m m odity potato rate;Q T L location
.E-m ail:yuzhuo58@sina.com
10.11686/cyxb2015369
2015-07-27;改回日期:2015-10-26
内蒙古自然科学基金重大项目(2013Z D03)和国家科技支撑计划项目(2012 B A D02 B05)资助。
崔阔澍(1987-),女,内蒙古满洲里人,博士。E-m ail:cuikuoshu@126.com

