干旱和钠盐胁迫对罗布麻种子萌发的影响
刘克彪,姜生秀(1.甘肃沙生植物工程技术研究中心,甘肃 兰州 730070;.民勤沙生植物园,甘肃 民勤 733300)
干旱和钠盐胁迫对罗布麻种子萌发的影响
刘克彪1*,姜生秀2
(1.甘肃沙生植物工程技术研究中心,甘肃 兰州 730070;2.民勤沙生植物园,甘肃 民勤 733300)
为探明罗布麻种子在不同水分和钠盐胁迫下的萌发特性,通过模拟盐渍化土壤溶液渗透势和主要阴离子组成,研究罗布麻种子在P E G-6000不同渗透势溶液和不同钠盐(NaCl、Na2S O4、Na H C O3、复合钠盐)溶液中的萌发情况。结果表明,用P E G高渗透势(-0.05 M Pa)溶液、低浓度Na2S O4(0.2%)和复合钠盐(0.2%~0.6%)溶液处理种子,发芽率、发芽势、发芽指数、萌发抗旱指数>C K,平均发芽时间<C K,盐害率为负值,发芽高峰期集中于2~4 d,溶液对种子发芽具有促进和增效作用,随着溶液渗透势降低和盐浓度的增加,发芽率、发芽势、发芽指数、萌发抗旱指数逐步降低,平均发芽时间延长,盐害率增大,发芽高峰期集中于2~3 d。NaCl、Na H C O3溶液处理种子,随着浓度的增加,发芽率、发芽势、发芽指数有明显降低的趋势,平均发芽时间延迟,发芽高峰期集中于2~3 d,渗透胁迫和毒害作用增强,溶液对种子萌发有明显的抑制和延缓作用。P E G、复合盐溶液处理种子,渗透势和浓度的适宜值、临界值与极限值分别为-0.09,-0.70,-1.30 M Pa和0.85%,2.04%,3.22%。用相同浓度的钠盐溶液处理种子,盐害率大小总体依次为Na H C O3>NaCl>Na2S O4>复合钠盐。
罗布麻;干旱胁迫;钠盐胁迫;发芽率;发芽势;发芽指数;平均发芽时间;萌发抗旱指数;相对盐害率
http://cyxb.lzu.edu.cn
刘克彪,姜生秀.干旱和钠盐胁迫对罗布麻种子萌发的影响.草业学报,2016,25(5):214-221.
LIU Ke-Biao,JIA N G Sheng-Xiu.Responses of Apoceynum venetum seed germination to drought and salt stress.Acta Prataculturae Sinica,2016,25(5):214-221.
罗布麻(Apoceynum venetum)属夹竹桃科白麻属多年生草本,主产于我国东北、华北、西北和黄河流域。生于盐碱荒地和沙漠边缘、河流两岸、冲积平原、河泊周围及戈壁荒滩上,是一种重要的经济生态型植物,新疆、内蒙古等地已人工栽培。罗布麻叶作茶饮及药用有悠久的历史,花、叶、根入药[1],对治疗高血压、慢性血性心力衰竭、高脂血症等均有显著疗效,并具有抗过敏、抗癌、抗辐射、延缓衰老等保健功能,茎皮纤维是纺织工业的高级原料,也是很好的改良盐碱地和防风固沙植物,具有耐旱、耐寒和耐盐碱等特点,环境适应性强。学者对罗布麻进行了大量深度的研究,主要集中在药用有效成分的测定、提取、药理作用[2-7]和形态学特性、生理抗性、生态保护等方面[8-10],对种子萌发特性的研究较少,张永娟等[11]研究认为,在相同温度下,随着老化时间延长,种子电导率在初期先下降后升高,脱氢酶、过氧化物酶逐渐降低,浸出液可溶性糖逐渐升高,种子抗热性较强,朱小虎等[12]研究认为,大花罗布麻种子萌发速度快,寿命较短,适宜萌发变温周期是15~25℃,NaCl溶液主要是通过渗透效应影响大花罗布麻种子萌发。天然罗布麻主要以种子和根蘖繁殖扩大种群。本试验模拟罗布麻生境盐渍化土壤溶液渗透势和阴离子组成,探索土壤干旱和盐分胁迫对罗布麻种子萌发的影响,为人工辅助盐碱地罗布麻天然更新提供理论数据和界限,对建立和恢复以罗布麻为主的盐生-旱生植物群落,保护、开发利用罗布麻野生资源,改善地区生态环境,具有一定意义。
1 材料与方法
1.1 试验材料
参试种子2014年10月采收于临泽小泉子治沙站,种子千粒重0.42 g,含水率15.64%,净度100%,放入纸质种子袋,保存于民勤沙生植物园SD C-1600种子低温低湿储藏室内,储藏室温度-4℃,湿度35%。试验仪器有SP X-G B光照培养箱、Psypro植物水势仪、F A2004 N电子天平、发芽皿、滴管、量筒、滤纸等。试验药品有溶质聚乙二醇(P E G-6000)、NaCl、Na2S O4、Na H C O3、K M n O4,溶剂为蒸馏水。
1.2 试验方法
试验于2015年4月3日-5月6日在民勤沙生植物园实验室进行。
试验设计:4种钠盐以0.2%、P E G-6000以5%(溶质质量/溶液质量)为起始浓度和梯度,以种子发芽率小于20%的溶液浓度为终止浓度。用Psypro水势仪测定不同浓度P E G溶液渗透势,P E G溶液浓度5%,10%,15%,20%,25%,30%,35%,40%,相应渗透势为-0.05,-0.15,-0.28,-0.44,-0.77,-0.94,-1.26,-1.53 M Pa。NaCl溶液浓度为0.2%,0.4%,0.6%,0.8%,1.0%,1.2%,1.4%,1.6%,1.8%,2.0%,Na2S O4溶液浓度为0.2%,0.4%,0.6%,0.8%,1.0%,1.2%,1.4%,1.6%,1.8%,2.0%,2.2%,2.4%,2.6%,2.8%,Na H C O3溶液浓度为0.2%,0.4%,0.6%,0.8%,1.0%,1.2%,1.4%,1.6%,1.8%,复合盐溶液浓度为0.2%,0.4%,0.6%,0.8%,1.0%,1.2%,1.4%,1.6%,1.8%,2.0%,2.2%,2.4%,2.6%,2.8%,3.0%。复合钠盐为Na H C O3,NaCl,Na2S O4按1∶15∶84配制(盐渍化土壤溶液C O32-粒子含量非常少[13],故不配制Na2C O3溶液进行种子发芽试验)。发芽率相差大于6%的处理,进行重复试验,C K为蒸馏水处理。
试验:种子用0.5%K M n O4溶液消毒10 min,清洗后,用40℃蒸馏水浸泡24 h[14]催芽,待用;在清洗后的发芽皿中铺2层滤纸,放入烘箱内90℃下消毒24 h后,取出待用;用F A2004 N电子天平按上述浓度配制200 m L试验溶液,待用;在每个经过消毒的发芽皿内滤纸上置入催芽消毒后、用滤纸吸干表面水分的种子50粒,滴入各种不同浓度的溶液4 m L,共57个处理,每个处理重复4次,共计228个样品,放入SP X-G B光照培养箱,设定温度为25℃,光照为全暗。每天观测标本时加蒸馏水0.4 m L,保持滤纸湿润,不积水。
1.3 观测指标
每天15时开始观测记录罗布麻种子发芽情况。发芽始期:胚根伸出种皮2 m m时的天数;发芽高峰期:发芽粒数>2粒的天数;发芽结束期:连续3 d不再有种子发芽的天数。
1.4 测定指标
发芽率:F=n/N×100%,式中,n为发芽粒数,N为供试种子数。发芽势:Fs=n1/N×100%,式中,n1为种子发芽达到高峰发芽种子数。萌发抗旱指数:GD RI=n2/C K,式中,n2为干旱胁迫下发芽数,C K为对照发芽数。发芽指数:GI=Nt/Dt,式中,Nt为在t日后的发芽数,Dt为相应的发芽天数。平均发芽时间:T=∑(hn3)/∑n3,式中,h为从种子放入发芽皿之日算起的天数,n3为相应各日发芽粒数。相对盐害率:Sd=(C K发芽率-盐溶液处理发芽率)/C K发芽率×100%。
1.5 数据处理
用Excel统计并制图。
2 结果与分析
2.1 干旱胁迫对罗布麻种子萌发的影响
2.1.1 干旱胁迫对种子发芽率和发芽势的影响 用不同浓度的P E G溶液处理罗布麻种子,低浓度溶液(渗透势-0.05 M Pa),种子最终发芽率、发芽势高于C K,发芽率是C K的1.03倍(图1),发芽势是C K的1.05倍(图2),随着溶液浓度增加,渗透势降低,干旱胁迫程度增加,发芽率、发芽势逐步降低。高浓度溶液(渗透势-1.53 M Pa),种子最终发芽率为C K的24%,最终发芽势是C K的17%。方差分析表明,不同浓度P E G溶液处理种子,种子发芽率差异显著(P0.01>P>P0.05),发芽势差异不显著(P<P0.05)。
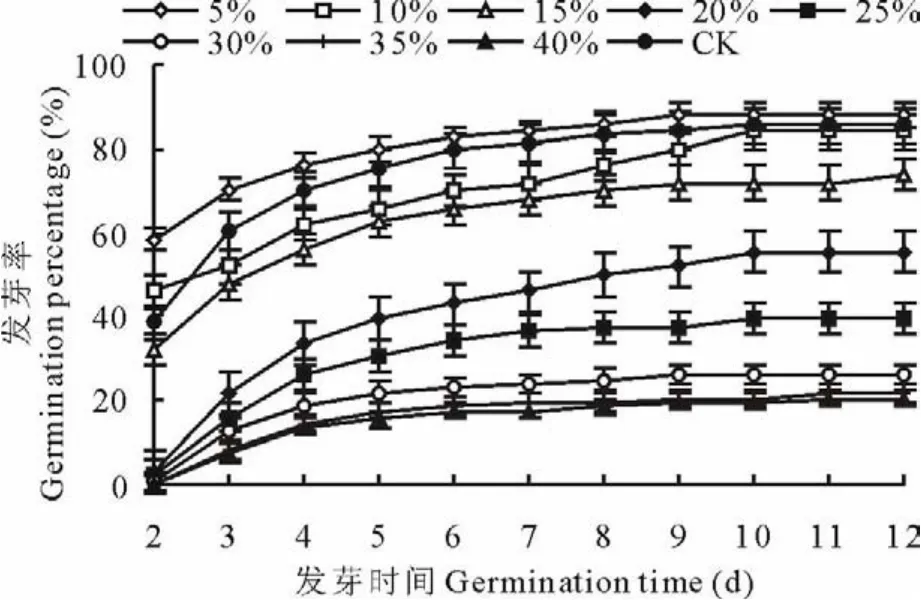
图1 不同PE G浓度溶液处理种子不同时间发芽率Fig.1 Germination percentage of seed in different PE G solution treatments on different time
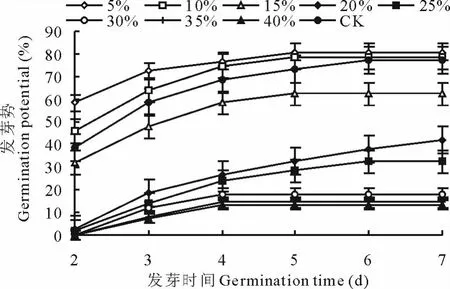
图2 不同PEG溶液浓度处理种子不同时间发芽势Fig.2 Germination potential of seed in different PEG solution treatments on different time
根据图1建立以P E G溶液渗透势为自变量(x)、以种子发芽率(y)为因变量的线性回归方程,得方程y=49.682x + 84.535,溶液渗透势和种子发芽率呈高度正相关(相关系数0.96),令种子发芽率y=80%,y=50%,
y=20%,得P E G溶液渗透势的适宜值(发芽率>80%)、临界值(发芽率>50%)、极限值(发芽率>20%)[15]分别为>-0.09,>-0.70,>-1.30 M Pa。
2.1.2 干旱胁迫对种子发芽指数和平均发芽时间的影响 用不同浓度P E G溶液处理种子,随着P E G溶液浓度升高、渗透势降低,种子发芽指数降低趋势明显(图3),P E G溶液浓度为5%,发芽指数>C K(发芽指数为
7.13,下同),为C K的1.03倍;溶液浓度为40%,发芽指数只有C K的24%。方差分析表明,不同浓度P E G溶液处理种子,种子发芽指数差异极显著(P>P0.01)。
较低浓度P E G溶液(5%~10%)处理种子,种子平均发芽时间比C K(平均发芽时间为3.29 d,下同)大约缩短0.5 d(图4),随着溶液浓度的增加(15%~20%),平均发芽时间逐步增大,溶液浓度20%,平均发芽时间比C K延迟1.5 d,为最大值,溶液浓度>20%,平均发芽时间有不规则降低的趋势,这主要是种子发芽率低造成的。低浓度溶液(5%~15%)处理种子,发芽高峰期集中于2~4 d,占种子发芽数的86%,高浓度溶液(浓度>20%)处理种子,发芽高峰期集中于3~4 d,占种子发芽数的64%。随着P E G溶液处理种子浓度增加,渗透势降低,发芽高峰期有向后推迟的趋势。方差分析表明,不同浓度P E G溶液处理种子,种子平均发芽时间差异极显著(P>P0.01)。
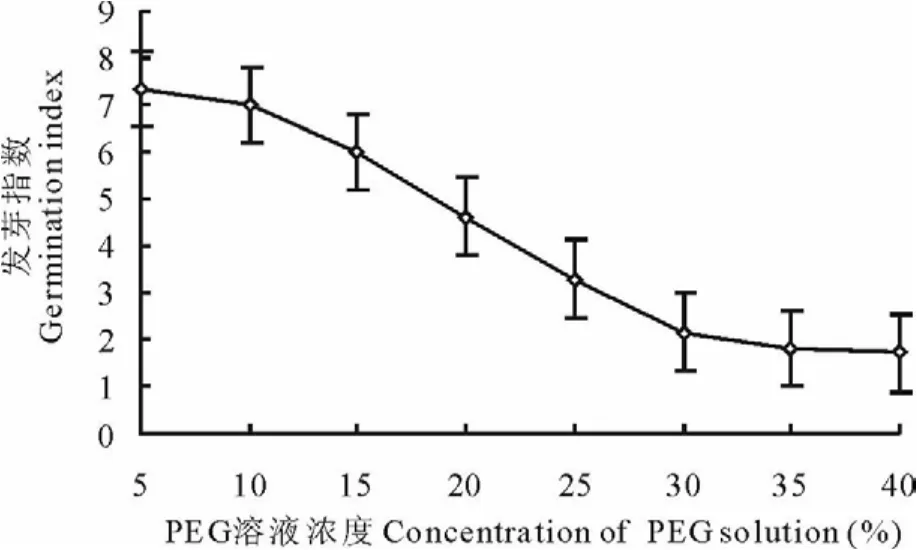
图3 不同PE G溶液处理种子发芽指数Fig.3 Germination index of seed in different PEG solution treatments
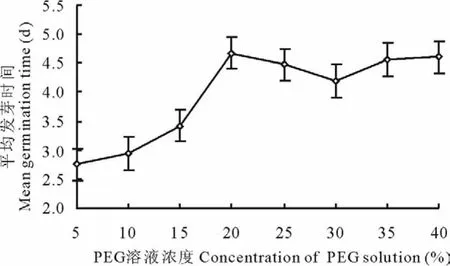
图4 不同PE G溶液处理种子平均发芽时间Fig.4 M ean seed germination time in different PEG solution treatments
2.1.3 干旱胁迫对种子萌发抗旱指数的影响 低浓度P E G溶液(5%)处理种子,种子萌发抗旱指数>1.0(图5),P E G溶液浓度>10%,萌发抗旱指数<1.0,且随着P E G溶液浓度的增加而降低,是种子在抵抗干旱胁迫时延长了种子萌发的准备期造成的,种子需要积累一定水分后才萌发,这种萌发机制降低了罗布麻在干旱区盐渍化土壤上生存的风险。方差分析表明,不同浓度P E G溶液处理种子,种子萌发抗旱指数差异极显著(P>P0.01)。
2.2 钠盐胁迫对罗布麻种子萌发的影响
2.2.1 钠盐胁迫对种子发芽率和发芽势的影响 用不同浓度、不同钠盐溶液处理种子,发芽率、发芽势变化明显(图6和图7)。低浓度溶液Na2S O4(0.2%)和复合钠盐(0.2%~0.6%)溶液处理种子,其发芽率分别>C K(发芽率为85.5%,下同)4.6%和1.1%,发芽势>C K(发芽势77.5%,下同)1.3%和≥C K,说明该浓度Na2S O4溶液处理种子,对发芽有促进和增效作用(这可能与S O42-的毒害作用小、离子对抗作用和碱盐交互胁迫作用有关,在低浓度盐溶液中,种子通过吸收盐溶液内的无机离子增加了细胞溶液的浓度,从而有效地进行渗透调节,以抵抗外界环境的胁迫[16]),随着溶液浓度增加,种子发芽率、发芽势降低趋势明显。Na2S O4溶液浓度2.8%,发芽率和发芽势只有C K的24.3%和8.4%,复合钠盐溶液浓度3.0%,发芽率和发芽势只有C K的24.2%和21.1%;NaCl不同浓度溶液处理种子,发芽率、发芽势呈倒“S”型降低的趋势。当溶液浓度为2.0%时,发芽率、发芽势仅为C K的25.3%和20.7%;用0.2%Na H C O3溶液处理种子,发芽率和发芽势是C K的86.0%和82.6%,溶液浓度1.8%,发芽率和发芽势只有C K的24.2%和14.7%。方差分析表明,不同浓度Na2S O4、NaCl、Na H C O3、复合钠盐溶液处理种子,发芽率、发芽势差异极显著(P>P0.01)。
根据图6建立以4种不同钠盐溶液浓度为自变量(x)、以种子发芽率(y)为因变量的线性回归方程,令种子发芽率y=80%,y=50%,y=20%,得4种钠盐溶液浓度的适宜值,临界值,极限值(表1)。表1说明,4种不同钠盐溶液处理种子,溶液浓度和种子发芽率呈高度负相关,4种钠盐溶液浓度的适宜值为复合钠盐>NaCl>Na2S O4,H C O3-对种子发芽毒害较大,无种子发芽的适宜溶液浓度。溶液浓度临界值、极限值为复合钠盐>Na2S O4>NaCl>Na H C O3,这和用不同钠盐不同浓度溶液处理种子,种子相对盐害率的大小顺序相一致。
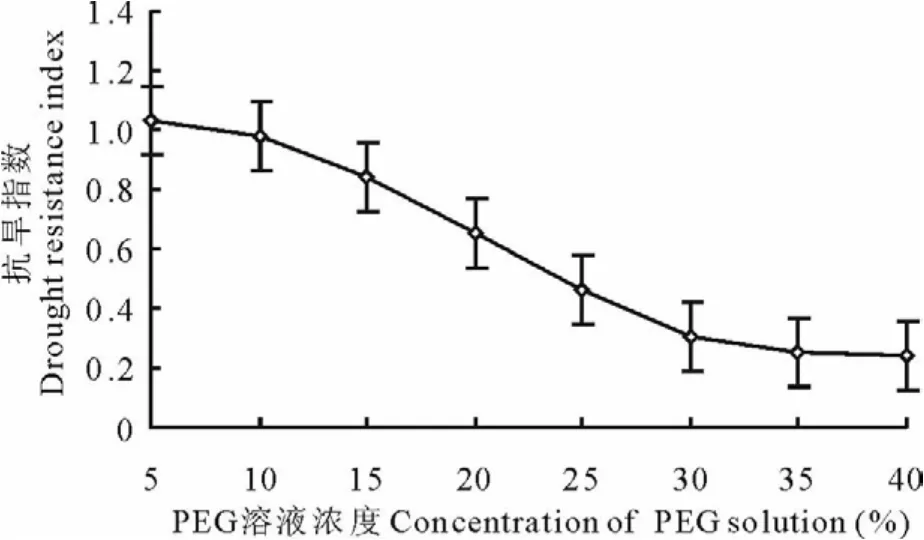
图5 不同PE G溶液处理种子萌发抗旱指数Fig.5 Drought resistance index of seed germination in different PE G solution treatments
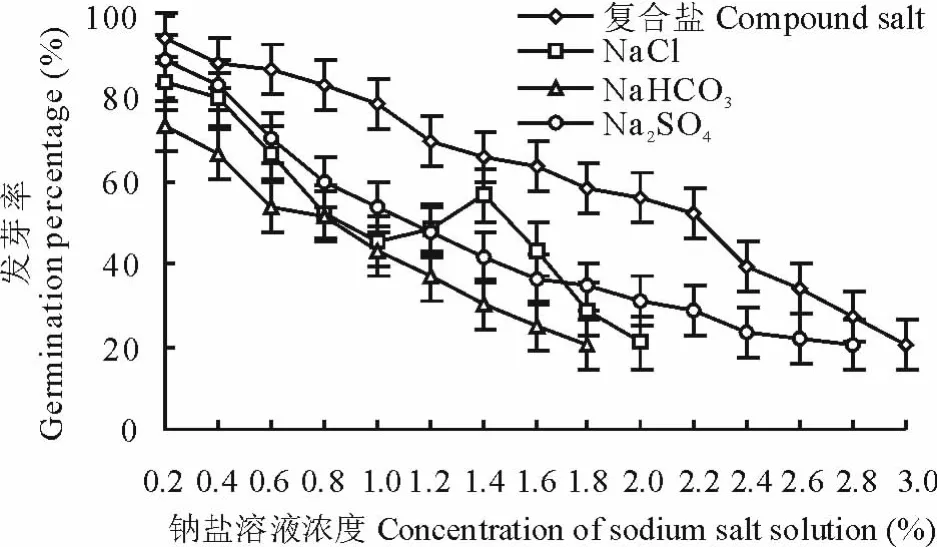
图6 不同钠盐溶液处理种子发芽率Fig.6 Seed germination rate in different sodiu m salt solution treatments
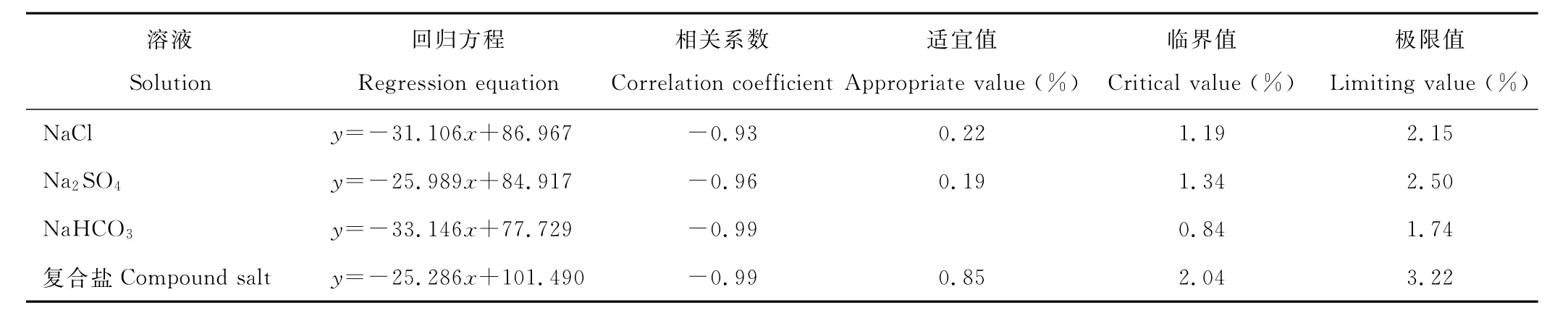
表1 钠盐溶液浓度和发芽率回归分析Table 1 The regression analysis of sodiu m salt concentrations with germination rate
2.2.2 钠盐胁迫对种子发芽指数和平均发芽时间的影响 不同浓度钠盐溶液处理种子,发芽指数和平均发芽时间各不相同(图8和图9),除Na2S O4和复合钠盐低浓度溶液对种子萌发有促进作用外,随着溶液浓度的增加,发芽指数降低趋势明显,而平均发芽时间有增加的趋势,对种子发芽有明显的抑制作用和延缓作用。Na2S O4溶液处理种子,平均发芽指数为3.82,平均发芽时间为4.3 d,低浓度溶液(0.2%~1.2%)处理种子,发芽高峰期在2~4 d,占种子发芽数的82.4%,高浓度溶液(>1.2%)处理种子,发芽高峰期在2~3 d,占种子发芽数的71.7%,溶液浓度0.2%,发芽指数是C K的1.05倍,平均发芽时间是C K的0.95倍,溶液浓度2.8%,发芽指数是C K的0.23倍,平均发芽时间为C K的1.57倍;NaCl溶液处理种子,溶液浓度0.2%~1.0%,发芽指数几乎以直线下降,平均发芽时间缓慢增大,溶液浓度>1.0%,发芽指数呈倒“V”型降低,平均发芽时间呈倒“V”型增大,平均发芽指数为5.52,平均发芽时间为3.55 d,发芽高峰期为2~3 d,占种子发芽数的78.1%,且有向后推迟的趋势,溶液浓度2.0%,发芽指数只有C K的25.4%,平均发芽时间是C K的1.64倍;Na H C O3不同浓度溶液处理种子,发芽高峰期集中于2~3 d,占种子发芽数的73.8%,平均发芽时间在溶液浓度0.2%~1.4%时逐步增加,溶液浓度超过1.4%,平均发芽时间随浓度的增加而降低,溶液浓度1.8%,发芽指数是C K的0.24倍,平均发芽时间是C K的1.24倍;复合盐溶液处理种子,在碱盐胁迫下,发芽高峰期集中于2~3 d,占种子发芽数的84.4%,溶液浓度0.2%~0.6%,发芽指数是C K的1.05倍,平均发芽时间是C K的0.83倍,溶液浓度3%,发芽指数是C K的0.24倍,平均发芽时间是C K的1.44倍。方差分析表明,用不同浓度的钠盐溶液处理种子,发芽指数和平均发芽时间差异极显著(P>P0.01)。
2.2.3 盐分胁迫对种子萌发相对盐害率的影响 不同钠盐、不同浓度溶液处理种子,对种子萌发的毒害作用不同(图10),除Na2S O4和复合钠盐低浓度溶液(0.2%Na2S O4和0.2%~0.6%复合钠盐)处理种子,相对盐害率为负值(这可能与溶液阴离子对抗作用和S O42-所占比例较大有关),对种子萌发有促进作用外,随着溶液浓度的增加,相对盐害率逐步增大。Na2S O4溶液浓度>0.2%,随着溶液浓度的增大,相对盐害率缓慢增大,当溶液浓度达到2.8时,相对盐害率为76%;NaCl溶液浓度0.2%~1.0%,随着溶液浓度的增加,相对盐害率明显增大,溶液浓度>1.0%,相对盐害率呈“V”型增大,溶液浓度2.0%,相对盐害率为75.4%;Na H C O3溶液处理种子,溶液浓度为1.8%时,相对盐害率为76%;复合盐溶液处理种子,溶液浓度>0.6%,在碱盐胁迫下,随着溶液浓度的增大,相对盐害率逐渐增大,当溶液浓度为3.0%时,相对盐害率为76.2%。方差分析表明,用不同浓度的钠盐溶液处理种子,种子相对盐害率差异极显著(P>P0.01)。用同浓度的钠盐溶液处理种子,种子相对盐害率的大小顺序总体为Na H C O3>NaCl>Na2S O4>复合盐。
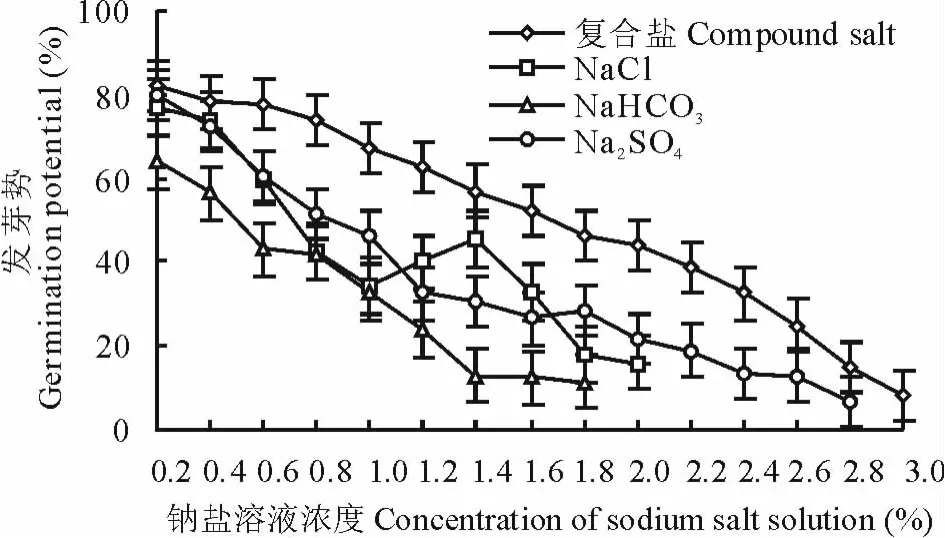
图7 不同钠盐溶液处理种子发芽势Fig.7 Seed germination potentialin different sodiu m salt solution treatments
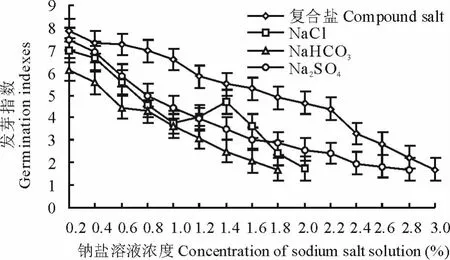
图8 不同钠盐溶液处理种子发芽指数Fig.8 Seed germination indexes in different sodiu m salt solution treatments
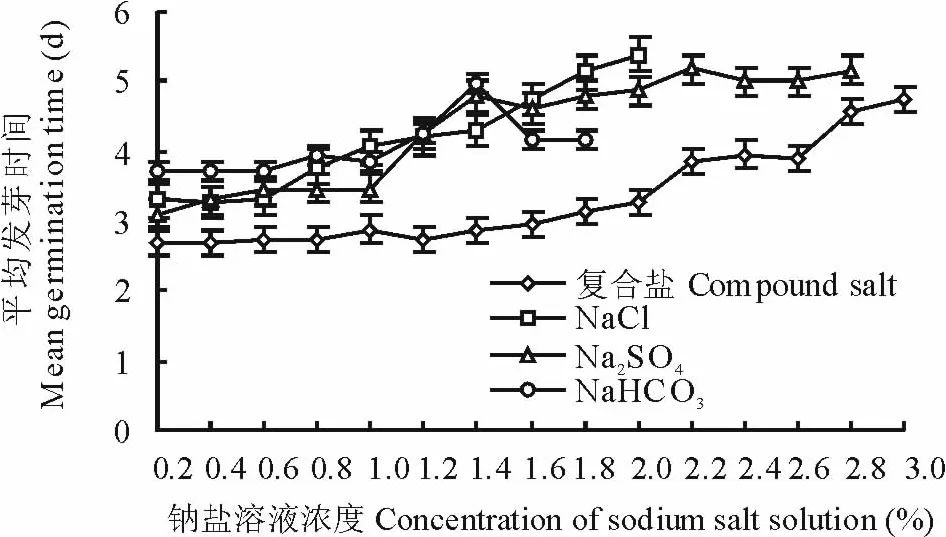
图9 不同钠盐溶液处理种子平均发芽时间Fig.9 Seed mean germination time in different sodiu m salt solution treatments
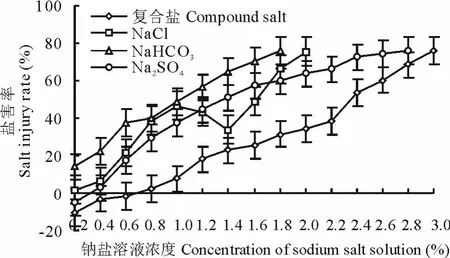
图10 不同钠盐溶液处理种子盐害率Fig.10 Seed injury rate on different sodium salt solution treatments
3 讨论与结论
聚乙二醇(P E G)是常用来造成干旱胁迫的渗透剂,它使组织失水而起到类似自然干旱的作用,对种子萌发的影响仅仅表现为渗透效应。干旱胁迫显著影响罗布麻种子的萌发,用高渗透势(-0.05 M Pa)溶液处理种子,发芽率、发芽势、发芽指数、萌发抗旱指数>C K,种子平均发芽时间比C K大约缩短0.5 d,发芽高峰期集中于2~4 d,对种子萌发有促进和增效作用,其机理目前还不十分清楚,可能是一定浓度的干旱胁迫能够启动种子体内一系列保护机制,减少种子吸胀过程中膜系统的损伤,有利于膜系统的修复,从而提高植物种子发芽率,也可能是由于提高了种子内酶的活性,加速了新陈代谢作用或对核酸产生了有利影响[17]。随着P E G溶液浓度逐渐增加,干旱胁迫程度增加,溶液渗透势降低,发芽率、发芽势、发芽指数、萌发抗旱指数逐步降低且<C K,平均发芽时间有逐步延长的趋势,对种子萌发具有一定的延缓作用和明显的抑制作用,发芽高峰期集中于2~3 d。方差分析表明,干旱胁迫影响种子萌发,发芽率差异显著,发芽势差异不显著,发芽指数、萌发抗旱指数、平均发芽时间差异极显著,说明适度的干旱可以促进种子的萌发,且发芽整齐,时间集中,但重度干旱胁迫则会显著降低发芽指数和萌发抗旱指数,使其平均发芽时间延长,种子丧失了膜的完整性和选择性,在吸胀初期的数分钟内膜系统处于不连续状态[18],可能是导致罗布麻种群天然更新能力变弱的原因之一,罗布麻种子萌发的P E G溶液渗透势的适宜值、临界值与极限值分别为-0.09,-0.70,-1.30 M Pa。种子在水分条件良好时成为竞争种,而在条件不利时,它会增加萌发数以避免种群的过度萎缩,又成为胁迫忍耐种。对干旱环境的忍耐力越强可能会使其在干旱环境中的竞争力更强,这种生存机制对于生长在干旱盐渍化荒漠的罗布麻来说非常重要[19]。
盐分对种子萌发的影响一般可归结为渗透胁迫和离子毒害。种子萌发期往往是对盐胁迫十分敏感的时期,不同钠盐溶液处理罗布麻种子,对萌发的影响效应不同,用Na2S O4和复合盐低浓度溶液处理种子,能提高种子的发芽率,且发芽整齐,萌发时间短,发芽高峰期集中于3~4 d,Sd为负值,低浓度盐溶液有调节渗透压,促进种子萌发的作用,随着溶液处理种子浓度的增加,发芽率、发芽势、发芽指数逐步降低,对种子萌发渗透和毒害作用增强,平均发芽时间延长,高浓度盐溶液对种子萌发有明显的抑制和延缓作用,这和张利霞等[20]的研究一致。用不同浓度的Na2S O4和复合盐溶液处理种子,萌发的适宜值,临界值、极限值分别为0.19%,1.34%,2.50%和0.85%,2.04%,3.22%。Na H C O3和NaCl溶液处理种子,随着溶液浓度的增加,种子发芽率、发芽势和发芽指数均有明显的下降趋势,平均发芽时间、相对盐害率有增大的趋势,但盐液浓度和降低幅度各不相同,用不同浓度的NaCl溶液处理种子,在0.2%~1.0%范围内,发芽率、发芽势、发芽指数几乎以直线下降,平均发芽时间、相对盐害率以直线增大,发芽高峰期集中于2~3 d,溶液浓度>1.4%,发芽率、发芽势、发芽指数呈倒“V”型下降,平均发芽时间呈倒“V”型增大,相对盐害率呈“V”型增大,种子萌发的适宜值,临界值、极限值为0.22%,1.19%,2.15%。用不同浓度的Na H C O3溶液处理种子,临界值、极限值分别为0.84%,1.74%,这和于德花等[21]的研究结果明显不同,造成这种差异的原因可能是罗布麻本身的特性和其环境的异质性及催芽方法的差异。在实际栽培中,由于减小或避免了单盐的毒害作用,罗布麻种子耐盐的临界值可能会提高,在野外条件下,罗布麻可在含盐量5%左右的土壤中存活并长期生存繁衍,对盐渍化土壤有较强的适应能力。用相同浓度的钠盐处理罗布麻种子,其对种子萌发的盐害率大小总体依次为Na H C O3>NaCl>复合盐>Na2S O4。
References:
[1]Shi Q M,Deng F Y,W u M Y,etal.Study on salt tolerance of Apocynum venetum Linn.and Poacynum hendersonii(H ook.f.)W oodson at stages of seed germination and seedlings growth.Northern H orticulture,2014,38(12):128-133.
[2]Zheng M Z,Liu C M,Cong D L,etal.Accelerating expression of antidepressant effect associate-gene C R E B and B D N F of flavonoid extract content fro m Apocynum venetum leaves.Geno mics and A pplied Biology,2011,30(2):184-189.
[3]W ang W,Zhang W B,Fan H Y,etal.Microwave-assisted extraction of apocynu m tea polyphenols.China Feed Edditives,2012,6:151-154.
[4]Y u Y Y,Shao J Z,W ang H M.Biological effects of Apocynum venetum rea on hypertension hyperlipide mia and anti-aging.Journal of Tongji U niversity(m edical science),2006,27(4):40-42.
[5]W u W,Nie J F.Study on anti-inflanunatory effect of the water extract of Apocynum venetum leaves.Journal of A nhui A gricultural Sciences,2013,41(11):4789-4790.
[6]W ang D Q,Li G Q,W ang L.Daily dyna mics of photosynthesis and water physiological characteristics of Apocynum venetum and A.cannabinum under drought stress.Acta Botanica Boreali-Occidentalia Sinica,2012,32(6):1198-1205.
[7]W ang L,H uang G Q,Li Y,etal.Research on physiological response of Apocynum venetum under abiotic stress.Norther H orticulture,2014,23:136-138.
[8]Ning J F,Zheng Q S,Yang S H,etal.Im pact of high salt stress on Apocynum venetum growth and lonic ho m eostasis.Chinese Journal of A pplied Ecology,2010,21(2):325-330.
[9]Ning J F,Zheng Q S,Zou X Z,etal.Physiological responses of Apocynum venetum to differentlevels of salt stress.Chinese Bulletin of Botany,2010,45(6):689-697.
[10]Ping X Y,Lin C C,Bai Y,etal.The ecological effects of planting Apocynum venetum in the plain desert of the Altay Region,Xinjiang Province.Acta Prataculturae Sinica,2014,23(2):49-58.
[11]Zhang Y J,H an R,Y uan Y,etal.Physiological and bioche mical characteristics of Apocynum venetum seeds in the process of artificial aging.Pratacultural Science,2011,28(12):2130-2135.
[12]Zhu X H,W ei Y,Yan C.Effect of storage tim e,te m perature and salinity on seed germination of Toacynum hendersonii.Seed,2010,29(12):69-72.
[13]W ang J H.Saline Alkali Treatm ent of Gansu Province[M].Lanzhou:Lanzhou U niversity Press,2000:35-38.
[14]Zhang Y,Xue L G,Gao T P,etal.Research advance seed germination of desert plants.Journal of Desert Research,2005,25(1):106-111.
[15]Song L H,Liu W W,Chen S F.Effect of P E G on seed germination of Ailanthusltissima.Journal of A gricultural Sciences,2005,26(4):25-29.
[16]Shen Z R,Yang W R,Xu X M.Effect of salt stress on germination of alfalfa seeds feng m ei.Seed,2006,25(4):34-37.
[17]Sun Y R,Shi Y,Chen G J,etal.Evaluation of the germination characteristics and drought resistance of green m anure crips under P E G stress.Acta Prataculturae Sinica,2015,24(3):89-98.
[18]Yang J N,W ang Y R.Effects of drought stress sim ulated by P E G on seed germination of four desert plant species.Acta Prataculturae Sinica,2012,21(6):23-29.
[19]Lv M T,Yang J Y,Yang M,etal.Effect of different drought stress conditions on germination of Reaumuria soongorica seeds.Chinese Journal of Grassland,2010,32(6):58-62.
[20]Zhang L X,Chang Q S,H ou X G,etal.Effects of sodiu m salt stress on seed germination of Prunella vulgaris.Acta Prataculturae Sinica,2015,24(3):177-186.
[21]Y u D H,Xu H L,Chang S L.Effect of NaCl stress on seed germination and seeding growth of Apocynum venetum.H ubei A gricultural Sciences,2008,47(7):772-775.
[1]石秋梅,邓翻云,吴敏言,等.罗布麻和大叶白麻种子萌发及幼苗生长耐盐性研究.北方园艺,2014,38(12):128-133.
[2]郑梅竹,刘春明,丛大力,等.罗布麻叶总黄酮提取物促进小鼠抗抑郁基因C R E B、B D N F的表达.基因组学与应用生物学,2011,30(2):184-189.
[3]王伟,訾王贝,樊海燕,等.微波辅助提取罗布麻茶茶多酚的工艺研究.中国食品添加剂,2012,6:151-154.
[4]虞颖映,邵健忠,王海明.罗布麻茶对心血管系统的生物学效应研究.同济大学学报(医学版),2006,27(4):40-42.
[5]武炜,聂姬锋.罗布麻叶水煎剂抗炎作用的研究.安徽农业科学,2013,41(11):4789-4790.
[6]王东清,李国旗,王磊.干旱胁迫下红麻和大麻状罗布麻水分生理及光合作用特征研究.西北植物学报,2012,32(6):1198-1205.
[7]王雷,黄国庆,李瑶,等.逆境胁迫下罗布麻生理响应研究.北方园艺,2014,23:136-138.
[8]宁建凤,郑青松,杨少海,等.高盐胁迫对罗布麻生长及离子平衡的影响.应用生态学报,2010,21(2):325-330.
[9]宁建凤,郑青松,邹献中,等.罗布麻对不同浓度盐胁迫的生理响应.植物学报,2010,45(6):689-697.
[10]平晓燕,林长存,白宇,等.新疆阿勒泰平原荒漠罗布麻种植区的生态效益评价.草业学报,2014,23(2):49-58.
[11]张永娟,韩蕊,原烨,等.罗布麻种子老化过程中的生理生化特性.草业科学,2011,28(12):2130-2135.
[12]朱小虎,魏岩,严成.储藏时间、温度和NaCl对大花罗布麻种子萌发的影响.种子,2010,29(12):69-72.
[13]王继和.甘肃盐碱地治理[M].兰州:兰州大学出版社,2000:35-38.
[14]张勇,薛林贵,高天鹏,等.荒漠植物种子萌发研究进展.中国沙漠,2005,25(1):106-111.
[15]宋丽华,刘雯雯,陈淑芬.P E G处理对臭椿种子萌发的影响.农业科学研究,2005,26(4):25-29.
[16]沈振荣,杨万仁,徐秀梅.不同盐分胁迫对苜蓿种子萌发的影响.种子,2006,25(4):34-37.
[17]孙艳茹,石屹,陈国军,等.P E G模拟干旱胁迫下8种绿肥作物萌发特性与抗旱性评价.草业学报,2015,24(3):89-98.
[18]杨景宁,王彦荣.P E G模拟干旱胁迫对四种荒漠植物种子萌发的影响.草业学报,2012,21(6):23-29.
[19]吕美婷,杨九艳,杨明,等.不同强度干旱胁迫对红砂种子萌发的影响.中国草地学报,2010,32(6):58-62.
[20]张利霞,常青山,侯小改,等.不同钠盐胁迫对夏枯草种子萌发特性的影响.草业学报,2015,24(3):177-186.
[21]于德花,徐化凌,常尚连.NaCl胁迫对罗布麻种子萌发及幼苗生长的影响.湖北农业科学,2008,47(7):772-775.
Responses of Apoceynum venetum seed germination to drought and salt stress
LIU Ke-Biao1*,JIA N G Sheng-Xiu2
1.Gansu Psam mophytes Engineering Technology Research Center,Lanzhou 730070,China;2.Minqin Desert Botanical Garden,Minqin 733300,China
In order to study the seed germination characteristics of Apoceynum venetum under different stresses of drought and sodiu m salt,germination was tested with four different os m otic potential and sodiu m salt solutions(NaCl,Na2S O4,Na H C O3,co m pound sodiu m salt).T he results showed that w hen seeds were treated with the P E G high os m otic potential(-0.05 M Pa),low concentration of Na2S O4(0.2%)and the co m pound salt solutions(0.2%to 0.6%),the germination rate,index and drought index were m ore than C K,the average germination tim es were less than C K and salt da m age rate was a negative value.Germination peak was in 2-4 d.T he solutions pro m oted seed germination according to decreasing os m otic potential and increasing salt concentration.T he germination potential,rate,index,and droughtindex gradually reduced,average germination tim e extended and salt da m age rate increased,with germination peak at 2-3 d.W hen treated with the NaCl and Na H C O3solutions,increasing concentrations caused the germination rate,potential and index to significantly decrease.T he average germination tim e was delayed,germination peak was in 2-3 d,seed germina-tion penetration and toxic effects were enhanced.W hen treated with the P E G and co m pound salt solutions,the appropriate value,critical value and limit value of os m otic potential and concentration was-0.09,-0.70,-1.30 M Pa and 0.85%,2.04%,3.22%respectively.W hen treated with the sa m e concentration of salt solution,the salt injury rate was Na H C O3>NaCl>Na2S O4>co m pound salt.
Apoceynum venetum;water stress;sodiu m salt stress;germination rate;germination potential;germination index;m ean germination tim e;germination index of drought resistance;relative salt da m age rate
.E-m ail:1548473585@qq.com
10.11686/cyxb2015318
2015-06-25;改回日期:2015-08-25
国家地区自然科学基金(31460223)和甘肃省科技创新信息平台服务建设项目(1306 T T P A034)资助。
刘克彪(1964-),男,甘肃张掖人,高级工程师,本科。E-m ail:1548473585@qq.com

