老芒麦种子发育过程中生殖枝中糖分、丙酮酸含量及硝酸还原酶活性变化
刘金平,范宣,游明鸿,王思思,宗人旭(.西华师范大学生命科学学院,四川 南充 637009;.四川省草原科学研究院,四川 成都 673)
老芒麦种子发育过程中生殖枝中糖分、丙酮酸含量及硝酸还原酶活性变化
刘金平1,范宣1,游明鸿2,王思思1,宗人旭1
(1.西华师范大学生命科学学院,四川 南充 637009;2.四川省草原科学研究院,四川 成都 611731)
以灌浆期、乳熟期、蜡熟期老芒麦生殖枝的叶、茎、穗柄、穗轴、种子等构件为研究对象,通过测定各构件可溶性糖(SS)、蔗糖(S U)、淀粉(ST)含量变化,呼吸作用中间产物丙酮酸(P A)含量变化及硝酸还原酶活性(N R)变化,分析糖分含量、呼吸强度及氮代谢速度在发育期间、构件间差异,研究种子发育过程中灌浆物质在源、流、库器官间转移规律,探讨种子饱满度与构件物质含量的关系。结果表明,1)可溶性糖、蔗糖和丙酮酸含量及硝酸还原酶活性在发育期间和构件间均有极显著差异(P<0.01),淀粉含量在构件间差异显著,在发育期间变化较小。2)随种子发育各构件可溶性糖和蔗糖含量显著下降(P<0.05),而淀粉含量无显著增加;乳熟期构件中丙酮酸含量显著增加,蜡熟期又显著下降(P<0.05);灌浆期和乳熟期构件中硝酸还原酶活性无差异,蜡熟期硝酸还原酶活性显著下降(P<0.05)。3)种子发育过程中叶片丙酮酸含量显著高于其他构件,穗轴中可溶性糖、蔗糖和淀粉含量及硝酸还原酶活性数倍于其他构件。4)灌浆期硝酸还原酶活性与构件中可溶性糖、蔗糖、淀粉和丙酮酸含量呈显著正相关(P<0.05),相关性大小为淀粉>蔗糖>可溶性糖>丙酮酸;乳熟期硝酸还原酶活性与糖相关性大小为可溶性糖>淀粉>蔗糖,与丙酮酸含量无显著相关(P>0.05);蜡熟期硝酸还原酶活性仅与可溶性糖和淀粉呈极显著正相关(P<0.01)。5)种子饱满度与叶中可溶性糖含量和穗柄中丙酮酸含量呈显著正相关(P<0.05),与穗轴中硝酸还原酶活性、蔗糖含量呈显著负相关(P<0.05),与种子中硝酸还原酶活性、淀粉含量呈显著正相关。总之,生殖枝各构件均参与种子发育过程中“源-库”物质运输,乳熟期运输速度与贮藏物沉积最快,穗轴对源库流起调控作用,氮代谢速度与种子饱满度显著相关。
老芒麦;生殖枝;种子发育;糖分运输;呼吸强度;氮代谢
http://cyxb.lzu.edu.cn
刘金平,范宣,游明鸿,王思思,宗人旭.老芒麦种子发育过程中生殖枝中糖分、丙酮酸含量及硝酸还原酶活性变化.草业学报,2016,25(5):69-77.LIU Jin-Ping,F A N Xuan,Y O U Ming-H ong,W A N G Si-Si,Z O N G Ren-Xu.Changes in sugar,pyruvic acid content and nitrate reductase activity of Elymussibiricus reproductive branches during seed develop m ent.Acta Prataculturae Sinica,2016,25(5):69-77.
老芒麦(Elymussibiricus),是禾本科披碱草属多年生疏丛型中旱生植物,为披碱草属中营养价值最高的牧草。“川草2号”老芒麦(E.sibiricus cv.Chuancao N o.2)是青藏高原广泛种植的优良牧草品种[1-2]。在川西北高原建有约3500 h m2老芒麦种子生产基地,该区太阳辐射强、日照时间长,年总辐射量为20.93×106~29.30× 106kJ/m2,为老芒麦生长发育提供了良好的光照条件。但由于受年积温低、生长期短等自然条件的限制,受交通、人力、物力等经营条件的限制,种子投入产出比率低下,种子产量不能满足青藏高原东缘生态恢复重建、退化沙化草地治理、退牧还草、种草养畜等工程对“川草2号”老芒麦种子的需求。近年来,研究了行距、播量、施肥等栽培措施对该区老芒麦种子产量的影响[1-3],分析了生长调节剂[4]、肥药混施[1]对种子产量构成因子的调控作用,探讨了提高收种率及种子调制技术措施。系列研究虽为种子生产提供了理论基础和技术支撑,对实际生产起到了一定的技术指导,但由于缺乏系统、实用技术的支撑,实际种子产量仅为潜在种子产量的10%左右[3]。所以,系统开展种子生产技术研究,开发适合川西北高原气候特点的生产技术,是提高种子产量与质量急需解决的关键问题。
光合作用是植物生长的原初动力,是种子发育的最终营养来源。关于老芒麦光合生理的报道较少,仅对光合特性[5]、光合日变化[6]、行距对光合影响[7]进行了初步的研究。种子发育实质是营养器官向生殖器官输送营养物质的过程,叶作为光合同化的主要器官是种子发育的能量来源,叶光合能力一定程度上决定了种子产量源的大小,源库互作对种子产量和品质形成起至关重要的作用,种子产量高低取决于产量源、库容和物质运输能力(流)及其协调程度[8]。对不同位叶光合速率和光合贡献率研究发现,开花期老芒麦1~5叶光合速率和生物量(源)与种子产量(库)均呈正相关,灌浆期第1,3叶光合速率和第1,2叶生物量与种子产量(库)呈显著正相关[9]。库的大小在抽穗前就已被决定,种子发育是源器官向库器官运输灌浆物质的过程,源器官最初光合产物是葡萄糖,库器官灌浆物质主要是淀粉、蛋白质和脂肪,光合产物向灌浆物质转化、运输效率,与种子成粒率、饱满度和实际产量(库容量)密切相关[10]。目前未见关于老芒麦种子发育过程中物质转化、运输的相关报道。
氮代谢是植物体内的重要生理过程,直接影响植物新陈代谢和发育[11]。碳代谢则直接影响着光合产物的形成、转化及作物的产量。老芒麦落粒性强,多在蜡熟后期进行收种[12],且完熟期种子停止物质与营养吸收。本文以灌浆期、乳熟期、蜡熟期生殖枝的叶、茎、穗柄、穗轴、种子等构件为研究对象,通过测定可溶性总糖、蔗糖、淀粉含量变化,研究种子发育过程中糖分的转移过程;通过呼吸作用中间产物丙酮酸含量的变化,分析构件间三大营养物质代谢速度及提供A T P能力差异;通过测定硝酸还原酶活性的变化,推测发育期和构件间氮素代谢速度及物质转化能力差异。试图通过糖分、丙酮酸含量及硝酸还原酶活性变化,探讨老芒麦种子发育时物质、能量在构件中的转化和运输过程,以期为合理选择提高种子产量与质量的技术措施提供科学依据。
1 材料与方法
1.1 试验地概况
试验于红原县二农场进行,为大陆性高原温带季风气候,东经102°32′,北纬32°46′,海拔3497 m,年均温1.1℃,极端高温23.5℃,极端低温-33.8℃,年降水量738 m m,相对湿度71%,≥10℃年积温865℃。土壤为草甸土,0~20 cm 土壤的有效氮、磷、钾含量分别为276,10.2和131 m g/kg,有机质含量5.87%,p H值5.91。
1.2 试验材料及测定指标
2015年8月,在行距60 cm 、密度约1000枝/m2的“川草2号”老芒麦种子试验小区(3 m×6 m)中,在晴朗无风的上午10点,分别在盛花期后10 d选灌浆期、26 d选乳熟期,32 d选蜡熟期的健壮无病虫害的3生殖枝为材料,将其分为叶片、茎、穗柄、穗轴、种子5部分,用“苏州科铭生物有限公司”生产的试剂盒,分别测定与计算蔗糖(S U)、可溶性糖(SS)、淀粉(S T)、丙酮酸(P A)含量和硝酸还原酶(N R)活性。设3次重复。具体测定方法如下。
蔗糖:用“苏州科铭生物有限公司”生产的试剂盒,按试剂盒说明书,取0.1~0.2 g组织,加1 m L提取液,常温研碎后,移到离心管置80℃水浴锅10 min,冷却4000 r/min常温离心10 min,取上清,加2 m g试剂5,80℃脱色30 min,再加1 m L提取液,离心10 min,取上清测定。设空白管、标准管、测定管,按要求依次加试剂1、2、3、4混匀,80℃水浴内反应10 min,冷却后480 n m处蒸馏水调零,可见分光光度计依次测空白管、标准管和测定管的值A1、A2和A3。蔗糖含量(m g/g鲜重)=(C×V1)×(A3-A1)÷(A2-A1)÷(W×V1÷V2),式中,C为标准液浓度,V1为样本体积,V2为提取液体积,W为样本鲜重。
可溶性糖:蒽酮比色法,取0.1~0.2 g组织,加1 m L蒸馏水研磨成浆,移到带盖离心管置100℃水浴锅10 min,冷却后,常温8000 r/min离心10 min,取上清定容至10 m L备用。设空白管、测定管,依次加入蒸馏水、工作液和浓硫酸混匀,95℃水浴锅10 min,冷却后于波长620 n m测空白管、测定管吸光值A1、A2。可溶性糖含量(m g/g鲜重)=[(A2-A1+ 0.07)÷8.55×V1]÷(W×V1÷V2),式中,V1为样本体积,V2为提取液体积,W为样本鲜重。
淀粉含量:用“苏州科铭生物有限公司”生产的试剂盒,按试剂盒说明书,取0.1~0.2 g组织常温研碎后,加1 m L试剂1,匀浆后移至E P管,80℃水浴提取30 min,常温3000 r/min离心30 min,弃上清,留沉淀加0.5 m L蒸馏水,沸水浴中糊化15 min,冷却加0.35 m L试剂2,常温提取15 min,加0.85 m L蒸馏水混匀,常温3000 r/min离心10 min,取上清液待测。取0.2 m L样本液和1 m L工作液至E P管,95℃水浴反应10 min,冷却后于波长620 n m下测吸光度值A。淀粉含量(m g/g鲜重)=[(A + 0.0295)×V1]÷(W×V1÷V2),式中,V1为样本体积,V2为提取液体积,W为样本鲜重。
丙酮酸:用“苏州科铭生物有限公司”生产的试剂盒,按试剂盒说明书,按组织质量(g)∶提取液体积(m L)为1∶5~10的比例,进行冰浴匀浆,静置30 min,常温8000 r/min离心10 min,取上清待测。取300μL样本+ 100 μL试剂1于1.5 m L E P管中,混匀静置2 min,加入500μL试剂2,混匀于520 n m波长处测定吸光值A。丙酮酸含量(μg/g鲜重)=[(A-0.0675)÷0.0466×V1]÷(W×V1÷V2),式中,V1为样本体积,V2为提取液体积,W为样本鲜重。
硝酸还原酶活性:用“苏州科铭生物有限公司”生产的试剂盒,按试剂盒说明书,取适量新鲜组织,淹没于诱导剂应用液2 h,取出样本吸干后置-20℃冷冻30 min后,按组织质量(g)∶提取液体积(m L)为1∶5~10的比例,进行冰浴匀浆后,4℃下8000 r/min离心10 min,取上清置冰上待测。设测定管、对照管、标准管和空白管,依次加入试剂1、2、3、4混匀,显色20 min,540 n m波长处分别测定吸光值A。N R活性(U/g鲜重)=(C×V1)×(A测-A对)÷(A标-A空)÷(W×V1÷V2)÷T,式中,C为标准液浓度,V1为样本体积,V2为提取液体积,W为样本鲜重,T为反应时间。
种子千粒重:蜡熟后期(36 d)随机选100生殖枝,人工采种,自然风干,随机选200粒种子称重,3次重复,计算1000粒种子重量。
1.3 数据处理
采用S A S 9.3进行方差分析、多重比较和相关分析等数据处理。
2 结果与分析
2.1 构件中可溶性糖、蔗糖和淀粉含量的多重比较
叶中SS、S U、S T含量随种子发育均显著下降(P<0.05)(表1);茎和穗柄中SS含量随种子发育几无变化,S U含量显著降低,S T则显著先减后增(P<0.05);穗轴中SS随种子发育显著逐步下降,S U在蜡熟期下降明显,S T则维持稳定;种子中SS和S U含量在乳熟期后显著降低,S T含量随种子发育逐步增加。可见SS由叶向茎向穗柄转移,穗轴中S T含量是茎叶中的5倍左右,S T在穗轴富集为种子发育贮藏能源。
在种子发育过程中,穗轴中SS、S U和S T含量显著高于其他构件(P<0.05);种子中SS、S U和S T含量显著大于叶、茎和穗柄含量(P<0.05);叶、茎和穗柄的SS和S T含量无显著差异,仅穗柄中S U含量显著低于叶。进一步交叉两因素方差表明,发育期间SS、S U含量有极显著差异(P<0.01)(表2);构件间3种糖均有极显著差异,差异大小为S T>S U>SS;发育期与构件互作对3种糖含量有显著影响(P<0.05)。
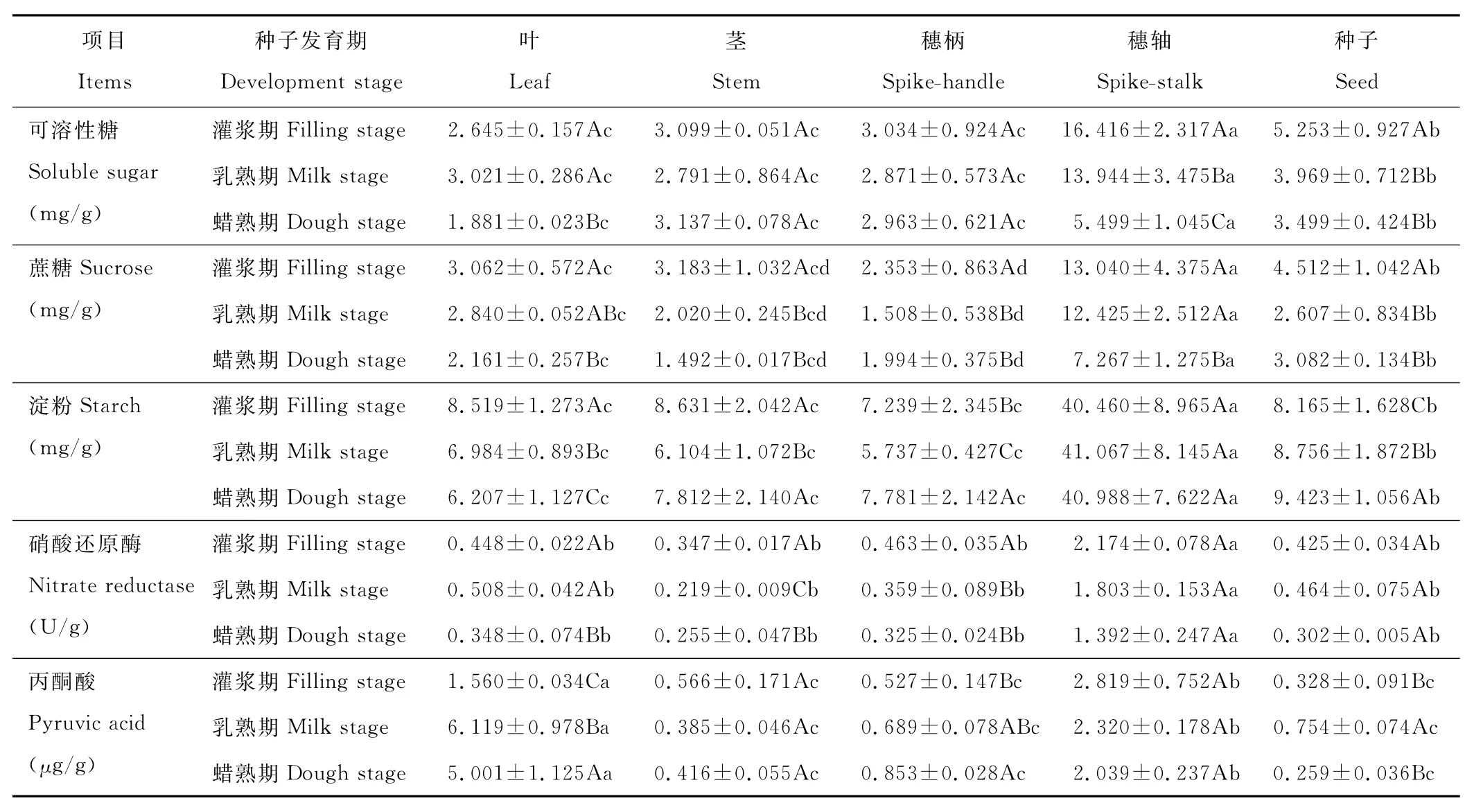
表1 种子发育过程构件中糖分、丙酮酸含量及硝酸还原酶活性变化的多重比较Table 1 M ultiple comparison about sugar,pyruvic acid content and nitrate reductase activity during seed development
2.2 构件中丙酮酸含量和硝酸还原酶活性的多重比较
叶中P A含量随种子发育先增后减,乳熟期比灌浆期提高了3.922倍,蜡熟期显著下降(P<0.05)(表1),穗柄P A含量随种子发育不断增大,茎和穗轴P A含量无显著变化,种子中乳熟期显著增加后,蜡熟期则显著下降(P<0.05)。可见,乳熟期叶和种子的呼吸作用达最大值,蜡熟期穗柄的呼吸作用达最大值,茎和穗轴新陈代谢在种子发育过程中一直处于较高水平。在种子发育过程中,叶中P A含量显著高于其他构件(P<0.05);穗轴中P A含量显著高于叶、茎和种子(P<0.05)(表1);叶、茎和种子间P A含量差异较小。进一步交叉两因素方差表明,发育期、构件及互作间P A含量均有极显著差异(P<0.01)(表2),构件间差异大于发育期间。
叶中N R活性乳熟期显著高于灌浆期与蜡熟期,茎与穗柄中N R活性在灌浆期后显著下降(P<0.05)(表1),穗轴和种子N R活性随种子发育无显著变化。可见,种子发育不同时期,生殖枝不同构件氮化物合成或分解速度不同。穗柄中N R活性显著高于其他构件,叶、茎、穗柄、种子间无显著差异(P>0.05)。方差分析表明,发育期间和构件间N R活性均有极显著差异(P<0.01)(表2),构件间差异大于发育期间。
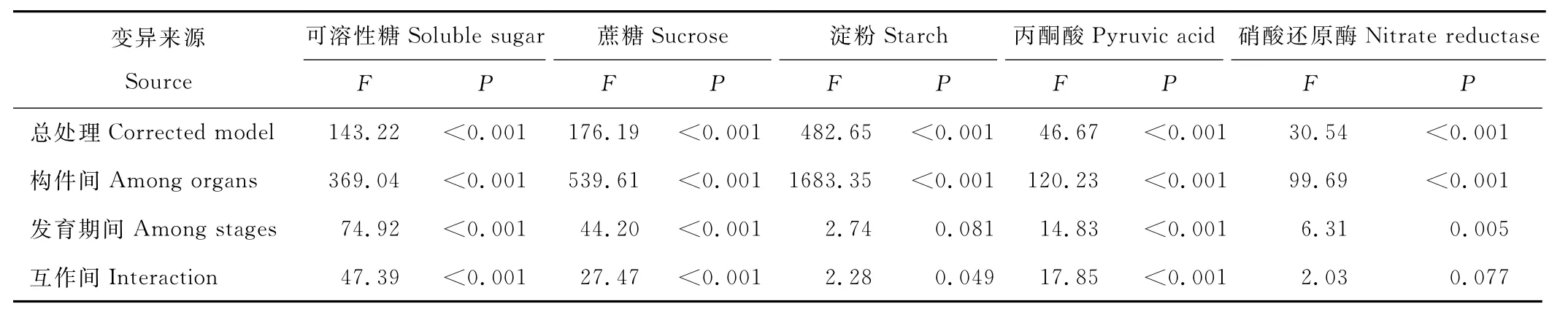
表2 糖分、丙酮酸含量和硝酸还原酶活性的方差分析Table 2 Analysis of variance about sugar,pyruvic acid content and nitrate reductase activity
2.3 不同发育期糖分与丙酮酸含量和硝酸还原酶活性的相关性分析
灌浆期N R活性与构件中SS、S U和S T含量呈极显著正相关(P<0.01)(表3),与P A含量呈显著正相关(P<0.05),相关性大小为S T>S U>SS>P A;乳熟期N R活性与P A含量无显著相关(P>0.05),与糖相关性大小为SS>S T>S U;蜡熟期N R活性仅与SS和S T呈极显著正相关(P<0.01)。
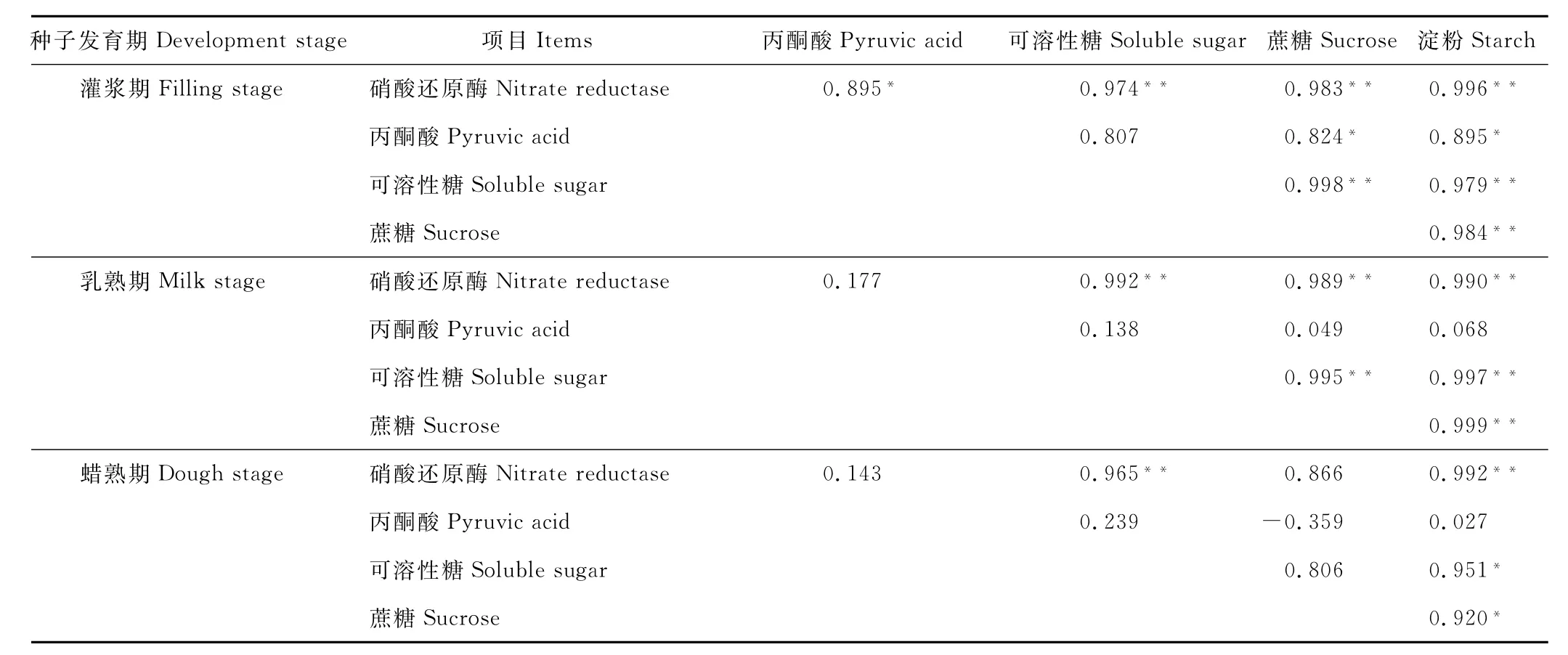
表3 不同发育期糖分与丙酮酸含量和硝酸还原酶活性相关性的差异Table 3 Correlation difference about sugar and pyruvic acid content and nitrate reductase activity during seed development
灌浆期P A含量仅与S T含量呈显著正相关(P<0.05),乳熟期P A含量与糖无显著相关,蜡熟期则与S U呈一定的负相关。随种子发育P A含量与N R活性相关性越来越低。
灌浆期S T含量与SS、S U、N R、P A均为极显著正相关(P<0.01),乳熟期后S T含量则与P A无显著相关,而S T含量与SS、S U含量的相关性呈下降趋势,与N R呈相对稳定的极显著正相关(P<0.01)。
进一步对同一指标在不同种子发育期含量进行相关分析表明,SS、S U、S T、N R含量在3个发育期间均为显著正相关(P<0.05)(表4),灌浆期SS、S U、S T含量与乳熟期含量的相关系数大于与蜡熟期的相关系数。灌浆期P A含量与乳熟期、蜡熟期含量无显著相关,而乳熟期P A含量与蜡熟期含量有极显著正相关。
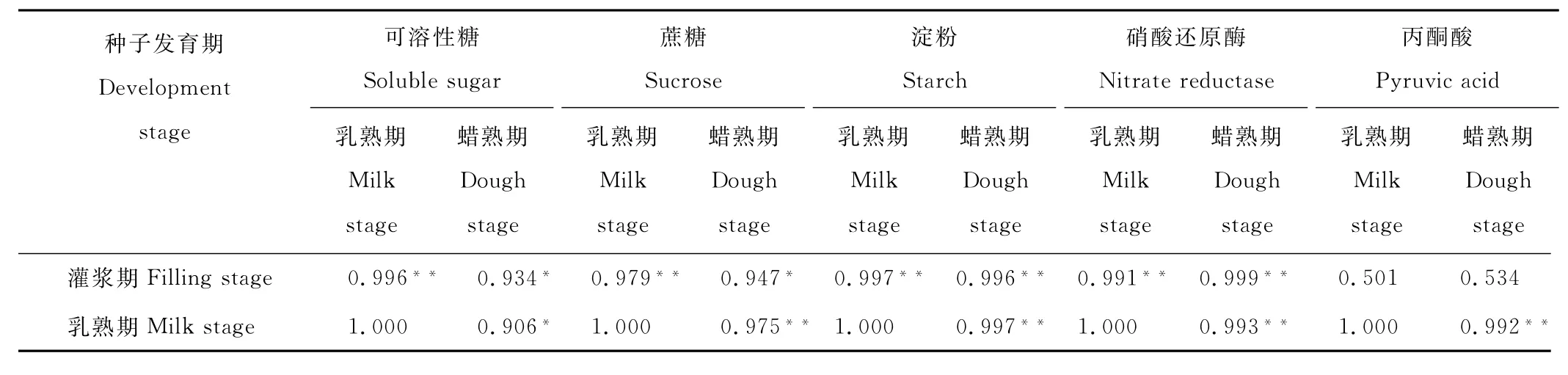
表4 糖分、丙酮酸含量及硝酸还原酶活性在发育期间的相关性Table 4 Correlation about sugar and pyruvic acid content and nitrate reductase activity during seed development
2.4 种子千粒重与构件糖分、丙酮酸含量及硝酸还原酶活性的相关性
种子千粒重与叶中SS含量呈显著正相关(P<0.05)(表5),与穗柄中P A含量呈显著正相关(P<0.05),与穗轴中N R活性、S U含量呈显著负相关(P<0.05),与种子中N R活性、S T含量呈显著正相关。
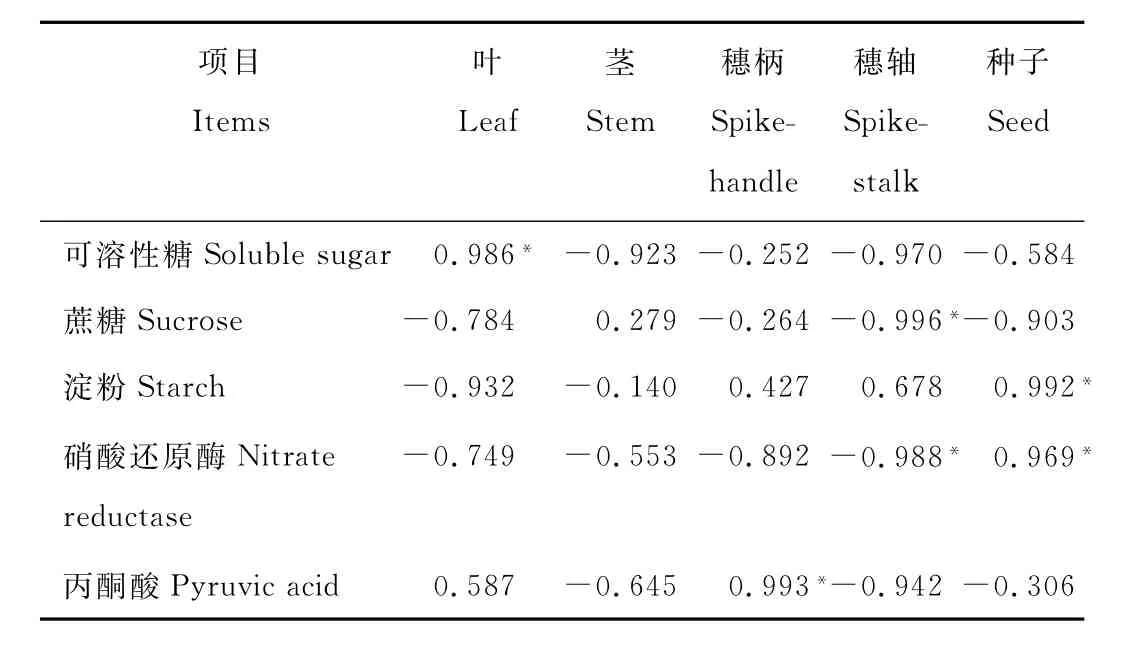
表5 种子千粒重与构件糖分、丙酮酸含量及硝酸还原酶活性的相关性Table 5 Correlation between 1000-seed weight and sugar,pyruvic acid content and nitrate reductase activity
3 讨论
3.1 糖分运输与种子发育
种子发育过程,实质就是淀粉、蛋白质和脂肪等主要灌浆物质充盈库器官的过程,淀粉是老芒麦种子主要的灌浆物质,占种子总重量60%左右。源器官最初光合产物是葡萄糖,向库器官运输的过程以葡萄糖、蔗糖、果糖、鼠李糖、木糖、肌醇、氨基葡糖等可溶性糖形式进行运转。可溶性糖是主要光合产物,是碳水化合物代谢、暂时贮藏和运输的主要形式,也是呼吸作用的主要底物,与植物的抗性有密切关系[13]。可溶性糖也是种子发育中一种重要的信号分子,浓度水平控制了胚胎从发育到衰老的整个过程[14]。蔗糖是可溶性糖在各器官间分配和运输的主要形式,淀粉的积累速率依赖于高浓度的蔗糖[15]。光合产物向灌浆物质转化、运输效率,与种子成粒率、饱满度和实际产量(库容量)密切相关[10]。本文通过分析源器官、运输器官、库器官中可溶性总糖、蔗糖、淀粉含量变化发现,随种子发育叶、茎、穗柄、穗轴、种子中可溶性糖和蔗糖含量均显著下降,但上述构件中淀粉含量在发育期间无显著变化,是因该测定值为构件单位生物量中淀粉含量。在种子发育过程中营养器官生物量比例逐渐下降,穗柄生物量分配比相对稳定,穗生物量在乳熟-蜡熟显著增加(另文发表),所以种子总淀粉量是不断增加。各构件维持相对的淀粉含量,因为淀粉不仅是重要的贮藏物质,也要参与种子成熟的代谢过程[16]。由于库容大小在抽穗前就已被决定,运输器官的运输能力(流)及其协调能力决定了物质运转的有效性,本文发现穗轴中SS、S U、S T含量均显著高于其他构件,是叶、茎、穗柄中含量的数倍,穗轴为种子发育就近提供营养的同时,富集和贮藏了大量能源,对流速、流量起到了调控作用。老芒麦原胚发育所需的营养主要由合子本身贮藏的营养物质供给,分化期后胚发育所需营养物质则由胚乳来提供[17],目前对种子中可溶性糖和淀粉含量随发育进程的消长关系进行了研究[18-20],关于胚或胚乳发育过程中贮藏物质(如淀粉)合成、转化(如糖转蛋白质)与积累规律,以及遗传物质、结构物质、生理活性物质与贮藏物质的权衡关系进行深入的研究。
3.2 呼吸作用和种子发育
植物由营养生长转为生殖生长是新陈代谢最旺盛的时期,种子发育是胚和胚乳细胞增殖与贮藏物沉积的过程,细胞增殖需要大量A T P(三磷酸腺苷)的供应[21],灌浆物质的合成、运输都需消耗能量,贮藏物沉积也需要A T P供能,随种子发育种子中A T P含量相对增高[20],同时随种子发育营养器官的衰老也加剧了呼吸作用强度。此阶段植物进行着极其复杂的新陈代谢过程,存在着不断制造与消耗A T P的动态变化。本文以呼吸作用第一阶段产物丙酮酸作为评定呼吸强度的参数,表明不同发育期、不同构件间呼吸作用存在显著差异,乳熟期呼吸强度达最大值,源器官和库器官丙酮酸含量成倍增加,可见此阶段的糖分运输与贮藏物沉积速度最快。整个发育过程叶片丙酮酸含量显著高于其他构件,表明叶片是植物生长发育的动力车间;穗轴中丙酮酸含量相对稳定,一方面表明穗轴对物质运输起调控作用,一方面丙酮酸是三大营养物质代谢联系中起着重要的枢纽作用,说明穗轴中糖、脂肪和氨基酸间保持相对稳定的互相转化过程。但是丙酮酸含量与3个发育阶段可溶性糖、蔗糖和淀粉含量相关性较低,除灌浆期淀粉外均无显著的相关性。呼吸强度受遗传影响,不同时期不同器官间均有差异,同时也受温度、水分、氧气等外界生境的影响,所以关于种子发育过程呼吸作用强度变化规律及与底物浓度的关系有待于进一步研究。
3.3 氮代谢和种子发育
硝酸还原酶是植物体内最基本氮代谢的关键酶,其活性对无机氮的还原、同化和氨基酸、蛋白质的合成等氮代谢过程起关键的调控作用,对光合、呼吸及碳代谢等都有重要影响[22]。氮代谢与糖代谢密切相关,25%光合总能量用于氮代谢[23],某些组织中氮代谢可消耗掉55%的光合能量[24]。本文中N R活性与SS、S U和S T含量呈极显著正相关,说明氮代谢与糖代谢关系密切。随种子发育N R活性与丙酮酸含量的相关性越来越低,说明发育后期氮代谢对呼吸作用的依赖性越来越小。不同发育期的N R活性有极显著相关性,说明种子过程中氮代谢有显著的递进和连续性。一般认为N R主要存在于根和叶片,营养生殖转向生殖生长后,氮代谢中心由根系(吸收同化为主)转移到地上部分(合成转化为主),N R主要分布于叶绿体和质膜外膜。本试验穗轴中N R活性显著高于其他构件,且茎、叶、种子中N R活性无显著差异。氮代谢随氮源种类、时间、生态、发育阶段以及部位的不同而差异较大[25],蜡熟期生殖枝N R活性显著下降,与其他植物上研究结果一致[26-27]。本文中随种子发育穗轴和种子中N R活性无显著变化,表明穗轴和种子氮代谢强度对种子发育起重要作用,相关分析说明种子饱满度(千粒重)与穗轴和种子中N R活性有显著相关性。
3.4 源库平衡和种子发育
诸多学者对老芒麦种子发育过程中,种子(库)中含水量变化、糖分组成和含量变化、硝酸还原酶活性变化与种子发育关系进行了研究[12-20],试图通过库中上述指标的变化规律,总结出种子发育的生理生化特点和物质累积规律。种子发育实质是源器官通过流器官向库器官运输灌浆物质的过程,源、流、库的协同和平衡作用是决定种子产量质量的关键。本文对灌浆期、乳熟期和蜡熟期,生殖枝叶片、茎、穗柄、穗轴、种子中糖分、丙酮酸含量和硝酸还原酶活性分析,表明叶(源)中可溶性糖含量、种子中淀粉和硝酸还原酶含量(库)与种子千粒重显著相关,穗柄丙酮酸含量(流)或呼吸强度与种子千粒重显著相关,穗柄长度和直径与生殖枝种子数、种子数、表现种子产量、实际种子产量呈正相关[12],穗柄性状和呼吸强度能否成为反映生殖枝营养状态、判断种子成熟度、预测种子产量等问题待于研究。穗轴对流速、流量起调控作用,但对糖类、蛋白质、脂肪等营养物质的合成与转化调控机理,及贮藏物质与结构性物质、生理活性物质及遗传物质之间的物质能量分配,待于进一步深入研究。源库平衡受植物种类、株龄、发育阶段及生境条件的影响[8,25],合理的栽培措施能营造或改善老芒麦生长发育的环境条件[28-29],影响源、流、库关系,提高库容和灌浆效益,以提高种子产量和质量。如施N肥可增大光合叶面积及叶绿素含量,提升捕获、固定光能能力而扩大光合产物的源量[30];施硼(B)、钼(M o)和锰(M n)能促进糖分等物质向库流动,提高种子物质积累量和千粒重[31-33];施锌(Zn)会提高硝酸还原酶活性,促进游离氨基酸和粗蛋白含量合成[33],提高种子质量。所以,针对川西北辐射强、日照长、积温低、生长期短的气候特点,不断开发利于源器官生产光合产物,利于库器官灌浆物质累积,利于源、流、库协同作用的栽培技术,是提高该区老芒麦种子产量及质量的根本途径。
References:
[1]You M H,Liu J P,Bai S Q,etal.Effect of mixed application of fertilizers and herbicides on production perform ance of Elymussibiricus.Acta Prataculturae Sinica,2010,19(5):283-286.
[2]You M H,Zhang C B,Liu J P,etal.Effect of row spacing and fertilizing on productivity of Elymussibiricus cv.chuancao No.2.Pratacultural Science,2008,25(2):69-72.
[3]You M H,Liu J P,Bai S Q,etal.Influence of row spacing on fertile tiller and characters of seed yield of Elymussibiricus cv.chuancao No.2.Acta Prataculturae Sinica,2011,20(6):299-302.
[4]Liu J P,You M H.Response of fertile tiller characteristics and seed yield of Elymussibiricus to Row Space.Journal of A nim al and Plant Sciences,2014,21(3):3347-3355.
[5]Chen Y J.Study on Photosynthetic Traits and Production Perform ance of Elymussibiricus in the Qinghai-Tibetan Plateau [D].Xining:Qinghai U niversity,2013:34-26.
[6]W ang Y C,Gan Y M,Qiu Y,et al.Physiological and ecological characteristics of photosynthesis of Elymussibiricus cv.Chuancao No.2 in alpine area.Jiangsu A gricultural Sciences,2007,(6):211-213,235.
[7]You M H,Liu J P,Bai S Q,etal.Effect of row space on photosynthetic index and seed yield of Elymussibiricus L.Prataculture & A nim al H usbandry,2013,(1):14-17,22.
[8]Cao X Z,Zhu Q S.Study on characteristics of the relationship between source and sink in rice varieties and their classification.Acta A grono mica Sinica,1987,13(4):265-272.
[9]Liu J P,You M H,Ceng X L,etal.Change of bio m ass,energy distribution and horm one content of Elymussibiricus reproductive branches during the seed develop m ent.Acta Prataculturae Sinica,2015,24(11):118-127.
[10]Tu N M,Guan C Y.Effects ofleaf-cutting treatm ents on source-sink relation of rice during panicle initiation.Journal of H unan A gricultural U niversity,1999,25(6):430-436.
[11]Li X M,Zhu C F,Miao Y N,etal.Changes of N O3--N and activity of nitrate reductase in different parts of soybean during plant develop m ent.Plant Physiology Co m m unications,1993,29(4):263-265.
[12]You M H,Liu J P,Bai S Q,etal.Study on relationship of seed shattering,seed develop m ent and yield traits of Elymus sibiricus L.South west China Journal of A gricultural Sciences,2011,24(4):1256-1260.
[13]H uang Y,Xiong Z T,Guo M W,etal.Sugar im port and m etabolis m during seed develop m ent.Seed,2007,26(4):50-54.
[14]W obus U,W eber H.Sugars as signal m olecules in plant seed develop m ent.Biological Che mistry,1999,380(7):937-944.
[15]Vandeputte G E,Delcour J A.Fro m sucrose to starch granule to starch physical behavior:a focus on rice starch.Carbohydrate Poly m ers,2004,58(3):245-266.
[16]M ao P S,H an J G,W ang P,etal.Changes of physiology and bioche mistry during seed develop m ent of s m ooth bro m egrass.Grassland of China,2001,23(1):26-31.
[17]H e X,Yan J,Li Q F,etal.O bservations on seed develop m ent of Elymussibiricus L.Journal of China A gricultural U niversity,2004,9(6):9-14.
[18]M a C H,Cheng J,H an J G,etal.Study on the dyna mic changes of physiology and bioche mistry during the seed developm ent of tall fescue in Xinjiang.Acta Prataculturae Sinica,2002,11(4):76-80.
[19]Shi P,Zhou Q P,Yan H B,etal.Changeable features of several physiological para m eters of seed develop m ent process of Puccinelliatenuiflora cv.Tongde.Pratacultural Science,2012,29(7):1084-1087.
[20]M a C H,H an J G,Sun J F,etal.A study on the changes of physiology and bioche mistry during zoysiagrass seed developm ent.Acta Prataculturae Sinica,2009,18(6):174-179.
[21]Ching T M,Crane J M,Sta m p D L.A denylate energy pool and energy change in m aturing rape seed.Plant Physiology,1974,54:748-751.
[22]M a F M,Gao J G.Studies on nitrate reductase activity as indices of nitrogen nutrition diagnosis and sugar yield prediction in sugar beet.Scientia A gricultura Sinica,1995,29(5):16-22.
[23]Solo m onson L P,Barber M J.Assimilatory nit rate reductase:Functional properties and regulation.A nnual Review of Plant Physiology and Plant M olecular Biology,1990,41(4):225-253.
[24]Song J M,Tian J C,Zhao S J.Relationship between photosynthetic carbon and nitrogen m etabolis m in plants and its regulation.Plant Physiology Co m m unications,1998,34(3):230-238.
[25]Qi H Y.Studes on Transloeation,M etabolis m and Related Influencing Factors of Sucrose of Photosynthate Transportation of To m ato[D].Shenyang:Shenyang A gricultural U nlversity,2003.
[26]W ang Y L,Miao Y H,H an Y L,etal.Effect of slow/controlled release N fertilizer on N m etabolis m,N accu m ulation and yield of su m m er m aize.Chinese Journal of Soil Science,2012,43(1):147-150.
[27]Liu L,Gan Z J,W ang X Z.A dvances of studies on the regulation of nitrate m etabolis m of plants at nitrate reductase level.Acta Botanica Boreali-Occidentalia Sinica,2004,24(7):1355-1361.
[28]Liu J P,You M H.Effect of growth inhibitors on bio m ass structure,energy distribution and lodging rates for populations of Elymussibiricus.Acta Prataculturae Sinica,2012,21(5):195-203.
[29]Liu J P,You M H,Bai S Q.Effect of row space on population co m ponent co m ponent,bio m ass structure and energy distribution of Elymussibiricus.Acta Prataculturae Sinica,2012,21(3):69-74.
[30]Su Y L,Sun Q Z,Zhang L J,etal.Coupling effect of water and fertilizer on chlorophyll content and nitrate reductase activity in alfalfa leaves.Chinese Journal of Grassland,2011,33(3):52-56.
[31]Zong Y Z,W ang W Y,H an Q F,etal.Effects of differentlevels of boron fertilizer on alfalfa photosynthesis and source-sink translocation of soluble carbohydrate in alfalfa.Acta A grono mica Sinica,2010,36(4):665-672.
[32]Zu Y Q,Lin K H.The role of boron in plants and its effect on the yield and quality of crops.Journal of Y unnan A gricultural U niversity,2000,12(4):359-363.
[33]H e X,Li Q F,Lu H P.Effects of 4 micro-nutrients foliar spray on the m oisture,sugar and protein m etabolis m in the seed develop m ent of Elymussibiricus.Acta Prataculturae Sinica,2005,14(3):100-105.
[1]游明鸿,刘金平,白史且,等.肥料和除草剂混施对老芒麦生产性能的影响.草业学报,2010,19(5):283-286.
[2]游明鸿,张昌兵,刘金平,等.行距和肥力对川草2号老芒麦生产性能的作用.草业科学,2008,25(2):69-72.
[3]游明鸿,刘金平,白史且,等.行距对川草2号老芒麦生殖枝及种子产量性状的影响.草业学报,2011,20(6):299-302.
[5]陈有军.青藏高原老芒麦光合特性及生产性能研究[D].西宁:青海大学,2013:34-36.
[6]王岩春,干友民,邱英,等.高寒地区老芒麦川草2号的光合生理特性.江苏农业科学,2007,(6):211-213,235.
[7]游明鸿,刘金平,白史且,等.行距对老芒麦光合性能及种子产量的影响.草业与畜牧,2013,(1):14-17,22.
[8]曹显祖,朱庆森.水稻品种的源库特征及其类型划分的研究.作物学报,1987,13(4):265-272.
[9]刘金平,游明鸿,曾晓琳,等.老芒麦种子发育时不同位叶光合速率和生物量变化与种子产量的相关分析.草业学报,2015,24(11):118-127.
[10]屠乃美,官春云.水稻幼穗分化期间减源对源库关系的影响.湖南农业大学学报,1999,25(6):430-436.
[11]李雪梅,朱长甫,苗以农,等.大豆植株发育过程中不同部位的硝态氮含量和硝酸还原酶活力的变化.植物生理学通讯,1993,29(4):263-265.
[12]游明鸿,刘金平,白史且,等.老芒麦落粒性与种子发育及产量性状关系的研究.西南农业学报,2011,24(4):1256-1260.
[13]黄宇,熊治廷,郭明武,等.种子发育过程中糖的吸收和代谢过程.种子,2007,26(4):50-54.
[16]毛培胜,韩建国,王培,等.无芒雀麦种子发育过程中的生理生化变化.中国草地,2001,23(1):26-31.
[17]贺晓,闫洁,李青丰,等.老芒麦种子发育过程的形态解剖学特征.中国农业大学学报,2004,9(6):9-14.
[18]马春晖,程军,韩建国,等.新疆高羊茅种子发育生理生化变化的动态研究.草业学报,2002,11(4):76-80.
[19]史鹏,周青平,颜红波,等.同德小花碱茅种子发育过程中几个生理指标的变化.草业科学,2012,29(7):1084-1087.
[20]马春晖,韩建国,孙洁峰,等.结缕草种子发育过程中生理生化变化的研究.草业学报,2009,18(6):174-179.
[22]马凤鸣,高继国.硝酸还原酶活力作为甜菜氮素营养诊断及预测产量指标的研究.中国农业科学,1995,29(5):16-22.
[24]宋建民,田纪春,赵世杰.植物光合碳和氮代谢之间的关系及其调节.植物生理学通讯,1998,34(3):230-238.
[25]齐红岩.番茄光合运转糖-蔗糖的运转、代谢及其相关影响因素的研究[D].沈阳:沈阳农业大学,2003.
[26]王宜伦,苗玉红,韩燕来,等.缓/控释氮肥对夏玉米氮代谢、氮素积累及产量的影响.土壤通报,2012,43(1):147-150.
[27]刘丽,甘志军,王宪泽.植物氮代谢硝酸还原酶水平调控机制的研究进展.西北植物学报,2004,24(7):1355-1361.
[28]刘金平,游明鸿.生长抑制剂对老芒麦种群生物量结构、能量分配及倒伏率的影响.草业学报,2012,21(5):195-203.
[29]刘金平,游明鸿,白史且.行距对老芒麦种群构件组成、生物量结构及能量分配的影响.草业学报,2012,21(3):69-74.
[30]苏亚丽,孙启忠,张力君,等.水肥耦合对紫花苜蓿叶绿素含量和硝酸还原酶活性的影响.中国草地学报,2011,33(3):52-56.
[31]宗毓铮,王雯玥,韩清芳,等.喷施硼肥对紫花苜蓿光合作用及可溶性糖源库间运转的影响.作物学报,2010,36(4):665-672.
[32]祖艳群,林克惠.硼在植物体中的作用及对作物产量和品质的影响.云南农业大学学报,2000,12(4):359-363.
[33]贺晓,李青丰,陆海平.四种微量元素对老芒麦种子发育过程中水分、糖及蛋白质代谢的影响.草业学报,2005,14(3):100-105.
Changes in sugar,pyruvic acid content and nitrate reductase activity of Elymus sibiricus reproductive branches during seed development
LIU Jin-Ping1,F A N Xuan1,Y O U Ming-H ong2,W A N G Si-Si1,Z O N G Ren-Xu1
1.Collegeof Life Sciences,China West Normal University,Nanchong 637009,China;2.Sichuan Academy of Grassland Science,Chengdu 611731,China
W hen Elymussibiricus was in the filling stage,milk stage and dough stage,respectively,co m ponents of reproductive branch,including leave,ste m,spike-handle,spike-stalk and seed all were used as research subject.So m e index,including soluble sugars(SS),sucrose(S U),starch(S T),respiration interm ediate product pyruvate acid(P A)content and nitrate reductase activity(N R)were m easured.T he objective of study was to analyze the difference of sugar content,respiration rate and m etabolic rate of nitrogen during theseed develop m ent and a m ong either co m ponent,to research the transfer rule of filling m aterialfro m the source to the library during the seed develop m ent,and to explore the relationship between seed plu m pness and m aterial content of co m ponents.T he results showed that:1)SS,S U and P A content and N R activity exists high significant difference during the seed develop m ent and a m ong either co m ponents(P<0.01).S T content exists significant difference a m ong either co m ponent,and only a little change during the seed develop m ent.2)With seed developing,SS and S U content of either co m ponent significantly decline(P<0.05),but S T content has no significant rising.P A content significantly increases at milk stage,but significantly decreases at dough stage (P<0.05).N R activity in the filling stage and milk stage were no difference,but significantly decrease in the dough stage(P<0.05).3)During the seed develop m ent,P A content of leave is significantly higher than that of other co m ponents,but SS,S U and S T content and N R activity in the spike-stalk are several tim es higher than those of other co m ponents.4)During filling stage,N R activity has a significantly positive correlation with SS,S T,S U content and P A activity(P<0.05),with the correlation order of S T>S U>SS>P A.During milk stage,the correlation order between N R activity and sugar content was SS>S T>S U,and N R activity has no significant correlation with P A content(P<0.05).During dough stage,N R activity only has a significant correlation with SS and S T content(P<0.01).5)Seed plu m pness has a significantly positive correlation with SS content of leave,P A content of spike-handle and N R activity and S T content of seed(P<0.05),and a significantly negative correlation with N R activity and S U content of spike-stalk(P<0.05).In a w ord,co m ponents of reproductive branch all participate in m aterial transportation fro m source to library during seed develop m ent.At the milk stage,transportation speed and storage deposit are fastest,and spike-stalk has a control function on source-library flow.Nitrogen m etabolis m rate is significantly associated with seed plu m pness.
Elymussibiricus;reproductive branch;seed develop m ent;sugar transportation;respiration intensity;nitrogen m etabolis m
刘金平(1972-),男,山西临县人,教授,博士。E-m ail:jpgg2000@163.com
10.11686/cyxb2015502
2015-11-04;改回日期:2015-12-10
四川省科技厅应用基础项目(2012JY0062)和国家牧草产业体系阿坝试验站(C A R S-35-35)项目资助。

