玉米穗轴长与穗轴粗的QTL定位及全基因组预测
李宗泽 徐晓明 孙 强 杨彩霞 许加波 吴鹏昊
(新疆农业大学 农学院,乌鲁木齐 830052)
玉米(ZeamaysL.)是我国重要的粮食作物,同时也是重要的工业原材料,是全球种植面积最大的作物,对我国粮食安全具有重要影响[1]。作物产量构成因子在不同生长条件下表现出很高的遗传力和稳定性[2],玉米穗轴长和穗轴粗与籽粒性状呈显著相关性,是影响产量构成因子的重要性状[3]。而且,玉米穗轴长与穗轴粗是典型的数量性状,受到多个基因调控,对控制玉米穗轴长与穗轴粗性状的QTL进行鉴定不仅有助于揭示玉米产量的遗传机制,而且能指导玉米育种实践[4]。
关于玉米穗部发育相关性状的QTL鉴定,石云素等[5]利用F2群体对玉米穗部性状进行定位,发现5个与穗轴长相关QTL位点,4个穗轴粗QTL位点,其中穗轴长定位到1个主效QTL位点,可解释14.3%的表型变异。张建华等[6]利用玉米加倍单倍体(DH)群体对穗轴长和穗轴粗进行了QTL定位,共定位6个QTL位点,其中穗轴长定位到3个QTL位点,穗轴粗定位到3个QTL位点。在定位穗轴粗性状时找到1个主效QTL位点,该QTL解释了16.1%的表型变异。崔新建等[7]利用2个RIL群体对产量相关性状进行QTL定位,定位到穗轴长相关QTL位点有13个,其中位于2号染色体的q2sEL2-1为主效位点,其贡献率为18.32%;定位到穗轴粗的相关QTL位点14个,位于1号染色体上的q2sCD-1为主效QTL,表型贡献率为24.31%。王满等[8]利用2个F2群体定位到11个穗轴长QTL,鉴定到1个主效QTLqEL1-2,表型贡献率为22.3%;定位到14个穗轴粗QTL,其中qCD4-2为主效位点,能够解释19.9%的表型变异。对已发表的与玉米穗轴长和玉米穗轴粗相关QTL[5-11]进行分析发现,其在数量、位置和效应方面都具有差异,且共定位的QTL很少。由于作图群体、应用标记及种植环境等因素都影响定位结果,因而挖掘多次被定位到的、稳定存在的、具有较高表型贡献的QTL,对穗轴长和穗轴粗进行分子标记选择育种将具有更高应用价值[9]。
全基因组预测(Genomic selection, GS)技术是改良作物数量性状的有效工具之一,已在国内外迅速发展利用[12]。GS技术利用训练群体的表型与基因型建立预测模型,估计分子标记的遗传效应,根据训练群体的基因型对表型进行预测,选择优良材料,可提高育种效率[13]。刘小刚等[14]利用不同群体对玉米穗长和穗粗进行GS分析,结果表明在自然群体中穗长和穗粗的预测精度分别为0.45和0.53,在RIL和DH群体中预测精度分别为0.49和0.60,在F2群体中预测精度分别为0.66和0.72。GS的预测精度受多个因素影响,包括遗传力、标记密度、训练群体大小、训练群体与预测群体间亲缘关系等。通过对影响GS的各个因素进行研究,可提高GS预测精度,促进GS在育种上的应用。
目前在玉米穗轴性状方面尚未见利用全基因组进行选择的研究报道。本研究利用玉米自交系‘B 73’与‘郑58’构建的F2群体,在多环境下采集玉米穗轴长和穗轴粗的表型,结合48K液相杂交探针捕获获得的基因型数据,对玉米穗轴长和穗轴粗进行QTL定位,采用岭回归最佳线性无偏预测(Ridge regression best linear unbiased prediction, rrBLUP)方法对玉米穗轴长和穗轴粗进行全基因组预测,分析标记密度和训练群体大小对预测精度的影响,旨在明确玉米穗部发育相关性状的主效QTL位点,以期为解析玉米穗部性状发育的遗传机制提供参考。
1 材料与方法
1.1 试验材料
2018年11月—2019年3月在海南省乐东黎族自治县实验站种植玉米自交系‘B 73’与‘郑58’,并组配获得杂交F1,2019年5—10月于新疆维吾尔自治区昌吉市三工镇九圣禾实验站种植并自交获得F2,于2019年11月—2020年3月在海南省乐东黎族自治县实验站种植F2并自交获得200个F2∶3家系。2020年5—10月,将F2∶3家系分别种植于新疆维吾尔自治区昌吉市三工镇九圣禾实验站、新疆维吾尔自治区昌吉市二六工镇实验站和新疆维吾尔自治区乌鲁木齐市三坪农场实验站。每个地点设置2个重复,采用完全随机区组试验设计,行长3 m,株距0.25 m,行距0.67 m,单行区种植,田间管理同大田生产。在F2∶3家系吐丝期,利用玉米‘农大高油高诱3号’对F2∶3家系进行多次授粉,以保证果穗的结实率。收获的果穗在室内进行考种,测量穗轴长和穗轴粗。游标卡尺测量脱粒后穗轴基部到顶部的距离为穗轴长,cm;游标卡尺测量脱粒后的穗轴最粗部分为穗轴粗,cm。
1.2 表型数据分析
利用CIMMYT开发的META-R软件(http:∥hdl.handle.net/11529/10201)对3个环境的穗轴长和穗轴粗表型数据进行联合分析,获得最佳线性无偏估计值(Best Linear Unbiased Prediction, BLUP)[15],用于QTL定位和GS分析。利用QTL IciMapping软件[16]估计出不同组分的方差,并进行遗传力分析。遗传力计算公式[17]:
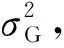
1.3 基因分型和连锁图谱构建
在苗期对亲本和F2群体叶片进行取样,送中玉金标记(北京)生物技术股份有限公司,采用48K液相杂交探针捕获测序技术获得基因型数据。液相探针捕获是在溶液中进行的核酸分子碱基互补杂交,而实现目标片段DNA富集,再经过高通量测序技术检测分析。将获得的原始测序数据过滤获得高质量测序数据,通过BWA软件比对到B73_RefGen_v4_genomic参考基因组[18]。采用GATK(The Genome Analysis Toolkit)软件进行过滤,共获得1 785 794 个SNP标记。利用VCFtools对SNP数据进行过滤,过滤参数为:缺失率<0.20,最小等位基因频率>0.05,测序深度为4~500,个体变异基因型值质量值(GQ)>10,Phred格式(Phred_scaled)的质量值(Q)>30,获得62 504个SNP标记用于全基因组预测分析。通过VCFtools对SNP数据进行严格过滤,过滤参数为:GQ>30,Q>30,缺失率<0.97,获得2 111个高质量SNP标记。筛选亲本纯合且有差异的标记,剩余标记为2 010个,对P<0.05的偏分离标记进行过滤,剩余1 855个SNP标记用于连锁图谱的构建。
使用QTL IciMapping软件进行连锁图谱的构建,SNP标记根据物理位置进行排序后导入IciMapping软件,选择MAP(Linkage map construction in biparental populations)功能进行连锁群的划分及遗传距离的确定,在软件界面“Grouping”命令中选择By Anchor only,在Order命令中选择By Anchor order,连锁群选择10,进行输出,获得连锁图谱。
1.4 QTL定位
采用META-R软件获得的BLUP值作为表型值,使用QTL IciMapping软件的BIP(QTL mapping in biparental populations)功能对穗轴长与穗轴粗进行QTL定位,定位方法采用完备区间作图加性模型(ICIM-ADD)[16]。分子标记之间每隔0.5 cM 进行1次全基因组扫描,窗口的设定为5.0 cM。
1.5 全基因组预测
采用48K液相杂交探针技术获得的62 504个SNP标记进行全基因组预测(Genomic selection GS),利用多环境的BLUP值作为表型值,使用R软件包rrBLUP,对穗轴长和穗轴粗性状进行全基因组预测分析。采用五倍交叉验证方法[19],即随机选取群体的80%作为训练群体,剩下的20%作为预测群体,进行GS,计算预测群体的真实育种值与全基因组估计育种值间的相关系数,即全基因组预测精度,重复100次。
标记个数设定为10、30、50、100、300、500、1 000、3 000、5 000、10 000和60 000,采用五倍交叉验证方法,每个标记密度进行100次GS,研究标记数目对GS预测精度的影响。训练群体设定为总群体的10%,20%,30%,40%,50%,60%,70%,80%和90%,剩余群体为预测群体,采用全部62 504个SNP标记,每个训练群体大小进行100次GS,研究训练群体大小对GS预测精度的影响。
2 结果与分析
2.1 F2群体穗轴长和穗轴粗表型分析
由表1可知,在F2群体中穗轴长的均值为14.42 cm,最小值为12.94 cm,最大值为16.40 cm,变异系数为0.05。穗轴粗的均值为2.51 cm,最小值为2.40 cm,最大值为2.67 cm,变异系数为0.02。穗轴长与穗轴粗的峰度和偏度都<1,基本符合正态分布的规律,是典型的数量性状。

表1 F2∶3家系穗轴长和穗轴粗统计分析Table 1 Descriptive statistics of cob length and cob diameter in the F2∶3 families
2.2 穗轴长和穗轴粗方差分析
由表2可知,穗轴长与穗轴粗2个性状在不同基因型、环境、基因型与环境的互作上都具有显著差异。穗轴长与穗轴粗的广义遗传力分别是0.71与0.52,说明群体中穗轴长主要受遗传因素影响,穗轴粗受基因型和环境因素共同影响。
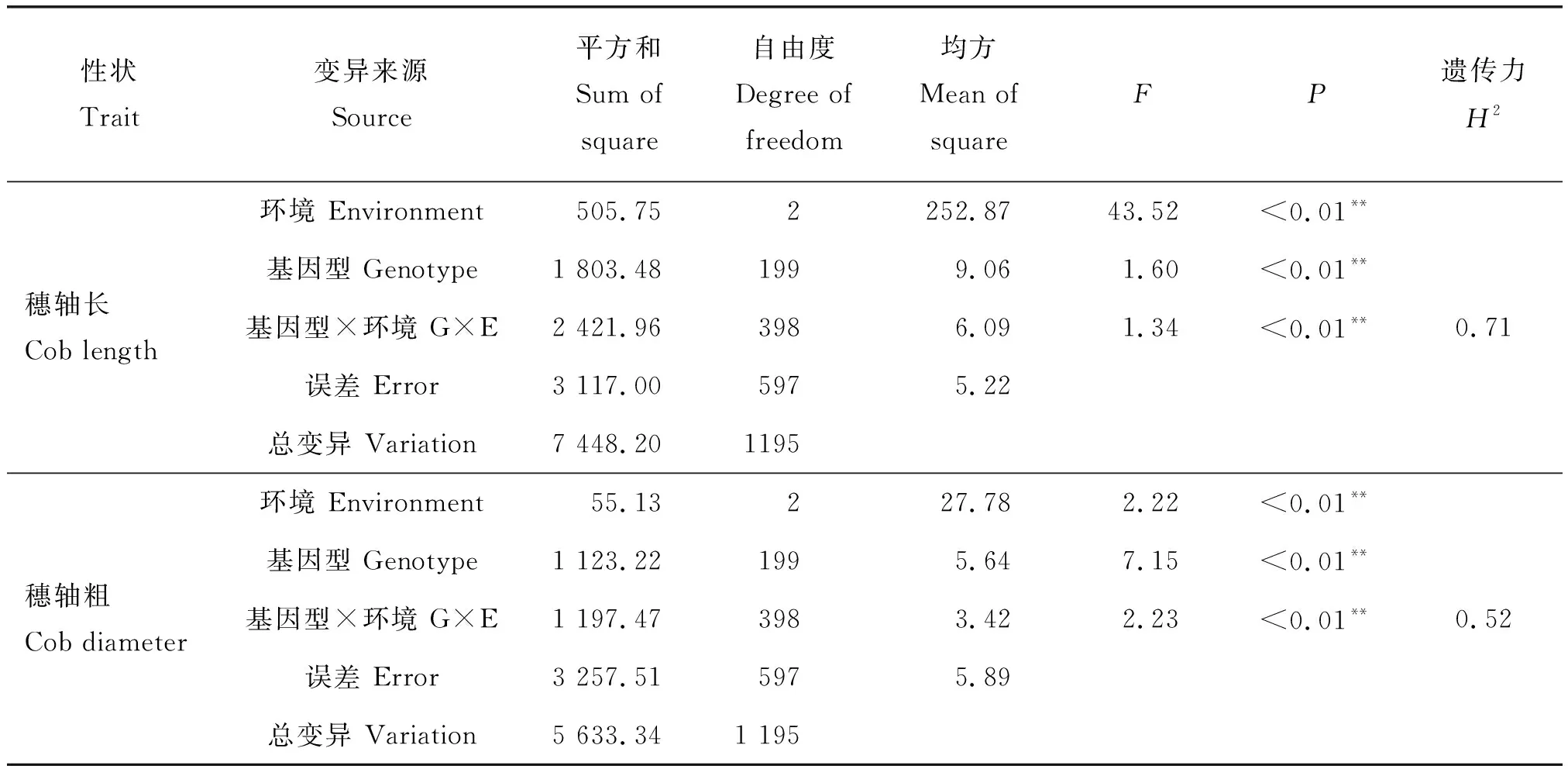
表2 F2∶3家系穗轴长与穗轴粗方差及广义遗传力分析Table 2 ANOVA and broad-sense heritability (H2) analysis for cob length and cob diameter in the F2∶3 families
2.3 构建遗传图谱
由表3可知,其中3号染色体标记数目最多为346个,6号染色体标记数最少为85个。构建的遗传图谱总长度为2 788.80 cM,平均2个标记间的遗传距离为1.50 cM,其中3号染色体图谱最长为432.86 cM,6号染色体图谱最短为168.57 cM。
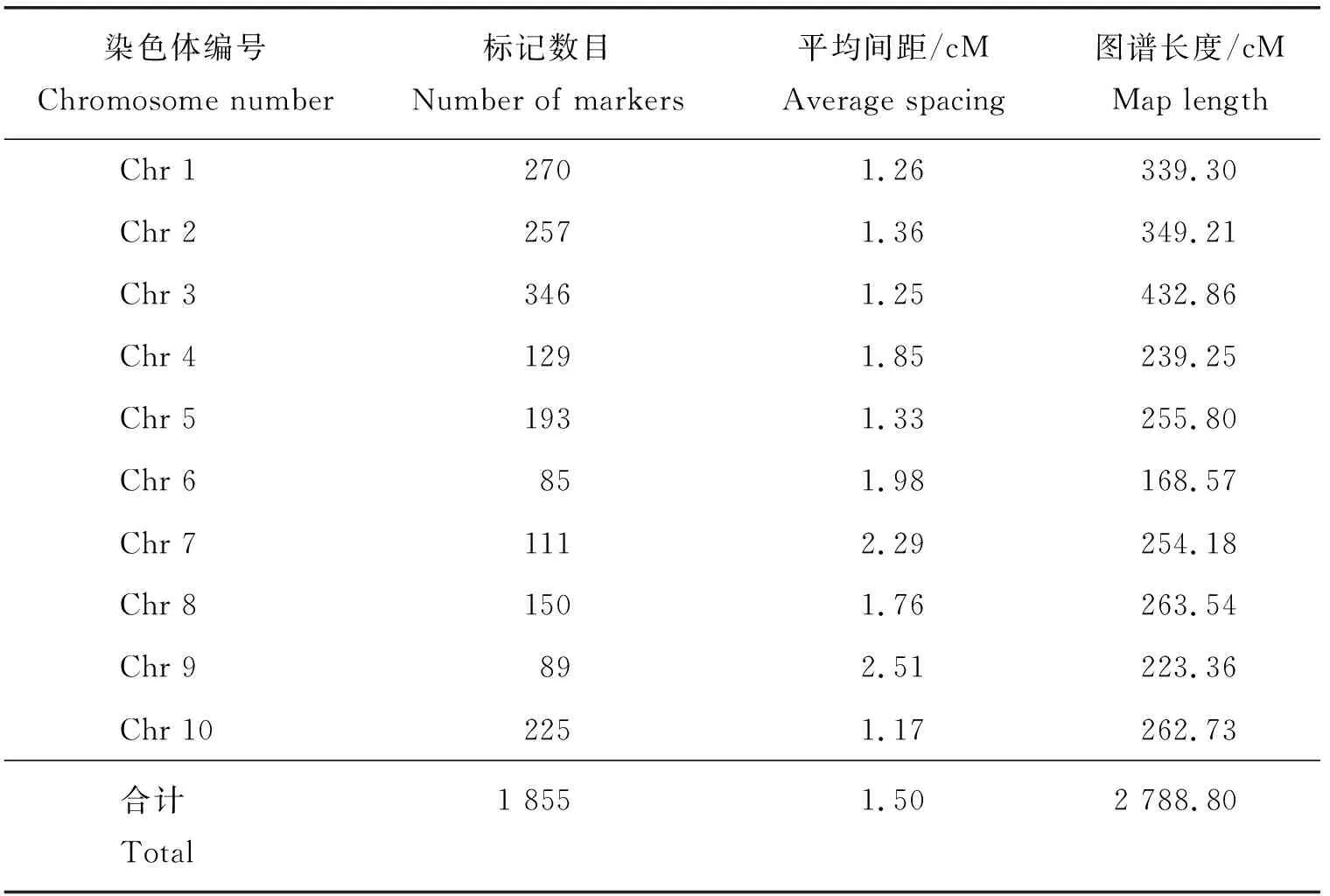
表3 F2群体遗传连锁标记与图谱长度Table 3 Marker and genetic distance information for the 10 maize linkage groups in F2 population
2.4 QTL定位结果分析
由表4可知,在第1、2、3、4、8和9号染色体上定位到8个控制穗轴长的QTL,其对穗轴长的表型贡献率为3.54%~12.64%。位于第3号染色体的第54.3—54.7 Mb处的QTLqCL3,LOD 8.31,表型贡献率为12.64%,加性效应为-0.37,是控制穗轴长的主效QTL。这个控制穗轴长的QTL来自于自交系‘B 73’。
在第2和4号染色体上定位到3个控制穗轴粗的QTL,其对穗轴粗的表型贡献率为7.92%~10.61%。位于第4号染色体的第165.6—168.6 Mb 处的QTLqCD4-1,LOD 5.14,表型贡献率为10.61%,加性效应为0.10,是控制穗轴粗的主效QTL。这个提高穗轴粗的QTL来自于自交系‘郑58’,见表4。
2.5 全基因组预测
采用五倍交叉验证法对玉米穗轴长与穗轴粗进行全基因组预测,穗轴粗与穗轴长的GS精度分别为0.39和0.56。其中穗轴粗的预测精度较低,变异范围较大,这可能是因为穗轴粗的遗传力低于0.7。
由图1可知,穗轴长GS精度随着标记数目增多而升高。当标记数目从10增加到500时,GS预测精度有显著的提升,当标记数目>500时,穗轴长的预测精度增加幅度很小。采用不同标记时穗轴粗的预测精度的变化趋势与穗轴长是一致的,即随着标记数目的增加而不断增加,当标记数目超过500后,穗轴粗的预测精度增加很小(图1(b))。
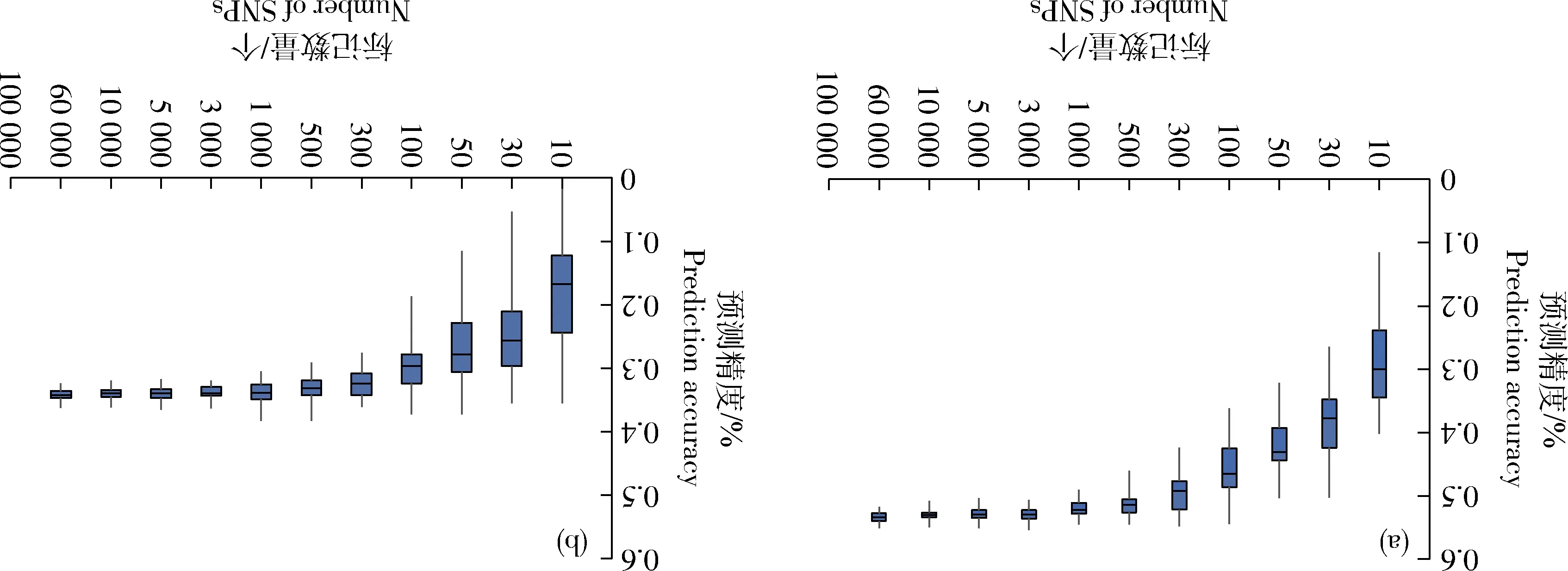

图1 F2群体不同SNP个数穗轴长(a)和穗轴粗(b)全基因组预测精度Fig.1 Genomic selection accuracy of cob length (a) and cob diameter (b) with different SNP numbers in the F2 population
由图2可知,穗轴长的GS精度随着训练群体的增大而增加,当训练群体从10%增加到60%时,穗轴长的预测精度显著提升,当训练群体>60%时,穗轴长的预测精度增加幅度很小。在样本数量不同的训练群体中穗轴粗的预测精度与穗轴长变化趋势是一致的,穗轴粗的预测精度随着训练群体的增大而不断的增加,当训练群体>60%后,穗轴粗的预测精度增加幅度很小(图2(b))。

图2 F2群体不同训练群体大小穗轴长(a)和穗轴粗(b)全基因组预测精度Fig.2 Genomic selection accuracy of cob length (a) and cob diameter (b) in the F2 population with different training population sizes
3 讨 论
提高产量一直以来都是作物育种工作的主要目标之一,产量性状的复杂性降低了玉米育种的效率,产量构成因子一般具有较高的遗传力,因此是遗传改良的目标性状[9]。本研究中考察了F2群体的2个穗部性状,分别是穗轴长与穗轴粗。其遗传力分别为0.71与0.52,说明这2个性状的基因型在表型变异中起重要作用。本研究利用1 855个SNP标记构建遗传连锁图谱,分子标记数目多,平均遗传距离为1.50 cM,有效地提高了QTL定位的准确性和精度。利用62 504个SNP标记进行全基因组预测,估计分子标记的遗传效应。结合QTL定位与全基因组预测结果,可以更好地解析穗轴长与穗轴粗的遗传基础,提高育种效率,有效改良目标性状。
本研究中穗轴长共检测到8个QTL,位于1、2、3、4、8和9号染色体上,LOD变异范围为2.68~8.31,能够解释51.04%的表型变异。王辉等[20]利用RIL群体对不同密度下的穗部性状进行定位,定位到的qEL1其物理位置在第191.0—214.6 Mb,与本试验定位到的qCL1-2(第199.8—205.1 Mb)所在染色体区间基本一致。Huo等[21]定位到的qCL8与本研究在8号染色体第176.8—176.9 Mb检测到的QTL一致。这些共定位到的QTL是稳定QTL,也说明了本研究定位结果的可靠。同时本试验中还定位到一个新的主效QTLqCL3,位于3号染色体,LOD为8.31,能够解释12.64%的表型变异,为玉米穗轴长的遗传研究提供了新的QTL位点,可以用于精细定位,克隆相关基因。
穗轴粗共检测到3个QTL,能够解释26.83%的表型变异。定位到1个控制穗轴粗的主效位点qCD4-1,表型贡献率为10.61%。马娟等[22]利用309份材料对穗轴粗进行全基因组关联分析,检测到位于2号染色体的主效SNP S2位于本研究所检测到的位于第197—198 Mb的qCD2。该SNP同时在控制穗粒重及籽粒大小这2个性状的定位中被检测到。赵强等[23]利用2个F2∶3家系对玉米产量相关性状进行定位,在1号染色体检测到穗轴粗相关的QTL与本研究检测到的位于第238—241 Mb的qCD4-2在同一染色体区段。吴律等[24]利用全基因组关联分析检测到穗轴粗相关的SNP为SCD9,其表型贡献率为8.4%,该SNP位于本试验所检测到的第238—241 Mb的qCD4-2。本试验定位到的2个穗轴粗相关的QTL为qCD2和qCD4-2,均在马娟等[22]、赵强[23]和吴律[24]的研究中报道过,说明这些QTL是控制穗轴粗的稳定位点。本研究所定位到的穗轴粗主效QTL为qCD4-1尚未见报道,为该性状提供了新的遗传位点。王宝宝[25]认为可靠的遗传组成可以为培育理想的玉米品种提供可靠的分子标记,因此,本试验得到的结果有利于揭示玉米穗部性状的遗传组成,为培育理想穗型的玉米品种提供可靠的分子标记。
全基因组预测技术是改良复杂数量性状有效工具之一,利用覆盖全基因组的高密度SNP标记,可对依赖于基因型、受环境影响大和微效基因控制的复杂数量性状进行有效预测。本研究结果与Guo等[26]的结果是一致,即在双亲后代群体,标记数目达到500个就可以获得良好的预测精度;训练群体包含群体总遗传变异的60%时可以获得良好的预测精度。
4 结 论
通过对玉米穗部性状进行QTL定位,共检测到了8个穗轴长相关QTL位点,分别解释表型变异的3.54%~12.64%;共检测到3个穗轴粗相关QTL位点,可解释表型变异的7.92%~10.61%。采用五倍交叉验证法对穗轴长与穗轴粗进行GS分析,穗轴长与穗轴粗的预测精度分别为0.56和0.39,预测精度中等。在探究不同SNP个数与预测群体对穗预测精度的影响时,发现GS预测精度随着标记数目的增多而升高,但分子标记达到500时,GS预测精度就基本达到峰值,继续增加分子标记对提高GS预测精度非常有限。GS预测精度也随着训练群体的增大而增加,训练群体>60%时,GS的预测精度增幅较小。

