沉默GRP94基因对乳腺癌MCF7细胞增殖和凋亡的影响
樊建军 武家燕 李 韵 曾 帆 宋方洲
(重庆医科大学分子医学与肿瘤研究中心,生物化学与分子生物学教研室,重庆400016)
沉默GRP94基因对乳腺癌MCF7细胞增殖和凋亡的影响
樊建军武家燕李韵曾帆宋方洲
(重庆医科大学分子医学与肿瘤研究中心,生物化学与分子生物学教研室,重庆400016)
[摘要]目的:研究沉默葡萄糖调节蛋白GRP94 (Glucose regulated protein,GRP94)对乳腺癌MCF7细胞增殖、凋亡的影响及潜在机制。方法:设计并化学合成靶向沉默GRP94基因的小干扰RNA,通过脂质体转染入MCF7细胞中,采用qRT-PCR和Western blot分别检测GRP94、cyclinD1、Bax和Bcl-2 mRNA和蛋白的表达水平;通过流式细胞术检测细胞凋亡比例变化,Hoechst 33258染色检测凋亡细胞核变化、CCK8实验检测细胞增殖能力的变化。结果:GRP94 siRNA组GRP94基因的表达水平被有效抑制;与对照组相比,GRP94-siRNA转染组的细胞凋亡比例明显增加;凋亡细胞核形态发生变化;增殖能力明显下降;mRNA及蛋白水平cyclinD1、Bcl-2表达明显下调,Bax表达增加。结论:沉默GRP94基因可明显抑制乳腺癌MCF7细胞增殖能力,促进细胞凋亡的发生,且其可能通过下调cyclinD1、Bcl-2和上调Bax表达参与其中。
[关键词]GRP94基因;MCF7细胞;增殖;凋亡
乳腺癌是严重危害女性身心健康的恶性肿瘤,占女性恶性肿瘤第二位,近几年在我国其发病率逐年上升,且呈年轻化趋势[1]。研究表明乳腺癌的发生发展是多因素作用的结果,其中许多重要基因参与其发生发展的过程,已报到cyclinD1、MMP9等基因的异常表达促进了乳腺癌的发生[2,3],因此针对乳腺癌发生相关的基因靶向进行研究,有助于进一步揭示乳腺癌的发病机制及预后。
分子伴侣GRP94作为内质网的丰度蛋白之一,参与了蛋白质的组装、折叠与降解,同时可与Ca2+离子结合参与细胞免疫应答反应[4]。研究表明,GRP94在食管癌、胰腺癌及子宫癌等多种肿瘤中呈高表达趋势,与肿瘤的发生发展密切相关[5]。有学者在乳腺癌细胞中发现GRP94呈高表达趋势[6],沉默GRP94可有效抑制肿瘤的侵袭迁移能力,提示肿瘤中高表达的GRP94对于肿瘤细胞远处迁移能力的获得具有重要作用[7]。为了进一步研究GRP94与乳腺癌生物学特性的关系,本研究采用小干扰RNA技术靶向沉默乳腺癌MCF7细胞中GRP94的表达,观察其对MCF7细胞增殖及凋亡的影响并探讨其可能机制,进而为研究GRP94在乳腺癌发生发展中的作用及机制奠定基础。
1材料与方法
1.1主要试剂PRMI1640培养基、胎牛血清购自Gibco公司;Total RNA 提取试剂盒购自Omega公司;脂质体转染试剂LipofectamineRNAIMAX购自美国Invitrogen公司;蛋白提取试剂盒、β-actin单克隆抗体和ECL发光试剂盒购自上海碧云天生物技术有限公司;各引物由上海生工生物公司合成;兔抗人GRP94、cyclinD1单克隆抗体购自英国Abcam;兔抗人Bax、Bcl-2单克隆抗体购自北京博奥森公司;HRP标记的羊抗兔IgG购自CST公司。
1.2方法
1.2.1siRNA的合成根据GRP94基因在Genebank中的序列(Genebank Accession No:NM-003299.2设计靶向GRP94基因的siRNA序列:(UACUGUACCAUCCACAUCA);siRNA-negative control序列,由上海吉玛制药技术有限公司合成,干粉siRNA用DEPC水稀释成20 μmol/L,-20℃保存。
1.2.2细胞培养及转染人乳腺癌MCF7细胞由重庆医科大学分子医学与肿瘤研究中心保存。由含10%胎牛血清的RPIM1640培养液,于37℃、5% CO2培养箱中培养,转染前24 h,以2×105个/孔细胞接种于6孔培养板中,当细胞达70%~80%汇合度时,参照LiopfectamineRNAIMAX产品说明书,分别将siRNA-NC和siRNA-GRP94转染至六孔培养板中,转染4~6 h后更换完全培养基。
1.2.3qRT-PCR法收集转染48 h两组细胞,按照Total RNA 提取试剂盒说明书提取细胞总RNA,再分别进行逆转录获得cDNA,采用SYBR Green法进行qRT-PCR,用于扩增各目的基因cDNA片段的引物见(表1),反应条件为:95℃、3 min;95 ℃、5 s;60 ℃、15 s;72 ℃、15 s,共39个循环。同一实验重复3次,实验数据分析采用2-△△Ct法计算。
1.2.4Western blot法分别收集转染72 h后各组细胞,加入细胞裂解液提取总蛋白,采用BCA法测定蛋白浓度。加入5×SDS上样缓冲液100℃,5 min,每孔40 μg,80 V恒压SDS-PAGE电泳,250 mA恒流2 h冰浴电转至PVDF膜,5%脱脂牛奶室温封闭2 h,加入一抗(GRP94 1∶1 000、cyclinD1 1∶1 000、Bax 1∶1 000、Bcl-2 1∶500、β-actin 1∶3 000)4 ℃过夜,次日TBST漂洗5 min×5次,加入HRP标记的二抗(羊抗兔1∶4 000)室温孵育1 h,TBST漂洗10 min×4次,ECL化学发光显影。
1.2.5CCK-8法将转染24 h后的各组细胞分别消化收集,细胞计数,以每孔3 000个/100 μl接种于96孔板中,以细胞贴壁后计为1 d,分别在1、2、3、4、5 d不同时间段加入10 μl CCK-8溶液,37℃孵育2 h后在波长450 nm处检测其光密度值。
1.2.6流式细胞术消化收集转染72 h后各组细胞,细胞凋亡比例变化的检测按照Annexin V-FITC/PI凋亡检测试剂盒说明书操作,消化收集各组转染72 h的各组细胞,1 000 r/min离心5min,弃去上清液,PBS洗涤并重悬,先后加入5 μl Annexin V-FITC与5 μl PI各在4 ℃孵育15 min后,上机检测。
1.2.7Hoechst 33258染色将对数增殖期MCF7细胞消化计数,以2×105个/孔提前24 h接种于放有玻片的12孔板中,置于37℃、5%CO2培养箱中培养过夜后,去除培养基,加入1 ml 4%多聚甲醛,室温固定30 min,后去除固定液,PBS漂洗3次,5 min/次,晾干后每孔加入100 μl Hoechst 33258液,室温染色10 min,PBS漂洗3次,10 min/次,去除多余水分,使用抗荧光猝灭封片液封片,荧光显微镜下拍照。
2结果
2.1qRT-PCR、Western blot分别在mRNA和蛋白水平验证GRP94siRNA沉默效果结果显示:siRNA-NC组中GRP94基因的相对表达量明显高于siRNA- GRP94,差异具有统计学意义(P<0.05)(图1A、B)说明GRP94基因被有效沉默。
2.2沉默GRP94对乳腺癌MCF7细胞增殖能力的影响通过CCK-8法检测细胞贴壁后1、2、3、4、5 d的光密度值,绘制生长曲线,结果显示与siRNA-NC相比,siRNA-GRP94组中细胞生长速率明显下降,说明沉默GRP94对MCF7细胞生长有抑制作用,差异具有统计学意义(图2)。
表1引物序列
Tab.1Sequences for primers

GenenamePrimersequenceGRP94Forward5'-GGGAGGTCACCTTCAAGTCG-3'Reverse5'-GGGTGTAGACGTGGAGCTC-3'CyclinD1Forward5'-AAGCTGTGCATCTACACCGA-3'Reverse5'-CTTGAGCTTGTTCACCAGGA-3'BaxForward5'-GGCGAATTGGAGATGAACTG-3'Reverse5'-TGCCATCAGCAAACATGTCA-3'Bcl-2Forward5'-ATCCAGGATAACGGAGGCTG-3'Reverse5'-CAGGTATGCACCCAGAGTGA-3'β-actinForward5'-AGCGAGCATCCCCCAAAGTT-3'Reverse5'-GGGCACGAAGGCTCATCATT-3'
2.3沉默GRP94对乳腺癌MCF7细胞细胞凋亡的影响结果显示:沉默GRP94基因表达后,与siRNA-NC组相比siRNA-GRP94组中细胞凋亡比例明显增加(图3A)(P<0.05);Hoechst 33258 染色后siRNA-GRP94组中细胞荧光显微镜下,细胞核发生明显变化,染色质凝集,边缘化的细胞量显著增加(图3B)。提示沉默GRP94促进MCF7细胞凋亡。
2.4沉默GRP94对乳腺癌MCF7细胞中cyclinD1、Bax和Bcl-2表达的影响qRT-PCR、Western blot结果显示,与siRNA-NC组相比,siRNA-GRP94组中cyclinD1、Bax表达明显减少,Bcl-2表达明显增加差异具有统计学意义(P<0.05),提示沉默GRP94表达可有效抑制cyclinD1、Bax表达,且上调Bcl-2表达(图4、5)。
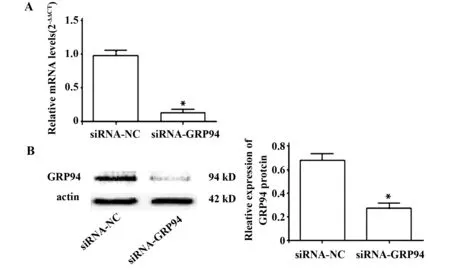
图1 qRT-PCR、Western blot分别检测GRP94 mRNA和蛋白表达水平Fig.1 Expression of GRP94 mRNA and protein level was detected by qRT-PCR and western blotNote: A.mRNA level;B.Protein level.*.P<0.05,compare with RNA-NC group.

图2 CCK-8测定沉默GRP94基因表达对乳腺癌MCF7细胞增殖的影响Fig.2 Effect of silencing GRP94 expression was evaluated by CCK-8 on the cell proliferation of MCF7 cellsNote: *.P<0.05,**.P<0.01 compare with siRNA-NC group.

图3 沉默GRP94基因表达对乳腺癌MCF7细胞凋亡的影响Fig.3 Effect of silencing GRP94 expression was detected by flow cytometry and hoechst 33258 staining on cell apoptosis of MCF7 cellsNote: A.Flow Cytometry assay;B.Hoechst 33258 Staining;*.P<0.05,compare with siRNA-NC group.

图4 沉默MCF7细胞中GRP94基因对cyclinD1表达的影响Fig.4 Effects of silencing GRP94 on expression of cyclinD1 in MCF7 cellsNote: A.mRNA level;B.Protein level.*.P<0.05,compare with siRNA-NC group.

图5 沉默GRP94基因表达对MCF7细胞中Bax和Bcl-2表达的影响Fig.5 Effects of silencing GRP94 on expression of Bax and Bcl-2 in MCF7 cellsNote: A.mRNA level;B.protein level;*.P<0.05,compare with siRNA-NC group.
3讨论
肿瘤的发生是一个多层次、多阶段演进的过程,其涉及到多种因子的表达调控,同时也与众多信号通路的异常活化密切相关[8]。在乳腺癌的发生发展过程中,由于肿瘤细胞处于缺氧、营养不良等微环境中,导致错误折叠或未折叠的蛋白增多,进而激活内质网未折叠蛋白反应(Unfolded protein response,UPR),GRP94表达被诱导,协助未折叠蛋白的折叠、装配及转运[9]。近几年研究发现GRP94可通过影响多条信号通路的活化参与肿瘤的生物学进程[10],且与肿瘤细胞的耐药性的获得密切相关[11]。Hua等[12]在一项多发性骨髓瘤的研究中发现,分子伴侣GRP94通过活化Wnt信号通路,促进肿瘤细胞的增殖,而通过选择性抑制剂WS13处理后,肿瘤细胞的增殖能力受到抑制,促进细胞凋亡的发生。Chen等[12]通过对小鼠肝脏特异性敲除模型的研究发现,GRP94可选择性激活ERK信号通路,参与肿瘤的发生。张黎川等[11]证实上调GRP94表达可提高肺癌SK-MES-1细胞对VP-16的耐药性。提示GRP94与肿瘤的发生发展密切相关,而针对分子伴侣GRP94的研究对探讨实体瘤的发病机制具有重要的实用价值。
本研究在乳腺癌MCF7细胞中采用RNAi技术外源性导入靶向GRP94的siRNA,结果显示mRNA与蛋白水平GRP94表达均显著降低,提示MCF7细胞中GRP94表达被显著抑制。同时研究发现,沉默GRP94表达后细胞增殖能力受到明显抑制,细胞凋亡比例明显增加,提示GRP94参与了乳腺癌细胞的增殖与凋亡的发生。细胞周期蛋白D1(cyclinD1)主要定位于细胞核,其表达具有严格的周期顺序性,研究发现cyclinD1作为Wnt信号通路的下游靶基因,参与了肿瘤细胞的增殖、凋亡等生理过程,且与乳腺癌的发生发展密切相关[14]。沉默GRP94表达后发现cyclinD1明显降低,提示沉默GRP94可能通过影响cyclinD1表达调控乳腺癌MCF7细胞的增殖能力。而进一步我们推测沉默GRP94可能通过阻断Wnt信号通路调节乳腺癌MCF7细胞的增殖能力。Bax与Bcl-2作为Bcl-2家族重要的抑制凋亡和促进凋亡蛋白,肿瘤中Bcl-2/Bax表达比例决定着细胞幸存还是凋亡[15]。沉默GRP94表达后,结果显示Bax表达降低,Bcl-2表达明显增加,细胞凋亡发生,提示沉默GRP94可通过影响Bcl-2/Bax表达比例,促进肿瘤细胞凋亡。而GRP94如何介导这一过程的发生,有待于我们进一步的研究。
综上所述,乳腺癌中高表达的GRP94参与了肿瘤细胞的增殖,抑制凋亡的发生,提示GRP94对乳腺癌的发生与恶化起着重要的作用,而其是否可作为乳腺癌的一个肿瘤标志物,及其转录调节的机制研究是我们今后的研究重点,而本研究以GRP94基因对乳腺癌MCF7细胞增殖与凋亡的影响作为切入点,为乳腺癌的基因治疗靶点的探索提供理论基础。
参考文献:
[1]Merabishvili VM.Breast cancer:morbidity,mortality,survival (population study)[J].Vopr Onkol,2011,57 (5):609-615.
[2]Umekita Y,Ohi Y,Sagara Y,etal.Overexpression of cyclinD1 predicts for poor prognosis in estrogen receptor-negative breast cancer patients.[J].Int J Cancer,2002,98 (3):415-418.
[3]Beeghly-Fadiel A,Lu W,Shu XO,etal.MMP9 polymorphisms and breast cancer risk:a report from the Shanghai Breast Cancer Genetics Study[J].Breast Cancer Res Treat,2011,126 (2):507-513.
[4]Dersh D,Jones SM,Eletto D,etal.OS-9 facilitates turnover of nonnative GRP94 marked by Hyperglycosylation[J].Mol Biol Cell,2014,25(15):2220-2234.
[5]Takahashi H,Wang JP,Zheng HC,etal.Overexpression of GRP78 and GRP94 is involved in colorectal carcinogenesis[J].Histol Histopathol,2011,26(6):663-671.
[6]Hodorova I,Rybarova S,Solar P,etal.Gp96 and its different expression in breast carcinomas[J].Neoplasma,2008,55 (1):31-35.
[7]樊建军,武家艳,李海玉,等.RNAI沉默GRP94基因对人食管癌ECA109细胞迁移及侵袭能力的影响[J].第三军医大学学报,2015,12(37):1222-1225.
[8]Liu X,Lazenby AJ,Siegal GP.Signal transduction cross-talk during colorectal tumorigenesis[J].Adv Anat Pathol,2006,13 (5):270-274.
[9]甄春英,于海丰,叶磊光,等.GRP94 生物学特点与肿瘤的关系的研究进展[J].现代生物医学进展,2012,12(22):4380-4383.
[10]Li X,Liu Z,Yan X,etal.Induction of regulatory T cells by high-dose gp96 suppresses murine liver immune hyperactivation[J].PLoS One,2013,8 (7):e68997.
[11]张黎川,王佳瑞,孟强,等.GRP94表达在肺癌细胞对VP-16化疗耐药中的作用[J].大连医科大学学报,2011,3(33):211-215.
[12]Hua Y,White-Gilbertson S,Kellner J,etal.Molecular chaperone gp96 is a novel therapeutic target of multiple myeloma[J].Clin Cancer Res,2013,19 (22):6242-6251.
[13]Chen WT,Ha D,Kanel G,etal.Targeted deletion of ER chaperone GRP94 in the liver results in injury,repopulation of GRP94-positive hepatocytes,and spontaneous hepatocellular carcinoma development in aged mice[J].Hepatology,2014,59 (3):947-957.
[14]Peng H,Zhong XY,Liu KP,etal.Expression and significance of adenomatous polyposis coli,beta-catenin,E-cadherin and cyclin D1 inesophageal squamous cell carcinoma assessed by tissue microarray[J].Ai Zheng,2009,28(1):38-41.
[15]陈惠瑜,施腾飞,成玲,等.SU11248对白血病细胞HL-60增殖及凋亡作用的实验研究[J].中国免疫学杂志,2012,28(6):512-551.
[收稿2015-09-10修回2015-06-01]
(编辑许四平)
Effect of GRP94 silencing on proliferation and apoptosis of human breast carcinoma MCF7 cells
FAN Jian-Jun,WU Jia-Yan,LI Yun,ZENG Fan,SONG Fang-Zhou.
Department of Biochemistry and Molecular Biology,Chongqing Medical University,Chongqing 400016,China
[Abstract]Objective:To determine the effects of silencing glucose regulated protein (GRP94) on the proliferation and apoptosis of breast carcinoma MCF7 cells.Methods: Chemically synthesized siRNA targeting GRP94 gene and transfected into MCF7 cells used by Liopfectamine RNAIMAX.The mRNA and protein expression levels of GRP94,cyclinD1,Bax and Bcl-2 were detected by Real-time PCR and Western blot.CCK8 assay was used to detect the effect of specific GRP94 siRNA on cell proliferation and the effect on cell cycle and apoptosis were analyzed by flow cytometry and Hoechst 33258 staining.Results: Compared with the siRNA-NC cells,the expression of GRP94 was significantly down-regulated in MCF7 cells.Knockdown of GRP94 in MCF7 cells decreased cell proliferation and promoted cell apoptosis.The expression of cyclinD1and Bcl-2levels were significantly reduced,and Bax level was increased in siRNA-GRP94 MCF7 cells.Conclusion: The siRNA-mediated GRP94 silence significantly inhibits MCF7 cell proliferation,promoted cell apoptosis by down-regulating cyclin D1,Bcl-2 expression and up-regulating the Bax expression in MCF7 cells.
[Key words]GRP94 gene;MCF7 cells;Proliferation;Apoptosis
doi:10.3969/j.issn.1000-484X.2016.06.013
作者简介:樊建军(1986年-),男,硕士,主要从事肿瘤生物学、肿瘤标志物的相关研究,E-mail:steve4802@163.com。 通讯作者:宋方洲 (1956年-),男,教授,博士生导师,华中科技大学兼职博导,主要从事细胞与分子生物学、功能基因组学与蛋白质组学、基因工程药物与基因治疗方面的研究,E-mail:fzsongcq@163.com。
中图分类号R392.12R737.9
文献标志码A
文章编号1000-484X(2016)06-0828-04