γ-干扰素释放试验在免疫受损合并肺结核患者中的应用
邹琳琳 黎友伦
(重庆医科大学附属第一医院呼吸内科,重庆400016)
γ-干扰素释放试验在免疫受损合并肺结核患者中的应用
邹琳琳黎友伦
(重庆医科大学附属第一医院呼吸内科,重庆400016)
[摘要]目的:探讨γ-干扰素释放试验(IGRA)在免疫受损合并肺结核患者中的应用价值。方法:选取免疫受损患者、肺结核患者、免疫受损合并肺结核患者以及健康志愿者180例,均行IGRA检测,测定其血浆中特异性γ-干扰素(IFN-γ)的含量并比较,同时对免疫受损合并肺结核者行结核菌素皮肤试验(TST)进行比较,P<0.05为差异有统计学意义。结果:共检测入选者180例,其中免疫受损患者组40例,肺结核组50例,免疫受损合并肺结核组40例,健康对照组50例。四组入选者血浆中IFN-γ含量的中位数分别为0.112、7.835、5.726、0.697 U/ml。四组比较,差异有统计学意义(χ2=74.046,P<0.001)。四组间两两比较,肺结核组与免疫受损合并肺结核组间差异无统计学意义,但该两组的IFN-γ含量明显高于其他两组,而健康对照组又高于免疫受损组,差异均有统计学意义。在免疫受损合并肺结核组中,IGRA的检出率为65%,显著高于TST检出率的27.5%,且差异有统计学意义(χ2=11.314,P=0.001)。结论:IGRA诊断方法在免疫受损合并肺结核患者的应用中受免疫状态的影响较小,且较TST有更高的检测灵敏度,可用于辅助临床诊断。
[关键词]免疫受损;肺结核;γ-干扰素释放试验
结核病是当今危害人类健康的重大传染性疾病,我国是全球22个结核病流行严重的国家之一,同时也是全球27个耐多药结核病高负担国家之一。据统计,目前我国≥15岁人口中活动性肺结核患者高达499万[1],而肺结核与癌症、糖尿病、艾滋病等免疫受损的疾病并存的病例临床上也并不少见[2-4]。所以,免疫受损的患者合并肺结核也逐渐受到人们的重视。
结核病临床表现复杂,而作为诊断结核病“金标准”的细菌学检查阳性率低、耗时长,临床上广泛应用的结核菌素皮肤试验(Tuberculin skin test,TST)又受接种卡介苗、非结核分枝杆菌感染、机体免疫力等因素的影响,易产生假阳性、假阴性结果[5],所以TST准确性备受质疑。近年来,细胞免疫介导的结核分枝杆菌特异性γ-干扰素释放试验(Interferon gamma release assay,IGRA)以其较高的灵敏性及特异性备受关注,在结核病早期诊断中的作用也已得到国际上结核病防控领域的普遍认可[6,7]。本文通过测定免疫受损患者、肺结核患者、免疫受损合并肺结核患者血浆中特异性γ-干扰素(IFN-γ)的含量,探讨IGRA在免疫受损合并肺结核患者中的应用价值。
1资料与方法
1.1研究对象2013年12月至2014年3月期间在重庆医科大学附属第一医院招募研究对象,所有受试者均获得知情同意。
1.1.1免疫受损患者组(A组)结核感染风险问卷调查提示为结核分枝杆菌低暴露风险,TST试验阴性的免疫受损患者40例,其中男性26例,女性14例,年龄43~76岁,平均58岁。入选的免疫受损患者包括,肺癌患者33例,糖尿病患者3例,肺癌合并糖尿病患者3例,类风湿性关节炎患者1例。
1.1.2肺结核组(B组)为初治肺结核患者,抗结核治疗时间小于4周,共50例,其中男性23例,女性27例,年龄18~85岁,平均40岁。包括痰抗酸杆菌涂片或培养阳性的菌阳患者及痰抗酸杆菌涂片或培养阴性,但具有典型肺结核的临床表现及影像学特点,抗结核治疗有效,并除外其他非结核性肺部病变的菌阴性患者。入选者HIV检测阴性,无急性病毒感染、妊娠等病史。
1.1.3免疫受损合并肺结核组(C组)为既往有明确肺癌、糖尿病病史的患者,痰抗酸杆菌涂片或培养阳性,或经纤维支气管镜、肺穿刺组织病理学证实为抗酸杆菌阳性,或其他非结核性新增肺部病变的菌阴患者且抗结核治疗有效者。共入选40例,其中男性31例,女性9例,年龄37~80岁,平均57岁。入选患者中包括肺癌患者3例,糖尿病患者37例。
1.1.4健康对照组(D组)选取50例既往无肺结核和肺结核接触史,且TST试验、HIV检测阴性,无急性病毒感染、妊娠等病史的健康志愿者作为正常对照组。
1.2方法
1.2.1IGRA检测采用海口维瑅瑷生物研究院研制生产的结核杆菌特异性细胞免疫反应检测试剂盒(酶联免疫法)(简称A.TB)进行IGRA检测。无菌采集每个入选者新鲜的肝素钠抗凝全血3 ml,分别吸取1 ml全血加入至N(阴性刺激剂)、P(阳性刺激剂)、T(ESAT-6和CFP-10)3个反应管中,16 h内完成。37℃水浴箱中孵育22~24 h,收集N、P、T管血浆,2~8℃保存,两周内完成检测,或≤-20℃长期保存。按照A.TB产品说明书提供的方法绘制标准曲线,计算出N、P、T管血浆中IFN-γ的水平,其中N值表示待检样本在未经任何抗原刺激时表现出的IFN-γ水平,T值表示样本中的淋巴细胞针对结核杆菌特异性抗原ESAT-6和CFP-10刺激后特异性释放的IFN-γ水平,P值代表此淋巴细胞受到丝裂原(本产品中为伴刀豆球蛋白A,Con A)刺激后非特异性释放的IFN-γ水平,反映受试者基础的细胞免疫状态和样本中淋巴细胞的活力。T-N即代表受试者血浆中的特异性IFN-γ含量。按照产品说明书规定,当N<0.5 U/ml时,(T-N)/(P-N)≥0.60时结果判为阳性,否则为阴性;当N≥0.5 U/ml时,(T-N)/(P-N)≥0.85时结果判为阳性,否则为阴性。
1.2.2TST检测在采集IGRA检测用血的同时,对免疫受损合并肺结核组进行TST试验,对受试者进行皮内注射PPD(5 U),注射部位为前臂屈测上1/3处,72 h后观察注射部位的反应情况。按照《全国结核病防治工作手册》规定对结果进行判断,硬结直径≥5 mm或有水泡、破溃者为TST试验阳性,否则为阴性。
1.3统计学分析采用SPSS19软件进行统计学分析。对A、B、C、D四组采用Shapiro-Wilk法进行正态性检验,四组中IFN-γ含量的比较采用Wilcoxon秩和检验,而对于C组中IGRA与TST试验检出率的比较采用卡方检验,P<0.05为差异有统计学意义。
2结果
2.1IFN-γ含量A组血浆中结核分枝杆菌特异性IFN-γ含量分布范围为-0.022~11.768 U/ml,B组血浆中结核分枝杆菌特异性IFN-γ含量分布范围为0.166~16.110 U/ml,C组血浆中结核分枝杆菌特异性IFN-γ含量分布范围为0.163~15.722 U/ml,D组血浆中结核分枝杆菌IFN-γ含量分布范围为-0.009~16.854 U/ml。经检验C组满足正态性分布(P=0.070),而A、B、D三组不满足正态性分布(P<0.05),故采用中位数(P50)作为受试者血浆中IFN-γ的含量。A组P50为0.112 U/ml,分布范围为0.008~1.084 U/ml(P25~P75),B组P50为7.835 U/ml,分布范围为2.248~12.305 U/ml(P25~P75),C组P50为5.726 U/ml,分布范围为2.095~9.345 U/ml(P25~P75),D组P50为 0.697 U/ml,分布范围为0.122~4.163 U/ml(P25~P75)。
表1A、B、C、D四组间两两比较
Tab.1A,B,C,D pairwise comparisons among four groups

Group(I)Group(J)Meandifference(I-J)SEPvalue95%CILowerlimitUpperlimitGroupAGroupB-81.8001)8.5360.000-98.645-64.955GroupA-74.2751)8.9970.000-92.032-56.518GroupD-25.8201)8.5360.003-42.665-8.975GroupBGroupA81.8001)8.5360.00064.95598.645GroupC7.5251)8.5360.379-9.32024.370GroupD55.9801)8.0470.00040.09871.862GroupCGroupA74.2751)8.9970.00056.51892.032GroupB-7.5251)8.5360.379-24.3709.320GroupD48.4551)8.5360.00031.61065.300GroupDGroupA25.8201)8.5360.0038.97542.665GroupB-55.9801)8.0470.000-71.862-40.098GroupC-48.4551)8.5360.000-65.300-31.610
Note:1)Significant level of mean difference was 0.05.
表2IGRA与TST试验在C组中的诊断性能比较
Tab.2Comparison of diagnostic performance of IGRA and TST in group C
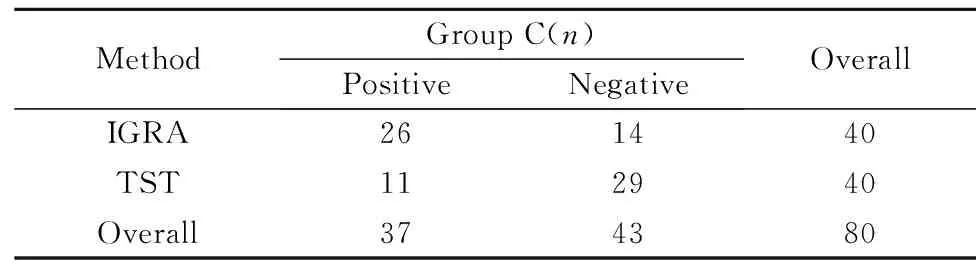
MethodGroupC(n)PositiveNegativeOverallIGRA261440TST112940Overall374380
四组比较,差异有统计学意义(χ2=74.046,P<0.001)。四组间进行两两比较,由表1可知,B组与C组间差异无统计学意义(P=0.379),但该两组分泌的IFN-γ明显高于A、D两组,而D组分泌的IFN-γ又高于A组,差异均有统计学意义(P<0.05)。
2.2IGRA与TST在免疫受损合并肺结核组中的诊断性能比较C组患者中IGRA与TST的诊断性能,由表2可知, IGRA的检出率为65%(26/40),显著高于TST检出率的27.5%(11/40),且差异有统计学意义(χ2=11.314,P=0.001)。
3讨论
IGRA是在体外检测T细胞经存在于结核分枝杆菌,但在卡介苗和大多数非结核分枝杆菌中普遍缺失的RD1区编码的结核特异性抗原ESAT-6和CFP-10刺激后产生和释放的IFN-γ,藉此判断机体是否存在针对结核杆菌特异性的细胞免疫反应[8]。目前有两种较为成熟的IFN-γ释放分析技术,即英国生产的T-SPOT.TB试验和澳大利亚生产QFT-G试验,而本文所采用的A.TB试剂盒是以GFT-G试验为基础的国内首款结核杆菌特异性细胞免疫反应检测试剂盒,已有研究结果表明A.TB具有较高的敏感性和特异性,其诊断性能与T-SPOT.TB及QFT-G相当[9,10],已广泛应用于临床。
近年来,癌症、糖尿病、艾滋病等免疫功能受损的疾病发病率较高,结核发病率亦呈上升趋势,免疫受损合并肺结核者也越发多见。患者机体免疫力下降,增加了结核感染的机率,或使得已静止的结核病活动或恶化。当免疫受损患者并发肺结核时,由于药物或其他因素的影响,其临床症状可隐匿或轻微,缺乏呼吸道症状,也可由于免疫预防机制的受损,出现疾病暴发性进展。在疾病诊断方面,因患者免疫预防机制受损,并发的肺部感染病因多样且复杂,当其合并结核感染时,其临床表现与影像学特点可与一般肺结核显著不同,加之基础疾病的肺浸润,药物的肺部反应等干扰,使得诊断十分困难,容易误诊、漏诊。因此,尽早甄选出免疫损害人群中的结核感染者,并对其进行有效的治疗或监测,在提高患者存活率,改善其生活质量以及结核病防控方面都有着重要的意义。本研究通过测定免疫受损患者、肺结核患者、免疫受损合并肺结核患者血浆中IFN-γ的含量,同时与健康对照组血浆中IFN-γ含量比较,结果表明,免疫受损患者血浆中特异性IFN-γ含量明显低于健康对照组,且差异有统计学意义,这可能是因为在免疫受损患者中,反应机体免疫功能及应激程度的淋巴细胞计数会有所减少[11],而IGRA结果又受外周血淋巴细胞计数的影响[12],因此免疫受损患者IFN-γ含量低于健康者。但是与肺结核患者相比,免疫受损患者合并肺结核时所释放的IFN-γ并无明显差异,由此说明,当机体合并结核感染时,结核特异性抗原ESAT-6和CFP-10刺激机体产生和释放的IFN-γ量可能主要是受结核特异性抗原这一“质”,而非免疫反应强度这一“量”决定。对免疫受损合并肺结核患者同时行TST检测,与IGRA结果相比,TST的检出率明显低于IGRA,这也进一步说明TST受机体免疫功能影响较大。IGRA诊断方法在免疫受损合并肺结核患者的应用中受免疫状态的影响较小,且较TST有更高的检测灵敏度,在一定程度上避免了TST因机体免疫功能受损而产生的假阴性结果,可用于合并免疫受损的肺结核患者的辅助诊断与鉴别诊断,这与文献报道亦相符[13-15]。但本研究中试验样本量较少,对比比较单一,还需要大量本、前瞻性队列研究,以期获得更加准确、客观的结果。
参考文献:
[1]全国第五次结核病流行病学抽样调查技术指导组.2010年全国第五次结核病流行病学抽样调查报告[J].中国防痨杂志,2012,34(8):485-508.
[2]Tsunezuka Y,Ishikawa N,Hiranuma C,etal.Mycobacteria other than tuberculosis combined primary lung cancer[J].Kyobu Geka,2004,57(2):119-122.
[3]Banerjee S,Banerjee M.Diabetes and tuberculosis interface[J].J Indian Med Assoc,2005,103(6):318-322.
[4]Alamo ST,Kunutsor S,Walley J,etal.Performance of the new WHO diagnostic algorithm for smear-negative pulmonary tuberculosis in HIV prevalent settings:a multisite study in Uganda[J].Tropical Med Int Health,2012,17(7):884-895.
[5]Diel R,Goletti D,Ferrara G,etal.Interferon-γ release assays for the diagnosis of latent Mycobacterium tuberculosis infection:a systematic review and meta-analysis[J].Eur Respir J,2011,37(1):88-99.
[6]Pai M,Kalantri S,Dheda K.New tools and emerging technologies for the diagnosis of tuberculosis:Part Ⅰ.Latent tuberculosis[J].Expert Rev Mol Diagn,2006,6(3):413-422.
[7]Pai M,Kalantri S,Dheda K.New tools and emerging technologies for the diagnosis of tuberculosis:Part Ⅱ.Active tuberculosis and drug resistance[J].Expert Rev Mol Diagn,2006,6(3):423-432.
[8]Andersen P,Munk ME,Pollock JM,etal.Specific immune-based diagnosis of tuberculosis[J].Lancet,2000,356(9235):1099-1104.
[9]高孟秋,刘菲,纪滨英,等.两种γ干扰素释放分析技术在结核病临床诊断中的比较[J].中华结核和呼吸杂志,2012,35(10):762-765.
[10]Wei Z,Yang M,Quan B,etal.Prevalence tuberculosis infection among healthcare workers in China as detected by two interferon-gamma release assays[J].J Hosp Infect,2013,84(4):323-325.
[11]周文,张鹏,宋世辉,等.300例肺癌患者淋巴细胞计数结果分析[J].中国肺癌杂志,2009,12(10):1127-1129.
[12]杨新婷,杨扬,杜凤娇,等.肺结核患者全血γ干扰素释放试验影响因素的探讨[J].中国防痨杂志,2013,35(12):1007-1012.
[13]Riceldi L,Losi M,D′Amico Retal.Performance of testes for latent tuberculosis in different group of immunocompromised patients[J].Chest,2009,136(1):198-204.
[14]Walsh MC,Camerlin AJ,Miles R,etal.The sensitivity of interferon-γ release assays is not compromised in tuberculosis patients with diabetes[J].Int J Tuberc Lung Dis,2011,15(2):179-184.
[15]Kim EY,Lim JE,Jung JY,etal.Performance of the tuberculin skin test and interferon-γ release assay for detection of tuberculosis infection in immunocompromised patients in a BCG-vaccinated population[J].BMC Infect Dis,2009,9:207.
[收稿2015-08-15修回2015-08-31]
(编辑许四平)
Application of interferon-γ release assay in immunocompromised patients with pulmonary tuberculosis
ZOU Lin-Lin,LI You-Lun.
Department of Respiratory Medicine,the First Affiliated Hospital of Chongqing Medical University,Chongqing 400016,China
[Abstract]Objective:To investigate the application value of interferon-γ release assay(IGRA) in immunocompromised patients with pulmonary tuberculosis.Methods: 180 cases were chose including immunocompromised patients,pulmonary tuberculosis patients,immunocompromised patients with pulmonary tuberculosis and healthy volunteers to undergo IGRA in order to determine and compare the content of specific interferon-γ(IFN-γ)in plasma.At the same time,the result of immunocompromised patients with pulmonary tuberculosis was compared with tuberculin skin test (TST).Results: 180 cases of the list were tested,included 40 immunocompromised patients(group A),50 pulmonary tuberculosis patients(group B),40 immunocompromised patients with pulmonary tuberculosis patients(group C),and 50 cases in healthy control group(group D).The median of specific IFN-γ contents in the four groups were respectively 0.112,7.835,5.726,0.697 U/ml.The comparison of differences among the four groups was statistically significant (χ2=74.046,P<0.001).Pairwise comparisons among the four groups,and the differences between group B and group C were no significant,but specific IFN-γ content of the two groups was significantly higher than the other two groups,while the group D was higher than group A,the differences were statistically significant.The positive rate of IGRA was significantly higher than that of TST in group C(χ2=11.314,P=0.001).Conclusion: IGRA diagnosis in the application of immunocompromised patients with pulmonary tuberculosis was less affected by immune status and was more sensitive than TST,which can be used as auxiliary diagnosis.
[Key words]Immunocompromised;Pulmonary tuberculosis;Interferon-γ release assay
doi:10.3969/j.issn.1000-484X.2016.06.024
作者简介:邹琳琳(1989年-),女,在读硕士,主要从事结核病的临床研究。 通讯作者及指导教师:黎友伦(1965年-),男,博士,教授,主要从事结核病发病机制和耐药研究,E-mail:liyoulun83@163.com。
中图分类号R44
文献标志码A
文章编号1000-484X(2016)06-0878-04