IL-21调节外周血中Treg细胞的表达在 Graves病发病机制中的研究①
黄小庆 刘 纯
(重庆医科大学附属第一医院内分泌科,重庆400016)
IL-21调节外周血中Treg细胞的表达在 Graves病发病机制中的研究①
黄小庆刘纯
(重庆医科大学附属第一医院内分泌科,重庆400016)
[摘要]目的:探究IL-21调节外周血Treg细胞的表达在Graves病发病机制中的研究。方法:收集28 例初发Graves病患者(GD)、27例经药物治疗后甲状腺功能恢复正常的GD(eGD)患者和24例健康对照者(NC),电化学发光法检测患者的血清 FT3、FT4、 uTSH、TgAb、TPOAb 和 TRAb 水平。分离研究对象外周血单个核细胞分为IL-21刺激组与未刺激组。实时荧光定量PCR法检测Foxp3和IL-10 mRNA的表达水平;ELISA 法检测培养上清液中IL-10蛋白的表达。结果:GD组甲功和自身抗体水平与eGD 组和NC组比较,差异均有统计学意义(P<0.05);但eGD组甲功和自身抗体水平与NC组比较差异无统计学意义(P>0.05)。IL-21刺激前,GD组的Foxp3、IL-10 mRNA和IL-10蛋白表达水平均较eGD组和NC组明显升高,差异有统计学意义(P<0.05) ,但eGD组与NC组比较差异无统计学意义(P>0.05)。经 IL-21 刺激后,GD组的Foxp3、IL-10 mRNA和IL-10蛋白的表达水平均显著低于刺激前,差异有统计学意义(P<0.05)。结论:IL-21可能通过抑制Treg细胞的分化及其效应分子IL-10的产生,使Treg细胞数量和功能下降,降低其对效应T细胞的抑制能力,从而参与GD的发病过程。
[关键词]IL-21;Graves病;Treg细胞;Foxp3;IL-10
Graves病(Graves disease,GD)是一种以甲状腺素合成增多的器官特异性自身免疫性疾病,是内分泌科常见的疾病之一。传统理论认为,Th1细胞、Th2细胞是主要参与免疫反应的CD4+T细胞;Th1细胞通过分泌细胞因子IL-2、IFN-γ,Th2细胞通过分泌细胞因子IL-4、IL-13和IL-5参与免疫反应[1,2]。Th17细胞是CD4+T细胞的一个新分支,它参与许多自身免疫性疾病的发病过程[3]。免疫系统的主要功能是识别并清除外来抗原,产生免疫记忆,并产生免疫耐受;免疫平衡的维持依赖于许多因素,其中包括Th17细胞的激活和Treg细胞的抑制,当免疫平衡被打破时,免疫系统趋向于激活,此时机体更容易发生自身免疫性疾病[4]。Th17/Treg的失衡参与了许多自身免疫性疾病的发病过程,如1型糖尿病(DM1)、多发性硬化(MS)、系统性红斑狼疮(SLE)和银屑病等[5-8]。Treg细胞是CD4+T细胞的一个新亚群,具有免疫应答低下和免疫抑制特性,在维持机体免疫耐受和免疫应答稳态方面具有非常重要的作用。Treg细胞主要通过产生细胞因子IL-10、TGF-β而发挥生物学效应。许多自身免疫性疾病都与外周血Treg细胞缺陷有关[9]。叉头蛋白P3(Forkhead box protein P3,Foxp3)是近几年来发现的控制Treg细胞发育和功能的关键转录因子,其主要表达在Treg细胞的细胞核上[10]。Foxp3作为一个转录调控因子,通过直接调控多种基因来调节Treg的活性,目前关于Foxp3通过何种方式调控这些基因表达的机制尚未阐明。
IL-21由一系列CD4+T细胞亚型及NKT细胞产生[11]。IL-21受体存在于CD4+T、CD8+T、NK细胞、巨噬细胞、DC细胞及角质细胞上;IL-21通过与IL-2、IL-4、IL-7、IL-9、IL-13同源受体及IL-21特异性受体结合而发挥作用[12]。Th17细胞和Treg细胞的分化均需要TGF-β的参与[13], 只有TGF-β存在的情况下,CD4+T细胞分化为Th17细胞,在TGF-β和IL-21共同存在的情况下,CD4+T细胞分化为Treg细胞[14]。我们前期研究发现,IL-21可能通过调节Th17细胞分化而上调IL-17的表达水平,参与了GD的发病过程[15]。有研究表明IL-21不但不能诱导Treg的增殖[16],同时还会抑制Treg的抑制功能。本文通过检测IL-21刺激前后外周血单个核细胞(PBMC)中Treg细胞特异性转录因子Foxp3及其分泌的细胞因子IL-10的水平,深入了解Treg细胞在GD中的作用和意义,进一步探讨Graves病的发病机理。
1材料与方法
1.1材料
1.1.1研究对象收集2014年10月~2015年6月在重庆医科大学附属第一医院内分泌科门诊就诊的Graves病患者,根据诊断标准分为GD 组和甲状腺功能恢复正常的GD (eGD) 组。GD组:根据中华医学会内分泌病分会2008年颁布的《中国甲状腺疾病诊治指南》[17]首次确诊为GD 且未服用任何抗甲状腺药物的患者,有甲状腺功能亢进的症状和体征;血浆游离 T3(FT3)或 T4(FT4)升高及敏感 TSH(sTSH)降低;均有不同程度弥漫性甲状腺肿大;血浆 TRAb 抗体不同程度阳性;共28例,其中女性21例,男性7例。eGD组:明确诊断为GD的患者,经抗甲状腺药物治疗时间≥1年且甲状腺功能恢复正常,现甲巯咪唑(赛治)治疗剂量5~10 mg/d的GD患者27例,其中女性21例,男性6例。正常对照组(NC):无甲状腺疾病史及家族史,甲状腺功能正常,甲状腺自身抗体阴性,排除妊娠、其他自身免疫性疾病、过敏性疾病、炎症性疾病等,年龄及性别匹配的24名健康志愿者设为正常对照组,其中女性16例,男性8例。所有入选对象均需排除患有1型糖尿病、系统性红斑狼疮、类风湿性关节炎、自身免疫性肝炎等常见的自身免疫性疾病、妊娠、急性感染及慢性炎症性疾病等。
1.1.2实验材料IL-21、anti-CD3和anti-CD28抗体(德国 MiltenyiBiotec 公司);RPMI1640 、胎牛血清(美国 Gibco 公司)淋巴细胞分离液(天津TBD生物技术发展中心);RNAiso Plus、PrimeScriptTMRT reagent Kit(Perfect Real Time)和SYBR®Premix Ex TaqTMⅡ(Tli RNaseH Plus)( 宝生物工程有限公司,中国);人IL-10 ELISA试剂盒(美国R&D公司);游离三碘甲状腺原氨酸(Free triiodothyronine,FT3)、游离甲状腺素(Free thyroxine,FT4)、超敏促甲状腺激素(Ultra-sensitive thyrotropin,uTSH )、甲状腺球蛋白抗体(Thyroglobulin antibody,TgAb )、甲状腺过氧化物酶抗体(Thyroidperoxidase antibody,TPOAb)、促甲状腺素受体抗体(Thyrotropin receptor antibody,TRAb)试剂盒及检测仪器(美国贝克曼库尔特),采用电化学发光法测定。
1.2方法
1.2.1样本的采集和外周血单个核细胞(Peripheral blood mononuclear cells,PBMCs) 的分离及培养采集研究对象空腹静脉10 ml于EDTA抗凝真空采血管内,Ficoll密度梯度离心法分离PBMC,调整PBMC细胞密度为2×106个/ml,悬浮于含10%胎牛血清的RPMI1640培养液中,分为IL-21刺激组和IL-21非刺激组,接种于24孔平底培养板中,两组均加入1 μg/ml anti-CD3和1 μg/ml anti-CD28抗体,IL-21刺激组加入10 ng/ml IL-21,放于37℃、5%CO2的孵箱内孵育72 h,收集未贴壁细胞用于抽提RNA,收集培养上清液于-80℃下保存。活细胞数≥95%。
1.2.2荧光定量RT-PCR法测定Foxp3和IL-10 mRNA的表达细胞总RNA的提取按照RNAiso Plus的说明书进行。逆转录成cDNA按照PrimeScriptTMRT reagent Kit的说明书进行。聚合酶链反应,引物的设计采用 PrimerPremier 5.0。β-actin 、Foxp3和IL-10 mRNA的引物序列参见表1。使用荧光定量PCR 仪(CFX 96 Real-Time System,Bio-RAD,美国),反应条件为95℃,30 s;95℃,5 s;60℃,30 s;重复 39个循环。反应体系(10 μl):cDNA 1 μl,上游引物1 μl,下游引物1 μl,SYBE GREEN 5 μl,DEPC水2 μl。以未用IL-21干预的NC组为对照,计算各组2-△△Ct,获得各组目的基因的相对表达量。
1.2.3ELISA法测定IL-10蛋白的表达取上述冻存细胞培养上清,ELISA法测定IL-10蛋白的表达,具体操作严格按试剂盒说明书进行。
1.2.4甲状腺功能及抗体的检测电化学发光法检测FT3、FT4、uTSH、TgAb、TPOAb、TRAb的水平。
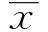
2结果
2.1甲功及相关抗体水平GD组甲功与eGD 组和NC组比较,差异均有统计学意义(P<0.05);但eGD组甲功与NC组比较差异无统计学意义(P>0.05)。GD组自身抗体水平较 eGD组和NC组增高,差异均有统计学意义(P<0.05);但eGD组自身抗体水平与NC组比较差异无统计学意义(P>0.05)。见表2。
表1β-actin、Foxp3和IL-10 mRNA 的引物序列
Tab.1Primer sequences for β-actin,Foxp3 and IL-10 mRNA

PrimerSequencesbpβ-actinForward5'CCACGAAACTACCTTCAACTCC3'132Reverse5'GTGATCTCCTTCTGCATCCTGT3'Foxp3Forward5'AGAAGGGCAGGGCACAATG3'151Reverse5'TCGGATGATGCCACAGATGAA3'IL-10Forward5'CAAGACCCAGACATCAAGGCG3'134Reverse5'GCATTCTTCACCTGCTCCACG3'



GDgroupeGDgroupNCgroupn(F/M)21/721/616/8FT3(pg/ml)11.62±9.062)3)2.90±0.351)2.96±0.37FT4(ng/dl)3.36±1.722)3)0.88±0.111)0.89±0.09uTSH(μU/ml)0.06±0.072)3)1.65±0.911)1.53±0.72TGAb(ng/ml)87.00±182.982)3)11.65±26.701)0.39±1.09TPOAb(U/ml)342.9±423.032)3)145.27±242.771)1.71±3.71TRAb(U/L)14.94±14.692)3)3.89±3.981)0.71±1.23
Note:1)P>0.05 vs.NC group;2)P<0.05 vs.NC group;3)P<0.05 vs.eGD group.
2.2Foxp3 mRNA表达水平未用IL-21处理时,GD组Foxp3 mRNA的表达量较eGD组和NC组增高,差异均有统计学意义(P<0.05);但eGD组与NC组比较差异无统计学意义(P>0.05)。经IL-21处理后,GD组、eGD组和NC组的Foxp3 mRNA的表达水平均有所降低,且较各组自身处理前有统计学意义(P<0.05)。见表3、图1。
2.3IL-10 mRNA 表达水平未用IL-21处理时,GD组IL-10 mRNA的表达量较eGD组和NC组增高,差异均有统计学意义(P<0.05);但 eGD 组与NC组比较差异无统计学意义(P>0.05)。经IL-21处理后,GD组、eGD组和NC组的Foxp3 mRNA的表达水平均有所降低,且较各组自身处理前有统计学意义(P<0.05)。见表4、图2。



Groupsn2-△△CtGD281.62±0.702)3)GD+IL-21280.47±0.311)eGD271.11±0.592)eGD+IL-21270.73±0.321)NC240.94±0.44NC+IL-21240.51±0.181)
Note:Compared with the corresponding groups without IL-21,1)P<0.05;compared with NC group,2)P>0.05;compared with eGD group,3)P<0.05.
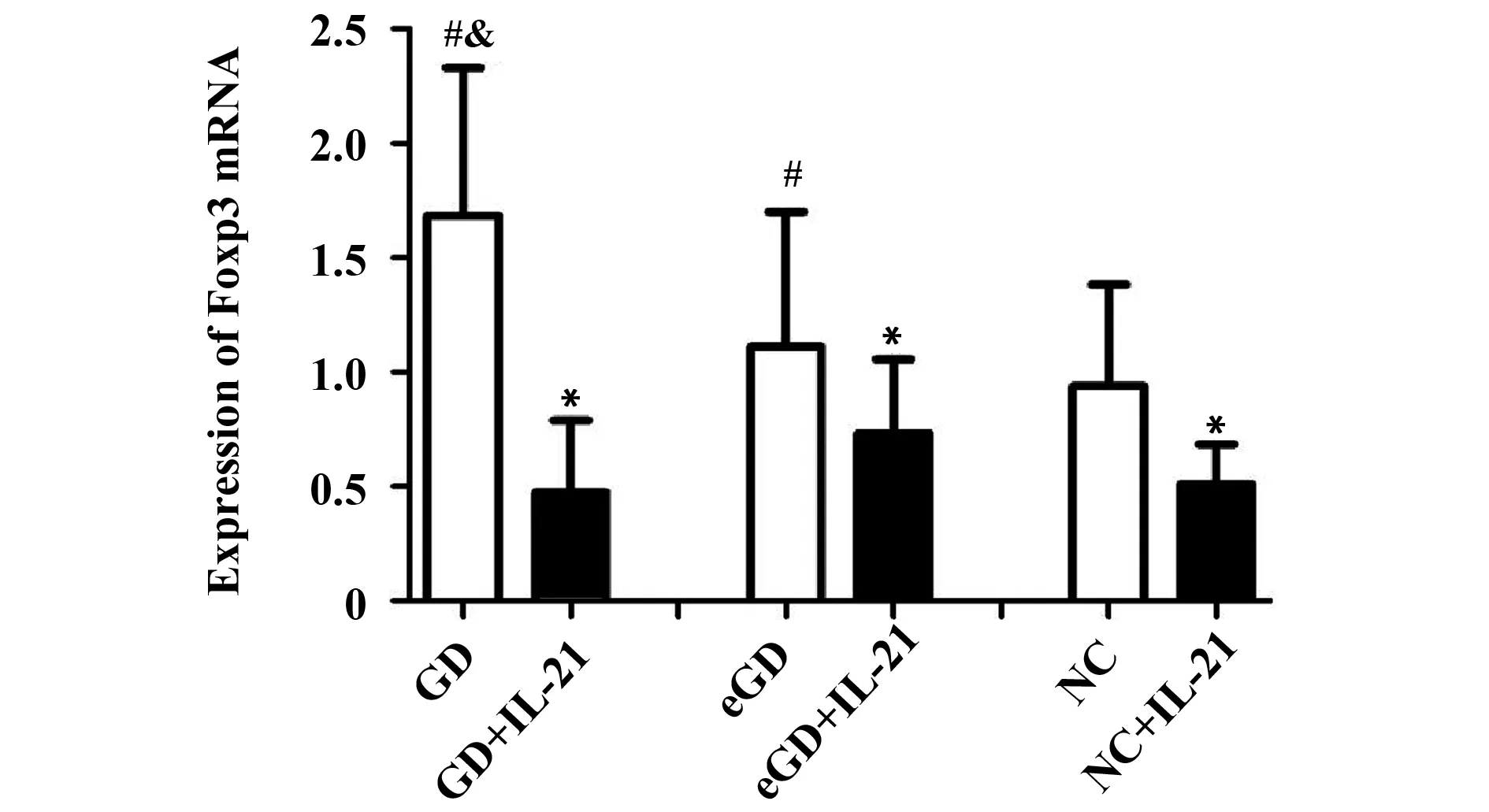
图1 IL-21处理前后Foxp3 mRNA 表达水平比较Fig.1 Expression of Foxp3 mRNA before and after intervention of IL-21Note: Compared with the corresponding groups without IL-21,*.P<0.05;compared with NC group,#.P>0.05;compared with eGD group,&.P<0.05.



Groupsn2-△△CtGD281.77±0.602)3)GD+IL-21280.73±0.411)eGD271.25±0.652)eGD+IL-21270.69±0.261)NC241.09±0.64NC+IL-21240.65±0.441)
Note:Compared with the corresponding groups without IL-21,1)P<0.05;compared with NC group,2)P>0.05;compared with eGD group,3)P<0.05.

图2 IL-21处理前后IL-10 mRNA表达水平比较Fig.2 Expression of IL-10 mRNA before and after intervention of IL-21Note: Compared with the corresponding groups without IL-21,*.P<0.05;compared with NC group,#.P>0.05;compared with eGD group,&.P<0.05.
2.4IL-10 蛋白表达水平未用IL-21处理时,GD组IL-10蛋白的表达量较eGD组和NC组增高,差异均有统计学意义(P<0.05);但eGD组与NC组比较差异无统计学意义(P>0.05)。经IL-21处理后,GD组、eGD组和NC组的IL-10蛋白的表达水平均有所降低,且较各组自身处理前有统计学意义(P<0.05)。见表5、图3。
3讨论
一类新的抑制性细胞Treg于1970年首次被Gershon和Kondo发现,这种细胞能够在体外抑制免疫反应[18]。Treg细胞在维持免疫耐受方面发挥着至关重要的作用[19]。研究表明Treg细胞的功能缺陷或细胞数量减少参与了多种自身免疫性疾病的发病过程[20-27]。Foxp3是Treg细胞分化过程中的关键性转录因子,当Foxp3基因敲除,Treg细胞的数量减少,增加了自身免疫性疾病的发生率[28]。Sasaki等[29]的研究表明,在感染时IL-10 mRNA同IFN-γmRNA一样都升高;这是因为机体免疫本身处于一个平衡状态,促炎因子升高的同时相应的也会引起抗炎因子的升高,只是在疾病的不同阶段促炎因子与抗炎因子所占的比重不同。

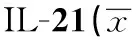
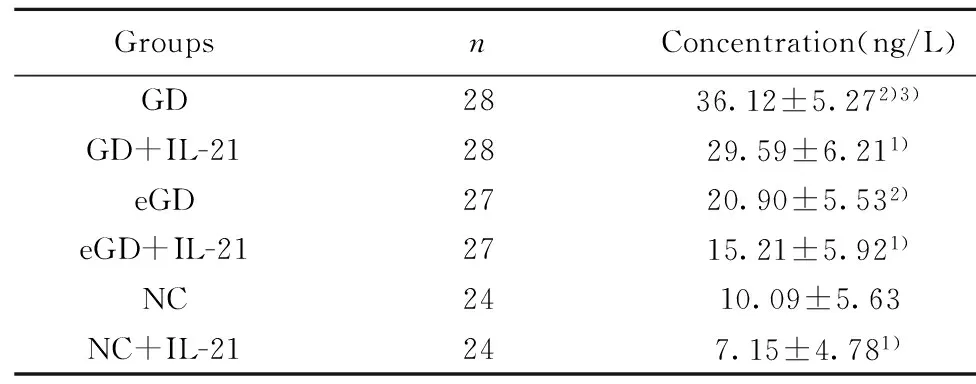
GroupsnConcentration(ng/L)GD2836.12±5.272)3)GD+IL-212829.59±6.211)eGD2720.90±5.532)eGD+IL-212715.21±5.921)NC2410.09±5.63NC+IL-21247.15±4.781)
Note:Compared with the corresponding groups without IL-21,1)P<0.05;compared with NC group,2)P>0.05;compared with eGD group,3)P<0.05.

图3 IL-21处理前后 IL-10蛋白表达水平比较Fig.3 Levels of IL-10 protein before and after intervention of IL-21Note: Compared with the corresponding groups without IL-21,*.P<0.05;compared with NC group,#.P>0.05;compared with eGD group,&.P<0.05.
本实验结果中,GD患者外周血单个核细胞中的Foxp3 mRNA 和IL-10 mRNA表达水平显著高于正常人群,而且其分泌的IL-10蛋白在GD患者中也明显升高,这与以往研究结果相符[29]。这些结果说明在GD的发病过程中,Treg细胞的功能随着免疫状态的激活也受到一定程度的激活,且其通过增加分泌免疫抑制性细胞因子IL-10来使免疫达到平衡状态。但Treg细胞具体通过何种途径发挥作用仍不十分清楚。
IL-21是新近发现的IL-2细胞因子家族的新成员。IL-21主要由活化的各类CD4+T细胞亚型产生,其受体表达于多种免疫细胞,因此对多种免疫细胞有重要的生物调节作用。IL-21与其受体结合后通过激活Jak-STAT信号通路,从而引发一系列生物学效应[30]。研究表明,IL-21参与了多种自身免疫性疾病的发病过程,如系统性硬化、系统性红斑狼疮(SLE)、1型糖尿病、自身免疫性甲状腺疾病[31-34]。在IL-21缺乏的情况下,IL-6诱导的CD4+T细胞中Foxp3+的表达量增加。Korn等[35]的研究发现,IL-6和TGF-β能够诱导Th17细胞的分化;在IL-6缺失的情况下,IL-21协同TGF-β通过非IL-6依赖途径使Th17细胞分化并抑制Treg细胞的表达。与细胞因子IL-2、IL-15和IL-7能诱导Treg细胞增殖的能力相反,IL-21非但不能诱导Treg细胞的增殖,反而还会抑制CD4+Treg细胞或CD8+Treg细胞的免疫抑制功能[16]。IL-21能通过活化CD4+T细胞亚型中的效应性T细胞来抑制调节性T细胞的活性[36]。以上研究表明IL-21可以作为一个独立的因素在调节Treg细胞的分化过程中发挥着重要的作用。
本研究结果显示,IL-21 刺激PBMCs后,GD组、eGD组和NC组的Foxp3 mRNA和IL-10 mRNA的表达水平显著低于刺激前。这可能是因为IL-21可以通过下调转录因子Foxp3的表达,抑制了Treg细胞的活化[16],并抑制细胞因子IL-10的分泌[37]。IL-21 刺激PBMCs后,GD组较正常组Foxp3 mRNA和IL-10 mRNA降低趋势更明显,这提示在疾病状态下,免疫系统被激活,机体更容易受炎症因子的影响。因此,IL-21是促进GD发病的重要因素。
综上所述,本研究表明IL-21可能通过抑制Treg细胞的分化及其效应分子IL-10的产生,使Treg细胞数量和功能下降,降低其对效应T细胞的抑制能力,从而参与GD的发病过程。由于本研究样本量较小,所以IL-21在GD中的发病机制仍有待大样本的研究资料进行验证。
参考文献:
[1]Noack M,Miossec P.Th17 and regulatory T cell balance in autoimmune and inflammatory diseases[J].Autoimmun Rev,2014,34(6):668-677.
[2]Song X,Qian Y.The activation and regulation of IL-17 receptor mediated signaling[J].Cytokine,2013,62(2):175-182.
[3]Duhen R,Glatigny S,Arbelaez CA,etal.Cutting edge: the pathogenicity of IFN-γ-producing Th17 cells is Independent of T-bet[J].J Immunol,2013,190(9):4478-4482.
[4]Peck A,Mellins ED.Breaking old paradigms: Th17 cells in autoimmune arthritis[J].Clin Immunol,2009,132(3):295-304.
[5]Esendagli G,Kurne AT,Sayat G,etal.Evaluation of Th17-related cytokines and receptors in multiple sclerosis patients under interferon β-1 therapy[J].J Neuroimmunol,2013,255(1/2):81-84.
[6]Ryba-Stanistawowska M,Skrzypkowska M,Myliwiec M,etal.Loss of the balance between CD4(+)Foxp3(+) regulatory T cells and CD4(+)IL17A(+) Th17 cells in patients with type 1 diabetes[J].Hum Immunol,2013,74(6):701-707.
[7]Vincze K,Kovats Z,Cseh A,etal.Peripheral CD4+cell prevalence and pleuropulmonary manifestations in systemic lupus erythematosus patients[J].Respir Med,2014,108(5):766-774.
[8]Zhang L,Yang XQ,Cheng J,etal.Increased Th17 cells are accompanied by FoxP3(+) Treg cell accumulation and correlated with psoriasis disease severity[J].Clin Immunol,2010,135(1):108-117.
[9]Sakaguchi S,Miyara M,Costantino CM.FOXP3(+) regulatory T cells in the human immune system[J].Nat Rev Immunol,2010,10(7):490-500.
[10]Maruyama T,Kono K,Mizukami Y,etal.Distribution of Th17 cells and FoxP3(+) regulatory T cells in tumor-infiltrating lymphocytes,tumor-draining lymph nodes and peripheral blood lymphocytes in patients with gastric cancer[J].Cancer Sci,2010,101(9):1947-1954.
[11]Leonard WJ,Zeng R,Spolski R.Interleukin 21: a cytokine/cytokine receptor system that has come of age[J].J Leukoc Biol,2008,84(2):348-356.
[12]Spolski R,Leonard WJ.The yin and yang of interleukin-21 in allergy,autoimmunity and cancer[J].Curr Opin Immunol,2008,20(3):295-301.
[13]Bettelli E,Carrier Y,Gao W,etal.Reciprocal developmental pathways for the Generation of pathogenic effector TH17 and regulatory T cells[J].Nature,2006,441(790):235-238.
[14]Leung S,Liu X,Fang L,etal.The cytokine milieu in the interplay of pathogenic Th1/Th17 cells and regulatory T cells in autoimmune disease[J].Cell Mol Immunol,2010,7(3):182-189.
[15]卢永霞,刘纯.IL-21上调IL-17的表达在Graves病中的意义[J].上海交通大学学报:医学版,2014,34(1):65-69.
[16]Peluso I,Fantini MC,Fina D,etal.IL-21 counteracts the regulatory T cell-mediated suppression of human CD4+T lymphocytes[J].J Immunol,2007,178(2):732-739.
[17]滕卫平,曾正陪,李光伟,等.中国甲状腺疾病诊治指南[M].北京:中华医学会内分泌学分会,2007:47.
[18]Gershon RK,Kondo K.Cell interactions in the induction of tolerance: the role of thymic lymphocytes[J].Immunology,1970,18(5):723-737.
[19]Sakaguchi S,Yamaguchi T,Nomura T,etal.Regulatory T cells and immune tolerance[J].Cell,2008,133(5):775-787.
[20]Grant CR,Liberal R,Mieli-Vergani G,etal.Regulatory T-cells in autoimmune diseases: challenges,controversies and--yet--unanswered questions[J].Autoimmun Rev,2015,14(2):105-116.
[21]Kessel A,Haj T,Peri R,etal.Human CD19(+)CD25(high) B regulatory cells suppress proliferation of CD4(+) T cells and enhance Foxp3 and CTLA-4 expression in T-regulatory cells[J].Autoimmun Rev,2012,11(9):670-677.
[22]Liston A,Gray DH.Homeostatic control of regulatory T cell diversity[J].Nat Rev Immunol,2014,14(3):154-165.
[23]Dwivedi M,Kemp EH,Laddha NC,etal.Regulatory T cells in vitiligo: Implications for pathogenesis and therapeutics[J].Autoimmun Rev,2015,14(1):49-56.
[24]Osnes LT,Nakken B,Bodolay E,etal.Assessment of intracellular cytokines and regulatory cells in patients with autoimmune diseases and primary immunodeficiencies-novel tool for diagnostics and patient follow-up[J].Autoimmun Rev,2013,12(10):967-971.
[25]Gertel-Lapter S,Mizrachi K,Berrih-Aknin S,etal.Impairment of regulatory T cells in myasthenia gravis: studies in an experimental model[J].Autoimmun Rev,2013,12(9):894-903.
[26]Fenoglio D,Bernuzzi F,Battaglia F,etal.Th17 and regulatory T lymphocytes in primary biliary cirrhosis and systemic sclerosis as models of autoimmune fibrotic diseases[J].Autoimmun Rev,2012,12(2):300-304.
[27]Kornete M,Piccirillo CA.Critical co-stimulatory pathways in the stability of Foxp3+Treg cell homeostasis in Type I diabetes[J].Autoimmun Rev,2011,11(2):104-111.
[28]Zheng Y,Rudensky AY.Foxp3 in control of the regulatory T cell lineage[J].Nat Immunol,2007,8(5):457-462.
[29]Sasaki S,Nishikawa S,Miura T,etal.Interleukin-4 and interleukin-10 are involved in host resistance to Staphylococcus aureus infection through regulation of gamma interferon[J].Infect Immun,2000,68(5):2424-2430.
[30]Zeng R,Spolski R,Casas E,etal.The molecular basis of IL-21-mediated proliferation[J].Blood,2007,109(10):4135-4142.
[31]Lei L,He ZY,Zhao C,etal.Elevated frequencies of CD4(+) IL-21(+) T,CD4(+) IL-21R(+) T and IL-21(+) Th17 cells,and increased levels of IL-21 in bleomycin-induced mice May be associated with dermal and pulmonary inflammation and fibrosis[J].Int J Rheum Dis,2016,19(4):392-404..
[32]Wang HX,Chu S,Li J,etal.Increased IL-17 and IL-21 producing TCRαβ+CD4-CD8-T cells in Chinese systemic lupus erythematosus patients[J].Lupus,2014,23(7):643-654.
[33]Ferreira RC,Simons HZ,Thompson WS,etal.IL-21 production by CD4+effector T cells and frequency of circulating follicular helper T cells are increased in type 1 diabetes patients[J].Diabetologia,2015,58(4):781-790.
[34]Guan LJ,Wang X,Meng S,etal.Increased IL-21/IL-21R expression and its proinflammatory effects in autoimmune thyroid disease[J].Cytokine,2015,72(2):160-165.
[35]Korn T,Bettelli E,Gao W,etal.IL-21 initiates an alternative pathway to induce proinflammatory T(H)17 cells[J].Nature,2007,448(7152):484-487.
[36]Chevalier N,Thorburn AN,Macia L,etal.Inflammation and lymphopenia trigger autoimmunity by suppression of IL-2-controlled regulatory T cell and increase of IL-21-mediated effector T cell expansion[J].J Immunol,2014,193(10):4845-4858.
[37]Spolski R,Kim HP,Zhu W,etal.IL-21 mediates suppressive effects via its induction of IL-10[J].J Immunol,2009,182(5):2859-2867.
[收稿2015-10-11修回2015-10-27]
(编辑倪鹏)
Effect of IL-21 on Treg cells in peripheral blood mononuclear cells in pathogenesis of Graves disease
HUANG Xiao-Qing,LIU Chun.
Department of Endocrinology,The First Affiliated Hospital of Chongqing Medical University,Chongqing 400016,China
[Abstract]Objective:To explore the role of IL-21 in regulating the expression of peripheral blood Treg cells in the pathogenesis of Graves disease (GD).Methods: Electrochemical luminescence detection was used to determine levels of thyroid function indexes and autoantibodies.Peripheral blood mononuclear cells (PBMCs) were extracted,then,cultured in the presence or absence of IL-21 in vitro.The level of IL-10 protein was measured by enzyme-linked immunosorbent assay (ELISA),and expressions of Foxp3 and IL-10 mRNA were examined by Real-time PCR.Results: Compared to eGD and control group,there were significant differences in the levels of thyroid function indexes in GD group (P<0.05),whereas there was no difference between control group and eGD group (P>0.05).Before IL-21 stimulation,compared to eGD and control groups,expressions of Foxp3 and IL-10 mRNA and level of IL-10 protein were significantly higher in GD group(P<0.05);but there were no significant differences between eGD group and control group (P>0.05).After IL-21 stimulation,expressions of Foxp3,IL-10 mRNA and IL-10 protein levels were decreased markedly in all three groups,among which GD group showed the greatest change(P<0.05).Conclusion: IL-21 may inhibit the differentiation of Treg cells and the production of IL-10,therefore decreasing the number of Treg cells and the ability of suppressing effector T cells ,thus should be involved in the pathogenesis of GD.
[Key words]IL-21;Graves disease;Regulatory T cells;Foxp3;IL-10
doi:10.3969/j.issn.1000-484X.2016.06.018
作者简介:黄小庆(1989年-),女,硕士,主要从事甲状腺疾病免疫发病机制研究,E-mail:1548511929@qq.com。 通讯作者及指导教师:刘纯(1963年-),女,主任医师,硕士生导师,主要从事甲状腺疾病免疫发病机研究,E-mail:liuchun200157@163.com。
中图分类号R581.1
文献标志码A
文章编号1000-484X(2016)06-0853-06
①本文受重庆市渝中区科技计划项目(20140127) 和 国家临床重点专科建设项目资助(2011)。

