Oct4B1在结直肠癌干细胞中的表达及意义①
程家平 黎 江 苏 弦 陈奕霖 曾庆良 文坤明
(遵义医学院附属医院胃肠外科,遵义563003)
Oct4B1在结直肠癌干细胞中的表达及意义①
程家平黎江苏弦陈奕霖曾庆良文坤明
(遵义医学院附属医院胃肠外科,遵义563003)
[摘要]目的:探讨胚胎干细胞转录因子Oct4的亚型Oct4B1在结直肠癌干细胞中的表达及其可能的作用。方法:以结直肠癌细胞株SW480细胞采用悬浮培养法培养出的3D微球体及其亲本细胞SW480为研究对象,采用细胞分化实验、细胞软琼脂克隆实验、流式细胞技术检测干细胞标记物CD133、CD44的表达以验证3D微球体是否富集肿瘤干细胞(CSCs),实时荧光定量PCR(RT-qPCR)检测两种细胞Oct4B1 mRNA表达水平。结果:3D微球体具有分化为普通肿瘤细胞的能力,相对于亲本细胞,3D微球体体外克隆形成能力明显增强(P<0.01),干细胞标记物CD133、CD44明显高表达(P<0.01),Oct4B1 mRNA表达水平明显增高(P<0.01)。结论:干细胞调控因子Oct4的亚型Oct4B1在富集结直肠癌CSCs的3D微球体中表达明显增高,其可能参与结直肠癌CSCs的调控。
[关键词]结直肠癌;肿瘤干细胞;Oct4;Oct4B1
Oct4基因是维持胚胎干细胞(Embryonic stem cell,ES)多能性及自我更新主要调节剂。近来,越来越多的报道显示Oct4在多种恶性实体肿瘤中有异常表达,并且发现其参与肿瘤干细胞(Cancer stem cells,CSCs)的调控[1,2]。人Oct4基因通过选择性剪切产生3个主要的亚型,称为Oct4A、Oct4B及Oct4B1[3]。Oct4A和Oct4B是在1992年证实的,大多数报道把重点放在Oct4A的研究上,其作为维持ES干细胞特性的转录因子已经被证实。Oct4B1是最近才发现的Oct4的转录本,其在人ES及胚胎癌中表达,当这些细胞分化时Oct4B1表达下调,Papamichos等[4]认为Oct4B1可能是研究比较成熟的Oct4A更可靠的干细胞标记物,具有调节多能性的功能。在胃癌及结直肠癌中等多种肿瘤中已发现了Oct4B1有表达[5,6]。但目前尚未见Oct4B1在CSCs中的表达及作用的研究报道。本研究通过悬浮培养法培养富集结直肠癌CSCs的3D微球体,检测Oct4B1的表达水平,推测其可能的作用。
1材料与方法
1.1材料SW480购自中国科学院上海细胞库,胎牛血清(FBS)、L-15培养基购自美国Hyclone公司,B-27购于美国Gibco公司,EGF、FGF购自美国peprotech公司,Stempro Accutase cell购自美国Invitrogen公司,CD133-FITC、CD44-PE抗体购自德国Miltenyi Biotec公司,逆转录试剂盒购于大连TaKaRa公司,通用型SYBR快速定量试剂盒购于美国KAPA公司。
1.2方法
1.2.13D微球体的培养将生长状态良好、细胞融合度达80%的SW480细胞用PBS缓冲液清洗3遍后,加入适量干细胞培养液[含EGF(20 ng/ml)、FGF(10 ng/ml)、B-27(1∶50)的无血清L-15培养基],在37℃含5%CO2的培养箱中继续培养,3 d后更换上述培养液,去除凋亡脱落的细胞,之后待培养基颜色变淡后,适时加入适量的干细胞培养液,待折光性良好的3D微球体形成后,利用细胞球的重力作用,将细胞球与其他漂浮的死细胞进行分离纯化;细胞球继续在干细胞培养液中培养待3D微球体体积平均增大2倍左右时,进行后续相关实验。
1.2.23D微球体分化实验在上述纯化后的3D微球体中加入适量含10%FBS的L-15培养基,放入37℃ 5%CO2培养箱中培养。观察3D微球体是否逐渐贴壁生长及细胞形态变化;对贴壁生长的细胞,用0.25%胰酶消化后继续以含10%FBS培养基在37℃ 5%CO2培养箱培养,观察细胞形态,并照相记录。
1.2.33D微球体及亲本细胞的软琼脂克隆形成实验用三蒸水分别制备出1.2%和0.7%两个浓度的低熔点琼脂糖液,高压灭菌后,保存在60℃的烤箱中使其不会凝固。取上述纯化后的3D微球体及亲本细胞SW480,用Accutase酶及0.25%胰酶消化为单细胞悬液,进行细胞计数,并用含20%FBS的L-15培养液调整细胞密度至1×106细胞/L的细胞悬液,按1∶1比例使1.2%的琼脂糖和含20%FBS的L-15培养基混合后,取3 ml混合液注入直径6 cm玻璃平皿中,冷却凝固,作底层琼脂,置CO2温箱中备用。按1∶1比例使0.7%的琼脂糖和含20%FBS培养基在无菌试管中混匀,再向管中加入0.5 ml的细胞悬液充分混匀,注入铺有1.2%琼脂糖底层平皿中,固形成双琼脂层。待上层琼脂凝固后,置于37℃ 5%CO2培养箱中培养10~14 d。在倒置显微镜下,观察>50个细胞克隆数,以克隆形成率反映克隆形成能力,克隆形成率=细胞克隆数/接种细胞数×100%[7]。
1.2.4流式细胞仪检测3D微球体及亲本细胞的CD133、CD44阳性细胞百分率取上述纯化后的3D微球体及亲本细胞,相应的消化酶消化为单细胞悬液,每个检测样本细胞数量为1.0×106,用PBS洗涤后加入含0.5%BSA的PBS液重悬细胞,分别避光加入10 μl CD44-PE、CD133-FITC一抗及相应的阴性对照抗体,4℃避光孵育10 min,用PBS洗涤后加入100 μl PBS重悬细胞,送流式细胞仪检测荧光阳性细胞百分率(以上操作重复3次)。
1.2.5RT-qPCR技术检测Oct4B1 mRNA的表达情况采用天根公司细胞RNA提取试剂盒提取两种细胞RNA,反转录合成cDNA,采用SYBR Green染料法进行实时定量PCR反应。采用25 μl反应体系,反应条件为:95℃ 30 s;95℃ 5 s,59℃ 30 s,40个循环;65℃ 5 s,95℃ 5 min。绘制熔解曲线。每次检测均设立3个复孔,重复3次实验。选择β-actin为内参,运用2-△△Ct方法确定目的基因表达的相对水平[1]。Oct4 B1、β-actin上下游引物由大连宝生物公司合成。其引物序列分别为:Oct4B1:F:5′-AATCCCGAATGGAAAGG-3′, R:5′-GGAACCCACCAA-ATAGAAC-3′; β-actin:F:5′-GGAGATTACTGCCCTGGCTCCTA-3′, R:5′-GACTCATCGTACTCCTGCTTG-CTG-3′。
2结果
2.1SW480结直肠癌细胞在添加EGF、FFG、B-27生长因子的无血清培养基中能形成3D微球体,该3D微球体呈悬浮生长状态,排列较致密,继续培养后能体积明显增大变密,见图1。
2.2加入含10%FBS的L-15培养基后,3D微球体在1~2 d开始出现贴壁,不再悬浮生长,3~4 d时,细胞球边缘出现与SW480肿瘤细胞相似的细胞伪足,通过0.25%胰酶消化细胞继续含10%FBS培养基培养,细胞能继续生长,形态与亲本SW480肿瘤细胞相似。见图2。

图1 SW480结直肠癌肿瘤细胞及悬浮培养的3D微球体形态(×200)Fig.1 Microscopic morphology of SW480 cells and 3D microsphere(×200)Note: A.SW480 cells;B.3D microsphere morphology when cultivated 12 to 15 days;C.3D microsphere morphology when cultivated 20 days,it becomes bigger and more dense.
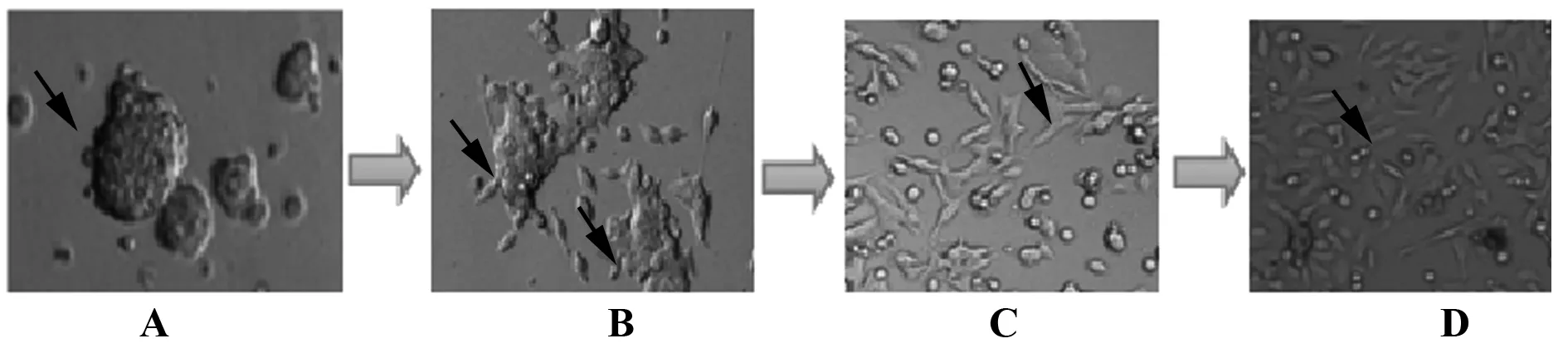
图2 3D微球体分化实验(×200)Fig.2 Results of differentiation of 3D microsphere form(×200)Note: A.3D microsphere;B.3D microsphere began to stick wall growth after adding the 10% fetal bovine serum culture medium;C.When it was subcultured,cells can continue to grow,and it′s morphology similar to parent SW480 cells;D.SW480 cells.

图3 体外克隆形成实验镜下观察结果(×200)Fig.3 Microscopic observations results of clone formation in vitro experiments microscopic observations(×200)Note: Compared with 3D microsphere;*.P<0.01.

图4 流式细胞技术检测3D微球体与亲本SW480细胞的CD133+、CD44+百分率Fig.4 Percentage of CD133+ and CD44+ cells was detected by flow cytometry

图5 RT-qPCR检测3D微球体及SW480的Oct4B1 mRNA表达水平Fig.5 Expression levels of Oct4B1 mRNA were detected by RT-qPCR in 3D microsphere and SW480 cellsNote: Compared with SW480 cells,*.P<0.01.
2.3软琼脂克隆形成实验3D微球体与其亲本SW480细胞通过在添加20%FBS的软琼脂培养基中都有克隆形成,其克隆形成率分别为(87±6)%和(18±3)%,3D微球体的克隆形成率明显高于SW480细胞(P<0.01),结果提示细胞球的克隆形成能力明显高于亲本细胞。
2.4流式细胞直接发法检测CD133、CD44阳性细胞百分率:亲本细胞与3D微球体相比较,CD133+细胞的比例由(5.45%±1.21%)上升到(16.58%±2.32%)(P<0.01),CD44+细胞的比例由(59.61%±2.87%)上升到(90.21%±3.11%)(P<0.01),见图4。
2.5RT-qPCR检测Oct4B1 mRNA的表达情况亲本细胞与3D微球体Oct4B1 mRNA的相对水平分别为(1.00±0.15)及(27.36±2.56),3D微球体较亲本SW480细胞增高约27倍(P<0.01),见图5。
3讨论
结直肠癌是发病率及死亡率均较高的恶性肿瘤[8],手术及化疗是其最主要的治疗方法,尽管实施了标准的根治性切除手术及规范的化疗,但其治疗效果仍不满意,5年生存率仍徘徊在50%,对化疗药物耐药是其治疗失败的主要原因[9]。近年来研究发现,在肿瘤组织内存在一小群称为CSCs的细胞,是众多肿瘤发生的起源,也是恶性肿瘤复发、转移和耐药的根本原因[10]。传统的化疗及放疗只能根除肿瘤组织内的普通肿瘤细胞,对CSCs则无效。因此,研究CSCs的调控机制,选择针对CSCs的治疗靶点,将为改善结直肠癌的治疗效果带来新的希望。
由于CSCs在肿瘤组织中的比例小,为了研究CSCs的功能及调控机制,常选择特定的CSCs标记物采用流式或免疫磁珠的方式分选,以及采用化疗药物或悬浮培养的方式富集CSCs。本实验中,我们采用悬浮培养法,对结直肠癌SW480细胞使用含干细胞生长因子的无血清培养基培养出3D微球体,通过细胞分化实验,软琼脂糖克隆实验及CSCs标记物检测发现,该3D微球体在含20%FBS的培养基中能够分化为贴壁生长的,与亲本细胞类似的肿瘤细胞的能力(见图2),与亲本细胞比较,克隆形成能力明显增强(P<0.01,见图3),CSCs标记物CD133、CD44阳性细胞百分比明显增高(P<0.01,见图4),提示3D微球体富集结直肠癌CSCs,该3D微球体为我们研究结直肠癌CSCs的功能及调控机制建立了良好的研究对象。
Oct4在多能的ES细胞中高表达,在ES细胞分化时Oct4下调,敲除Oct4基因后使ES细胞分化[11]。因此,调节ES细胞多能性及自我更新赋予Oct4作为多能性的标志。近来,越来越多的报道显示Oct4在多种恶性实体肿瘤中有异常表达。在我们之前的研究中已发现,Oct4具有维持结直肠癌CSCs存活的作用[1],提示Oct4参与结直肠癌CSCs的调控,而人Oct4基因存在Oct4A,Oct4B及Oct4B1三个主要亚型。Oct4A和Oct4B是在1992年证实的,之前的大多数报道把重点放在Oct4A的研究上,其作为维持干细胞特性的转录因子已经被证实。Oct4B1是最近才发现的Oct4的转录本,其在人胚胎干细胞及胚胎癌中表达,当这些细胞分化时Oct4B1表达下调,Asadi等[5]研究发现,Oct4B1在胃癌组织中有表达,而在同一病人的癌旁组织无表达或低表达,且Oct4B1在胃癌细胞株AGS中高表达,他们采用RNAi技术敲除该细胞株中的Oct4B1后,caspase-3/caspase-7活性及细胞凋亡均明显增高,说明Oct4B1在胃癌中具有癌基因功能,是一种抗凋亡因子。我们最近的研究发现Oct4B1在结肠癌细胞株及结肠癌耐药细胞株中均有表达,其作用与促进结肠癌细胞增殖、迁移、侵袭及降低细胞对奥沙利铂的化疗敏感性有关[6]。Papamichos等[4]认为Oct4B1可能是比研究比较成熟的Oct4A更可靠的干细胞标记物,具有调节多能性的功能。但Oct4B1是否在调控CSCs方面,亦发挥重要作用,目前未见相关文献报道。
我们采用RT-qPCR检测了ES干性调控因子Oct4的亚型Oct4B1的mRNA水平,结果提示,在富集CSCs的结直肠癌3D微球体中Oct4B1的mRNA水平较其亲本SW480细胞增高约27倍(见图5,P<0.01),结合我们之前的研究发现[6],SW480细胞过表达Oct4B1后CSCs标记物CD133及CD44表达量均明显提高,提示Oct4B1可能参与了结直肠癌CSCs的调控,其具体的调控机制有待进一步研究证实。
参考文献:
[1]Wen K,Fu Z,Wu X,etal.Oct-4 is required for an antiapoptotic behavior of chemoresistant colorectal cancer cells enriched for cancer stem cells:Effects associated with STAT3/Survivin[J].Cancer Lett,2013,333(1):56-65.
[2]Koo BS,Lee SH,Kim JM,etal.Oct4 is a critical regulator of stemness in head and neck squamous carcinoma cells[J].Oncogene,2015,34(18):2317-2324.
[3]Hwang JY,Oh JN,Lee DK,etal.Identification and differential expression patterns of porcine OCT4 variants[J].Reproduction,2015,149(1):55-66.
[4]Papamichos SI,Kotoula V,Tarlatzis BC,etal.OCT4B1 isoform:the novel OCT4 alternative spliced variant as a putative marker of stemness[J].Mol Hum Reprod,2009,15(5):269-270.
[5]Asadi MH,Mowla SJ,Fathi F,etal.OCT4B1,a novel spliced variant of OCT4,is highly expressed in gastric cancer and acts as an antiapoptotic factor[J].Int J Cancer,2011,128(11):2645-2652.
[6]Wen KM,Zhang GH,Li J,etal.OCT4B1 promotes cell growth,migration and invasion suppressing sensitivity to οxaliplatin in colon cancer[J].Oncol Rep,2015,34(6):2943-2952.
[7]牟霞,李明.siRNA沉默新趋化因子VCC-1抑制SMMC-7721肝癌细胞体外克隆形成能力和体内成瘤性[J].中国免疫学杂志,2013,29(4):347-349.
[8]Siegel R,Naishadham D,Jemal A .Cancer statistics,2013[J].CA Cancer J Clin ,2013,63:11-30.
[9]Nautiyal J,Kanwar SS,Yu Y,etal.Combination of dasatinib and curcumin eliminates chemo-resistant colon cancer cells[J].J Mol Signal,2011:6:7.
[10]Lobl NA,Shimono Y,Qian D,etal.The biology of cancer stem cells[J].Annu Rev Cell Dev Biol,2007,23:675-699.
[11]Hay DC,Sutherland L,Clark J,etal.Oct-4 knockdown induces similar patterns of endoderm and trophoblast differentiation markers in human and mouse embryonic stem cells[J].Stem Cells,2004,22(2):225-235.
[收稿2015-10-23修回2016-03-10]
(编辑张晓舟)
Expression and significance of Oct4B1 in colorectal cancer stem cells
CHENG Jia-Ping,LI Jiang,SU Xian,CHEN Yi-Lin,ZENG Qing-Liang,WEN Kun-Ming.
Department of Gastrointestinal Surgery,the Affiliated Hospital of Zunyi Medical College,Zunyi 563003,China
[Abstract]Objective:To investigate the expression and its possible role of Oct4B1 subtype of Embryonic stem cell transcription factor Oct4 in colorectal cancer stem cells.Methods: 3D microspheres were cultured by suspension culture to human colorectal cancer cell line SW480 cells.The 3D microspheres and SW480 cells were used as the research objects.Whether 3D microspheres were enriched cancer stem cells,we used the methods of cell differentiation experiments,soft agar cloning experiments,and the expression levels of cancer stem cells markers CD133,CD44 detected by flow cytometry.The expression levels of Oct4B1 mRNA were detected by RT-qPCR.Results: 3D microspheres could differentiate into normal cancer cells.Compared with the parental SW480 cells,in vitro colony formation was significantly enhanced(P<0.01),the percentage of positive cells of CD133 and CD44 were significantly increased(P<0.01),the expression levels of Oct4B1 mRNA were obviously higher(P<0.01)in 3D microspheres.Conclusion: Oct4B1 subtype of Embryonic stem cell transcription factor Oct4 in 3D microspheres enriched human colorectal cancer stem cells,which may be involved in the regulation of colorectal cancer stem cells.
[Key words]Colorectal cancer;Cancer stem cells;Oct4;Oct4B1
doi:10.3969/j.issn.1000-484X.2016.06.005
作者简介:程家平(1965年-),男,硕士,副主任医师,主要从事胃肠外科基础与临床研究,E-mail:jiapingzy08@163.com。 通讯作者及指导教师:文坤明(1978年-),男,医学博士,副教授,主要从事肿瘤干细胞与结直肠癌多药耐药的研究,E-mail:381224619@qq.com。
中图分类号R735.3
文献标志码A
文章编号1000-484X(2016)06-0794-04
①本文为国家自然科学基金(No.81260369)及贵州省科技厅科学技术基金[黔科合(J)字(2012)2365]资助项目。