预耐力训练预防急性酒精性肝损伤
——肝脏抗氧化能力与线粒体解偶联关系的研究
苏 文, 刘艳环, 王漫卓, 马国栋
(山东理工大学 体育学院,山东 淄博 255049)
预耐力训练预防急性酒精性肝损伤
——肝脏抗氧化能力与线粒体解偶联关系的研究
苏文, 刘艳环, 王漫卓, 马国栋
(山东理工大学 体育学院,山东 淄博 255049)
摘要:为了研究预耐力训练对急性酒精性肝损伤肝脏抗氧化能力与解偶联关系的影响,以SD大鼠建立急性酒精性肝损伤模型,以12周无负重游泳为运动手段,测定肝脏线粒体锰过氧化物歧化酶(Manganese superoxide dismutase,MnSOD)活性及线粒体三磷酸腺苷(Adenosine Triphosphate,ATP)合成活力,肝脏线粒体磷氧比(Phosphorus oxygen ratio,P/O)的变化和肝脏组织MnSOD、解偶联蛋白2(Uncoupling protein 2,UCP2)和肝细胞癌下调的线粒体转运蛋白(HCC-down-regulated mitochondrial carrier protein,HDMCP)mRNA表达.结果发现:未训练大鼠急性酒精摄入导致肝脏MnSOD酶活性、MnSOD、UCP2和HDMCP mRNA表达著升高,而ATP合成活力和P/O显著降低;预耐力训练后再给予急性酒精摄入使肝脏UCP2和HDMCPmRNA表达均显著低于直接急性酒精摄入大鼠,而肝脏线粒体P/O和MnSODmRNA表达均显著高于直接酒精摄入大鼠.结论:耐力训练可以有效提高肝脏抗氧化能力,降低解偶联蛋白表达,从而提高肝脏线粒体能量合成能力,达到预防急性酒精性肝损伤的目的.
关键词:预耐力训练;急性酒精性肝损伤;抗氧化能力;解偶联作用
酒精性肝病是世界范围内倍受关注的公共卫生问题.酒精性肝病包括从酒精性脂肪肝、酒精性肝炎到酒精性肝纤维化,而且部分会发展成为肝癌[1].据估计,全球死亡人数的3.2%与酒精有关[2].在美国死于肝病的人50%与酒精有关,在可预防的引起死亡的因素中,过量酒精摄入列第三位[3].我国尚缺乏全国性大规模酒精性肝病的流行病学调查资料,但各地一些相关的流行病学调查提示酒精性肝病发病率呈逐年上升趋势,有些地区在20年内甚至上升了70倍[4].我国作为酒的消费大国,酒精所致的肝脏损害已经成为一个不容忽视的严重的公共卫生问题.在日常饮酒的过程中,常常会出现急性大量饮酒的现象,而这常常会导致急性酒精性肝损伤,其中肝脏线粒体的氧化损伤是最为常见的损伤.线粒体平衡氧化损伤的方式主要存在两种方式:一是通过抗氧化酶或非酶类物质消除活性氧;二是通过温和解耦联的方式降低活性氧的产生[5].急性酒精性肝损伤发病过程中,这两种机制如何发挥作用?两者的关系如何?都是值得深入研究的问题.研究证实,耐力训练提高肝脏抗氧化能力[6],改善肝脏线粒体结构[7],逆转肝脏线粒体功能异常[8].运动训练可显著逆转酒精引起的抗氧化能力降低[9],我们研究也发现,预运动训练可以显著降低急性酒精摄入导致的肝脏损伤[10],但其机理尚不完全清楚.那么预训练后,急性酒精性肝损伤过程中,这两种机制的关系如何?这方面的研究罕见报道.本研究拟在此方面进行探讨,以期为进一步了解急性酒精性肝损伤以及耐力训练对急性酒精性肝损伤的影响提供实验依据.
1材料与方法
1.1实验设计
随机将SD大鼠(6周龄,48只)分为4组:(1)对照组(C,N=12);(2)12周运动组(E,N=12);(3)12周运动+5天酒精摄入组(EA,N=12);(4)对照组+5天酒精灌胃组(CA,N=12).在实验结束时,大鼠禁食12h,然后麻醉处死,取肝脏以备用于测试各种所需指标.
1.2耐力训练模型
采用无负重游泳训练,水温(29 ±2) ℃,第1周运动0.5 h /次,第2周1h/次,从第3周开始1.5 h/次 ,每周运动5次,共运动12周.
1.3急性酒精性肝损伤模型
参照文献,按0.8ml/ 100g体重给予大鼠灌胃(红星二锅头酒,56度),每天上午灌胃两次,间隔1h;对照组给予相同体积的生理盐水灌胃,连续5d.
1.4肝脏样本制备与线粒体提取
大鼠处死后,迅速取肝脏,剪取2g,用冰浴的生理盐水冲洗,然后剪碎,加入10mL冰浴的生理盐水,电动匀浆器匀浆,低温离心机下离心10min(600g),取上清液,然后10000g离心10min,将沉淀用约2mL冰浴生理盐水悬浮,悬浮液为线粒体.
1.5指标测定
1.5.1测定肝脏线粒体TBARS水平和MnSOD活性
参照文献[5],测定提取肝脏线粒体TBARS的水平;
MnSOD酶活性测定,采用南京建成生物工程研究所的试剂盒进行测定,测定过程中严格按照试剂盒操作说明进行操作.
1.5.2线粒体ATP合成活力的测定
利用荧光素-荧光素酶发光法[4],测定线粒体ATP合成活力.
1.5.3测定线粒体P/O比
根据参考文献[12],用Clark氧电极测定密闭反应系统中线粒体氧耗的速率,用以确定线粒体的P/O.
1.5.4RT-PCR半定量法测定肝脏组织MnSOD、UCP2和HDMCP mRNA表达
以上述的肝脏组织, 用Trizol Reagent试剂盒(Mrcgene产品)与逆转录试剂盒(Ferment产品)参照说明书进行逆转录反应,以备用于MnSOD、UCP2和HDMCP mRNA的扩增.引物为:
MnSOD上游5’-GCGACCTACGTGAACAATCTGAACG-3,下游5’ -TCAATCCCCAGCAGTGGAATAAGGC-3’
HDMCP:上游 5’ -GCCACTCCTTTGCCACCTAC -3’,下游:5’- CACAGCCTCATAAGCCACGA -3’;
UCP2:上游5‘CCTTCTGCACTCCTGTGTTC -3’, 下游5’- GTGGCCTTGAAACCAACCAT -3’;
GAPDH:上游: 5’-CCTTCATTGACCTCAACTACAT-3’,下游:5’-CCAAAGTTGTCATGGATGACC-3’
1.6统计学分析
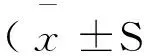
2结果
2.1肝脏线粒体MnSOD活性与TBARS含量
如表1 所示:肝脏线粒体MnSOD活性E、CA和EA组均显著高于C组,CA组显著低于E组,EA组显著高于E组和CA组;肝脏线粒体TBARS含量E组显著低于C组,而CA组和EA组显著高于C组,CA组和EA组显著高于E组,EA组显著低于CA组.
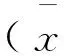

组别C组E组CA组EA组MnSOD活性/(U/mg)8.12±2.1318.43±4.25**13.24±3.87*$26.14±5.67**$#TBARS含量/nmol/(mg·pro)2.61±0.411.49±0.25*4.17±0.68**$$3.56±0.74*$$#
注:与C组比较:*p<0.05,**<0.01,***<0.001;与E组比较:$p<0.01,$$p<0.001;与CA组比较:#p<0.01
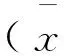

组别C组E组CA组EA组ATP合成活力/nmol/(min·mg·pro)9.68±2.1415.03±3.22**6.37±1.86*$10.01±2.06$#P/O2.14±0.142.52±0.29*1.610±0.16*$1.92±0.17*$#


组别C组E组CA组EA组MnSOD1.31±0.222.38±0.55**1.84±0.33*$3.16±0.61**$##UCP20.39±0.040.21±0.01*0.77±0.06**$$0.41±0.04$$#HDMCP1.01±0.120.54±0.08**1.61±0.27**$$0.89±0.09$#
注:与C组比较:*p<0.05,**<0.01;与E组比较:$p<0.05,$$p<0.01;与CA组比较:#p<0.05,##p<0.01.
2.2肝脏线粒体ATP合成活力与P/O
线粒体ATP合成活力E组显著高于C组,CA组显著低于C组,EA组与C组未见显著性差异,CA组和EA组显著低于E组,EA组显著高于CA组;肝脏线粒体P/O,E组显著高于C组,而CA组和EA组均显著低于C组,CA组和EA组均显著低于E组,EA组显著高于CA组.
2.3肝脏组织MnSOD、UCP2和HDMCP mRNA表达
如表3所示:肝脏MnSODmRNA表达,E组、CA组和EA组均显著高于C组,CA组显著低于E组,EA组显著高于E组和CA组;UCP2和HDMCPmRNA表达表现出相同的变化规律,E组显著低于C组,CA组显著高于C组,EA组与C组未见显著性差异,CA组和EA组均显著高于E组,EA组显著低于CA组.
3讨论
线粒体是细胞内主要活性氧的来源,线粒体产生的活性氧一方面起到信号分子的作用,另一方面也会因大量的产生而导致线粒体的氧化损伤.在生物进化的过程中,线粒体形成了一套精密的抗氧化体系.目前,多数研究者认为,线粒体通过两种方式达到保护线粒体免受氧化损伤的目的.一方面通抗氧化系统(包括非酶类和抗氧化酶,非酶类如维生素E、辅酶Q等,抗氧化酶如MnSOD酶、CAT酶等)清除产生的过多的活性氧,而另一方面通过“温和”解偶联的方式抑制活性氧的大量产生[13]. SkulaChev V P[14]最早提出了“温和”解偶联抗氧化的机制:通过“温和”地解偶联,降低线粒体膜电位,从而降低线粒体活性氧的生成,我们之前的研究也证实了这一点[15].近些年,多数研究证实,解偶联蛋白发挥着“温和”解偶联作用,解偶联蛋白在不同的组织中其类型不同,骨骼肌中主要是解偶联蛋白3(UCP3),心肌和肝脏中主要是解偶联蛋白2(UCP2)[16].Tan 等[17]2004年在肝细胞癌中克隆出一个新的基因,他们命名为肝细胞癌下调的线粒体转运蛋白(HCC-down-regulated mitochondrial carrier protein,HDMCP).此蛋白在小鼠、大鼠和人类的肝脏中表达较高,并且具有高度的同源性.Jin X等[18]进一步研究发现,在肝脏细胞中,HDMCP过表达能够显著降低线粒体膜电位,线粒体ATP合成能力显著降低,因此该作者认为,HDMCP具有“质子漏”的功能,HDMCP可能是肝脏线粒体中除解偶联蛋白2之外的又一个重要的起解偶联作用的蛋白质.
急性酒精性肝损伤过程中,肝脏细胞的氧化损伤是其重要的表现之一.许多研究均证实,急性酒精性肝损伤过程中MDA和活性氧含量显著增加[10, 19].本研究也发现,大鼠给予5d酒精摄入后,肝脏线粒体TBARS含量显著升高,说明肝脏线粒体受到显著的氧化损伤.有趣的是,在急性酒精摄入过程中,肝脏线粒体MnSOD酶的活性以及肝脏细胞MnSODmRNA表达显著升高,说明肝脏细胞在受到活性氧刺激的过程中,细胞产生了适应性反应,从而提高了抗氧化的能力.另外,本研究还发现,急性酒精摄入引起肝脏细胞UCP2和HDMCPmRNA表达显著升高,线粒体P/O显著降低,说明引起了线粒体“质子漏”的加强,而这一解偶联作用可能会引起线粒体活性氧生成的降低.尽管急性酒精性肝损伤过程中应激性地引起线粒体MnSOD酶活性和表达增强,线粒体“质子漏”增加,但结果却显示肝脏细胞出现了明显的氧化损伤,这一结果似乎相互矛盾.其实,这一结果并不矛盾,线粒体是否发生氧化损伤并不完全决定于抗氧化能力的高低,而决定于活性氧的产生与抗氧化能力的平衡能力.当活性氧产生明显超过抗氧化系统所承受能力时,也会造成线粒体的氧化损伤.急性酒精性摄入过程中导致的线粒体氧化损伤即是这一矛盾的表现.
在急性酒精性肝损伤过程中,尽管抗氧化酶与解偶联作用增强均以降低线粒体氧化损伤为目的,但其结果却并不想同.UCP2和HDMCP以“温和”解偶联方式减少活性氧的产生是以损失一部分能量作代价的(“质子漏”增强).本研究发现线粒体ATP合成能力与UCP2和HDMCP表达水平相反,说明“温和”解偶联确实降低了线粒体ATP的合成.由此我们认为:线粒体的氧化损伤对线粒体更为致命,因此,线粒体不得不以损失一部分能量作代价,避免或减少活性氧的产生.但这一部分能量的损失对肝脏细胞有时也可能是致命的,ATP合成减少时,使肝脏细胞坏死的敏感性提高,如在缺血、能量需求剧增、应激等情况下,肝细胞得不到足够的ATP供应,从而引起肝细胞坏死[20].所以,在急性酒精性肝损伤过程中线粒体“温和”解偶作用是一把“双刃剑”,如何平衡线粒体能量供应与活性氧产生之间的平衡是问题的关键.
研究证实,耐力训练提高肝脏抗氧化能力[6],改善肝脏线粒体结构[7],逆转肝脏线粒体功能异常[8].运动训练可显著逆转酒精引起的抗氧化能力降低[9].本研究发现,经过12周无负重游泳训练后可以显著提高肝脏MnSOD酶的活性和mRNA的表达,与之相对应,P/O显著升高.我们之前的研究表明,耐力训练显著降低骨骼肌UCP3和心肌UCP2的表达[5, 15].本研究发现,经过12周的耐力训练后,肝脏UCP2和HDMCP表达显著降低,而再给予急性酒精摄入后,UCP2和HDMCP表达又显著升高,但与对照组相比无显著性差异,说明不管是在训练大鼠还是未训练大鼠中,急性酒精摄入均能引起UCP2和HDMCP表达的升高,而耐力训练后线粒体ATP合成能力显著提高,说明耐力训练引起了“温和”解偶联降低,减少线粒体质子漏(P/O升高),从而提高了线粒体ATP合成能力.结合上述结果我们认为:在急性酒精性肝损伤过程中,线粒体活性氧产生增加,进而刺激抗氧化酶(如MnSOD)活性与表达升高,但其升高依然不能足以全部清除线粒体产生的活性氧,为避免更严重的氧化损伤,肝脏线粒体通过 “温和”解偶联的方式减少活性氧的产生,但这一过程是以损失一部分能量作为代价,从而也给肝脏细胞正常状态的维持留下了隐患;耐力训练可以有效提高抗氧化酶的活性和含量,大大增强了肝脏细胞的抗氧化能力,因此,肝脏无需或部分通过“温和”解偶联的方式减少线粒体活性氧的生成,从而降低了这一抗氧化方式的能量损耗,增强了肝脏细胞ATP供给能力,也说明肝脏细胞中抗氧化酶是抗氧化的主体,而“温和”解偶联仅可能是一种辅助的、应急抗氧化手段.
4结论
耐力训练可以有效提高肝脏抗氧化能力,降低解偶联蛋白表达,从而提高肝脏线粒体能量合成能力,达到预防急性酒精性肝损伤的目的.
参考文献:
[1]Szabo G. Gut-liver axis in alcoholic liver disease[J]. Gastroenterology, 2015,148(1):30-36.
[2]Forgione A, Miele L, Cefalo C, et al. Alcoholic and nonalcoholic forms of fatty liver disease[J]. Minerva Gastroenterol Dietol, 2007,53(1):83-100.
[3]Lucey M R, Mathurin P, Morgan T R. Alcoholic hepatitis[J]. N Engl J Med, 2009,360(26):2758-2769.
[4]历有名. 酒精性肝病的流行病学特点[J]. 实用肝脏病杂志, 2012,15(3):180-182.
[5]Jiang N, Zhang G, Bo H, et al. Upregulation of uncoupling protein-3 in skeletal muscle during exercise: a potential antioxidant function[J]. Free Radic Biol Med, 2009,46(2):138-145.
[6]Lima F D, Stamm D N, Della-Pace I D, et al. Swimming training induces liver mitochondrial adaptations to oxidative stress in rats submitted to repeated exhaustive swimming bouts[J]. PLOS ONE, 2013,8(2):e55668.
[7]Goncalves I O, Passos E, Rocha-Rodrigues S, et al. Physical exercise prevents and mitigates non-alcoholic steatohepatitis-induced liver mitochondrial structural and bioenergetics impairments[J]. Mitochondrion, 2014,15:40-51.
[8]Goncalves I O, Oliveira P J, Ascensao A, et al. Exercise as a therapeutic tool to prevent mitochondrial degeneration in nonalcoholic steatohepatitis[J]. Eur J Clin Invest, 2013,43(11):1184-1194.
[9]Mallikarjuna K, Shanmugam K R, Nishanth K, et al. Alcohol-induced deterioration in primary antioxidant and glutathione family enzymes reversed by exercise training in the liver of old rats[J]. Alcohol, 2010,44(6):523-529.
[10]Ma G, Liu Y, Zhang Q, et al. Pre-endurance training prevents acute alcoholic liver injury in rats through the regulation of damaged mitochondria accumulation and mitophagy balance[J]. Hepatol Int, 2014,8(3):425-435.
[11]朱平生, 庞亚丽,王宇亮,等. 大鼠急性酒精性肝损伤模型的脂质过氧化损伤观察[J]. 中华中医药杂志, 2006,36(1):376-377.
[12]Estabrook R. Mitochondrial respiratory control and the polarographic measurement of ADP/O ratios[J]. Methods Enzymol, 1967,11(10):41-47.
[13]Mailloux R J, Harper M E. Uncoupling proteins and the control of mitochondrial reactive oxygen species production[J]. Free Radic Biol Med, 2011,51(6):1 106-1 115.
[14]Skulachev V P. Role of uncoupled and non-coupled oxidations in maintenance of safely low levels of oxygen and its one-electron reductants[J]. Q Rev Biophys, 1996,29(2):169-202.
[15]Bo H, Jiang N, Ma G, et al. Regulation of mitochondrial uncoupling respiration during exercise in rat heart:role of reactive oxygen species (ROS) and uncoupling protein 2[J]. Free Radic Biol Med, 2008,44(7):1 373-1 381.
[16]Donadelli M, Dando I, Dalla P E, et al. Mitochondrial uncoupling protein 2 and pancreatic cancer: A new potential target therapy[J]. World J Gastroenterol, 2015,21(11):3232-3238.
[17]Tan M G, Ooi L L, Aw S E, et al. Cloning and identification of hepatocellular carcinoma down-regulated mitochondrial carrier protein, a novel liver-specific uncoupling protein[J]. J Biol Chem, 2004,279(43):45 235-45 244.
[18]Jin X, Yang Y D, Chen K, et al. HDMCP uncouples yeast mitochondrial respiration and alleviates steatosis in L02 and hepG2 cells by decreasing ATP and H2O2 levels: a novel mechanism for NAFLD[J]. J Hepatol, 2009,50(5):1 019-1 028.
[19]Stewart S, Prince M, Bassendine M, et al. A randomized trial of antioxidant therapy alone or with corticosteroids in acute alcoholic hepatitis[J]. J Hepatol, 2007,47(2):277-283.
[20]Cortez-Pinto H, Yang S Q, Lin H Z, et al. Bacterial lipopolysaccharide induces uncoupling protein-2 expression in hepatocytes by a tumor necrosis factor-alpha-dependent mechanism[J]. Biochem Biophys Res Commun, 1998,251(1):313-319.
(编辑:姚佳良)
The effect of pr-endurance training on relationship between mitochondrial antioxidant ability and uncoupling function in alcohol-induced acute hepatic injury rats
SU Wen, LIU Yan-huan, WANG Man-zhuo, MA Guo-dong
(School of Physical Education, Shandong University of Technology, Zibo 255049, China)
Abstract:To investigate the effect of pre-endurance training on the relationship between mitochondrial antioxidant ability and uncoupling function in alcohol-induced acute hepatic injury rats. We analysised the expressions of UCP2,HDMCP and MnSOD mRNA, mitochondrial P/O, activities of MnSOD and ATP synthase in liver tissue in alcohol-induced acute hepatic injury rats after 12 week unload swimming training.Acute alcohol treatment resulted in increased mRNA expression of MnSOD,UCP2 and HDMCP but decreased P/O and ATP synthase activity.Compared with acute alcohol treatment of untrained rats, acute alcohol treatment of trained rats have lower expressions of UCP2 and HDMCP but higher P/O and mRNA expression of MnSOD. Pre-endurance training can increase liver antioxidant ability, decrease expression of uncoupling proteins, which increases liver mitochondrial ATP synthesis, and it achieves a prevention of acute alcohol-induced hepatic injury.
Key words:pr-endurance training; acute alcohol-induced hepatic injury; antioxidant ability; uncoupling function
收稿日期:2015-05-07
基金项目:山东理工大学青年学者支持计划(110026)
作者简介:苏文,女,940486722@qq.com;通信作者:马国栋,男,mgdtj@sina.com
文章编号:1672-6197(2016)05-0056-05
中图分类号:G804.2
文献标志码:A

