甲基紫精胁迫下杨树抗氧化能力
李新林++邹吉祥++高榕择++盛莉
摘 要:为了研究杨树在甲基紫精胁迫下的抗氧化能力,以小胡杨和吴屯杨叶片为材料,经甲基紫精胁迫后分别测定各叶片中叶绿素的含量。结果表明:在甲基紫精胁迫下吴屯杨的抗氧化能力、抗逆性比小胡杨的强。该研究可为研究杨树抗氧化机理提供依据。
关键词:甲基紫精;杨树;抗氧化能力
中图分类号:S792.11 文献标识码:A DOI 编码:10.3969/j.issn.1006-6500.2016.08.005
Abstract: Leaves of Populus simonii×P. euphratica and Populus wutunensis were selected as the materials to study the antioxidant capacity of poplar under methyl viologen stress, and the chlorophyll contents of the leaves were measured after methyl viologen stress. The results showed that the antioxidant capacity and resistance of Populus wutunensis was stronger than Populus simonii×P. euphratica under methyl viologen stress. This paper provided evidence for studying the antioxidant mechanism of poplar.
Key words:methyl viologen; Populus; antioxidant capacity
杨树(Populus),为杨柳科杨属植物落叶乔木的统称[1],是世界上分布最广、适应性最强的树种之一,因此,杨树是一种适合在盐碱或干旱地区栽种的树种,但因品种不同,适应性也不同。目前,对于杨树的研究主要集中于通过转基因的生物技术手段来培育杨树新品种,以及对杨树抗逆生理机制的研究。杨树正常生长时体内活性氧(ROS)的产生和清除处于一个动态平衡,不会对植物体造成伤害,但是在逆境胁迫条件下,这种平衡会被破坏,积累大量的ROS。ROS使其产物丙二醛增加,导致膜脂不饱和度降低、膜蛋白聚合和交联,使膜流动性降低、膜透性增加[2-3],ROS 还可以引起蛋白质功能损失,攻击核酸导致DNA 损伤和突变[4],并阻断DNA 复制和转录[5] , 造成细胞死亡或异常蛋白如热激蛋白的形成。
杨树主要利用抗氧化酶系统和抗氧化剂来清除ROS阻止氧化损伤。研究表明, 抗氧化酶类可能是植物抵抗氧化胁迫的关键因素。对于抗逆性、抗氧化能力的研究,目前大多数人通过盐胁迫的方式来测定不同种类杨树的抗逆性、抗氧化能力强度[6],从而筛选出抗氧化能力、抗逆性较强的品种。本研究通过甲基紫精对吴屯杨和小胡杨两种杨树品种的叶片进行氧化胁迫处理,测定吴屯杨与小胡杨叶片中叶绿素的含量,进而讨论甲基紫精对于杨树抗氧化能力的影响,为杨树的抗氧化机理研究提供依据。
1 材料和方法
1.1 试验材料
以大连民族大学温室旁种植的吴屯杨和小胡杨为试验材料,分别取长势一致的20株待发芽的树枝,高约60 cm,消毒后用霍格兰氏营养液于室内培养。
1.2 试验方法
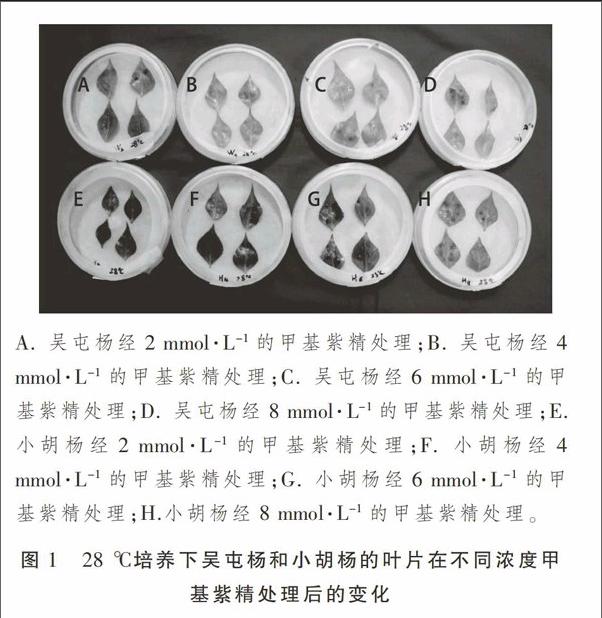
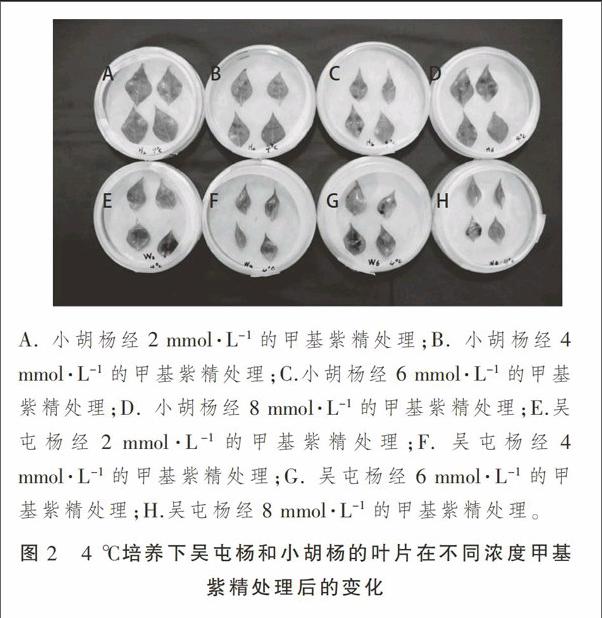
取吴屯杨和小胡杨枝条,分别在4,28 ℃条件下用水培法对两种杨树品种枝条进行水培发芽。在清洗干净的培养皿内放入经水湿润的滤纸,分别取不同条件处理的两种杨树侧芽顶端以下第3片叶子,清洗后正面向上整齐地摆放在培养皿中,每个培养皿放4片叶子,分别用浓度为2,4,6,8 mmol·L-1的甲基紫精对叶片进行滴定,每皿的右下角一片叶子滴清水做空白对照,每个处理重复3次,28 ℃光照培养24 h进行照相及叶绿素测定。
叶绿素含量测定方法:取28 ℃下培养的甲基紫精处理后的两种杨树叶片,用蒸馏水冲洗干净后用吸水纸吸干,称取0.1 g,剪成细丝,浸泡于乙醇∶丙酮∶水=4.5∶4.5∶1的浸提液中,45 ℃恒温12 h,利用分光光度计在663 nm和645 nm下测定其吸收值。利用公式:CA=12.7D663-2.59D645,CB=22.9D645-4.67D663,CA+B=20.3D645+8.04D663计算叶绿素浓度。根据稀释倍数利用公式:叶绿素含量=C×V×10/(A×1 000)计算叶绿素的含量,其中C为叶绿素浓度(mg·L-1) , V为提取液总体积(mL), A为叶片鲜质量。
1.3 数据处理方法
试验中所得数据用Excel软件整理后,采用spss22.0通过单因素分析法进行方差分析(ANOVE)。
2 结果与分析
2.1 甲基紫精对不同培养条件下两种杨树叶片的影响
从图1可以发现,随着甲基紫精的处理浓度增大叶片受损程度逐渐增大,28 ℃培养下的吴屯杨和小胡杨叶片在不同浓度甲基紫精处理下均出现褐色斑点,吴屯杨叶片在低浓度甲基紫精处理下褐斑颜色较浅,相比小胡杨受损程度较轻,说明28 ℃培养下吴屯杨的抗氧化能力比小胡杨强。
从图2可以看出,4 ℃培养下的吴屯杨和小胡杨叶片随着甲基紫精的处理浓度增大叶片受损程度逐渐增大,吴屯杨相比小胡杨的叶片受损程度较轻,说明4 ℃培养下吴屯杨的抗氧化能力比小胡杨强。28 ℃和4 ℃条件下培养的吴屯杨叶片分别经2,4,6,8 mmol·L-1甲基紫精处理,28 ℃的叶片受损程度与4 ℃叶片受损程度相差不大,说明吴屯杨在28 ℃和4 ℃下抗氧化能力基本相同。将4 ℃和28 ℃培养下的小胡杨叶片分别经2,4,6,8 mmol·L-1甲基紫精处理,28 ℃培养下的小胡杨和4 ℃培养下小胡杨叶片受损程度无明显差异,初步说明两种杨树分别在28 ℃和4 ℃下抗氧化能力无明显差异。
2.2 甲基紫精处理下小胡杨和吴屯杨叶绿素的含量
试验中测得甲基紫精处理24 h后小胡杨的叶绿素a含量为0.138 mg·g-1,叶绿素b含量为0.967 mg·g-1,总叶绿素含量为1.226 mg·g-1;吴屯杨的叶绿素a含量为0.136 mg·g-1,叶绿素b含量为1.005 mg·g-1,总叶绿素含量为1.258 mg·g-1,吴屯杨总叶绿素含量高于小胡杨,说明吴屯杨的抗氧化能力比小胡杨强。
3 结论与讨论
植物生长在正常环境下时,其体内代谢有条不紊地进行着,当植物受到逆境胁迫时其主要特征是活性氧代谢失调,从而引发抗氧化酶系统发挥作用,抗氧化酶能加快对活性氧的清除,以维持植物体稳态[7-8]。不同植物的抗氧化能力与抗逆性不同,当植物长期处于甲基紫精胁迫下,植物叶片光合色素降解,光合作用削弱,植物生长阻止[9-10],并且植物细胞遭受氧化损伤,导致一系列代谢变化。在甲基紫精处理下对小胡杨和吴屯杨的抗氧化能力进行对比,不同浓度的甲基紫精对杨树叶片损伤程度不同,本研究分别采用2,4,6,8 mmol·L-1甲基紫精对杨树叶片上表面进行滴定,发现在相同条件处理下的吴屯杨受损程度都比小胡杨低,初步说明吴屯杨的抗氧化能力比小胡杨的强。
叶绿素是一种重要的光合色素,构成光系统和光系统反应的中心[11]。叶绿素的含量处于合成与降解的动态平衡[12-15],氧化胁迫可影响叶绿素含量的变化。植物体内叶绿体类囊体膜上的电子传递链是产生活性氧较活跃的部位,产生的超氧离子形成H2O2对植物产生伤害[16]。目前,氧化胁迫通常用甲基紫精作为内源诱导物,本研究通过甲基紫精处理不同条件培养下的两种杨树叶片,发现两种杨树的叶绿素含量均处于较低水平,且吴屯杨的叶绿素含量比小胡杨的高,说明甲基紫精对小胡杨叶绿素的合成有较大影响。因此,可得出吴屯杨的抗氧化能力比小胡杨强。
参考文献 :
[1]王俊.浅谈杨树病害防治技术[J].现代园艺,2012 (14):140.
[2]陈少欲.膜脂过氧化对植物细胞的伤害[J].植物生理学通讯,1991,27(2):84-90.
[3]WANG H Z,MA J,LI X Y,et al.Effects of water stress on active Oxygen Generation and protection system in rice during grain filling stage[J].Scientia Agricultural Sinica,2007,40(7):1379-1387.
[4]IMLAY J A,LINN S.DNA damage and Oxygen radical toxicity[J].Science,1988,240(4857):1302-1309.
[5]BYRD S,REINS D,DOETSCH P W.Effects of oxidative DNA damage on transcription by RNA polymerases[J].Free radical biology & medicine,1990,9(1):47-57.
[6]姜国斌,丁丽娜,金华,等.盐胁迫对杨树幼苗叶片光合特性及叶绿素荧光参数的影响[J].辽宁林业科技,2007 (1):20-23, 43.
[7]LIU J C,ZHONG Z C,HE Y J.Effects of drought stress and re-watering on the active Oxygen scavenging system of Cupressus funebris seedlings in Karst area[J].The Journal of Applied Ecology, 2011,22(11):2836-2840.
[8] XU Q Z ,HUANG B R . Antioxidant metabolism associated with summer leaf senescence and quality decline for creeping bentgrass[J].Crop Science,2004,44:553-560.
[9]GOGORCENA Y,LARBI A,ANDALUZ S,et al.Effects of cadmium on cork oak (Quercus suber L.) plants grown in hydroponics[J].Tree Physiology,2011,31(12):1401-1412.
[10]MOHAMED A A,CASTAGNA A,RANIERI A,et al.Cadmium tolerance in Brassica juncea roots and shoots is affected by antioxidant status and phytochelatin biosynthesis[J].Plant Physiology and Biochemistry,2012,57:15-22.
[11] CHEESEMA J M. Mechanism of salinity tolerance in plants[J].Plant Physiology,1988,87: 547-550.
[12]张景云,缪南生,白雅梅,等.盐胁迫下二倍体马铃薯叶绿素含量和抗氧化酶活性的变化[J].作物杂志,2014 (5):59-63.
[13]朱敏嘉,栾彩霞,韩普,等.萘乙酸与乙草胺混用对谷子叶绿素含量及保护酶活性的影响[J].山西农业科学,2014,42(2):129-131.
[14]李春雷.氯胁迫对幼龄茶树叶绿素含量及抗氧化系统的影响[J].河南农业科学,2014 (9):56-59, 65.
[15]伍钧,付婷婷,郑超,等.Pb胁迫下氮素形态对日本毛连菜生物量、叶绿素含量及抗氧化酶活性的影响[J].华北农学报,2015 (1):213-218.
[16] 周玮, 张荣铣, 李瑞, 等. 不同甲基紫精诱导离体水稻叶片氧化胁迫方法的研究[J].安徽农业科学, 2007,35(32):10314-10315.

