小肝癌合并脾功能亢进的微创治疗的方法探讨
曾新桃,罗 华,张 伟,陈 熙,郭道宁,杨 培绵阳市中心医院肝胆外科,四川 绵阳 621000
小肝癌合并脾功能亢进的微创治疗的方法探讨
曾新桃,罗 华,张 伟,陈 熙,郭道宁,杨 培
绵阳市中心医院肝胆外科,四川 绵阳 621000
[摘要]背景与目的:肝癌切除、脾切除是目前治疗肝癌合并脾功能亢进的主要手段,但传统开腹手术创伤大。本研究探讨肝癌射频消融(radiofrequency ablation,RFA)联合腹腔镜脾切除(laparoscopic splenectomy,LS)治疗小肝癌合并脾功能亢进的安全性及可行性。方法:27例肝癌(直径<3 cm)合并脾功能亢进患者,在全麻下行RFA及LS,分析其临床资料。结果:中转开腹脾切除1例,中转为手助腹腔镜脾切除2例,RFA治疗肝脏肿瘤31个。术中出血量110~900 mL,中位出血量320 mL,手术时间72~127 min,中位手术时间107 min;腹壁皮下广泛气肿1例,术后2 d吸收;术后胰漏1例,经保守治疗治愈;术后腹腔大出血1例,再次开腹手术止血,恢复良好;腹水9例,经补充白蛋白和利尿等治疗,腹水消退;无死亡病例。结论:经选择的病例,RFA联合LS治疗小肝癌合并脾功能亢进微创、安全、可行。
[关键词]小肝癌;超声造影;腹腔镜脾切除;射频消融术
乙型病毒性肝炎、肝硬化和原发性肝癌通常被认为是肝癌发生的三部曲,约80%的原发性肝癌患者合并肝硬化,其中合并脾功能亢进者约占30%。由于加强对乙肝、丙肝患者的
Correspondence to: YANG Pei E-mail: yppppy@126.com
1 资料和方法
1.1 一般资料
2003年1月—2014年1月,绵阳市中心医院肝胆外科小肝癌(单个病灶直径<3 cm或2个病灶直径之和<3 cm)合并脾功能亢进患者27例。术前常规进行血液常规、骨髓穿刺、胃镜、彩超、增强CT或MRI、ICG R15测定和肿瘤标志物等检查明确诊断。因穿刺活检可能引起针道转移,所以术前一般不进行肿瘤穿刺活检(如病变性质难以明确,术中行穿刺活检),27例患者均合并不同程度肝硬化,合并慢性结石性胆囊炎2例,胆囊息肉(息肉直径1 cm)1例。所有患者无严重心肺疾病,无远处转移,无上消化道出血病史或有上消化道出血已行内镜下套扎治疗,脾功能亢进明显(WBC<3×109/L,PLT<50×109/L)。27例患者一般情况见表1、2。
如患者术前凝血功能明显异常,予以积极处理。处理方法包括:① 维生素K130~40 mg/d,静脉滴注;② 每天输注同型新鲜冰冻血浆200 mL(当血红蛋白<80 g/L时输注悬浮红细胞);③ 予以异甘草酸镁、甘利欣等保肝治疗;④ 输注纤维蛋白原及凝血酶原复合物;⑤ 冷沉淀输注等。
肝功能明显异常(Child-Pugh C),经积极抗病毒补充蛋白和保肝等治疗后,肝功能恢复为Child-Pugh B或A级,腹水基本消退后方能手术。
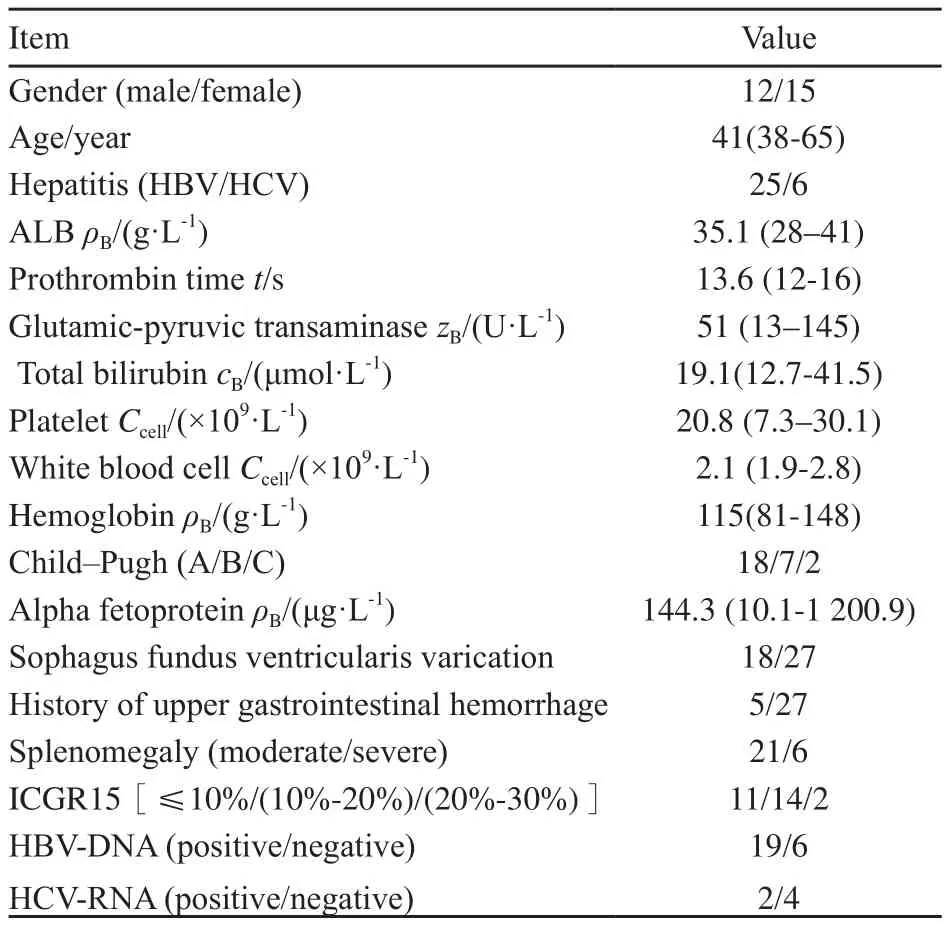
表1 患者一般情况Tab.1 General conditions of patients

表2 肝脏肿瘤分布情况Tab.2 Distribution of liver cancer
1.2 方法
1.2.1 肝癌RFA
超声检查,寻及肿瘤病灶,向瘤体插入射频针,RFA治疗,初始能量从20 W开始,逐渐加大功率,当肿瘤组织固化到一定程度后,阻抗上升,同时能量下降并自动停止,完成1次治疗。根据肿瘤大小决定治疗次数。射频治疗结束,行超声造影,病灶内部回声不均匀,并可见低回声区,无强化。
1.2.2 腹腔镜脾切除术
全麻后,取分腿、头高、足低15°仰卧位,根据需要左右倾斜。术者位于患者两腿之间,扶镜助手位于患者右侧,第1助手位于患者左侧。采用4孔法,于患者脐下缘穿刺建立气腹,气腹压力为12~14 mmHg,置入腹腔镜,观察患者腹腔有无转移病灶,注意肝脏大小、质地、表面结节、脾脏大小、有无副脾和脾与周围粘连等情况。根据脾脏大小确定操作孔位置,但一般左锁骨中线与脐水平线交点为主操作孔(12 mm Trocar),左腋前线与脐水平线交点、剑突与脐中点作为辅助操作孔(5 mm Trocar)。沿胃大弯以超声刀切开脾胃韧带至脾上极,注意胃短静脉处理,必要时用可吸收夹夹闭,勿损伤胃及脾脏。于胰腺上缘寻及脾动脉,用超声刀切开腹膜和脾动脉鞘膜,游离脾动脉后用可吸收夹双重夹闭并切断。此时可输血小板。待脾脏血液经脾静脉充分回流后,寻及脾静脉,以2-0慕丝线双重结扎脾静脉近端,远端结扎1次,予以切断。调整患者的体位为头高足低、右倾位,托起脾脏,超声刀分离切断脾周韧带,紧贴脾门,锐顿结合分离,注意保护胰腺尾部,切除脾脏,将脾脏装入塑料袋,夹碎后取出,脾窝留置引流管。
合并胆囊结石及胆囊息肉患者,胆囊切除一般最后进行,多采用顺逆结合的方法。
2 结 果
2.手术情况
腹腔镜胆囊切除3例,均未施行贲门周围血管离断术,术中及术后情况见表3。
2.2 术后情况
所有患者均未出现胃肠道损伤、膈肌损伤、肝肾功能衰竭等严重并发症,术前及术后肝功能见表4。1例女性患者出现广泛皮下气肿,术后予以吸氧,监测动脉血气变化,患者术后2 d气肿完全吸收。术后胰漏1例,考虑胰尾损伤,经禁食、抑酸、抑酶和支持等治疗,术后11 d,引流量为0 mL,复查彩超未见积液,拔出脾窝引流管治愈。术后腹腔大出血1例,再次开腹手术止血,发现胰尾附近一小动脉活动性出血,腹膜后亦有渗血,以3-0 Prolene线缝合后腹膜及出血点,术后出血停止,予以补充新鲜冰冻血浆及悬浮红细胞,恢复良好出院。腹水9例,经积极补充白蛋白、利尿和保肝等治疗,腹水消退。无死亡病例。彩超发现门静脉血栓3例,予以皮下注射低分子肝素钠和口服肠溶阿司匹林治疗,监测血栓无增大。左侧胸腔积液(>500 mL)5例,予以穿刺引流治愈。术后1个月复查甲胎蛋白较术前明显下降,差异有统计学意义(P<0.05)。HBV-DNA及HCVRNA>5.00E+2的患者常规予以抗病毒治疗。

表3 术中及术后情况Tab.3 Itraoperative and postoprative conditions
2.3 随访
术后中位随访时间为37个月(6~112个月)。术后1个月复查彩超并行超声造影,观察病灶情况,每3个月复查CT,动态监测甲胎蛋白、肝功能、HBV-DNA及HCV-RNA变化,指导患者抗病毒治疗,提高抗病毒治疗依从性。失访2例。随访发现肝内转移7例,肺部转移1例,因上消化道出血死亡2例,肝功能衰竭死亡4例,死于心肌梗死1例。对于复发性肝癌,一般采取手术切除、经皮RFA和TACE等方法处理。
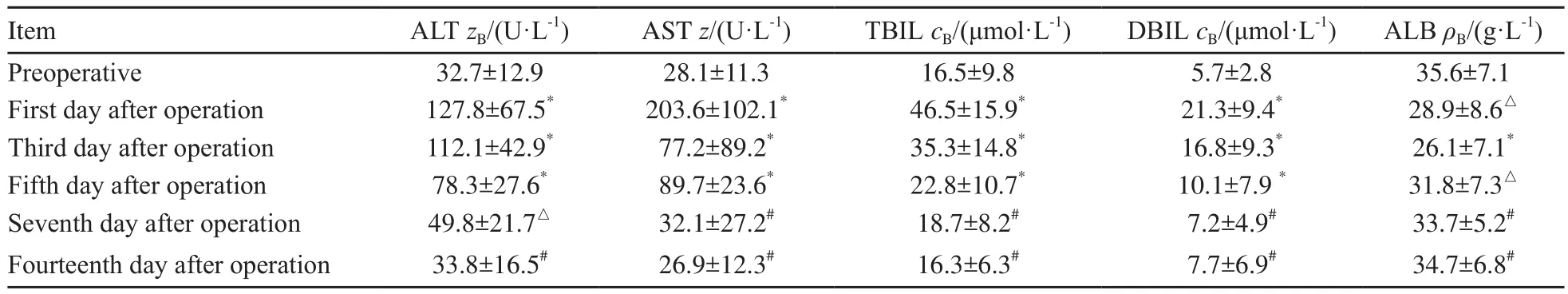
表4 术前及术后肝功能变化Tab.4 Change of liver function in preoperation and postoperation
3 讨 论
术前充分准备,科学的围手术期处理是手术成功的前提。Child-Pugh C级属于手术禁忌证,经积极治疗后,部分患者重新获得手术机会。术前影像学检查有利于评估肿瘤位置、大小、数目、比邻、脾脏长大方向、脾门血管情况及胰尾与脾门关系等,对于手术方式的选择极为重要。术前我们一般不对病灶进行穿刺活检,因为穿刺活检可能会导致种植转移。对于性质不明确的肝脏病变,根据患者的具体情况,采取积极手术治疗的态度。
脾脏是人体重要的免疫器官,有抑制肿瘤和清除病原菌等作用。对于肝癌合并脾功能亢进患者一期切除脾脏是否可行,多数学者认为切除脾脏可能减轻和延缓肝硬化的程度和进程[3];脾切除术后门静脉血流减少20%~30%,门静脉压力降低,减少了消化道大出血的概率[4];而且脾脏对肿瘤的免疫调节存在双向性,脾切除术后,可能增强机体抗肿瘤的能力,实践证明,切除脾脏后并未增加肿瘤复发率及感染率,并可能延长患者的累及生存率及无瘤生存率[5]。
自1991年首例腹腔镜脾切除术成功实施以来,因其具有出血少、术后并发症发生率低和术后恢复快等优点,在国内外广泛开展,常用于治疗脾脏良恶性疾病及脾功能亢进[6-7]。LS术中及术后出血仍是术者较为关心的问题之一,血小板减少及凝血功能差可能会导致术中和术后大出血;然而Wu等[8]认为,即使血小板<20×109/L,脾切除也可安全实施。当然,如果血小板明显减少,在脾动脉结扎后输注血小板,也是一种有效减少术后出血风险的方法。美国麻醉学会(American Society of Anesthesiology,ASA)评分及脾脏大小是术后严重并发症发生的2个独立危险因素[9],如术中出血难以控制和术野暴露困难,实时采用手助腹腔镜或开腹手术有利于手术操作,减少术后并发症。
对于符合米兰标准的肝癌,行肝移植手术是目前最有效的治疗措施,肝移植不仅能全部切除肝脏肿瘤及潜在的子灶,还能去除硬化的肝脏,从而预防肝癌的复发。新型免疫抑制剂的问世,使得肝癌肝移植患者长期生存率明显改善,5年生存率超过70%[10],但供体肝短缺及费用高昂等因素一直制约着肝移植的发展。肝癌多在肝硬化基础上发展而来,常合并脾功能亢进、凝血功能异常、腹壁静脉曲张及脐静脉开放等情况,制约肝癌手术的实施。脾脏与肝脏位于上腹部左右两侧,采用传统手术方法治疗肝癌合并脾功能亢进多需采用上腹部“屋顶样”切口,创伤大,出血多,手术切断了肝圆韧带内的脐静脉,术后门脉压力增大,增加了术后消化道出血的风险。部分肝癌位置深在,采用手术切除的方式可能导致更多有功能的肝脏组织丧失及大量失血,术后肝功能衰竭发生率增加,而且输血可能促进肿瘤的复发与转移。近年来,采用射频消融术治疗小肝癌被证明安全有效[2,11],尤其适用于位置深在的病变。我们在RFA术中常规行超声造影(contrastenhanced ultrasound,CEUS),防止肿瘤RFA治疗不完全。实践证明,CEUS能改善RFA治疗恶性肿瘤的效果[12]。如果病变临近胆囊和胃肠道,可在腹腔镜下切除胆囊,纱布将胃肠隔开,以利于RFA治疗的实施,如肿瘤位于肝脏边缘,我们通常采用腹腔镜下手术切除的方式进行治疗。
综上所述,选取合适病例,开展RFA联合LS治疗小肝癌合并脾功能亢进具有微创、安全、有效的优点。但本研究为回顾性研究,继续施行更多的前瞻性的随机对照研究是必要的。
[参 考 文 献]
[1]IKAI I, ARII S, OKAZAKI M, et al.Report of the 17th nationwide follow-up survey of primary liver cancer in Japan [J].Hepatol Res, 2007, 37(9): 676-691.
[2]FANG Y, CHEN W, LIANG X, et al.Comparison of long-term effectiveness and complications of radiofrequency ablation with hepatectomy for small hepatocellular carcinoma[J].J Gastroenterol Hepatol, 2014, 29(1): 193-200.
[3]COPE C, BAUM R A, HASKAL Z J.Balloon occlusion portography to diagnose new-onset left hepatic vein thrombosis and widening of an existing Wallstent TIPS by Palmaz stents for recurrent portal hypertension and variceal bleeding[J].1996, 19(5): 368-370.
[4]LACERDA C M, FREIRE W, VIEIRA D E, et al.Splenectomy and ligation of the left gastric vein in schistosomiasis mansoni:the effect on esophageal variceal pressure measured by a noninvasive techniques[J].Keio J Med, 2002, 51(2): 89-92.
[5]LI C, ZHAO H, ZHAO J, et al.Prognosis of patients with hepatocellular carcinoma and hypersplenism after surgery:a single-center experience from the People’s Republic of China[J].Onco Targets Ther, 2014, 7: 957-964.
[6]CHEN J, MA R, YANG S, et al.Perioperative outcomes of laparoscopic versus open splenectomy for nontraumatic diseases: a meta-analysis[J].Chin Med J, 2014, 127(13):2504-2510.
[7]CAI Y, LIU X, PENG B.A novel method for laparoscopic splenectomy in the setting of hypersplenism secondary to liver cirrhosis: ten years’ experiences[J].Wold J Surg, 2014,38(11): 2934-2939.
[8]WU Z, ZHOU J, LI J, et al.The feasibility of laparoscopic splenectomy for ITP patients without preoperative platele transfusion[J].Hepatogastroenterology, 2012, 59(113): 81-85.
[9]WANG X, LI Y, CROOK N, et al.Laparoscopic splenectomy:a surgeon’s experience of 302 patients with analysis of postoperative complications[J].Surg Endosc, 2013, 27(10):3564-3571.
[10]XU XS, LIU C, QU K, et al.Liver transplantation versus liver resection for hepatocellular carcinoma: a meta-analysiss[J].China Hepatobiliary Pancreat Dis Int, 2014, 13(3): 234-241.
[11]PENG Z W, LIU F R, YE S, et al.Radiofrequency ablation versus open hepatic resection for elderly patients (> 65 years)with very early or early hepatocellular carcinomas[J].Cancer, 2013, 119(21): 3812-3820.
[12]DONG Y, WANG W P, GAN Y H, et al.Radiofrequency ablation guided by contrast-enhanced ultrasound for hepatic malignancies: preliminary results[J].Clin Radiol, 2014,69(11): 1129-1135.
Radiofrequency ablation and laparoscopic splenectomy for the treatment of small hepatocellular carcinoma with hypersplenism
ZENG Xintao, LUO Hua, ZHANG Wei, CHEN Xi, GUO Daoning,YANG Pei (Department of Hepatobiliary Surgery, Mianyang Central Hospital, Mianyang 621000, Sichuan Province, China)
[Key words]Small hepatocellular carcinoma; Contrast-enhanced ultrasound; Laparoscopic splenectomy;Radiofrequency ablation随访,以及新的肿瘤标志物和影像学检查的出现,小肝癌的诊断率越来越高。在对日本肝癌患者的17次全国大普查中,小肝癌的诊断率为57.4%[1]。射频消融(radiofrequency ablation,RFA)是近年来治疗小肝癌的有效措施。有研究显示,对于直径<3 cm的肝癌,手术切除与RFA在复发率及长期生存率方面差异无统计学意义,但RFA术后并发症发生率更低、住院时间更短[2]。肝癌合并脾功能亢进的治疗以肝癌为中心,但是,脾功能亢进又制约肝癌手术的进行,影响肝癌患者的预后。腹腔镜脾切除(laparoscopic splenectomy,LS)联合RFA治疗小肝癌合并脾功能亢进鲜有报道,本文重点讨论其可行性及安全性。
[Abstract]Background and purpose: Liver cancer resection and splenectomy are the main methods to treat hepatocellular carcinoma and hypersplenism.The aim of this study was to discuss the safety and feasibility of simultaneous radiofrequency ablation (RFA) and laparoscopic splenectomy (LS) for the treatment of small hepatocellular carcinoma with hypersplenism.Methods: Twenty-seven patients with small hepatocellular carcinoma and cirrhotic hypersplenism underwent RFA and LS.The clinical data were also analyzed.Results: The surgery was converted to an open surgery in 1 patient, while laparoscopic splenectomy in a hand-assisted manner was performed in 2 patients.There were 31 liver tumors treated with RFA.Blood loss were 110-900 mL (mean=320 mL).Operation time were 72-127 min (mean=107 min).Subcutaneous emphysema occurred in 1 patient, and pancreatic leakage in another patient.Nine patients developed ascites.one patient suffered from massive haemorrhage, and emergency operation was adopted to stop bleeding.This patient recovered well after operation.No death was found during the hospitalization.Conclusion: Combining RFA with LS for the treatment of liver cancer and hypersplenism is minimally invasive, safe,and feasible.
DOI:10.3969/j.issn.1007-3969.2016.02.010
中图分类号:R735.7
文献标志码:A
文章编号:1007-3639(2016)02-0177-05
通信作者:杨培 E-mail:yppppy@126.com
收稿日期:(2014-09-22 修回日期:2015-06-18)

