PET-CT用于评价食管鳞癌放疗中18F-FDG高摄取区域的空间动态变化的前瞻性研究
刘 琪,余 雯,蔡旭伟,朱正飞,傅小龙,.复旦大学附属肿瘤医院放射治疗中心,复旦大学上海医学院肿瘤学系,上海 0003;.上海交通大学附属胸科医院放疗科,上海00030
PET-CT用于评价食管鳞癌放疗中18F-FDG高摄取区域的空间动态变化的前瞻性研究
刘 琪1,余 雯2,蔡旭伟1,朱正飞1,傅小龙1,2
1.复旦大学附属肿瘤医院放射治疗中心,复旦大学上海医学院肿瘤学系,上海 200032;2.上海交通大学附属胸科医院放疗科,上海200030
[摘要]背景与目的:放疗为食管癌重要的治疗方式之一,但疗效并不理想。目前认为肿瘤在PET-CT上高摄取的区域可能与放射抵抗有关。本文通过观察放疗前和放疗中两次PET-CT所显示的食管原发病灶18F-FDG高摄取区域的空间位置关系,从而推测依据放疗前的PET图像上所显示的食管癌原发灶高18F-FDG摄取的信息进行区域选择性加量放疗的可行性。方法:入组2011—2013年在复旦大学附属肿瘤医院放疗科接受同步放化疗治疗的初治食管鳞癌患者。所有患者在放疗前和放疗40 Gy时(第2次同步化疗前)分别行18F-FDG PET-CT扫描。在第1次PET图像上原发灶勾画首先以标准摄取值(standard uptake value,SUV)=2.5、5和40%~70%SUVmax-pre为阈值在PET图像上自动勾画得到大体肿瘤体积(gross tumor volume,GTV)2.5pre、GTV5pre、GTV40%pre、GTV50%pre、GTV60%pre和GTV70%pre。在第2次PET图像上,以SUV=2.5和70%~90%SUVmax-dur为阈值勾画得到GTV2.5dur、GTV70%dur、GTV80%dur和GTV90%dur。计算两次PET图像上以阈值自动勾画的区域的空间交集分数(overlap fraction,OF),即两个感兴趣区(region of interest,ROI)的交集的体积与两个ROI相对较小的体积的比值。结果:共入组22例患者。所有患者的原发灶SUVmax、SUVmean均有显著下降(P=0.003和P<0.0001)。残留高摄取区域与治疗前GTV50%pre的OF达到70%以上,其中热点区域GTV90%dur完全处于原发灶的高摄取区域内,OF达到100%。以不同阈值勾画的体积有很大差异,而放疗前和放疗中的食管癌原发灶高代谢区域尽管体积变化很大,但空间位置保持相对的稳定。结论:放疗中食管鳞癌原发灶的SUV显著下降,但食管癌原发灶残留的18F-FDG高摄取区域仍然较稳定的落在治疗前原发灶GTV及治疗前PET上所显示的18F-FDG高摄取区域内,提示依据治疗前PET图像来选择性对食管癌原发病灶的部分区域进行局部加量放疗是可行的。
[关键词]食管癌;放疗;PET-CT
Correspondence to: FU Xiaolong E-mail: xlfu1964@hotmail.com
食管癌是常见恶性肿瘤之一,根治性放化疗是局部晚期食管癌标准治疗方式。但是据报道采用50.4 Gy的剂量进行放疗后,仍然有90%的局部失败发生在照射野内[1]。基于调强放疗的同期加量放疗(simultaneous integrated boost-intensity modulated radiation therapy,SIB-IMRT)可对原发灶区域给予高剂量照射同时亚临床灶或选择性治疗区予以较低剂量的照射,理论上不仅可获得良好的靶区适形度,减少加量区周围高剂量的范围,更好地保护危及器官[2],而且从生物学角度有可能减少肿瘤克隆源细胞的加速再增殖,并显示出更好的肿瘤控制率。SIB-IMRT在头颈、乳腺肿瘤的应用中均显示了一定的优势[3-4]。而来自于美国MD Anderson癌症中心的资料显示,对食管癌病灶大体肿瘤体积(gross tumor volume,GTV)以SIB-IMRT技术设计放疗计划,对比常规的2D-CRT和调强放疗技术,GTV的处方剂量提高28%(64.8 Gy vs 50.4 Gy),但心脏、肺、肝脏和脊髓的受照射剂量均有所降低[5]。
复旦大学附属肿瘤医院放射治疗中心自2007年起开展一项Ⅱ期临床研究,对局部晚期食管鳞癌患者采用SIB-IMRT技术进行总剂量为计划靶体积(planning target volume,PTV)-G 63 Gy/28次、PTV-C 50.4 Gy/28次的放疗,前期的结果显示出较好的局部控制率及较低不良反应发生率[6]。但目前该照射技术并未在临床大规模开展,原因可能是担心提高局部照射剂量会增加食管穿孔等并发症的发生风险。根据既往的研究,肿瘤内部可能存在异质性,即便是放疗加量,也不意味着GTV内所有区域都要接受同样高剂量的照射。从现有的放疗剂量投照实施看,依据一定肿瘤生物学特性而实施不同剂量分布完全可能。Meijer等[7]报道在原发灶18F-FDG高代谢区域内依据标准摄取值(standard uptake value,SUV)阈值或依据同质像素点的数目等方式来确定加量区域都是可行的,周围型的肺癌病灶最高可加量至130 Gy,且可能提高局部控制率。已有报道显示,在非小细胞肺癌放疗过程中,18F-FDG高摄取区域即使体积和SUV有显著变化,但仍保持空间的相对稳定性[8]。但对于食管癌由于尚无此类研究开展,因此对18F-FDG高摄取区域行局部选择性加量放疗仍只存在理论性可能。此外,在放疗过程中食管癌原发灶的生物代谢信息会发生怎样的变化,是否可为局部的放疗加量提供更多的信息也仍不明确。本研究是一项前瞻性研究,旨在通过观察患者经过一定剂量的放疗后,食管原发灶的高摄取区域的空间位置及生物代谢特征的变化,来验证对食管癌依据18F-FDG PET-CT信息来实施局部加量的可行性。
1 资料和方法
1.1 研究对象
入组条件包括:① 食管镜病理确诊为鳞癌,食管钡餐检查支持食管癌诊断;② 治疗前未接受放化疗;③ 分期检查无远处转移;④放疗开始前和放疗第20次时愿意接受18F-FDG PET-CT检查;⑤ 放疗前均进行了评估,包括病史、体检、实验室检查、胸部X线片和心电图等;⑥ 患者治疗前至少可进半流质饮食,KPS评分>70,无糖尿病、肺部感染性疾病,无严重心、肝、肾疾病和肿瘤治疗史。排除条件包括:① 患者未完成预定放疗;② 治疗过程中出现远处转移。
1.2 治疗
所有患者接受同步放化疗,在模拟机下进行定位设野,行逆向调强技术等中心照射。放疗靶区定义GTV必须包括原发灶及与原发灶分界不清的邻近转移淋巴结,临床靶体积(clinical target volume,CTV)为食管癌GTV上下各外放2 cm及双侧锁骨上、上纵隔淋巴结引流区,PTV-G为GTV均匀外放1 cm,PTV-C为CTV均匀外放0.5 cm,手动修正PTV外界至皮缘内0.5 cm并避开脊髓。靶区勾画必须参考PET-CT和定位CT的信息。PTV-G放疗分次剂量为2.25 Gy,PTV-C分次剂量为1.8 Gy,总照射次数为28次,PTV-G达到总照射剂量63 Gy,PTV-C剂量为50.4 Gy。同步化疗开始于放疗第1、28天,接受2个疗程PF方案化疗。巩固化疗最早开始于放疗结束后1个月,化疗均不超过4个疗程。
1.3 PET-CT扫描
所有患者均于放疗前及放疗20次时行18F-FDG PET-CT检查,第1次为分期诊断需要做全身检查,第2次为颈胸段局部PET-CT扫描。患者在检查前禁食6 h以上,静脉注射7.4 MBq/kg(0.2 mCi/kg)18F-FDG,静卧l h后以德国Siemens公司的BIOGRAPH SENSASTION 16HR PET-CT机扫描。患者睡全碳素平板床,仰卧位,双手抱肘置于前额,常规全身扫描范围自颅底至股骨中段,颈胸段局部扫描范围为颅底至横膈下。在FOV(视野)中心X、Y、Z轴方向(以视野内左右方向为X轴,上下向为Y轴,扫描轴向为Z轴)上的空间分辨率分别为4.1、4.2和4.7 mm。CT扫描采用120 mA、120 kV,扫描层厚5 mm,重建层厚5 mm,并用于PET图像衰减校正。PET扫描轴向野每个床位16.2 cm,采集时间2 min/床位,三维采集。PET图像采用CT图像进行衰减校正,有序子集最大期望值法进行迭代重建,4次迭代,8个子集,重建FOV 700 mm,矩阵168×168,像素大小为4.1 mm×4.1 mm× 4.7 mm,平滑滤波的半高宽为5 mm。
1.4 PET-CT图像信息评价
将PET-CT扫描图像传至图像处理软件工作站行感兴趣区(region of interest,ROI)勾画及图像分析。首先采用刚性融合的方法将每个患者2次的PET-CT图像进行融合,解剖标志差异较大时以食管的配准为基本要求,以放疗前的PET作为主要图像,以放疗20次的PET作为次要图像。经患者的身高和体表面积等标化过的SUV值可由软件自动获得,在第1次PET图像上原发灶勾画首先以SUV=2.5、5和40%~70%SUVmax-pre为阈值在PET图像上自动勾画得到GTV2.5pre、GTV5pre、GTV40%pre、GTV50%pre、GTV60%pre和GTV70%pre。各ROI均手动修除可能包括的心脏、肺和正常食管等组织,再参考CT图像手工修正食管边界。在第2次PET图像上,以SUV=2.5 和70%~90%SUVmax-dur为阈值勾画得GTV2.5dur、GTV70%dur、GTV80%dur和GTV90%dur。按照放疗射野,CTVpre定义为食管PTV-C扣除PTV-G的部分,即PTV-G上下接受了预防剂量50.4 Gy照射的食管亚临床病灶。由于残余病灶的确定并无依据,以CTVpre的SUV值作为参考依据了解正常食管接受照射后的生物代谢变化情况。在第2次PET图像上因急性放射性食管炎引起的病灶附近管壁水肿增厚、FDG代谢增高难以同病灶区分,包括在勾画靶区内。利用软件自动读取各ROI的SUVmax和生物代谢体积(metabolic tumor volume,MTV)等信息。所有患者观察两次PET图像上食管原发灶ROI的SUV及MTV的变化情况。空间位置验证采用如下方法计算:空间交集分数(overlap fraction,OF)定义为两个ROI的交集的体积与两个ROI相对较小的体积的比值,以百分数表示。若OF=1认为两个ROI达到空间位置的吻合。计算A与B的OF公式为:
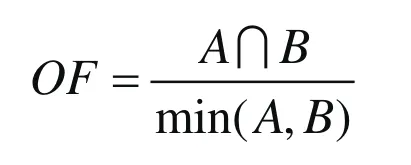
1.5 统计学处理
采用SPSS 13.0软件分析数据。所有基线特征采用一般统计描述。均值以x±95%CI表示。采用双侧检验。P<0.05为差异有统计学意义。
2 结 果
2011年4月—2013年12月共22例患者符合入组条件纳入研究。所有患者全部进行了根治性放疗,PTV-G放疗总剂量为63 Gy,分割剂量为2.25 Gy,中位治疗时间为39 d。除3例因Ⅳ度骨髓抑制未进行第2个疗程同步化疗外,其余19例患者均在放疗开始第1、28天进行2个疗程同步化疗。化疗方案均为PF方案(5-氟尿嘧啶2000 mg/m2,持续静脉滴注96 h+顺铂25 mg/m2,静脉滴注,第1~3天)。临床分期按照美国癌症委员会(American Committee on Cancer,AJCC)第6版分期。患者一般情况见表1。
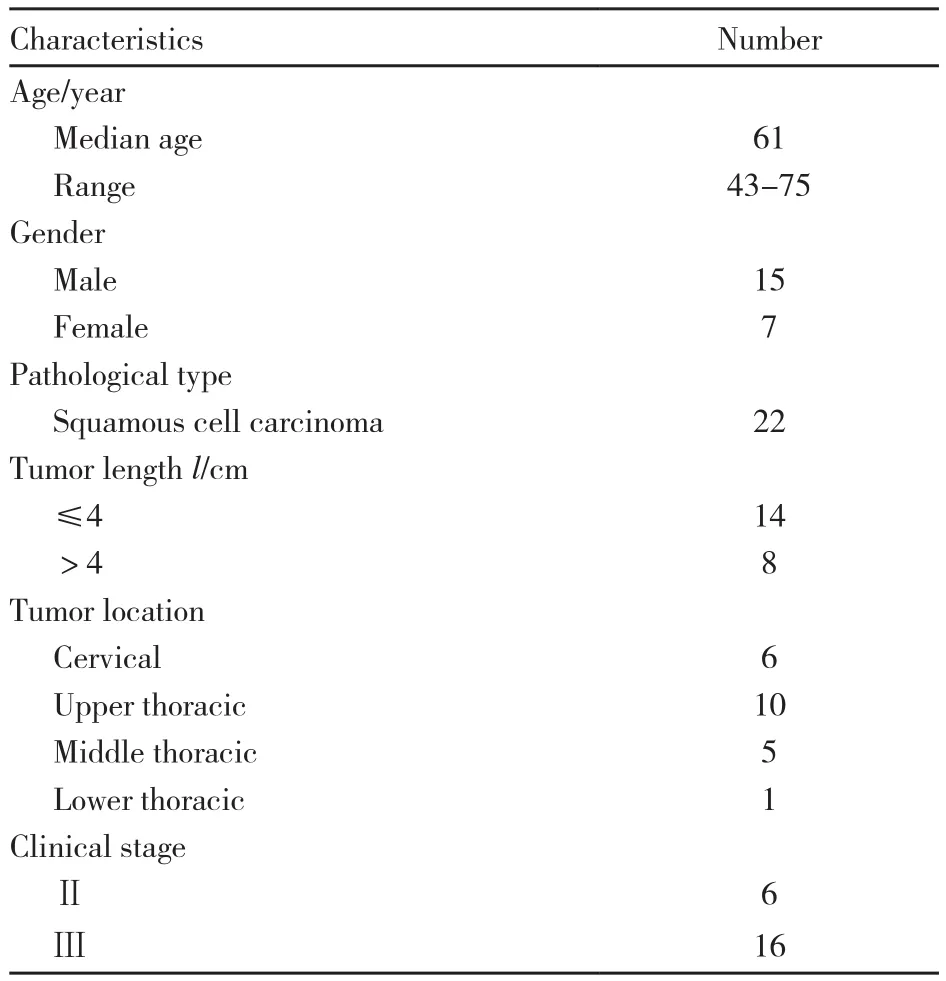
表1 患者一般特征Tab.1 Patient’s characteristics
对22例患者的治疗前及治疗中PET图像进行分析,原发灶GTV2.5pre治疗前的SUVmax中位值为12.6(4.4~38.7),体积为30.5 cm3(2.1~130.4 cm3),治疗中SUVmax中位值为5.3(3.3~14.7)。治疗前和治疗中原发灶GTV的SUVmean分别为4.81(95%CI: 4.27~5.35)和2.81(95%CI:2.44~3.18,图1)。原发灶GTV的SUVmax和SUVmean在大多数患者中呈下降趋势,但4号和6号患者的SUVmax分别由5.50、4.40上升到5.70、4.70,6号患者的SUVmean由3.10上升到3.32,可能是由较明显的急性放射性食管炎引起的。治疗前GTV5pre区域内的SUVmean-5的均值为7.27(95%CI:5.21~9.39),而CTVpre区域内的SUVmean-C的均值为1.80(95%CI:1.55~2.05),差异有统计学意义(P=0.000 8)。治疗中GTV5pre区域内的SUVmean-5的均值为3.38(95%CI:2.02~4.73),而CTVpre区域内的SUVmean-C的均值为2.01(95%CI:1.31~2.71),差异有统计学意义(P=0.002,图2)。
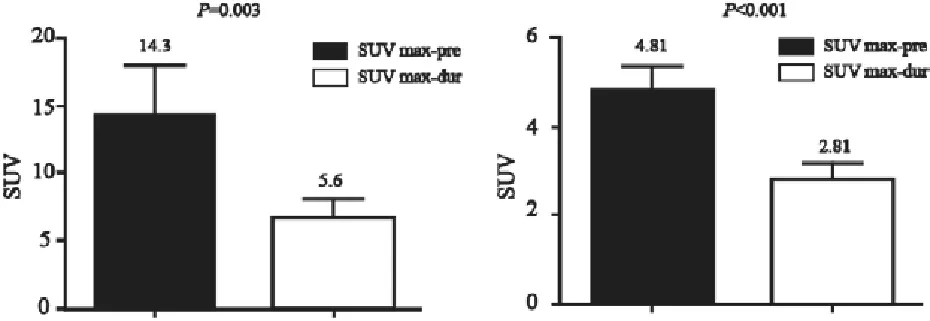
图1 22例患者放疗前和放疗中食管癌原发灶SUVmax和SUVmean的变化Fig.1 SUVmaxand SUVmeanof all 22 patients pre-radiotherapyand dur-radiotherapy
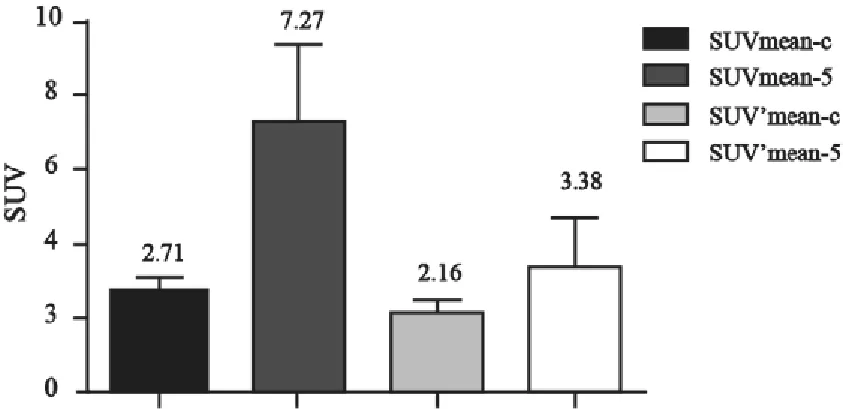
图2 治疗前与治疗中PET上GTV5pre内的SUVmean与CTVpre内的SUVmean的比较Fig.2 SUVmeanof GTV5preand CTVprepre-radiotherapy (the left figure) and dur-radiotherapy (the right figure)
治疗中以不同阈值勾画的FDG高摄取区的体积占以2.5为阈值确定的原发灶GTV的百分比见表2。治疗前PET上的肿瘤内FDG高摄取区(40%~70%SUVmax)小于以2.5为阈值确定的原发灶GTV,而残余病灶内的高摄取区域的体积小于治疗前原发灶GTV。
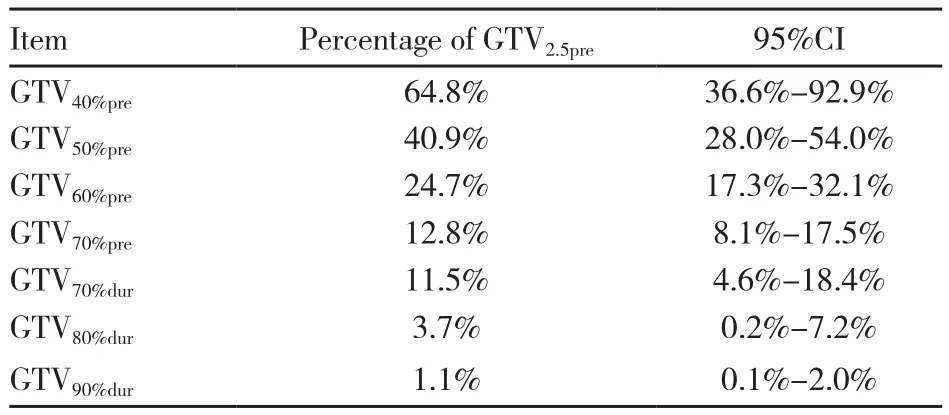
表2 以各阈值勾画的GTV与原发灶GTV比较Tab.2 Comparison between the GTV outlined based on different thresholds and the GTV of primary tumor
治疗前PET和治疗中PET图像上各种阈值勾画的FDG高摄取区域的OF见图3。残留的病灶高摄取区域依旧处于原发灶GTV内,其中在第2次PET上以90%SUVmax为阈值勾画所得的GTV90%dur完全位于原发灶内(OF=100%),以80%SUVmax为阈值勾画所得的GTV80%dur和原发灶GTV的OF为95.2%(95%CI:83.6~106.9%),以70%SUVmax为阈值勾画所得的GTV70%dur和原发灶GTV的OF为84.7%(95%CI:68.6~100.0%)。对比治疗前后的FDG高摄取区域,GTV90%dur与GTV40%pre、GTV50%pre、GTV60%pre和GTV70%pre的OF均达到100%。GTV80%dur与GTV40%pre、GTV50%pre、GTV60%pre和GTV70%pre的平均OF分别为91.8%、87.4%、80.7%和74.4%,GTV70%dur与GTV40%pre、GTV50%pre、GTV60%pre和GTV70%pre的平均OF分别为89.5%、82.4%、76.4%和71.4%。GTV90%dur与治疗前GTV的OF能够达到100%,可能与治疗后高摄取区域的体积较小(平均体积为0.1 cm3)、包含的像素点太少有关。
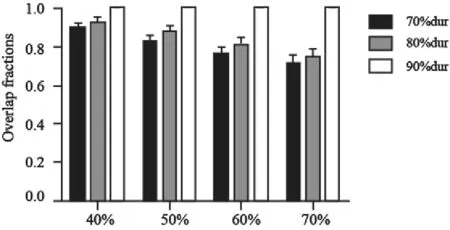
图3 治疗前PET与治疗中PET以不同SUVmax阈值勾画的GTV之间的OFFig.3 OF of pre-radiotherapy with dur-radiotherapy relative maximal SUVmaxthresholds are shown
3 讨 论
在肿瘤病灶内选择放射抵抗性高的区域进行加量放疗是目前研究的一个热点。分子影像学技术使得肿瘤内不同区域显示出不同的生物学特征[9-10],使筛选稳定的加量放疗区域成为可能。选择性加量放疗的一个好处是可以对某些高危区域给予更高剂量照射,在提高局部控制率的同时降低周围正常组织的受量[11],从而从目前将肿瘤当成一个同质性个体不加选择进行均一剂量照射改变为根据肿瘤的放射生物异质性特征进行“Dose Painting”的治疗模式。目前食管癌的放疗疗效仍不理想,局部失败是治疗失败的重要原因之一,盲目提高照射剂量会导致放射性肺、食管、脊髓和心血管等损伤的发生概率大幅增加。采用SIB-IMRT放疗技术从理论上带来了剂量学优化的希望,在大规模开展临床试验之前,必须解决的重要问题包括:① 在放疗过程中是否存在放射抵抗的区域,需要更高剂量的照射;② 如何找出需要进行加量放疗的区域;③ 验证需要加量放疗的区域在放疗过程中是否保持稳定和连续。
在利用PET来指导局部加量的研究中,不同示踪剂均可作为信息来源的工具。但受到临床可行性影响,我们将目光聚焦在18F-FDG上。18F-FDG作为最常用的PET示踪剂其特异度并不高,常常受到许多干扰因素影响,但是已有许多研究报道18F-FDG的摄取与食管癌的治疗反应及预后有关[12-14],因此本研究仍选用18F-FDG作为示踪剂。其他的示踪剂如18F-FMISO和18F-FLT等在食管癌的应用较少,因此需要开展更多的对照性研究来了解这些示踪剂的作用和价值,同时这些示踪剂未获批常规应用于临床,也影响了其应用价值。用18F-FDG PET-CT指导食管癌局部加量从理论上来说是值得研究的。首先,放疗抵抗区域常常与18F-FDG高摄取相关,但目前尚不清楚其具体关系。其次,尚不清楚食管癌原发灶在放疗过程中的18F-FDG摄取的变化规律,要实现依靠治疗前的PET信息在放疗前指导选择加量区域,验证其可行性很大程度上需要探讨放疗前FDG高摄取与放疗中的残留FDG高摄取是否在空间位置上有很大的重合性。
有研究显示,治疗前18F-FDG异常摄取的区域的体积大小与放疗后的总生存和局部控制率有关[15]。还有研究显示,在治疗过程中18F-FDG摄取的动态变化可以预测局部控制率[16]。本研究观察了在根治性放化疗过程中,食管癌原发灶的18F-FDG摄取的变化情况,以及治疗前和治疗中18F-FDG高摄取区域的空间位置的变化情况,结果显示:① 在治疗过程中,食管鳞癌原发灶的SUV显著下降,即使受急性放射性食管炎的影响也未明显上升,因而治疗过程中PET-CT所提示的生物代谢信息还是具有研究意义的;② 对治疗前与治疗中PET上GTV5pre内的SUVmean与CTVpre内的SUVmean的比较,差异均有统计学意义(P=0.000 8和0.002),若假定GTV5pre是一个高危区域,可见经过一定剂量的照射后,该区域的肿瘤细胞活性仍显著高于接受预防剂量照射的正常食管和亚临床病灶;③ 在放疗过程中,原发灶的生物代谢残留体积相对治疗前有所变化,但描述18F-FDG高代谢区域稳定性的参数OF显示治疗前的18F-FDG高代谢区域在治疗过程中保持相对的稳定(治疗后高摄取区域与治疗前高摄取区域的OF都在60%以上,与治疗前相对低摄取区域的OF都在80%以上)。本研究结果与Bosmans等[17]和Aerts等[18]的报道一致。前者的研究发现,在治疗过程中,异质性的肿瘤体积有显著变化,后者认为非小细胞肺癌的18F-FDG高摄取病灶在治疗过程中保持相对稳定。而18F-FMISO所显示的高摄取区域在空间重合性上较差,这可能也是限制其临床应用的问题之一。
由于本研究为探索性的,在研究过程中采用了治疗前40%~70%SUVmax和治疗中70%~90%SUVmax作为自动勾画阈值确定高代谢区域,尽管已有报道认为基于PET-CT勾画食管癌原发灶靶区的大小与病理结果有较高的符合度[19-20],但实际上对高低18F-FDG摄取区域的界定阈值并没有很多依据,而且确定一个最佳阈值需要考虑靶与本底的比值、图像重建的算法和扫描设备参数等许多因素[21]。本研究选择上述阈值主要是基于简便、易重复和软件易实现的目的,同时,太低的阈值会包括大部分的肿瘤组织使选择性加量的意义不大,而太高的阈值会使包括的组织太少而治疗不足。进行选择性加量放疗的区域也并未确定标准,可以是SUV大于某个绝对值的体积(如SUV>5),也可以采用SUVmax或SUVmean的百分比阈值来确定,这需要进一步的大样本的数据来研究。此外,尽管本研究结果显示,18F-FDG高摄取区域在治疗过程中具有空间稳定性,但选择哪些放疗前高危区域来加量更具有临床价值尚需要剂量学研究的进一步论证。
本研究的不足之处还包括样本量太小,不能充分代表食管癌放疗过程中的生物代谢的变化情况;图像融合采用的是刚性融合的方法,未考虑某些组织在治疗过后发生形变和两次扫描的摆位误差等,对组织器官空间位置的还原难免产生一定的影响。本研究显示,在放疗过程中肿瘤内的18F-FDG高摄取区域保持空间稳定,而SUV和体积绝对值大小则有显著的变化,基于此结果可进一步研究对治疗中放射抵抗的区域进行选择性加量放疗的可行性。
[参 考 文 献]
[1]WELSH J, SETTLE S H, AMINI A, et al.Failure patterns in patients with esophageal cancer treated with definitive chemoradiation[J].Cancer, 2012, 118(10): 2632-2640.
[2]BOS L, DAMEN E, DE BOER R, et al.Reduction of rectal dose by integration of the boost in the large-field treatment plan for prostate irradiation[J].Int J Radiat Oncol Biol Phys, 2002, 52(1): 254-265.
[3]MONTEJO M, SHRIEVE D, BENTZ B, et al.IMRT with simultaneous integrated boost and concurrent chemotherapy for locoregionally advanced squamous cell carcinoma of the head and neck[J].Int J Radiat Oncol Biol Phys, 2011,81(5): e845-e852.
[4]SINGLA R, KING S, ALBUQUERQUE K, et al.Simultaneous-integrated boost intensity-modulated radiation therapy (SIB-IMRT) in the treatment of early-stage left-sided breast carcinoma[J].Med Dosim, 2006, 31(3): 190-196.
[5]WELSH J, PALMER M, AJANI J, et al.Esophageal cancerdose escalation using a simultaneous integrated boost technique[J].Int J Radiat Oncol Biol Phys, 2012, 82(1):468-474.
[6]YU W W, ZHU Z F, FU X L, et al.Simultaneous integrated boost intensity-modulated radiotherapy in esophageal carcinoma: Early results of a phase Ⅱ study[J].Strahlenther Onkol 2014, 190(11): 979-986.
[7]MEIJER G, STEENHUIJSEN J, BAL M, et al.Dose painting by contours versus dose painting by numbers for stage II/III lung cancer: practical implications of using a broad or sharp brush[J].Radiother Oncol, 2011, 100(3): 396-401.
[8]AERTS H, VAN BAARDWIJK H, PETIT S, et al.Identification of residual metabolic-active areas within individual NSCLC tumours using a pre-radiotherapy(18)Fluorodeoxyglucose-PET-CT scan[J].Radiother Oncol,2009, 91(3): 386-392.
[9]PIERT M, MACHULLA H, PICCHIO M, et al.Hypoxiaspecific tumor imaging with18F-fluoro-azomycin arabinoside [J].J Nucl Med, 2005, 46(1): 106-113.
[10]BENTZEN S.Theragnostic imaging for radiation oncology:dose-painting by numbers[J].Lancet Oncol, 2005, 6(2):112-117.
[11]DOGAN N, KING S, EMAMI B, et al.Assessment of different IMRT boost delivery methods on target coverage and normaltissue sparing[J].Int J Radiat Oncol Biol Phys, 2003,57(5): 1480-1491.
[12]VAN HEIJL M, OMLOO J M, VAN BERGE HENEGOUWEN M I, et al.Fluorodeoxyglucose positron emission tomography for evaluating early response during neoadjuvant chemoradiotherapy in patients with potentially curable esophageal cancer[J].Ann Surg, 2011, 253(1): 56-63.
[13]HATT M, VISVIKIS D, PRADIER O, et al.Baseline18F-FDG PET image-derived parameters for therapy response prediction in oesophageal cancer[J].Eur J Nucl Med Mol Imaging, 2011, 38(9): 1595-1606.
[14]CALAIS J, DUBRAY B, NKHALI L, et al.High FDG uptake areas on pre-radiotherapy PET/CT identify preferential sites of local relapse after chemoradiotherapy for locally advanced oesophageal cancer[J].Eur J Nucl Med Mol Imaging, 2015,42(6): 858-867.
[15]HATT M, VISVIKIS D, ALBARGHACH N, et al.Prognostic value of18F-FDG PET image-based parameters in oesophageal cancer and impact of tumour delineation methodology[J].Eur J Nucl Med Mol Imaging, 2011, 38(7):1191-1202.
[16]SHARMA N, SILVERMAN J, LI T, et al.Decreased Posttreatment SUV on PET scan is associated with improved local control in medically inoperable esophageal cancer[J].Gastrointest Cancer Res, 2011, 4(3): 84-89.
[17]BOSMANS G, VAN BAARDWIJK A, DEKKER A, et al.Intra-patient variability of tumor volume and tumor motion during conventionally fractionated radiotherapy for locally advanced non-small-cell lung cancer: a prospective clinical study[J].Int J Radiat Oncol Biol Phys, 2006, 66(3): 748-753.
[18]Aerts H, BOSMANS G, VAN BAARDWIJK A, et al.Stability of18F-deoxyglucose uptake locations within tumor during radiotherapy for NSCLC: a prospective study[J].Int J Radiat Oncol Biol Phys, 2008, 71(5): 1402-1407.
[19]MAMEDE M, FAKHRI G.ABREU-E-LIMA E, et al.Preoperative estimation of esophageal tumor metabolic length in FDG-PET images with surgical pathology confirmation[J].Ann Nucl Med, 2007, 21(10): 553-562.
[20]ZHONG X, YU J, ZHANG B, et al.Using18F-fluorodeoxyglucose positron emission tomography to estimate the length of gross tumor in patients with squamous cell carcinoma of the esophagus[J].Int J Radiat Oncol Biol Phys, 2009, 73(1):136-141.
[21]DAISNE J, SIBOMANA M, BOL A, et al.Tri-dimensional automatic segmentation of PET volumes based on measured source-to-background ratios: influence of reconstruction algorithms[J].Radiother Oncol, 2003, 69(3): 247-250.
Spatial dynamic distribution and stability of18F-FDG uptake locations within primary tumor during radiotherapy for esophageal squamous cell carcinoma
LIU Qi1, YU Wen2, CAI Xuwei1, ZHU Zhengfei1, FU Xiaolong1,2(1.Department of Radiation Oncology, Fudan University Shanghai Cancer Center, Department of Oncology, Shanghai Medical College, Fudan University, Shanghai 200032, China;2.Department of Radiation Oncology, Shanghai Jiao Tong University Chest Hospital, Shanghai 200030,China)
[Key words]Esophageal squamous cell carcinoma; Radiotherapy; PET-CT
[Abstract]Background and purpose: Radiotherapy (RT) is one of the most important therapeutic tools for esophageal cancer.Because tumors are heterogeneous, including for18F-FDG uptake and, most likely, for radioresistance, selective boosting of high FDG uptake zones within the tumor has been suggested.Therefore, it is critical to know whether the location of these high FDG uptake patterns within the tumor remains stable during RT.Methods: Twenty-two patients with esophageal squamous cell carcinoma treated with concurrent chemo-radiation underwent repeated18F-FDG PET-CT scans before RT and after 20 fractions of RT.On all scans, the high and low FDG uptake regions were auto-delineated using several standard uptake value (SUV) thresholds, varying from 40% to 70% of SUVmaxon the pretreatment scan [gross tumor volume (GTV)40%pre, GTV50%pre, GTV60%pre, GTV70%pre]and from 70% to 90% of SUVmaxon the dur-treatment scan (GTV70%dur, GTV80%dur, GTV90%dur) and fixed thresholds of 2.5 and 5 (GTV2.5pre, GTV5pre).The volumes and overlap fractions (OF) of these delineations were calculated to demonstrate the stability of the high FDG uptake regions during RT.Results: The high uptake regions within the tumor during RT largely corresponded (OF>70%) with the 50% SUVmaxhigh FDG uptake area (GTV50%pre) of the pretreatment scan.The hotspot within the residual area (GTV90%dur) was completely within the GTV and pre-radiotherapy high uptake regions (OF=100%).Although the location of the high FDG uptake patterns within the tumor during RT remained stable, the delineated volumes varied markedly.Conclusion: The location of the high FDG uptake areas within the tumor remained stable during RT.This knowledge may enable selective boosting of high FDG uptake areas within the tumor.
DOI:10.3969/j.issn.1007-3969.2016.02.008
中图分类号:R735.1
文献标志码:A
文章编号:1007-3639(2016)02-0161-07
通信作者:傅小龙 E-mail:xlfu1964@hotmail.com
收稿日期:(2014-11-24 修回日期:2015-05-25)

