毕赤酵母GS115表达HSA-GCSFm的诱导工艺研究
李清亮, 周月涵, 丁 健, 段作营, 金 坚, 李华钟
1. 江南大学 工业生物技术教育部重点实验室,江苏无锡 214122;2. 江南大学 药学院,江苏无锡 214122
毕赤酵母GS115表达HSA-GCSFm的诱导工艺研究
李清亮1,周月涵1,丁健1,段作营1,金坚2,李华钟1
1. 江南大学 工业生物技术教育部重点实验室,江苏无锡 214122;2. 江南大学 药学院,江苏无锡 214122
摘要:本文探讨了甲醇流加控制、添加胰蛋白胨和甲醇/山梨醇共混诱导对重组毕赤酵母GS115/pPIC9K-HSA-GCSFm表达HSA-GCSFm的影响。结果显示:甲醇供应充足条件下HSA-GCSFm表达水平仅为37 mg·L-1,而甲醇添加受限条件下HSA-GCSFm表达水平可达到239 mg·L-1;甲醇添加受限并添加胰蛋白胨条件下,HSA-GCSFm表达水平可以提高到266 mg·L-1;在此基础上,流加山梨醇作为辅助碳源,表达水平可大幅提高至424 mg·L-1。通过对各诱导条件下OUR、胞外蛋白酶及碳流分配进行分析后发现,将甲醇限制在低浓度同时添加胰蛋白胨与山梨醇,可以改善细胞代谢活性,增加细胞用于HSA-GCSFm合成的碳流分配量,降低胞外蛋白酶活性,从而提高了HSA-GCSFm的表达水平并缓解了HSA-GCSFm的降解。因此,该诱导工艺适于毕赤酵母高效表达HSA-GCSFm。
关键词:毕赤酵母; HSA-GCSFm; 甲醇流加策略; 胰蛋白胨; 山梨醇
粒细胞集落刺激因子(Granulocyte Colony Stimulating Factor,G-CSF)由174个氨基酸残基组成,分子量为19.6 kDa,是一种由单核细胞和纤维组织母细胞产生的糖蛋白[1, 2]。G-CSF作用于骨髓中性粒细胞系造血前体细胞,促进其增殖、分化,促进中性粒细胞的成熟和释放,在临床上可用于治疗因放化疗而引起的中性粒细胞减少与再生障碍性贫血[3-5]。但是,G-CSF分子量较小,易被肾小球过滤,导致其在体内半衰期短。为了解决这一难题,本研究室将G-CSF突变体(GCSFm)与人血清白蛋白(Human Serum Albumin,HSA,66 kDa)进行基因融合并在毕赤酵母GS115中成功表达。融合蛋白HSA-GCSFm(86 kDa左右)兼具HSA抗原性及G-CSF活性,且突变型融合蛋白活性高出野生型融合蛋白30倍,具有良好的应用前景[6]。
典型的毕赤酵母发酵过程包括细胞生长期和甲醇诱导期两个阶段。为了进一步提高HSA-GCSFm产量,有必要从以下几个方面对其诱导表达工艺进行深入研究。首先,甲醇既作为诱导剂又作为碳源,其添加量对HSA-GCSFm表达水平有很大影响[7]。在诱导过程中确定最优的甲醇添加量对于HSA-GCSFm的高效表达十分重要。此外,毕赤酵母表达的重组蛋白易被降解,不但影响目标蛋白蛋白的产量还给后续的纯化带来困难[8]。因此在诱导表达过程中抑制其降解,也是提高HSA-GCSFm表达水平的有效途径之一。有文献报道,在甲醇诱导阶段添加辅助碳源山梨醇也同样可以提高目标蛋白表达水平[9]。因此,本研究从以上三个方面出发,将甲醇流加、抑制HSA-GCSFm降解以及山梨醇共混流加相结合,以寻求适用于HSA-GCSFm高效表达的最佳诱导工艺。
1材料与方法
1.1实验菌株
重组毕赤酵母(Pichiapastoris)GS115(pPIC9K-HSA-GCSFm),由江南大学药学院分子药理学实验室构建[6]。
1.2主要试剂与仪器设备
酵母浸粉、胰蛋白胨均由英国Oxiod公司生产,尿微量白蛋白检测试剂盒由上海名典生物工程公司生产,蛋白酶分析试剂盒由美国Invitrogen公司生产,其他试剂均为国药集团化学试剂有限公司产品。
蛋白电泳设备(美国Bio-Rad公司),生化培养箱(上海安亭科学仪器厂),恒温摇床(江苏强乐实验设备有限公司),分光光度计(上海光谱仪器有限公司),Multiskan MK3酶标仪(美国Thermo公司),尾气分析仪(LKM2000A,韩国LOKAS公司),GC112A气象色谱仪(上海精密科学仪器有限公司),Fc-2002甲醇电极(华东理工大学)。
1.3培养基
YPD培养基(1 L):葡萄糖 20 g,酵母浸粉 10 g,胰蛋白胨 20 g。用于重组毕赤酵母种子培养。
初始培养基(3.5 L):甘油 70 g,(NH4)2SO416.8 g,MgSO43.5 g,CaSO40.35 g,K2SO43.5 g,KOH 70 g,磷酸70 mL,PTM135 mL,pH 6.0。
甘油流加培养基(2 L):甘油 1000 g,(NH4)2SO41 g,MgSO40.06 g,KH2PO40.5 g,组氨酸 4.0 g,PTM120 mL,pH 6.0。
甲醇补料培养基(1 L):甲醇 500 mL,MgSO40.03 g,(NH4)2SO40.5 g,PTM110 mL,pH 6.0。
山梨醇补料培养基(1 L):山梨醇 500 g。
PTM1(1 L):MnSO4·H2O 3.0 g,CuSO4·5H2O 6.0 g,Na2MoO4·2H2O 0.2 g,CoCl2·6H2O 0.5 g,ZnCl220.04 g,FeSO4·7H2O 65.05 g,生物素0.4 g,浓H2SO45 mL,NaI 80 μg,H3BO30.02 g。
1.4分析方法
1.4.1菌体密度的测定
以ddH2O调零点,将发酵液进行适当稀释,使稀释液在600 nm的吸光度处于0.1~0.7范围内,细胞密度(OD600)=分光光度计读数×稀释倍数。
1.4.2发酵状态在线测量
利用尾气分析仪测定发酵尾气中的O2和CO2分压,将数据记录于工业控制计算机中,按文献[10]所报道的公式在线计算摄氧速率(oxygen uptake rate,OUR)和CO2释放速率(carbon dioxide evolution rate,CER)。利用电子天平在线记录甲醇流加瓶的质量损失,并据此计算甲醇的实际添加量,以及特定发酵时刻和时间间隔内的甲醇平均消耗速率。
1.4.3HSA-GCSFm浓度测定
利用尿微量蛋白检测试剂盒测定样品中HSA的含量,根据公式C(HSA-GCSFm)=1.30×C(HSA)来计算融合蛋白的浓度,其中1.30代表HSA-GCSFm与HSA的相对分子质量之比。
1.4.4甲醇浓度与山梨醇浓度检测方法
甲醇浓度采用气相色谱仪测定,色谱条件见文献所述[10]。
山梨醇浓度采用高效液相色谱法测定选用示差折光检测器 (RID),采用Aglient氨基柱(250×4.6 mm),进样量20 μL,柱温控制在30 ℃;流动相包含70%乙腈和30%超纯水,流速设定在1.0 mL·min-1。
1.4.5蛋白酶活性测定
参照参考文献[11]进行。
1.4.6SDS-PAGE蛋白电泳
参照参考文献[12]进行。
1.5培养方法
1.5.1毕赤酵母的高密度培养方法
在7 L发酵罐进行毕赤酵母细胞高密度培养,初始装液量为3.5 L,接种量为20%,通气量为1 vvm,温度设定为30 ℃,整个过程通过流加氨水控制pH为6.0,调节搅拌转速来调节溶氧在20%以上,当溶氧浓度(DO)反弹时,启动DO-Stat流加程序进行甘油流加培养基的流加,当通空气无法控制DO时向发酵罐内通入纯氧。当发酵液OD600超过450以上时,终止流加甘油培养基,饥饿2 h待残留的甘油以及其他中间代谢产物耗尽后,添加甲醇诱导HSA-GCSFm表达。
1.5.2甲醇流加策略
策略Ⅰ:诱导温度为25 ℃,根据甲醇电极的示数自动调节流加速率使甲醇浓度维持在5 g/L左右。甲醇供应充足条件下耗氧剧烈,因此诱导过程全程通纯氧将DO控制在10%左右。
策略Ⅱ:诱导温度设定为25 ℃,全程通空气诱导,不使用纯氧。将DO设定为10%,按照下列公式修正甲醇流加速率:
其中:F表示甲醇流加速率(F≥ 0);F*代表基准甲醇流加速率,本次实验中F*=0.7 mL·min-1;控制参数Kc在实验中设定为0.01。
1.6碳消耗速率的计算
甲醇消耗速率Rmeth(t)(g·L-1·h-1)与山梨醇消耗速率Rsor(t)(g·L-1·h-1)通过公式(1)与(2)计算。式中cmeth(t)与csor(t)为离线测定的甲醇质量浓度与山梨醇质量浓度,单位为g·L-1;N为2次取样之间的时间间隔,单位为h;V为发酵体积,单位为L;mmeth(t)与msor(t)为t~(t+N)h之间甲醇的流加量与山梨醇的流加量,单位为g。碳消耗速率Rc(t)(mol·L-1·h-1)由公式(3)计算得到。其中32.04和182.17分别是甲醇和山梨醇的摩尔质量,单位为g·mol-1。
(1)
(2)
(3)
1.7碳流分配计算
假设一部分碳源进入异化途径,被完全氧化为CO2,同时伴随大量ATP生成,为细胞生命活动和蛋白质合成提供能量。其余碳源全部用于合成目标蛋白。采用本研究中所提出策略进行诱导的发酵批次中,流向能量代谢途径以及蛋白合成途径的碳流量可以通过计算得到。首先,t1~t2时间段内碳消耗总量Ctotal(mol·L-1)可由公式(4)计算
(4)
其次,t1~t2流向能量代谢途径的碳消耗量Cenergy及流向蛋白合成途径的碳流量Csynthesis可由公式(5)、(6)计算
(5)
(6)
2结果与讨论
2.1甲醇浓度对HSA-GCSFm表达水平的影响
甲醇浓度是毕赤酵母表达外源蛋白过程中的关键环境因素。因此分别采用前述的甲醇流加策略Ⅰ和策略Ⅱ控制甲醇流加和发酵液中甲醇浓度,以比较甲醇添加充足和甲醇添加受限条件对HSA-GCSFm表达量的影响,结果如图1a所示。

(a)

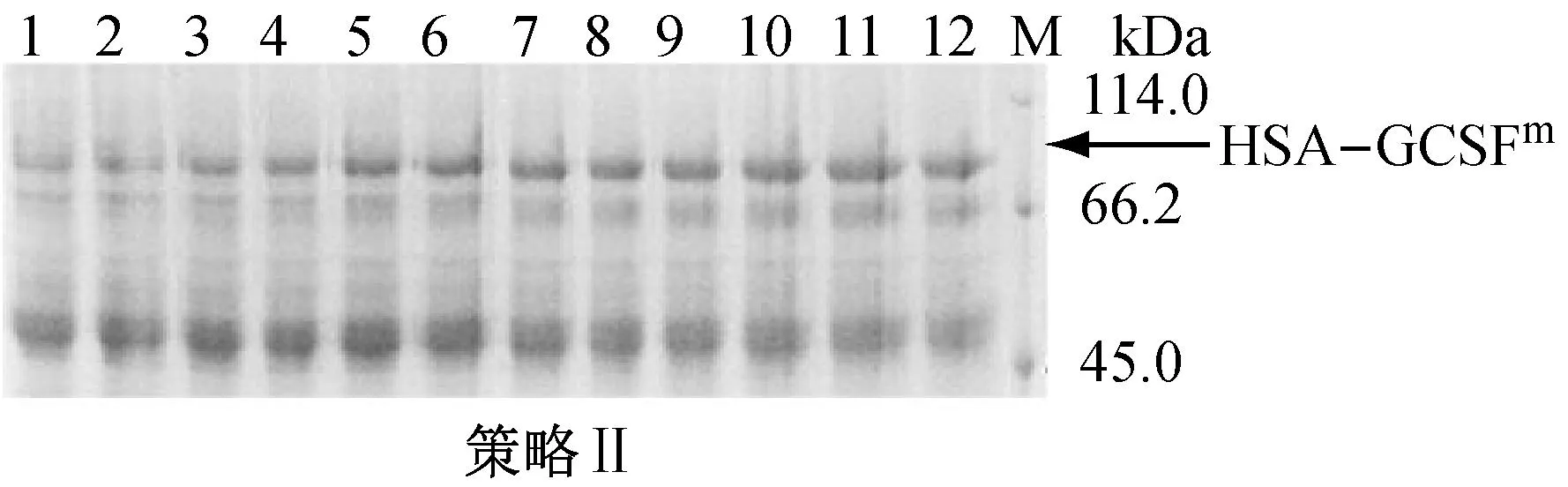
(b)
a:甲醇浓度变化及HSA-GCSFm表达曲线,■:HSA-GCSFm浓度,▲:甲醇浓度,实心:甲醇流加策略Ⅰ,空心:甲醇流加策略Ⅱ;b:诱导阶段不同时间发酵上清液中HSA-GCSFm的SDS-PAGE鉴定,图中1~12对应诱导时间分别为4 h、8 h、12 h、16 h、20 h、24 h、28 h、32 h、36 h、40 h、44 h、48 h;M:Protein Marker
图1甲醇浓度变化及HSA-GCSFm表达状况
从图中可以看出,在诱导期的绝大部分时间内,采用策略Ⅰ的发酵,其甲醇浓度维持在4 g·L-1~6 g·L-1,而采用策略Ⅱ的发酵,其甲醇浓度则一直低于1 g·L-1。而目标蛋白表达结果显示,采用策略Ⅰ的发酵批次,HSA-GCSFm的表达量仅为37 mg·L-1;而将甲醇浓度限制在较低水平,则HSA-GCSFm的表达量可以达到239 mg·L-1(图1a)。由此可见,诱导阶段甲醇受限条件更有利于HSA-GCSFm的表达。因此,之后的试验均采用甲醇流加策略II,将甲醇添加控制在受限水平。
2.2添加胰蛋白胨及山梨醇对HSA-GCSFm发酵的影响
蛋白胨含有丰富的有机氮化合物、氨基酸等营养物质,不仅可用做毕赤酵母旳氮源维持其正常生理代谢,还可以作为外源蛋白的竞争性底物与蛋白酶结合来缓解外源蛋白的降解[13]。有文献报道:将BMMY中的蛋白胨去除则测不出目的蛋白,总蛋白含量也大量减少,并得出氮源的缺乏是造成目标蛋白降解的重要原因[14]。毕赤酵母生长进入稳定期后,由于发酵液中代谢产物积累、氮源营养物质逐渐耗尽而形成不利于细胞生存的环境,进而对外源蛋白的表达产生不利影响。为提高菌体的代谢活力与HSA-GCSFm表达水平,在仍然利用甲醇流加策略Ⅱ控制甲醇浓度的基础上,在诱导阶段每12 h添加35 g胰蛋白胨,并通过OUR与SDS-PAGE图谱来考察重组毕赤酵母代谢活力与HSA-GCSFm表达状况的变化,结果见图2与图3。


注:采用甲醇流加策略Ⅰ时以纯氧供氧,氧气分压超出尾气分析仪的量程而无法计算OUR
图2不同批次发酵的OUR的变化
从图2可以看出,添加胰蛋白胨的批次与对照批次相比, OUR获得显著的提升并趋于稳定。有文献报道,诱导阶段高而稳定的OUR是毕赤酵母高效表达外源蛋白的关键因素[15]。由图3可知,在诱导阶段添加胰蛋白胨后, HSA-GCSFm表达水平获得显著提高,在诱导48 h后表达量达到了266 mg·L-1(图3a),比对照批次提高了11.3%,而且66 kDa降解片段有所减少,但是45 kDa降解片段无明显减少(图3c)。

(a)

(b)
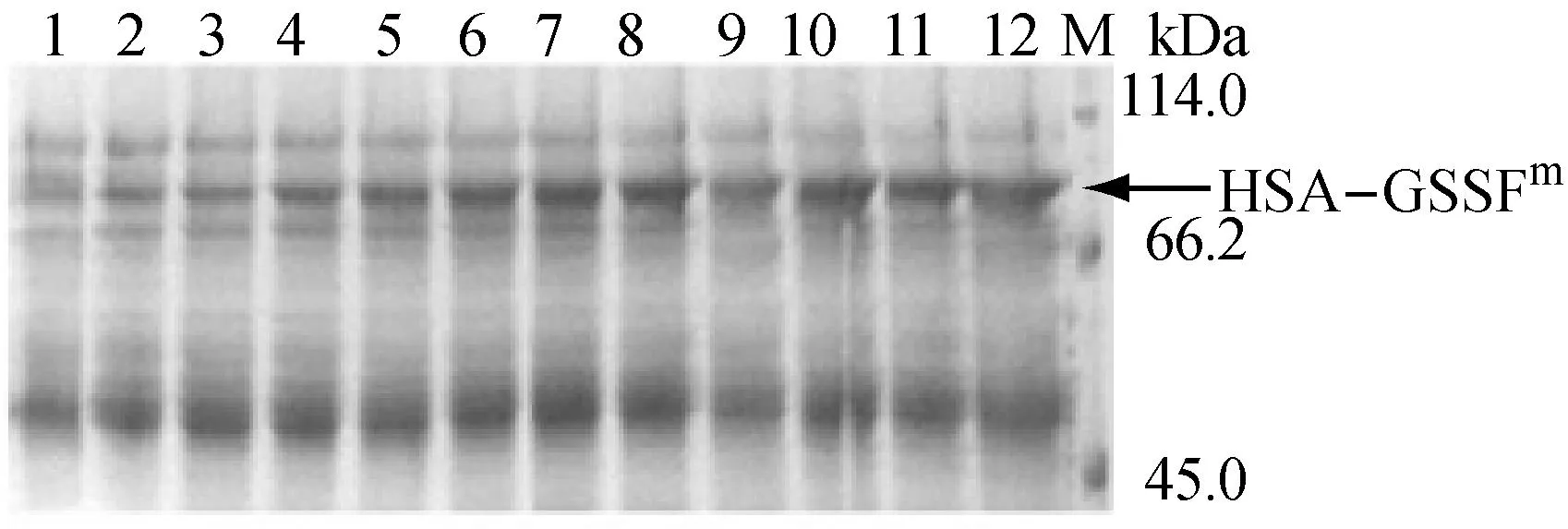
(c)

(d)
a:不同批次的HSA-GCSFm的表达曲线,■:对照,●:采用甲醇诱导策略Ⅱ、添加胰蛋白胨,▲;采用甲醇诱导策略Ⅱ、添加胰蛋白胨与山梨醇;b:对照批次发酵上清液的SDS-PAGE分析;c:采用甲醇诱导策略Ⅱ、添加胰蛋白胨批次发酵上清液的SDS-PAGE分析;d:采用甲醇诱导策略Ⅱ、添加胰蛋白胨与山梨醇批次发酵上清液的SDS-PAGE分析;1~12对应诱导时间分别为4 h、8 h、12 h、16 h、20 h、24 h、28 h、32 h、36 h、40 h、44 h、48 h,M:Protein Marker
图3不同批次的HSA-GCSFm的表达情况
在诱导过程中添加辅助碳源是提高目标蛋白表达水平的有效途径之一。辅助碳源能够为蛋白合成途径提供额外的ATP,减轻甲醇的供能压力,从而缓解甲醇异化途径代谢中间物甲醛和甲酸对细胞的毒害作用[16]。为进一步提高HSA-GCSFm的表达水平,本研究在使用甲醇流加策略Ⅱ限制甲醇浓度和添加胰蛋白胨的基础上,按照固定体积比流加山梨醇补料培养基(甲醇培养基∶山梨醇培养基=4∶1),以期获得HSA-GCSFm高效表达,结果见图3a与图3d。
从图3a中可以看出,HSA-GCSFm表达量在诱导32 h后达到了424 mg·L-1,较只采用流加策略II的对照批次提高了93.6%,较只添加胰蛋白胨的发酵批次也提高了59.4%,并且目标蛋白降解获得有效的控制(图3d)。同时诱导阶段具有水平较高且较稳定的OUR(图2)。
2.3采用甲醇流加策略Ⅱ各批次的胞外蛋白酶活性
诱导阶段形成的不利于细胞的环境会促进蛋白酶的活化与分泌,还会引起菌体自溶而释放胞内蛋白酶,进而导致外源蛋白的水解[17]。在本研究中,通过采用甲醇流加策略Ⅱ并添加胰蛋白胨与山梨醇能有效地控制HSA-GSCFm的降解。为进一步探求其抑制降解的原因,分别测定了对照批次、添加胰蛋白胨批次、添加胰蛋白胨与山梨醇的各批次的胞外蛋白酶活性,其结果如图4所示。
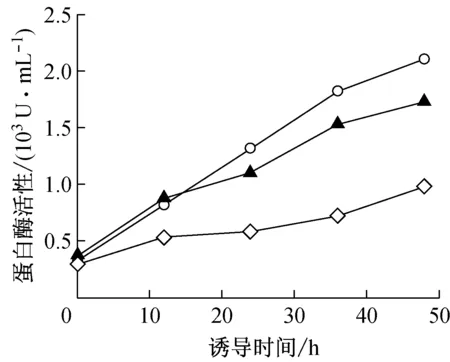
○:对照(采用甲醇流加策略Ⅱ,不添加胰蛋白胨与山梨醇);▲:采用甲醇诱导策略Ⅱ,添加胰蛋白胨;◇:采用甲醇诱导策略Ⅱ,添加胰蛋白胨与山梨醇
图4不同批次诱导阶段蛋白酶活性的变化
结果显示,对照批次蛋白酶活性>添加胰蛋白胨批次蛋白酶活性>添加胰蛋白胨与山梨醇批次蛋白酶活性;在诱导48 h放罐后,添加胰蛋白胨批次、添加胰蛋白胨与山梨醇批次的胞外蛋白酶活性与对照批次相比分别下降了17.9%、54.3%。这表明添加胰蛋白胨与山梨醇可以减少胞外蛋白酶的分泌,进而控制HSA-GCSFm的降解。
2.4采用甲醇流加策略Ⅱ各批次碳流分配比较
计算对照批次、添加胰蛋白胨批次、添加胰蛋白胨与山梨醇批次的诱导48 h的碳流分配,结果如图5所示。

图5 不同批次碳流分配分析
从图5中可以看出,同时添加胰蛋白胨与山梨醇,碳消耗总量为5.45 mol·L-1,分别是只添加胰蛋白胨和对照批次的1.1和1.6倍,其中有55.1%流入蛋白合成途径,高于对照批次和只添加胰蛋白胨的批次(分别为49.2%和46.2%)。同时添加胰蛋白胨与山梨醇,不仅改善了细胞的代谢活性,提高了细胞碳代谢速率,而且改变了细胞内碳代谢流向,更多的碳源用于HSA-GCSFm合成,使得该批次中HSA-GCSFm的表达水平明显高于其他批次。
3结论
综上所述,本研究建立了一套适用于毕赤酵母GS115表达HSA-GCSFm融合蛋白的诱导工艺。该工艺通过采用控制溶解氧浓度间接限制甲醇流加速率的甲醇流加策略,同时补加胰蛋白胨与山梨醇,增强了细胞代谢活性,提高了碳消耗总量和用于蛋白合成途径的碳流分配量,同时降低了胞外蛋白酶活性,缓解了HSA-GCSFm的降解,从而保证了HSA-GCSFm的高效表达。
参考文献
[1]Hill CP, Osslund TD, Eisenberg D. The structure of granulocyte-colony-stimulating factor and its relationship to other growth factors[J]. Proceedings of the National Academy of Sciences of the United States of America, 1993, 90(11): 5167-5171.
[2]Layton JE, Shimamoto G, Osslund T,etal. Interaction of granulocyte colony-stimulating factor (G-CSF) with its receptor-evidence that Glu19of G-CSF interacts with Arg288of the receptor[J]. Journal of Biological Chemistry, 1999, 274(25): 17445-17451.
[3]Anderlini P, Przepiorka D, Champlin R,etal. Biologic and clinical effects of granulocyte colony-stimulating factor in normal individuals[J]. Blood, 1996, 88(8): 2819-2825.
[4]Vainstein V, Ginosar Y, Shoham M,etal. The complex effect of granulocyte colony-stimulating factor on human granulopoiesis analyzed by a new physiologically-based mathematical model[J]. Journal of Theoretical Biology, 2005, 234(3): 311-327.
[5]Wittman B, Horan J, Lyman GH. Prophylactic colony-stimulating factors in children receiving myelosuppressive chemotherapy: A meta-analysis of randomized controlled trials[J]. Cancer Treatment Reviews, 2006, 32(4): 289-303.
[6]朱书峰. 计算机辅助HSA-hGCSF融合蛋白的分子改造[D]. 无锡: 江南大学, 2008.
[7]Wu D, Yu XW, Wang TC,etal. High yield Rhizopus chinenisis prolipase production inPichiapastoris: Impact of methanol concentration[J]. Biotechnology and Bioprocess Engineering, 2011, 16(2): 305-311.
[8]Kobayashi K, Kuwae S, Ohya T,etal. High-Level Expression of Recombinant Human Serum Albumin from the Methylotrophic YeastPichiapastoriswith Minimal Protease Production and Activation[J]. Journal of Bioscience & Bioengineering, 2000, 89(1): 55-61.
[9]Ding J, Zhang C, Gao M,etal. Enhanced porcine circovirus Cap protein production byPichiapastoriswith a fuzzy logic DO control based methanol/sorbitol co-feeding induction strategy[J]. Journal of Biotechnology, 2014, 177(7): 35-44.
[10]Jin H, Zheng Z, Gao M,etal. Effective induction of phytase inPichiapastorisfed-batch culture using an ANN pattern recognition model-based on-line adaptive control strategy[J]. Biochemical Engineering Journal, 2007, 37(1): 26-33.
[11]Sinha J, Plantz BA, Inan M,etal. Causes of proteolytic degradation of secreted recombinant proteins produced in methylotrophic yeastPichiapastoris: Case study with recombinant ovine interferon-τ[J]. Biotechnology & Bioengineering, 2005, 89(1): 102-112.
[12]汪家政. 蛋白质技术手册[M]. 北京: 科学出版社, 2000. 79-90.
[13]Werten MWT, van den Bosch TJ, Wind RD,etal. High-yield secretion of recombinant gelatins byPichiapastoris[J]. Yeast, 1999, 15(11): 1087-1096.
[14]邹敏, 方曙光, 黄立等. 重组毕赤酵母表达瑞替普酶(Reteplase)过程中的降解控制[J]. 工业微生物, 2006, 36(2): 7-11.
[15]金虎, 高敏杰, 徐俊等. 多变量在线测量条件下的猪α干扰素高效表达[J]. 过程工程学报, 2009, 9(3): 563-567.
[16]Xie J, Zhou Q, Du P,etal. Use of different carbon sources in cultivation of recombinantPichiapastorisfor angiostatin production[J]. Enzyme & Microbial Technology, 2005, 36(2): 210-216.
[17]van den Hazel HB, KiellandBrandt MC, Winther JR. Review: Biosynthesis and function of yeast vacuolar proteases [J]. Yeast, 1996, 12(1): 1-16.
Study on induction method ofPichiapastorisexpressing HSA-GCSFm
LI Qing-liang1, ZHOU Yue-han1, DING Jian1, DUAN Zuo-ying1, JIN Jian2, LI Hua-zhong1
1. Key Laboratory of Industrial Biotechnology, Ministry of Education, Jiangnan University, Wuxi, 214122, Jiangsu, China;2. School of Pharmaceutical Science,Jiangnan University,Wuxi, 214122, Jiangsu, China
AbstractThe effects of methanol feeding control, adding tryptone and methanol/sorbitol co-feeding induction on the expression of HSA-GCSFm in Pichia pastoris GS115/pPIC9K-HSA-GCSFm were discussed. The results showed that the concentration of HSA-GCSFm was only 37 mg·L-1when supply of methanol was sufficient, but the concentration of HSA-GCSFm increased to 239 mg·L-1when methanol was supplied restrictedly. Adding tryptone with methanol supplied restrictedly could increase concentration of HSA-GCSFm to 266 mg·L-1; and feeding sorbitol as auxilary carbon source simultaneously, the concentration of HSA-GCSFm increased to 424 mg·L-1. After analyzing OUR, extracellular protease activity and carbon distribution, it could be concluded that restricting methanol concentration at low level and adding tryptone and sorbitiol properly could improve metabolic activity of cells and increase carbon flux in protein synthesis route and reduce activity of extracellular protease. Therefore, this induction method enhancing expression and inhibiting degration of HSA-GCSFm was optimal for Pichia pastoris to express HSA-GCSFm with high performance.
Key wordsPichia pastoris; HSA-GCSFm; methanol feeding strategy; sorbitol; tryptone
doi:10.3969/j.issn.1001-6678.2016.02.002
基金项目:国家自然科学基金项目(30970029); 江苏省优势学科建设工程资助项目。
作者简介:李清亮(1989~),男,硕士。E-mail: xiaobanchao@sina.com。

