海参i-型溶菌酶在毕赤酵母基因工程菌中优化表达及纯化
马 俊, 张 洋, 丛丽娜, 李 成
大连工业大学 生物工程学院,辽宁 大连 116034
海参i-型溶菌酶在毕赤酵母基因工程菌中优化表达及纯化
马俊,张洋,丛丽娜*,李成
大连工业大学 生物工程学院,辽宁 大连 116034
摘要:将实验室已构建的毕赤酵母基因工程菌(pPIC9K-SjLys/GS115)作为海参i-型溶菌酶生产菌株,本研究分别从甲醇浓度、培养基pH、温度和诱导时间对其产酶发酵条件进行优化。实验得出甲醇诱导浓度为1.0%,发酵培养基初始pH 6.0,温度30 ℃,培养96 h为最佳目的蛋白表达条件,其发酵液中海参i-型溶菌酶含量达10.63 mg/L。将发酵液经离心和超滤浓缩后得到上清液,再经离子交换和凝胶过滤层析纯化获得海参i-型溶菌酶产品,其酶活力达826.44 U/mg。经测定该酶对革兰氏阳性菌溶壁微球菌和革兰氏阴性菌副溶血弧菌均具有明显的抑菌作用。
关键词:海参i-型溶菌酶; 毕赤酵母; 发酵条件优化; 酶活性
溶菌酶广泛分布于不同生物体中,同时作为先天免疫因子具有较广的抗菌谱[1]。它通过破坏细菌细胞壁中肽聚糖的β-1,4糖苷键,从而使其原有结构受到破坏造成菌体死亡[2]。溶菌酶作为一种天然的蛋白质具有对人体无毒性,易吸收,不污染等特性[3]。根据溶菌酶的来源分类可为动物溶菌酶、植物溶菌酶、微生物溶菌酶和噬菌体溶菌酶。同时动物溶菌酶包含三种类型,即c-型溶菌酶、g-型溶菌酶和i-型溶菌酶。i-型溶菌酶最早由Jolles于1975年在欧洲海星中发现[4],随后相继在贝类、虾、海参、海胆等海洋生物中发现该类菌酶[5,6]。海参i-型溶菌酶基因由本实验室于2007年首次分离和鉴定[7];进一步研究发现,该溶菌酶具有广谱抗菌活性,尤其对革兰氏阴性菌,如弧菌和假单胞菌这两种常引起水产动物严重病害的病原菌,具有明显的杀伤力[8]。
巴斯德毕赤酵母表达系统是迄今为止应用最广的外源基因表达系统之一。它不仅克服了大肠杆菌表达系统不能表达结构复杂的蛋白质、表达产物多为不溶性包涵体、表达产量低、背景蛋白多等缺点,而且具有生长快、翻译后修饰、操作简单等优点[9]。Wang等[10]将T4溶菌酶基因导入到甲醇型酵母中并成功表达。Zhao等[11]利用毕赤酵母表达LYZL6,并且通过条件优化确定最佳发酵条件。
本实验室的前期研究已将海参i-型溶菌酶基因导入毕赤酵母中进行表达,然而目的蛋白表达量较低[12]。为了提高该溶菌酶的表达水平,本实验从甲醇浓度、培养基pH、温度和诱导时间几个方面对摇瓶发酵条件进行优化,并对表达产物进行纯化及抑菌活性的测定,为今后大规模的发酵生产海参i-型溶菌酶奠定基础。
1材料与方法
1.1菌株
实验菌株:海参i-型溶菌酶毕赤酵母基因工程菌 pPIC9K-SjLys/GS115,由本实验室构建;指示菌菌株溶壁微球菌(Micrococcuslysodeikticus),副溶血弧菌(Vibrioparahemolyticus)由本实验室保存。
1.2试剂
蛋白低分子量Marker购自TaKaRa Biotechnology(大连)公司;弱酸性阳离子交换柱CM Sepharose Fast Flow和凝胶过滤柱Sephacryl S-100 High Resolution购自GE公司,其它试剂均为国产分析纯。
1.3培养基
YPD培养基:1%酵母提取物,2%胰蛋白胨,2%葡萄糖。
BMGY培养基:1.34%YNB,1%甘油,4×10-7生物素,100 mmol/L 磷酸钾缓冲溶液(pH 6.0),1%酵母提取物,2%胰蛋白胨。
BMMY培养基:1.34%YNB,0.5%甲醇,4×10-7生物素,100 mmol/L磷酸钾缓冲溶液(pH 6.0),1%酵母提取物,2%胰蛋白胨。
1.4培养方法
1.4.1摇瓶培养
从YPD平板上挑取一个毕赤酵母基因工程菌单菌落,接种到25 mL BMGY培养基中。在30 ℃、230 r/min条件下培养14 h~16 h,至OD600=4~5。将收集的种子液于4 ℃、4 000 r/min离心5 min,弃尽上清,并用100 mL BMMY培养基重悬菌体。初始发酵条件为温度28 ℃、pH 6.0、转速250 r/min条件下培养120 h,每24 h加入1.5%甲醇诱导表达海参i-型溶菌酶。
1.4.2海参i-型溶菌酶表达条件的优化
采用单因素试验方法。改变其中一个发酵条件,固定其他因素不变,实验重复三次。分别选取浓度为0.5%、1.0%、1.5%、2.0%甲醇诱导表达。分别配制pH 4.0、pH 5.0、pH 6.0、pH 7.0 BMMY发酵培养基。发酵温度分别选择26 ℃、28 ℃、30 ℃、32 ℃。发酵培养液在第0 h、24 h、48 h、72 h、96 h、120 h取样,检测海参i-型溶菌酶表达含量及活性。
1.5海参i-型溶菌酶的纯化
将诱导后的发酵液在4 ℃、12 000 r/min条件下离心10 min,收集上清液。选用5 kD的超滤膜对上清液进行超滤浓缩,再用20 mmol/L pH 6.0磷酸盐缓冲液透析浓缩液。根据海参i-型溶菌酶的等电点选用弱酸性阳离子交换柱CM Sepharose Fast Flow进行纯化。首先用磷酸盐缓冲液平衡柱子,上样后用0~1 mol/L NaCl进行梯度洗脱,流速为2.5 mL/min。收集具有抑菌活性的流出液,并用超滤管浓缩。根据该酶的分子量大小选用凝胶层析柱Sephacryl S-100 High Resolution进一步纯化。凝胶层析柱经平衡后加入样品,设定流速为1 mL/min,之后用20 mmol/L pH 6.0磷酸盐缓冲溶液洗脱柱子,利用自动分部收集器收集流出液,检测流出液中蛋白含量及溶菌酶活性。
1.6蛋白含量测定
采用考马斯亮蓝法,测定发酵液总蛋白含量。将1 mL发酵液浓缩并进行SDS-PAGE凝胶电泳,电泳胶上样品表达条带经凝胶成像仪扫描后,再使用BandScan5.0软件分析,得出海参i-型溶菌酶所占总蛋白的比例,从而计算出该酶的产量。
1.7溶菌酶活力测定
采用比浊法测定溶菌酶活性。选用200 mmol/L磷酸盐缓冲液(pH 6.2)溶解溶壁微球菌菌粉,使底物的吸光度达到OD450=0.45~0.77。首先将底物与样品在25 ℃条件下分别预热,取2 mL底物与1 mL样品迅速混合,每隔15 s测1次OD450,共计时3 min。酶活力单位的定义:在温度25 ℃、pH 6.2 条件下,波长在450 nm处,每分钟引起吸光度下降0.001为1个酶活力单位(1 U)。
1.8抑菌活性测定
采用牛津杯法对海参i-型溶菌酶的抑菌活性进行检测。选用革兰氏阳性菌溶壁微球菌和革兰氏阴性菌副溶血弧菌作为指示菌。在LB固体培养基上分别均匀涂布这两种指示菌,放上已灭菌的牛津杯,并向杯中加入200 μL样品。在37 ℃条件下,过夜培养,测定抑菌圈直径。
2结果与讨论
2.1甲醇诱导浓度对发酵产酶的影响
通过SDS-PAGE分析发酵液中目的蛋白表达水平,利用比浊法测定发酵液中海参i-型溶菌酶活性,根据最大酶活力计算出相对酶活力。不同甲醇诱导浓度对毕赤酵母基因工程菌产海参i-型溶菌酶(SjLys)的影响如图1所示。实验发现,发酵液在14.3 kD处有明显的电泳条带,表明目的蛋白成功表达。甲醇既是毕赤酵母的碳源,也是外源基因表达的诱导物[13]。添加不同浓度的甲醇对海参溶菌酶的表达有不同的影响。当甲醇浓度为1.0%时,SjLys的活性最高。甲醇浓度为2.0%时,相对酶活力为66%。这表明过高浓度的甲醇对毕赤酵母有毒害作用,抑制毕赤酵母的生长与蛋白分泌。根据以上实验结果选择浓度为1%甲醇为最佳诱导量。

M:Marker; 1:0.5%甲醇; 2:1.0%甲醇;3:1.5%甲醇; 4:2.0%甲醇
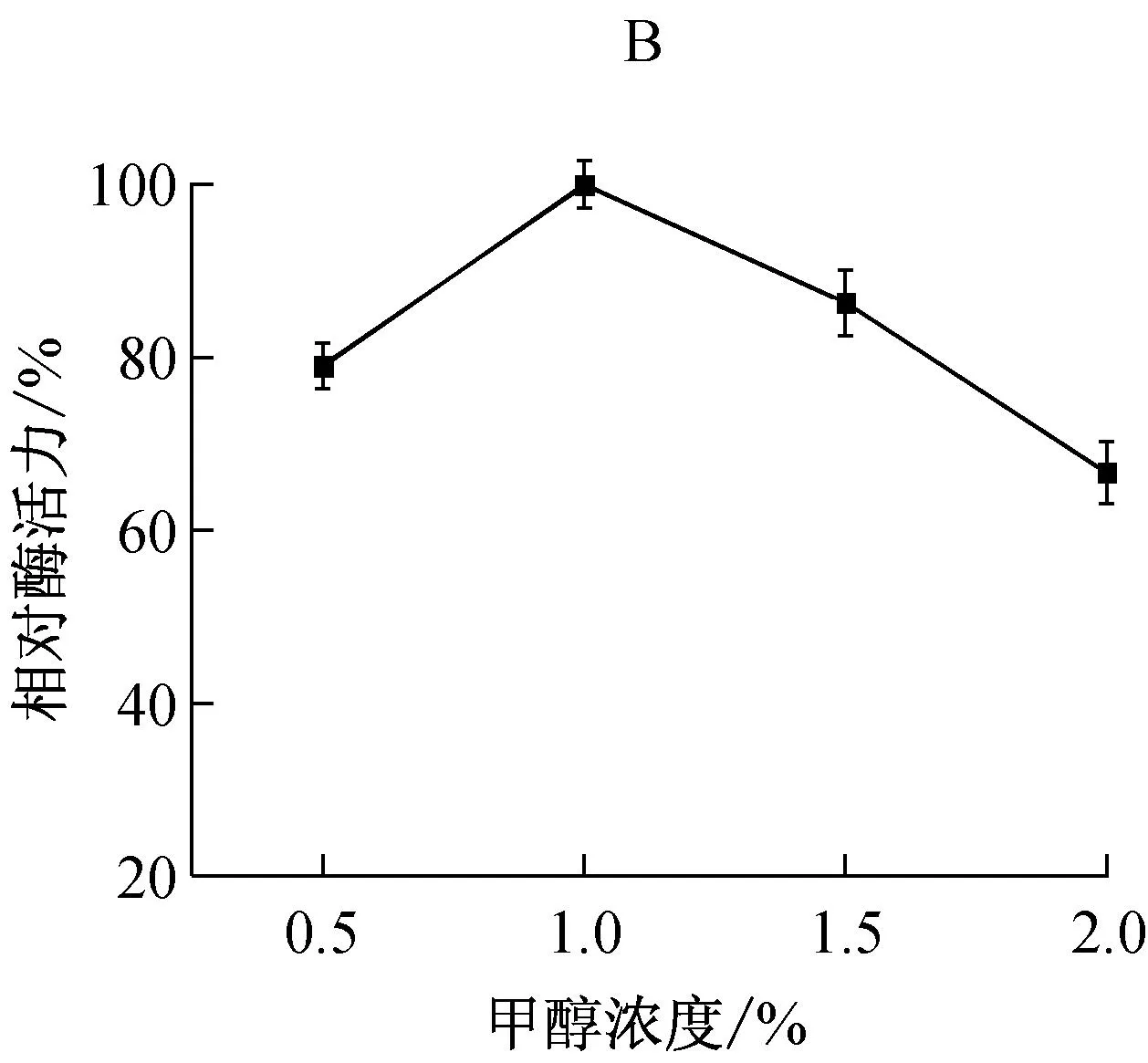
图1 甲醇诱导浓度对海参i-型溶菌酶的表达电泳
2.2培养基初始pH对产酶的影响
毕赤酵母细胞生长的最适pH和海参溶菌酶活性的最适pH,这些是影响发酵培养pH选择的两个因素[14]。发酵培养基中的不同初始pH对海参i-型溶菌酶表达的影响如图2所示。在pH为6.0时,SjLys的活性最高。当pH为4.0时,相对酶活力为57%,这表明较低pH使该溶菌酶表达量和活性明显降低。而过高的pH也同样影响毕赤酵母的生长,当pH为7.0时,相对酶活力为83%。根据以上实验结果,将pH 6.0作为发酵培养基的最佳值。
2.3发酵温度对发酵产酶的影响
毕赤酵母的最适生长温度为28 ℃~30 ℃,然而根据表达不同的外源蛋白,最佳诱导温度也不同[15]。本实验不同的发酵温度对海参i-型溶菌酶表达的影响如图3所示。当培养温度低于28 ℃,发酵液中SjLys活性较低,因为在该条件下毕赤酵母生长缓慢,分泌较少的目的蛋白。当诱导温度为32 ℃,相对酶活力为78%,因为过高的温度使毕赤酵母出现死亡。当诱导温度为30 ℃时,该酶活性最高。根据以上实验结果,选择30 ℃为最佳培养温度。

M:Marker;1:pH 4.0发酵培养基;2:pH 5.0发酵培养基;3:pH 6.0发酵培养基; 4:pH 7.0发酵培养基

图2 发酵培养基初始pH对海参i-型溶菌酶的
2.4发酵时间对发酵产酶的影响
不同发酵时间对海参i-型溶菌酶表达的影响如图4所示。随着发酵时间的增加,SjLys产量及活性持续增加,在96 h之后呈平稳的趋势。毕赤酵母基因工程菌随时间逐渐衰老,产酶的能力下降,并且大量产物的积累对菌株的生长产生了抑制。根据以上实验结果,选择96 h为最佳发酵时间。
根据以上的发酵条件优化,确定摇瓶中生产海参i-型溶菌酶的最佳发酵条件为发酵液初始pH 6.0,培养温度30 ℃,每24 h向培养液中添加1%甲醇,培养时间96 h,海参i-型溶菌酶产量达10.63 mg/L。
M:Marker; 1:发酵温度26 ℃; 2:发酵温度28 ℃;3:发酵温度30 ℃; 4:发酵温度32 ℃

图3 发酵温度对海参i-型溶菌酶的表达
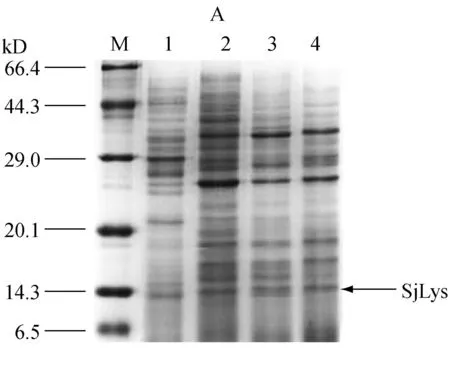
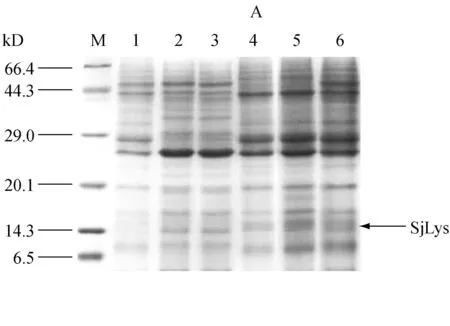
2.5海参i-型溶菌酶的纯化
发酵结束后离心收集上清液,用于后期纯化。各纯化步骤的电泳分析结果如图5所示。与空白对照(泳道1)比较,发酵上清液(泳道2)在14.3kD处呈现明显的目的蛋白表达条带,这与理论计算的海参i-型溶菌酶分子量大小相一致。通过离子交换层析纯化后大部分杂蛋白被除去,目的蛋白占总蛋白的70%,达到初步分离的效果(泳道3)。通过凝胶过滤层析进一步纯化后,海参i-型溶菌酶占总蛋白90%以上(泳道4)。通过测定纯化后酶液中蛋白含量和溶菌酶活性,计算出海参i-型溶菌酶比活力为826.44 U/mg。
2.6海参i-型溶菌酶抑菌活性分析
采用牛津杯法检测纯化后的海参i-型溶菌酶的抑菌活性,结果如图6所示。经测量溶壁微球菌的抑菌直径为16 mm,副溶血弧菌的抑菌直径为14 mm。副溶血弧菌是威胁水产养殖业的主要病原菌之一,进食含有该菌的食物可致食物中毒,纯化后的溶菌酶对这两种指示菌均具有抑菌性。该实验结果为海参i-型溶菌酶的应用提供了更广阔的前景。
M: Marker; 1:第0 h; 2:第24 h;3:第48 h; 4:第72 h;5:第96 h; 6:第120 h

图4 发酵时间对海参i-型溶菌酶的表达

M:Marker; 1:不含海参溶菌酶基因的重组毕赤酵母发酵液;2:海参i-型溶菌酶毕赤酵母基因工程菌发酵上清液;3:离子交换柱CM Sepharose Fast Flow纯化后的粗酶液;4:凝胶过滤柱Sephacryl S-100 High Resolution纯化后的海参i-型溶菌酶
图5纯化后海参i-型溶菌酶的SDS-PAGE电泳分析

3结论
溶菌酶具有抗菌和抗病毒的作用,这使其在食品防腐、医学治疗和畜牧养殖等领域中拥有巨大的应用价值。目前已有大量关c-型溶菌酶的研究,然而c-型溶菌酶对革兰氏阴性菌的抑菌效果具有局限性[16]。本实验所研究的海参i-型溶菌酶对革兰氏阳性菌和阴性菌均具有明显的抑菌效果,这为该溶菌酶作为抗生素代用品应用于水产养殖提供了可能性。
相关研究表明,通过对发酵条件的优化可以增加毕赤酵母表达外源蛋白的产量[17]。本实验为提高海参i-型溶菌酶在毕赤酵母基因工程菌中表达水平,对发酵条件进行优化。确定最佳条件为发酵培养基初始pH为6.0,温度30 ℃,每24 h添加终浓度为1.0%甲醇,发酵时间96 h。实验结果得到发酵液中海参i-型溶菌酶的表达量为10.63 mg/L,纯化后酶的纯度达到90%以上,比活力826.44 U/mg。 该研究为进一步放大生产海参溶菌酶奠定基础,目前发酵罐逐级放大生产该酶正在试验中。
参考文献
[1]Jollès P,Jollès J.What's new in lysozyme research? Always a model system,today as yesterday[J].Molecular and Cellular Biochemistry,1984,63(2):165-89.
[2]Supungul P,Rimphanitchayakit V,Aoki T,etal.Molecular characterization and expression analysis of a c-type and two novel muramidase-deficient i-type lysozymes fromPenaceusmonodon[J].Fish and Shellfish Immunology,2010,28(3):490-498.
[3]Liburdi K,Benucci I,Esti M.Lysozyme in Wine:An Overview of Current and Future Applications[J].Comprehensive Reviews in Food Science and Food Safety,2014,13(5):1062-1073.
[4]Jollès J,Jollès P.The lysozyme fromAsteriasrubens[J].European Journal of Biochemistry,1975,54(1):19-23.
[5]Xin Y,Liu B,Xue Q.An i-type lysozyme from the Asiatic hard clamMeretrixmeretrixpotentially functioning in host immunity[J].Fish and Shellfish Immunology,2011,30(2):550-558.
[6]Ding JF,Wang R,Yang F,etal.Identification and characterization of a novel phage-type like lysozyme from Manilaclam,Ruditapesphilippinarum[J].Developmental and Comparative Immunology,2014,47(1):81-89.
[7]Cong LN,Yang XJ,Wang XX,etal.Characterization of an i-type lysozyme gene from the sea cucumberStichopusjaponicus,and enzymatic and nonenzymatic antimicrobial activities of its recombinant protein[J].Journal of Bioscience and Bioengineering,2009,107(6):583-588.
[8]王秀霞,丛丽娜,王丹等.海刺参i 型溶菌酶基因的重组表达及抑菌谱分析[J].生物工程学报,2009,25(2):189-194.
[9]Ahmad M,Hirz M,Pichler H,etal.Protein expression inPichiapastoris:recent achievements and perspectives for heterologous protein production[J].Applied Microbiology and Biotechnology,2014,98(12):5301-5317.
[10]Wang N,Wang YJ,LI GQ,etal.Expression,characterization,and antimicrobial ability of T4 lysozyme from methylotrophic yeastHansenulapolymorphaA16[J].Science China,2011,54(6):520-526.
[11]Zhou XY,Yu Y.Production of LYZL6,a novel human c-type lysozyme,in recombinantPichiapastorisemploying high cell density fed-batch fermentation[J].Journal of Bioscience and Bioengineering,2014,118(4):420-425.
[12]谷跃峰,丛丽娜,骆宁.海参溶菌酶基因克隆及在毕赤酵母中的表达与纯化[J].大连工业大学学报,2010,29(5):317-320.
[13]袁东华,蔡国林,任晓静等.重组毕赤酵母产木聚糖酶的发酵条件优化研究[J].工业微生物,2012,42(1):39-44.
[14]Yu Y,Zhou X,Wu S,etal.High-yield production of the human lysozyme byPichiapastorisSMD1168 using response surface methodology and high-cell-density fermentation[J].Electronic Journal of Biotechnology,2014,17(6):311-316.
[15]苟万晓,卫红伟,胡元森等.毕赤酵母发酵生产甲醇蛋白工业条件的优化[J].中国酿造,2014,33(7):78-83.
[16]Vaughan NH,Smith SL.Isolation and characterization of a c-type lysozyme from the nurse shark[J].Fish and Shellfish Immunology,2013,35(6):1824-1828.
[17]李青,周晓宏.新型生物防腐剂—多聚阳离子抗菌肽在毕赤酵母中的表达[J].食品科学,2013,34(5):161-166.
Optimization of fermentation conditions for i-type lysozyme produced by recombinantPichiapastoris
MA Jun, ZHANG Yang, CONG Li-na, LI Cheng
School of Biological Engineering, Dalian Polytechnic University, Dalian 116034, China
AbstractIn this study, the genetic strain Pichia pastoris pPIC9K-SjLys/GS115 (SjLys) was used to produce the i-type lysozyme from sea cucumber Apostichopus japonicus. The fermentation conditions were optimized for enhancement of i-type lysozyme production. The results showed that the maximum i-type lysozyme yield of 10.63 mg/L was achieved under the conditions of initial pH 6.0, culture temperature 30 ℃, fermentation time 96 h and methanol concentration of 1%. The fermentation culture of SjLys was centrifuged and concentrated by ultra-filtration, then purified by cation exchange and gel filtration chromatography. The specific activity of the purified i-type lysozyme was 826.44 U/mg. The purified SjLys product diaplayed inhibitive effects on the growth of the gram-positive bacterium Micrococcus lysodeikticus and gram-negative bacterium Vibrio parahemolyticus.
Key wordsi-type lysozyme; Pichia pastoris; optimization; enzyme activity
doi:10.3969/j.issn.1001-6678.2016.02.008
基金项目:辽宁省教育厅重点实验室(LZ2014029),辽宁省研究生教育创新计划项目(2014-154),国家海洋食品工程技术研究中心开放实验室(2012FU125X03)。
作者简介:马俊(1990~),男,硕士研究生。E-mail:majun617@163.com。 *通讯作者:丛丽娜(1962~),女,教授。E-mail:linacong@163.com。

