下调gankyrin通过调节β-catenin/cyclin D1信号通路抑制胃癌细胞增殖
潘 杰 汪伟民 蔡炜龙 许洪宝# 韩春蕃 钱福初
浙江省湖州市中心医院普外科1(313000) 中心实验室2
下调gankyrin通过调节β-catenin/cyclin D1信号通路抑制胃癌细胞增殖
潘杰1*汪伟民1蔡炜龙1许洪宝1#韩春蕃1钱福初2
浙江省湖州市中心医院普外科1(313000)中心实验室2
背景:Gankyrin是一个含锚蛋白重复序列的原癌蛋白,其高表达参与了多种恶性肿瘤的发生、发展进程。目的:探讨下调gankyrin表达对胃癌细胞增殖能力的影响及其可能机制。方法:以携带gankyrin siRNA的慢病毒载体转染人胃癌细胞株MKN28,分别采用MTT实验、流式细胞术和蛋白质印迹法检测下调gankyrin表达对MKN28细胞增殖、细胞周期分布及其β-catenin/cyclin D1信号通路的影响。结果:慢病毒载体的转染效率在90%以上,转染gankyrin siRNA后,MKN28细胞gankyrin蛋白表达显著受抑(P<0.01)。与未转染慢病毒和转染对照病毒的细胞相比,转染gankyrin siRNA的MKN28细胞体外生长于第3天起显著受抑,细胞周期G1期细胞比率增高,S期细胞比率降低,细胞中的β-catenin和cyclin D1表达水平降低,差异均有统计学意义(P<0.01)。结论:下调胃癌细胞中的gankyrin表达可通过抑制β-catenin/cyclin D1信号通路引起细胞周期G1期阻滞和细胞增殖抑制,gankyrin有望成为胃癌靶向治疗的新靶点。
关键词Gankyrin;胃肿瘤;RNA干扰;细胞增殖;细胞周期;β连环素;细胞周期蛋白D1
beta Catenin;Cyclin D1
胃癌是一种常见的消化系统恶性肿瘤,其发病率在全球恶性肿瘤发病中居第六位[1]。尽管近年关于胃癌的诊断和治疗已取得一定进展,但患者预后仍然不佳,寻求新的胃癌诊治方法一直是临床医师和肿瘤科学家共同努力的方向。近年来,分子靶向治疗技术的开展给肿瘤患者带来了福音,然而可能是由于胃癌异质性较高,现有针对胃癌的靶向治疗药物疗效有限。因此,寻求更多胃癌治疗的分子靶点对于改善患者预后具有重要意义。据文献报道,gankyrin高表达在恶性肿瘤的发生、发展中扮演重要角色,与结肠癌[2]、肝癌[3]、胆管癌[4]、食管鳞癌[5]、非小细胞肺癌[6]等多种恶性肿瘤的组织学分化程度、临床分期、侵袭、转移等临床病理特征以及预后不良密切相关,而下调其表达可显著抑制肿瘤细胞的增殖、迁移、侵袭和成瘤能力。本课题组前期实验发现gankyrin在胃癌组织中亦呈高表达,且其阳性表达与肿瘤低分化、转移和T分期呈显著正相关,并提示患者预后不良。本研究拟应用慢病毒载体携带的siRNA靶向抑制gankyrin在人胃癌细胞株中的表达,以探讨下调gankyrin表达对胃癌细胞增殖能力的影响及其可能机制,为明确gankyrin是否可作为胃癌靶向治疗的分子靶点提供依据。
材料与方法
一、细胞株和主要试剂
人胃癌细胞株MKN28(上海研谨生物科技有限公司);兔gankyrin多克隆抗体、小鼠β-连环蛋白(β-catenin)单克隆抗体、小鼠细胞周期蛋白D1(cyclin D1)单克隆抗体(Santa Cruz Biotechnology, Inc.),内参小鼠β-actin单克隆抗体、MTT(Sigma-Aldrich Co.),HRP标记山羊抗兔、抗小鼠IgG、ECL发光试剂盒(北京中杉金桥生物技术有限公司),PI染液(上海江莱生物科技有限公司);携带gankyrin siRNA序列(5’-CTG ACC AGG ACA GCA GAA C-3’[2])的慢病毒载体pGCSIL-GFP和对照病毒(未携带任何siRNA序列)由上海吉凯基因化学技术有限公司构建。
二、方法
1. 细胞培养和转染:MKN28细胞培养于含10% FBS的RPMI 1640培养基中,取对数生长期细胞以5×103/孔接种于96孔板,培养至对数生长期时,以无血清培养基清洗细胞一次,每孔先加入无血清培养基0.6 mL,再分别加入携带gankyrin siRNA的慢病毒载体pGCSIL-GFP或对照病毒5 μL,轻摇混匀后于培养箱中静置6 h,弃上清,加入含10% FBS的培养基培养24 h,荧光显微镜下观察带有荧光的细胞并计数。转染成功的细胞经接种、扩散后用于后续实验,分别命名为S-MKN28细胞(转染携带gankyrin siRNA的慢病毒载体)和C-MKN28细胞(转染对照病毒)。
2. 蛋白质印迹法:收集培养至90%融合的各组细胞,冰上裂解,提取总蛋白,蛋白定量,上样,12% SDS-PAGE电泳分离,电转至硝酸纤维素膜上, 10%脱脂奶粉抗原封闭,剪取与目的蛋白相对分子质量对应的条带,加入以2%牛奶配制的gankyrin抗体(1∶100)、β-catenin抗体(1∶500)、cyclin D1抗体(1∶100)或β-actin抗体(1∶1 000),室温静置4 h,TBS清洗3次,加入HRP标记山羊抗兔(1∶2 000)或抗小鼠IgG(1∶3 000)孵育50 min,TBS清洗3次,ECL显色、定影、扫描,凝胶成像分析系统分析各蛋白条带灰度值,目的蛋白相对表达量以其条带与内参β-actin条带灰度值的比值表示。每组细胞重复3次实验,结果取均值。
3. MTT实验:各组细胞以1×103/孔接种于96孔板,分别培养1~7 d(因7 d时MKN28、C-MKN28细胞生长至90%以上,故终止培养),每组每时间点设3个复孔。每天于相应孔加入MTT(5 mg/mL)20 μL,室温静置4 h,弃上清,加入150 μL DMSO,震荡10 min后于酶联免疫检测仪490 nm波长处读取A值,绘制细胞生长曲线。
4. 流式细胞检测:取各组对数生长期细胞,离心、弃上清,加入70%乙醇,4 ℃冰箱过夜,弃上清,PBS清洗细胞,弃上清,加入PI染液、Triton X-100和RNA酶A,4 ℃避光孵育30 min,上流式细胞仪检测细胞周期。每组细胞重复3次实验,结果取均值。
三、统计学分析
结果
一、慢病毒转染效率
转染24 h后,荧光显微镜观察显示,转染携带gankyrin siRNA的慢病毒载体和转染对照病毒的MKN28细胞绿色荧光细胞比率均在90%以上(图1),提示慢病毒转染成功。
二、Gankyrin siRNA抑制效率
蛋白质印迹法检测结果显示,gankyrin在MKN28、C-MKN28和S-MKN28细胞中的相对表达量分别为0.48±0.02、0.53±0.03和0.11±0.03,S-MKN28细胞显著低于MKN28和C-MKN28细胞(P<0.01)(图2),提示慢病毒载体携带的gankyrin siRNA可有效抑制MKN28细胞中的gankyrin表达水平,S-MKN28细胞建模成功,适用于后续实验。

A、B:转染携带gankyrin siRNA的慢病毒载体;C、D:转染对照病毒;A、C:明视野下细胞形态和数量;B、D:分别为A、C在荧光显微镜下的图像
图1MKN28细胞慢病毒转染效率
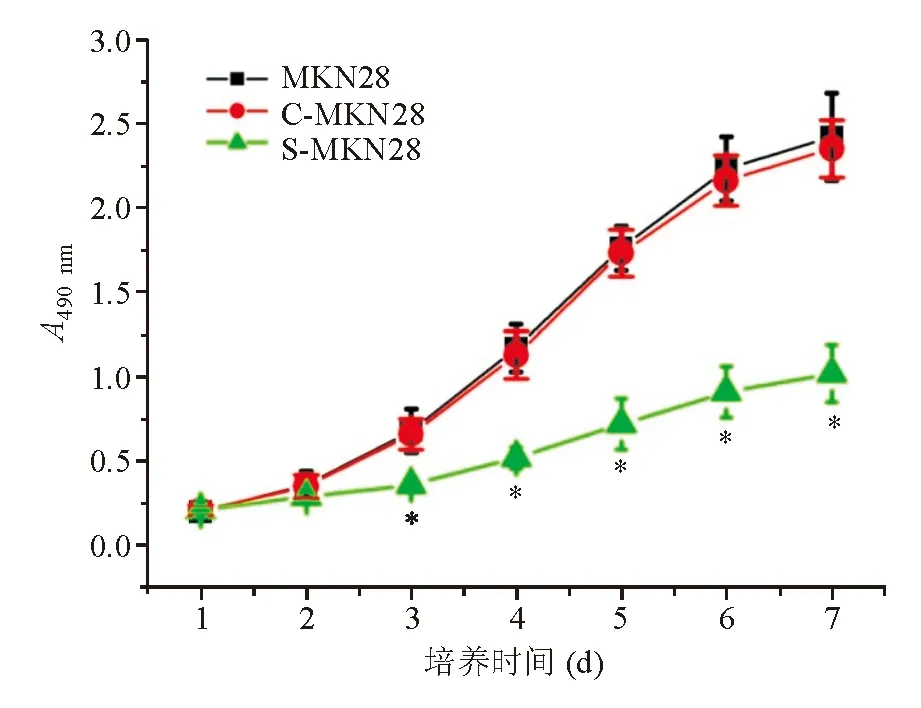
三、下调gankyrin对MKN28细胞增殖的影响
根据MTT实验结果绘制的MKN28、C-MKN28和S-MKN28细胞生长曲线显示,三组细胞第1天数量基本相同,第2天虽略有差异,但无统计学意义,第3天起MKN28和C-MKN28细胞的生长显著强于S-MKN28细胞(P<0.01)(图3),提示下调gankyrin表达可抑制MKN28细胞的体外增殖能力。
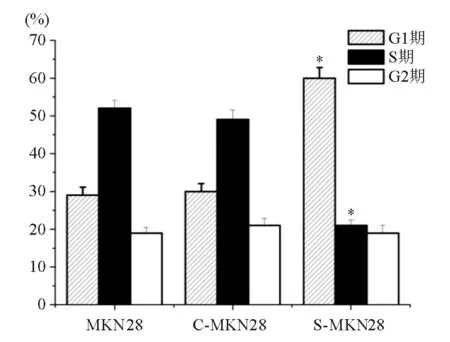
四、下调gankyrin对MKN28细胞周期的影响
流式细胞检测结果显示,S-MKN28细胞G1期细胞比率显著高于MKN28和C-MKN28细胞(P<0.01),S期细胞比率显著低于MKN28和C-MKN28
细胞(P<0.01),三组间G2期细胞比率差异无统计学意义(P=0.35)(图4),提示下调gankyrin表达可使MKN28细胞发生细胞周期G1期阻滞。
*与同时点MKN28和C-MKN28细胞比较,P<0.01
*与同期MKN28和C-MKN28细胞比较,P<0.01
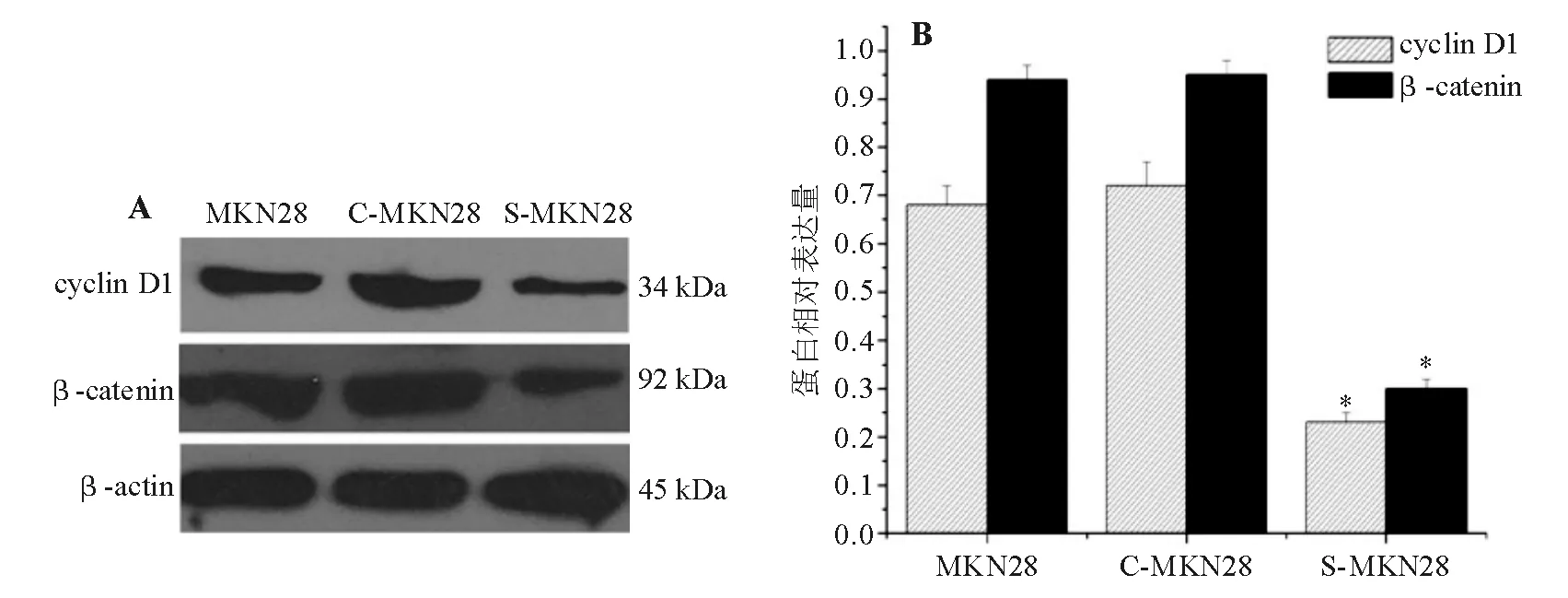
五、下调gankyrin对MKN28细胞β-catenin/cyclin D1信号通路的影响
蛋白质印迹法检测结果显示,β-catenin在MKN28、C-MKN28和S-MKN28细胞中的相对表达量分别为0.95±0.03、 0.95±0.03和0.29±0.02,

*与MKN28和C-MKN28细胞比较,P<0.01
cyclin D1相对表达量分别为0.68±0.04、0.73±0.05和0.23±0.04,与MKN28和C-MKN28细胞相比,S-MKN28细胞β-catenin、cyclin D1表达水平显著降低(P<0.01)(图 5)。综合上述结果,提示下调gankyrin表达可能通过调节β-catenin/cyclin D1信号通路影响MKN28细胞周期,抑制细胞增殖。
讨论
恶性肿瘤的发生、发展是一个多基因、多信号通路参与的复杂过程,β-catenin/cyclin D1信号通路是影响细胞周期的关键信号转导通路,明确其上游调控基因对于肿瘤恶性增殖机制的研究具有重要意义。 Gankyrin又名PSMD10,系由日本学者通过cDNA文库消减杂交技术克隆得到的在肝细胞癌中高表达的基因,是一个重要的原癌基因,其编码蛋白含有7个锚蛋白重复序列(ankyrin repeats),可诱导小鼠成纤维细胞株的非锚定依赖性生长和致瘤性[7]。既往研究显示gankyrin高表达参与了多种恶性肿瘤的发生、发展进程。本课题组前期实验应用免疫组化方法发现gankyrin在胃癌组织中的表达阳性率显著高于相应癌旁非癌组织,且其阳性表达与胃癌低分化、转移、T分期较晚以及患者预后不良显著相关,与既往研究发现的gankyrin在其他恶性肿瘤中的表达趋势相一致,表明gankyrin在胃癌恶性进展中起重要作用。肿瘤细胞的无限增殖能力是阻碍其治疗的关键问题,深入研究其中涉及的蛋白分子对于认识胃癌发病机制以及抗癌药物的研发具有重要意义。因此,本研究对下调gankyrin表达对胃癌细胞增殖能力的影响及其可能机制进行了探讨。
本研究应用携带gankyrin siRNA的慢病毒载体下调其在人胃癌细胞株MKN28中的表达,转染慢病毒后24 h荧光显微镜观察显示转染效率在90%以上,表明慢病毒作为转染载体具有高效性。转染慢病毒后,MKN28细胞中的gankyrin表达水平显著降低,提示细胞建模成功。MTT实验显示,下调gankyrin表达后,MKN28细胞的体外增殖能力显著受抑,提示gankyrin高表达是促进胃癌细胞增殖的重要因素,可能成为胃癌治疗的潜在分子靶点。进一步的流式细胞检测发现,下调gankyrin表达可使MKN28细胞周期阻滞于G1期,增殖能力最强的S期细胞比率显著下降,证实下调gankyrin表达可抑制胃癌细胞增殖,与国内学者发现抑制结肠癌细胞株SW620中的gankyrin表达可抑制其增殖和成瘤能力相一致[2]。鉴于下调gankyrin表达可引起细胞周期G1期阻滞,本研究检测了MKN28细胞中的细胞周期相关信号通路,结果显示下调gankyrin表达可使β-catenin和cyclin D1表达水平显著降低,与既往研究发现的gankyrin在结肠癌细胞中的表达变化与β-catenin和cyclin D1表达呈正相关相符[2],提示gankyrin可能通过β-catenin/cyclin D1信号通路影响MKN28细胞周期,调节细胞增殖能力。
泛素-蛋白酶体系统是细胞内蛋白降解的主要途径,通过特异性降解目的蛋白,26S蛋白酶体几乎参与了生物体内绝大多数的生命活动。gankyrin是26S蛋白酶体的调节性亚单位之一[8-9],因此其可能通过调控多种蛋白活性,在多种生物信号通路,如细胞生长、细胞周期调控以及细胞恶性转化过程中发挥重要作用[10]。研究显示蛋白酶体参与了DNA双链断裂的修复[11],gankyrin可增强暴露于DNA损
*与MKN28和C-MKN28细胞比较,P<0.01
伤物质的细胞的抗凋亡活性,而在抑癌基因p53为野生型的细胞中,下调gankyrin表达可诱导细胞凋亡;相关机制研究表明,gankyrin能与E3泛素连接酶Mdm2结合并使之激活,从而促进Mdm2与p53结合,增加p53的泛素化和降解,进而发挥抗凋亡作用[12]。Gankyrin尚可通过其C端LxCxE结构域与细胞周期相关抑癌蛋白RB1结合并促进其降解,从而释放转录因子E2F-1活性,激活DNA合成基因转录,推进细胞周期进程[7]。此外,gankyrin还可通过与26S蛋白酶体中的S6 ATP酶相互作用而与细胞周期蛋白依赖性激酶4(CDK4)形成复合物,通过影响CDK4功能而调控细胞周期,参与肿瘤发生[9]。对gankyrin三维晶体结构的研究[13]发现,其锚蛋白重复序列通过形成一个带有凹槽的内弧面结构而与Mdm2、RB、CDK4等其他蛋白结合形成复合物,发挥蛋白降解和细胞周期调控作用。卵巢癌相关研究[14]显示,gankyrin可通过PI3K/AKT/HIF-1α信号通路调节cyclin D1表达,参与促进促卵泡激素诱导的卵巢癌细胞增殖。而本研究发现gankyrin可通过β-catenin/cyclin D1信号通路影响MKN28细胞周期,PI3K/AKT/HIF-1α信号通路是否亦参与了cyclin D1的调节,有待进一步研究探讨。
综上所述,将慢病毒载体携带的gankyrin siRNA转染入人胃癌细胞株MKN28可下调其gankyrin表达,抑制β-catenin/cyclin D1信号通路,引起细胞周期G1期阻滞和细胞增殖抑制,上述发现为gankyrin作为胃癌靶向治疗的新靶点提供了理论依据。Gankyrin在胃癌发生、发展中作用的复杂分子机制尚需进一步深入研究。
参考文献
1 Jemal A, Bray F, Center MM, et al. Global cancer statistics[J]. CA Cancer J Clin, 2011, 61 (2): 69-90.
2 Tang S, Yang G, Meng Y, et al. Overexpression of a novel gene gankyrin correlates with the malignant phenotype of colorectal cancer[J]. Cancer Biol Ther, 2010, 9 (2): 88-95.
3 Jing H, Zhang G, Meng L, et al. Gradually elevated expression of Gankyrin during human hepatocarcinogenesis and its clinicopathological significance[J]. Sci Rep, 2014, 4: 5503.
4 Zheng T, Hong X, Wang J, et al. Gankyrin promotes tumor growth and metastasis through activation of IL-6/STAT3 signaling in human cholangiocarcinoma[J]. Hepatology, 2014, 59 (3): 935-946.
5 Ortiz CM, Ito T, Tanaka E, et al. Gankyrin oncoprotein overexpression as a critical factor for tumor growth in human esophageal squamous cell carcinoma and its clinical significance[J]. Int J Cancer, 2008, 122 (2): 325-332.
6 Wang WP, Yan XL, Li WM, et al. Clinicopathologic features and prognostic implications of Gankyrin protein expression in non-small cell lung cancer[J]. Pathol Res Pract, 2015, 211 (12): 939-947.
7 Higashitsuji H, Itoh K, Nagao T, et al. Reduced stability of retinoblastoma protein by gankyrin, an oncogenic ankyrin-repeat protein overexpressed in hepatomas[J]. Nat Med, 2000, 6 (1): 96-99.
8 Hori T, Kato S, Saeki M, et al. cDNA cloning and functional analysis of p28 (Nas6p) and p40.5 (Nas7p), two novel regulatory subunits of the 26S proteasome[J]. Gene, 1998, 216 (1): 113-122.
9 Dawson S, Apcher S, Mee M, et al. Gankyrin is an ankyrin-repeat oncoprotein that interacts with CDK4 kinase and the S6 ATPase of the 26 S proteasome[J]. J Biol Chem, 2002, 277 (13): 10893-10902.
10Welchman RL, Gordon C, Mayer RJ. Ubiquitin and ubiquitin-like proteins as multifunctional signals[J]. Nat Rev Mol Cell Biol, 2005, 6 (8): 599-609.
11Krogan NJ, Lam MH, Fillingham J, et al. Proteasome involvement in the repair of DNA double-strand breaks[J]. Mol Cell, 2004, 16 (6): 1027-1034.
12Higashitsuji H, Higashitsuji H, Itoh K, et al. The oncoprotein gankyrin binds to MDM2/HDM2, enhancing ubiquitylation and degradation of p53[J]. Cancer Cell, 2005, 8 (1): 75-87.
13Krzywda S, Brzozowski AM, Higashitsuji H, et al. The crystal structure of gankyrin, an oncoprotein found in complexes with cyclin-dependent kinase 4, a 19 S proteasomal ATPase regulator, and the tumor suppressors Rb and p53[J]. J Biol Chem, 2004, 279 (2): 1541-1545.
14Chen J, Bai M, Ning C, et al. Gankyrin facilitates follicle-stimulating hormone-driven ovarian cancer cell proliferation through the PI3K/AKT/HIF-1α/cyclin D1 pathway[J]. Oncogene, 2016, 35 (19): 2506-2517.
(2015-11-23收稿;2016-04-22修回)
Down-regulation of Gankyrin Inhibits Gastric Cancer Cell Proliferation via Regulating β-Catenin/Cyclin D1 Signaling PathwayPANJie1,WANGWeimin1,CAIWeilong1,XUHongbao1,HANChunfan1,QIANFuchu2.1DepartmentofGeneralSurgery,2DepartmentofCentralLaboratory,HuzhouCentralHospital,Huzhou,ZhejiangProvince(313000)
Correspondence to: XU Hongbao, Email: 913131791@qq.com
Background: Gankyrin is an ankyrin repeat oncoprotein overexpressed and involved in the tumorigenesis and progression of various cancers. Aims: To investigate the effect and underlying mechanism of down-regulation of gankyrin expression on proliferation of gastric cancer cells. Methods: Lentivirus vector carrying gankyrin-targeted siRNA was transfected into human gastric cancer cell line MKN28. Cell proliferation, cell cycle distribution and β-catenin/cyclin D1 signaling pathway was analyzed by MTT assay, flow cytometry and Western blotting, respectively, in gankyrin-silenced MKN28 cells and control cells. Results: The transfection efficiency of lentivirus vector was more than 90%, and the protein expression of gankyrin in gankyrin siRNA transfected MKN28 cells was significantly repressed (P<0.01). Compared with cells transfected with control lentivirus and cells without transfection, MKN28 cells transfected with gankyrin siRNA showed markedly repressed cell growth after 3-day-culture; the proportion of cells in cell cycle G1 phase was significantly increased, and that in S phase was significantly decreased; down-regulated expression of β-catenin and cyclin D1 was observed (Pall <0.01). Conclusions: Down-regulation of gankyrin expression in gastric cancer cells may induce cell cycle G1 phase arrest and inhibit cell proliferation by suppressing β-catenin/cyclin D1 signaling pathway. Gankyrin might be a promising novel target for targeted therapy of gastric cancer.
Key wordsGankyrin;Stomach Neoplasms;RNA Interference;Cell Proliferation;Cell Cycle;
DOI:10.3969/j.issn.1008-7125.2016.05.006
*Email: 905153254@qq.com
#本文通信作者,Email: 913131791@qq.com

