简化MELD评分可准确区分乙型肝炎相关肝硬化急性失代偿患者为不同短期预后群体*
陈柳莹 尹 珊 王十锦 张楠楠 李 海
上海交通大学医学院附属仁济医院消化内科 上海市消化疾病研究所(200001)
·论著·
简化MELD评分可准确区分乙型肝炎相关肝硬化急性失代偿患者为不同短期预后群体*
陈柳莹#尹珊王十锦张楠楠李海&
上海交通大学医学院附属仁济医院消化内科上海市消化疾病研究所(200001)
背景:对肝硬化急性失代偿(AD)患者而言,在入院初期准确进行预后判断具有重要临床意义。CLIF-C OF、MELD、MELD-Na评分为较好的短期预后预测模型,但评分方法复杂在一定程度上限制了它们的使用。目的:提出更简单、客观的简化MELD评分系统,以期准确预测乙型肝炎相关肝硬化AD患者的短期预后。方法:回顾性连续纳入2005年1月—2010年12月上海仁济医院住院乙型肝炎相关肝硬化AD患者共890例,收集患者临床数据和预后信息。计算入院当天简化MELD评分(含总胆红素、国际标准化比值、肌酐三项指标),根据评分及其对应的28 d 死亡率进行预后分群。以Kaplan-Meier生存曲线比较各群体1年累积生存率,以ROC曲线分析各预后模型预测28 d死亡的预测效能。结果:根据入院当天简化MELD评分可将乙型肝炎相关肝硬化AD患者分为低、中、高28 d 死亡率和不同中长期预后群体,三组对应评分分别为0~2分、3分和4~6分,28 d死亡率分别为5.5%、19.8% 和48.6%。简化MELD评分预测28 d死亡的预测效能与CLIF-C OF、MELD、MELD-Na评分无明显差异,ROC曲线下面积分别为0.828、0.831、0.828和0.830。结论:简化MELD评分可准确地在入院当天将乙型肝炎相关肝硬化AD患者区分为低、中、高28 d死亡率群体,评分方法简单,便于临床应用。
关键词乙型肝炎;肝硬化;急性失代偿;预后;MELD评分
肝硬化在组织学上是由肝脏慢性损伤引起的肝纤维化和假小叶形成,可导致患者出现门静脉高压以及各类并发症。根据预后差异,肝硬化可分为不同临床预后阶段[1],其中肝硬化急性失代偿(acute decompensation, AD)患者年死亡率达 10%~25%;部分AD患者可于短期内进展至多器官功能衰竭,28 d死亡率急剧升高[2-4]。因此,对肝硬化AD患者而言,在入院初期准确进行预后判断对于及时制定有效治疗策略具有重要意义。研究表明慢性肝功能衰竭协会-器官功能衰竭评分(Chronic Liver Failure-Consortium Organ Failure score, CLIF-C OFs)、终末期肝病模型评分(Model of End-stage Liver Disease score, MELDs)和终末期肝病模型-钠评分(MELD-Sodium score, MELD-Nas)均为较好的肝硬化AD患者短期预后预测模型[4-7],然而CLIF-C OF评分涉及肝脏、肾脏以及神经、凝血、呼吸、循环六大器官/系统功能的评价,指标较多,评分方法复杂,且对神经、循环系统功能衰竭的评价不尽客观,MELD评分则需进行自然对数运算,用于区分不同预后群体的临界值亦难以统一,这些缺点在一定程度上限制了它们的使用。本研究提出了更简单、客观的简化MELD评分系统,以期准确预测乙型肝炎相关肝硬化AD患者的短期预后。
对象与方法
一、研究对象
回顾性连续纳入2005年1月1日—2010年12月31日上海交通大学医学院附属仁济医院住院乙型肝炎相关慢性肝病伴AD患者。纳入标准:①HBsAg持续阳性>6个月,明确为乙型肝炎相关慢性肝病;②入院前1个月内有AD表现(腹水、肝性脑病、食管胃底静脉曲张破裂出血或感染,包括肺部感染、泌尿系统感染、自发性细菌性腹膜炎、菌血症或脓毒血症、皮肤或软组织感染等);③本次入院前或本次入院有肝硬化证据(影像学、临床门静脉高压征象或肝活检病理)。排除标准:①年龄<15周岁或≥80周岁;②妊娠期女性;③恶性肿瘤;④严重其他器官/系统慢性疾病。研究方案经医院医学伦理委员会审核批准。
二、资料收集
通过查阅病史收集入组患者以下临床数据:性别、年龄、主诉、现病史、慢性肝病病因、既往失代偿史、抗病毒用药史、影像学检查结果、入院当天实验室检查结果,并通过查阅病史和电话随访获得患者出院后1年的生存情况。死亡率以无移植死亡率表示,即接受肝移植术的患者视为失访。
三、简化MELD评分定义
参考亚太肝脏研究学会(APASL)关于严重肝功能损伤和欧洲肝脏研究学会(EASL)CANONIC小组关于器官/系统功能衰竭的评价标准,将简化MELD评分定义如下:①肝脏:0分,总胆红素(TB)<85.5 μmol/L;1分,85.5 μmol/L≤TB<205.2 μmol/L;2分,TB≥205.2 μmol/L。②凝血:0分,国际标准化比值(INR)<1.5;1分,1.5≤INR<2.5;2分,INR≥2.5。③肾脏:0分,血肌酐(Cr)<132.6 μmol/L;1分,132.6 μmol/L≤Cr<176.8 μmol/L;2分,Cr≥176.8 μmol/L 或行肾脏替代治疗。总分0~6分。
四、统计学分析
结果
一、患者基本特征
共890例乙型肝炎相关肝硬化AD患者纳入研究,平均年龄(50.0±11.2)岁,男性占76.7%(683例)。90.7%的患者肝硬化病因为单纯乙型肝炎病毒 (HBV)感染;绝大多数患者HBV DNA阳性(≥500 拷贝/mL),33.5%病毒>1×105拷贝/mL;44.9%的患者既往无失代偿史;患者入院时TB和转氨酶水平较高(表1)。
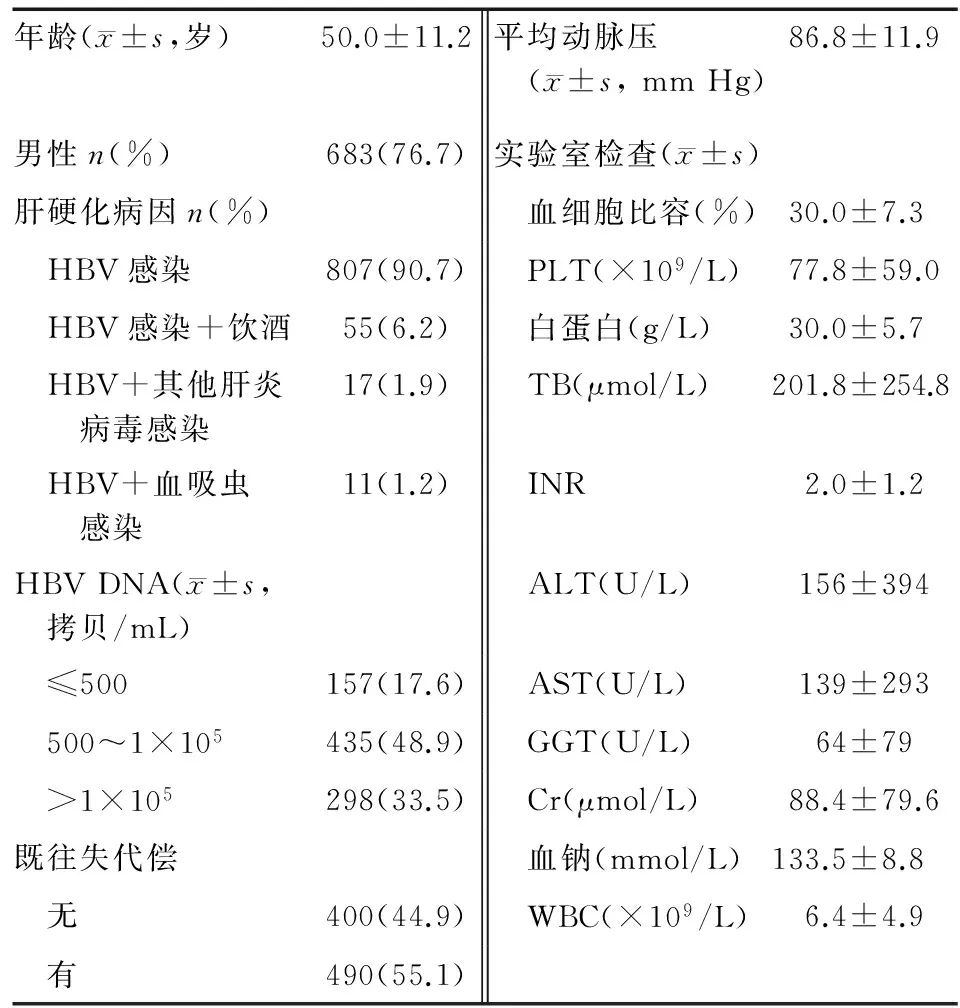
表1 890例患者入院时临床特征
二、简化MELD评分各分值患者28 d死亡率
入院当天简化MELD评分为0~6分者分别有317、164、104、126、123、23和33例,28 d死亡率分别为3.8%(12例)、6.1%(10例)、9.6%(10例)、19.8%(25例)、43.9%(54例)、56.5%(13例)和60.6%(20例)。根据28 d死亡率数据,可将患者分为3个群体:组1为低28 d死亡率组,简化MELD评分0~2分;组2为中28 d死亡率组,简化MELD评分3分;组3为高28 d死亡率组,简化MELD评分4~6分。三组28 d死亡率分别为5.5%(32/585)、19.8%(25/126)和48.6%(87/179),任意两组间比较差异均有统计学意义(P<0.001)。
三、低、中、高28 d死亡率组患者入院时临床特征比较
低、中、高28 d死亡率组(组1、组2、组3)患者入院时临床特征见表2。与组1和组2相比,组3患者年龄最轻[(43.8±10.7)岁],既往无失代偿史者比率最高(55.9%),TB、INR、ALT、AST、Cr、WBC显著升高,血钠则相对较低。进一步行组1与组2间比较,结果显示组2患者年龄更轻(P<0.001),TB、INR、ALT、AST、WBC更高(P均<0.001),血钠更低(P<0.001),两组间既往无失代偿史者比率(P=0.573)和Cr水平(P=0.931)则无明显差异。
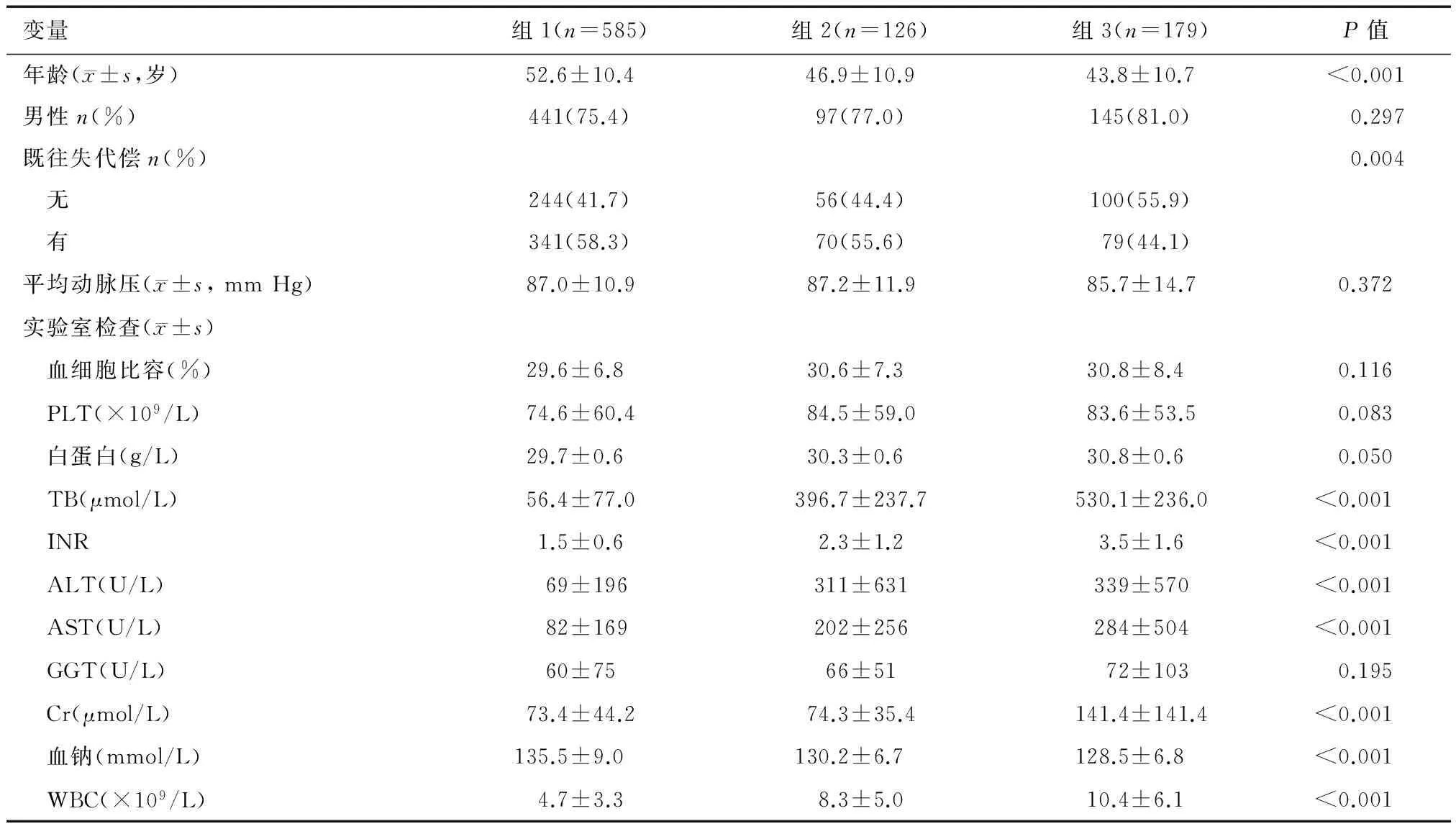
表2 低、中、高28 d死亡率组患者入院时临床特征比较
四、低、中、高28 d死亡率组患者1年累积生存率比较
Kaplan-Meier生存曲线显示,组1患者90 d、180 d、360 d累积生存率分别为87.5%、85.4%和79.6%,组2分别为57.3%、48.4%和45.3%,组3分别为23.0%、20.7%和20.7%。组1患者中长期预后最好,组3患者最差,任意两组间比较P均<0.000 1(图1)。
五、简化MELD评分预测28 d死亡的预测效能
890例患者入院时MELD、MELD-Na、CLIF-C OF、简化MELD评分分别为17.6±10.7、20.2±20.6、7.9±2.4和1.7±1.8,4项评分预测28 d死亡的AUC分别为0.828±0.020、0.830±0.017、0.831±0.019和0.828±0.020,任意两组间比较差异均无统计学意义(P>0.05)(图2)。
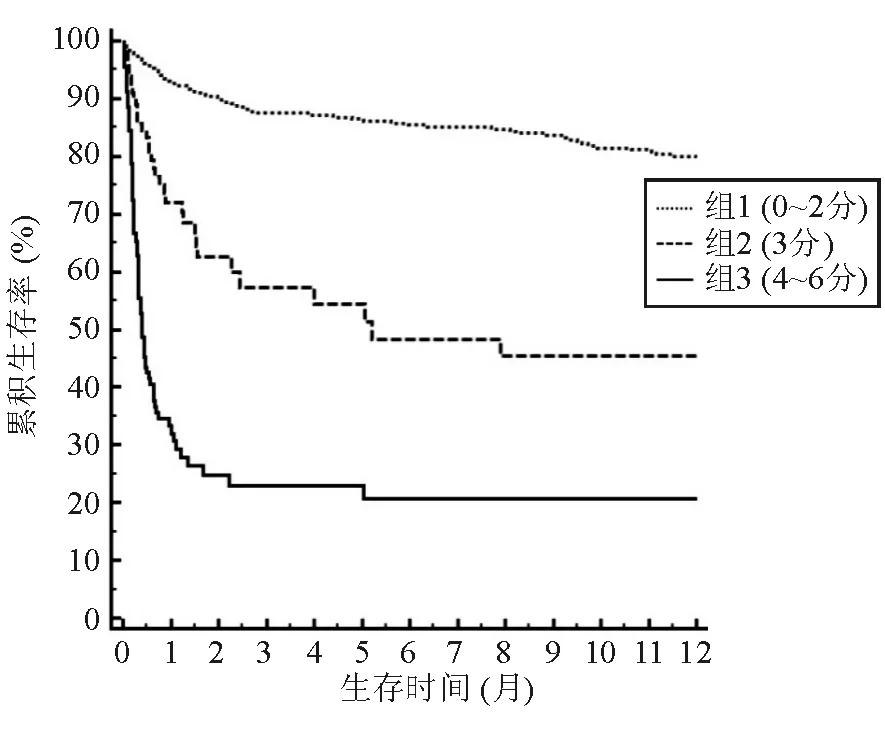
图1 低、中、高28 d死亡率组患者Kaplan-Meier生存曲线

图2不同预后模型预测乙型肝炎相关肝硬化AD患者 28 d 死亡的ROC曲线
讨论
肝硬化AD患者是一个混杂的群体,其中一部分疾病进展迅速,出现多器官功能衰竭,短期死亡率高,即所谓的慢加急性肝功能衰竭(acute-on-chronic liver failure, ACLF),早期准确识别这一群体是肝硬化AD临床诊治中的关键问题。EASL的前瞻性研究提示应用慢性肝功能衰竭-序贯性器官功能衰竭评分(Chronic Liver Failure-Sequential Organ Failure Assessment score, CLIF-SOFAs)及其简化版本CLIF-C OFs能成功区分出上述高死亡率患者群体[2,4]。然而,CLIF-C OFs中神经、循环系统功能衰竭的评价部分依赖于主观判断,使其临床应用受到限制。而同样对肝硬化AD有较好预后预测能力的MELD、MELD-Na评分则存在评分计算复杂、区分不同预后群体的临界值难以确定或统一等缺陷。因此,本研究利用MELD评分中的TB、INR和Cr三项指标组成评分方法更为简单的简化MELD评分,并对其预测效能进行评价。简化MELD评分中的TB、INR和Cr按严重程度简化为0、1、2分,单项评分达到2分即代表相关器官/系统功能衰竭,其最终评分基于完全客观的血清学指标,避免了神经、循环系统功能衰竭评价时混杂的部分主观因素的干扰,内容更简单、客观,便于临床应用。
本研究分析显示,根据入院首日简化MELD评分,可从乙型肝炎相关肝硬化AD患者中成功区分出高28 d死亡率群体(28 d死亡率>15%),即评分0~2分的患者归为普通肝硬化AD群体,评分3~6分的患者28 d死亡率>15%,归为ACLF群体。进一步的分析显示,评分为4~6分的患者有着极高的28 d死亡率(>40%),而评分为3分者28 d死亡率明显低于评分为4~6分者(19.8%对48.6%),表明简化MELD评分可简单、快速地将ACLF患者分成两组不同预后群体。此外,对简化MELD评分分别为0~2分、3分和4~6分患者入院时临床特征的比较显示,患者入院时肝损伤愈重、外周血WBC愈高,28 d死亡率愈高,合并肾功能损害者死亡率高于未合并肾功能损害者,与目前对ACLF病理生理学的认识相一致[8-9]。
肾功能损害是肝硬化患者的严重并发症之一,合并肾功能衰竭的肝硬化患者死亡率显著升高[10]。肝硬化患者的肾功能损害有多种类型,其发生原因主要包括门静脉高压出血引起的低血容量、感染、肝肾综合征(hepatorenal syndrome, HRS)等,其中HRS主要分为2型:1型HRS进展迅速,2型HRS进展较慢,多合并难治性腹水[11-14]。目前对ACLF患者肾功能损害的研究相对较少,但已明确仅单一肾功能衰竭的患者或肾功能失代偿合并单个肾外器官/系统功能衰竭的患者为ACLF 1级[2],低钠血症与ACLF患者预后不良相关[14]。本研究亦发现有着更高28 d死亡率的ACLF患者(组3)肾功能损害更严重,血钠水平更低。
以Kaplan-Meier生存曲线比较由简化MELD评分区分出的低、中、高28 d死亡率组患者的1年累积生存率,发现中、高28 d死亡率组(评分3分和4~6分)前5个月累积生存率降幅明显,后7个月维持稳定,而低28 d死亡率组(评分0~2分)前5个月累积生存率下降不明显,后7个月继续呈缓慢下降趋势,体现了ACLF病情进展迅速(短期内大量死亡)但可逆(病情逆转者预后良好)的特征。本研究中高28 d死亡率组患者年龄较轻、既往多无失代偿史以及存在多器官功能衰竭的特征与既往研究结果相符[2]。ROC曲线分析显示,简化MELD评分预测肝硬化AD患者28 d死亡的预测效能与临床常用的MELD、MELD-Na评分以及CLIF-C OF评分相同。
综上所述,本研究定义的简化MELD评分可准确地在入院当天将乙型肝炎相关肝硬化AD患者区分为低、中、高28 d死亡率群体,评分方法简单,便于临床应用。该结果尚需其他医学中心的数据加以验证,其动态应用亦有待进一步研究。
参考文献
1 Tsochatzis EA, Bosch J, Burroughs AK. Liver cirrhosis[J]. Lancet, 2014, 383 (9930): 1749-1761.
2 Moreau R, Jalan R, Gines P, et al; CANONIC Study Investigators of the EASL-CLIF Consortium. Acute-on-chronic liver failure is a distinct syndrome that develops in patients with acute decompensation of cirrhosis[J]. Gastroenterology, 2013, 144 (7): 1426-1437, 1437.e1-e9.
3 Arvaniti V, D’Amico G, Fede G, et al. Infections in patients with cirrhosis increase mortality four-fold and should be used in determining prognosis[J]. Gastroenterology, 2010, 139 (4): 1246-1256, 1256.e1-e5.
4 Jalan R, Saliba F, Pavesi M, et al; CANONIC study investigators of the EASL-CLIF Consortium. Development and validation of a prognostic score to predict mortality in patients with acute-on-chronic liver failure[J]. J Hepatol, 2014, 61 (5): 1038-1047.
5 Zhang Q, Han T, Li Y, et al. Predictors of progression into acute-on-chronic liver failure from acute deterioration of pre-existing chronic liver disease[J]. Hepatol Res, 2016, 46 (4): 320-328.
6 Dupont B, Delvincourt M, Koné M, et al. Retrospective evaluation of prognostic score performances in cirrhotic patients admitted to an intermediate care unit[J]. Dig Liver Dis, 2015, 47 (8): 675-681.
7 Ha JM, Sohn W, Cho JY, et al. Static and dynamic prognostic factors for hepatitis-B-related acute-on-chronic liver failure[J]. Clin Mol Hepatol, 2015, 21 (3): 232-241.
8 Li H, Xia Q, Zeng B, et al. Submassive hepatic necrosis distinguishes HBV-associated acute on chronic liver failure from cirrhotic patients with acute decompensation[J]. J Hepatol, 2015, 63 (1): 50-59.
9 Moreau R, Jalan R, Arroyo V. Acute-on-Chronic Liver Failure: Recent Concepts[J]. J Clin Exp Hepatol, 2015, 5 (1): 81-85.
10Fede G, D’Amico G, Arvaniti V, et al. Renal failure and cirrhosis: a systematic review of mortality and prognosis[J]. J Hepatol, 2012, 56 (4): 810-818.
11Egerod Israelsen M, Gluud LL, Krag A. Acute kidney injury and hepatorenal syndrome in cirrhosis[J]. J Gastroenterol Hepatol, 2015, 30 (2): 236-243.
12Fagundes C, Barreto R, Guevara M, et al. A modified acute kidney injury classification for diagnosis and risk stratification of impairment of kidney function in cirrhosis[J]. J Hepatol, 2013, 59 (3): 474-481.
13Angeli P, Merkel C. Pathogenesis and management of hepatorenal syndrome in patients with cirrhosis[J]. J Hepatol, 2008, 48 Suppl 1: S93-S103.
14Cárdenas A, Ginès P. Acute-on-chronic liver failure: the kidneys[J]. Curr Opin Crit Care, 2011, 17 (2): 184-189.
(2015-12-01收稿)
Simplified MELD Score Accurately Classifies HBV-related Cirrhotic Patients with Acute Decompensation into Different Short-term Prognostic GroupsCHENLiuying,YINShan,WANGShijin,ZHANGNannan,LIHai.DivisionofGastroenterologyandHepatology,RenJiHospital,SchoolofMedicine,ShanghaiJiaoTongUniversity;ShanghaiInstituteofDigestiveDisease,Shanghai(200001)
Correspondence to: LI Hai, Email: haili_17@126.com
Background: For patients with liver cirrhosis and acute decompensation (AD), it is of great clinical importance to predict short-term mortality at admission. It has been reported that CLIF-C OF, MELD and MELD-Na score can accurately predict the short-term mortality, but all these scoring systems are complicated and have limits in their application. Aims: To define a simple and objective scoring system -- simplified MELD score for short-term mortality prediction in HBV-related cirrhotic patients with AD. Methods: A total of 890 consecutive HBV-related cirrhotic patients with AD hospitalized during Jan. 2005 to Dec. 2010 at Shanghai Ren Ji Hospital were enrolled retrospectively. Clinical data and patients’ outcome were collected, and simplified MELD score was calculated by using total bilirubin, international normalized ratio and creatinine values at admission. Patients were classified into different prognostic groups according to their 28-day mortalities and simplified MELD score. Kaplan-Meier survival curve was used to analyze the 1-year accumulate survival rate, and ROC curve was used to evaluate the performance of different scoring systems in predicting 28-day mortality. Results: Simplified MELD score at admission could classify HBV-related cirrhotic patients with AD into low, moderate and high 28-day mortality groups and different long-term prognostic groups; the score of low, moderate and high 28-day mortality group was 0-2, 3 and 4-6, respectively, and the corresponding mortality was 5.5%, 19.8% and 48.6%, respectively. Simplified MELD score had the same good performance as compared with the CLIF-C OF, MELD and MELD-Na scores in predicting 28-day mortality, the area under ROC curve was 0.828, 0.831, 0.828 and 0.830, respectively. Conclusions: Simplified MELD score can accurately classify HBV-related cirrhotic patients with AD into low, moderate and high 28-day mortality groups at admission. It is convenient for using in clinical practice.
Key wordsHepatitis B;Liver Cirrhosis;Acute Decompensation;Prognosis;MELD Score
DOI:10.3969/j.issn.1008-7125.2016.05.002
*基金项目:国家自然科学基金面上项目(30971333,81170421,81470869)
#Email: jinniuzuo400@126.com
&本文通信作者,Email: haili_17@126.com

