血清miR-192和miR-29a在肝硬化无创诊断中的应用价值*
叶长虹 林 霖 褚以忞 吉 猛 曾 欣 林 勇&
第二军医大学附属长征医院消化内科1(200003) 上海交通大学医学院附属同仁医院内镜室2
血清miR-192和miR-29a在肝硬化无创诊断中的应用价值*
叶长虹1#林霖1#褚以忞2#吉猛1曾欣1林勇1&
第二军医大学附属长征医院消化内科1(200003)上海交通大学医学院附属同仁医院内镜室2
背景:早期诊断肝硬化并予早期干预可阻止病情进展,避免或延缓肝硬化失代偿发生。筛选血清学无创标记物是肝硬化临床诊断和评估研究的重要内容。目的:评价血清miR-192和miR-29a在肝硬化无创诊断中的应用价值。方法:通过文献检索和real-time PCR筛选验证发现在肝硬化患者血清中差异表达明显的miRNAs——miR-192和miR-29a,以real-time PCR检测两者在120例肝硬化患者和76名健康对照者血清中的表达水平;二元logistic回归建立两者联合检测诊断肝硬化的数学模型,ROC曲线评估诊断效能。结果:肝硬化组血清miR-192表达水平显著高于对照组,血清miR-29a表达水平则显著低于对照组(P<0.001)。由两者联合检测数学模型计算得到的风险评分诊断肝硬化的价值明显优于单一指标检测[ROC曲线下面积(AUC):0.968对0.887和0.933],且优于临床常用肝硬化血清学无创诊断指标APRI、FIB-4和ARR(AUC: 0.796、0.793和0.571)。血清miR-192、miR-29a表达水平以及两者联合检测的风险评分与肝硬化Child-Pugh分级显著相关(P<0.05)。结论:miR-192、miR-29a以及两者联合检测的风险评分可作为肝硬化无创诊断和评估新的血清分子标记物。
关键词血清;生物学标记;肝硬化;无创诊断;miR-192;miR-29a
肝硬化是各种慢性肝病的终末期改变,可能诱发门静脉高压和肝功能衰竭,并导致各种并发症[1]。目前,肝硬化在全球常见死因中居第14位,在发达国家中的发病率和死亡率均呈上升趋势[2]。失代偿期肝硬化病情进展迅速、预后差,且缺乏有效治疗手段,而早期诊断肝硬化并予早期干预可阻止病情进展,避免或延缓肝硬化失代偿发生[2]。肝活检是肝硬化诊断的金标准,但有发生出血、肝脏损伤等严重并发症的风险,并存在取样以及检查者误差,应用受到一定限制[3]。因此,探索更为方便、有效、无创的临床指标以代替肝活检用于肝硬化的早期诊断成为相关领域的研究热点。
微RNA(microRNAs, miRNAs)是一组由18~24个碱基组成的非蛋白质编码小分子RNA,可作用于靶mRNA的3’-非翻译区(3’-UTR),在转录后水平调控基因表达[4]。近年研究发现,miRNAs不仅稳定存在于组织细胞中,一些miRNAs在血清中亦有稳定表达,并与肿瘤以及多种慢性疾病相关,可作为诸多疾病诊断、治疗和预后评估的生物学标记物[5]。本研究通过文献检索和血清miRNAs检测,筛选出在肝硬化患者血清中差异表达较明显的miR-192和miR-29a并加以验证,并进一步评价两者在肝硬化无创诊断中的应用价值。
资料与方法
一、文献检索和miRNAs筛选验证
以 “miRNA”、“liver cirrhosis”、“liver fibrosis”等为关键词检索PubMed,以“微RNA”、“肝硬化”、“肝纤维化”等为关键词组合检索中国知网、万方、维普数据库,检索年限为2000年1月—2014年6月,获取有关肝硬化、肝纤维化患者血清差异表达miRNAs的文献,筛选肝硬化相关候选miRNAs。
收集2011年7月—2011年10月上海长征医院消化内科诊治的20例肝硬化患者的血清样本,用于候选miRNAs的筛选验证,其中男性12例,女性8例,年龄42~69岁。肝硬化组入选标准:①年龄>18周岁,性别不限;②有肝功能受损和(或)门静脉高压的临床表现,经临床、影像学或肝活检确诊为肝硬化。肝硬化组排除标准:①近1个月内发生各种感染、消化道出血;②确诊或怀疑合并恶性肿瘤(含原发性肝细胞癌),AFP≥20 ng/mL者须经CT、MRI等影像学检查排除肝脏肿瘤;③有严重血液系统疾病,如淋巴瘤、白血病等或结缔组织病;④有明显心、肺、肾脏疾病;⑤HIV或梅毒阳性;⑥妊娠或哺乳期女性。同期收集体检中心20名健康志愿者的血清样本作为对照组,其中男性12例,女性8例,年龄41~69岁。对照组入选标准:①年龄>18周岁,性别不限;②有完整病史资料和实验室、辅助检查结果。对照组排除标准:①各种急慢性肝病,包括肝功能指标异常、HBsAg或HBV DNA阳性、HCV抗体或HCV RNA阳性、自身免疫性肝病、非酒精性脂肪性肝病;②长期大量饮酒或近2周内大量饮酒;③同肝硬化组排除标准①~⑥。血清样本采集过程符合伦理要求并获得知情同意,所采集样本以real-time PCR行miRNAs表达检测(方法见下文)。
二、血清miR-192、miR-29a在肝硬化无创诊断中的应用
1. 一般资料:收集2012年1月—2014年11月上海长征医院消化内科诊治的肝硬化患者120例,其中男性62例,女性58例,年龄35~73岁。同期收集体检中心76名健康志愿者作为对照组,其中男性36例,女性40例,年龄35~70岁。肝硬化组和对照组入选和排除标准同miRNAs筛选验证步骤。采集两组临床资料,计算临床常用肝硬化血清学无创诊断指标,包括AST/血小板比值指数(AST/PLT ratio index, APRI)、基于四因素的肝纤维化指数(fibrosis index based on the 4 factors, FIB-4)和AST/ALT比值(AST/ALT ratio, AAR)。血清样本和临床资料采集过程符合伦理要求并获得知情同意。肝功能分级采用Child-Pugh分级,根据血清总胆红素(total bilirubin, TBIL)、白蛋白(albumin, ALB)、凝血酶原时间(prothrombin time, PT)、腹水和肝性脑病情况,分为A、B、C三级。
2. Real-time PCR检测miRNAs表达:取350 μL血清,加入内参cel-miR-238(2 μmol/L)1 μL(上海吉玛制药技术有限公司),以mirVanaTMPARISTMRNA and Native Protein Purification Kit(AmbionTM, Thermo Fisher Scientific Inc.)提取总RNA,95 ℃预热洗脱液100 μL溶解,检测质量后-80 ℃冰箱保存。
以PrimeScriptTMRT reagent Kit(Perfect Real Time)(TAKARA BIO INC.)行逆转录反应合成cDNA。5 μL逆转录体系中含3 μL总RNA、1 μL逆转录酶混合物、0.5 μL cel-miR-238逆转录引物、0.5 μL miR-192或miR-29a逆转录引物(表1)。反应条件:16 ℃ 30 min,30 ℃ 10 min,42 ℃ 30 min,85 ℃ 5 min,4 ℃保存。

表1 miR-192、miR-29a和内参引物以及内参序列
采用Applied Biosystems 7900HT快速实时荧光定量PCR系统(Thermo Fisher Scientific Inc.)行real-time PCR,所用试剂盒为SYBR®Premix Ex TaqTM(Tli RNaseH Plus)(TAKARA BIO INC.)。总反应体系10 μL,内含2×SYBR Green荧光混悬液5 μL、各miRNAs forward引物和通用reverse引物各0.2 μL(表1)、cDNA 0.8 μL、去RNA酶水3.8 μL。反应条件:95 ℃预变性30 s;95 ℃ 5 s,60 ℃ 34 s,40个循环;95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s。2-ΔΔCt法计算目的miRNAs相对表达量。每一样本设3个复孔,结果取均值。
三、统计学分析
结果
一、候选miRNAs的筛选验证
应用所设定的关键词检索PubMed、中国知网、万方、维普数据库,共得到有关肝硬化、肝纤维化患者血清差异表达miRNAs的文献233篇,文献中与肝硬化、肝纤维化相关的血清差异表达miRNAs主要包括miR-21、miR-122、miR-571、miR-155、miR-194、miR-29a、miR-370、miR-192、miR-652。设计针对上述9个候选miRNAs的引物序列,取用于候选miRNAs筛选验证的肝硬化患者和对照者的血清样本各20例,以real-time PCR进行检测鉴定,结果显示肝硬化组miR-192、miR-571表达明显上调,miR-29a、miR-155、miR-652表达明显下调,其中miR-192、miR-29a在两组间表达差异较为明显(图1)。
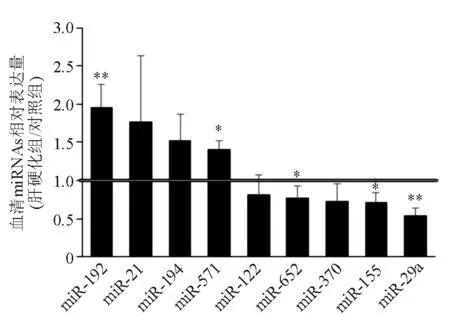
肝硬化组与对照组比较,*P<0.05,**P<0.01
图19个候选血清miRNAs在肝硬化组与对照组间的差异表达
二、血清miR-192、miR-29a在肝硬化无创诊断中的应用价值
1. 一般资料:肝硬化组和对照组一般资料见表2。肝硬化病因:乙型肝炎63例,丙型肝炎9例,自身免疫性肝炎8例,血吸虫性肝病10例,酒精性15例,原发性胆汁性肝硬化8例,肝豆状核变性2例,隐源性5例;肝硬化Child-Pugh分级:A级47例,B级39例,C级34例。与对照组相比,肝硬化组TBIL明显升高,ALT、AST有所升高,ALB、PLT、纤维蛋白原(FIB)下降,PT延长,国际标准化比值(INR)增高,APRI、FIB-4值分别为1.710±0.162和6.345±0.484,与对照组相比差异均有统计学意义(P<0.05),两组间凝血酶时间(TT)、AAR值无明显差异(P>0.05)。

表2 肝硬化组和对照组一般资料比较
2. 血清miR-192、miR-29a表达水平:real-time PCR检测结果显示,肝硬化组血清miR-192表达水平显著高于对照组,约为对照组的3.39倍(P<0.001)(图2A),血清miR-29a表达水平则显著低于对照组,约为对照组的16.9%(P<0.001)(图2B)。
除乙型肝炎外,本组由其他病因导致的肝硬化例数偏少,为明确血清miR-192、miR-29a表达变化是否与肝硬化病因有关,本研究进一步比较了两者在乙型肝炎和非乙型肝炎肝硬化组间的表达情况,结果显示两组间差异无统计学意义(P>0.05)(图3)。
3. 血清miR-192、miR-29a诊断效能分析:ROC曲线分析显示,以1.502为界值,血清miR-192诊断肝硬化的敏感性为84.17%,特异性为86.84%,ROC曲线下面积(AUC)为0.887(图4A);以0.287为界值,血清miR-29a诊断肝硬化的敏感性为89.17%,特异性为86.84%,AUC为0.933(图4B),两者对肝硬化均有较高的诊断价值。
采用二元logistic回归推导出血清miR-192和miR-29a联合检测诊断肝硬化的新数学模型:风险评分=1.978-11.320×miR-29a+1.183×miR-192。ROC曲线分析显示,以1.431为界值,风险评分>1.431诊断肝硬化的敏感性为87.50%,特异性为97.37%,AUC为0.968(图4C),诊断价值明显优于单一指标检测,尤其是在诊断特异性方面。APRI、FIB-4、AAR三项临床常用血清学无创诊断指标诊断肝硬化的AUC分别为0.796、0.793和0.571(图4D、4E、4F),诊断价值均低于血清miR-192、miR-29a两者单独或联合检测(表3)。
4. 血清miR-192、miR-29a与肝硬化严重程度的相关性:Spearman秩相关系数分析显示,血清miR-192、miR-29a表达水平以及两者联合检测的风险评分与肝硬化Child-Pugh分级显著相关(miR-192:P=0.021,rs=0.211;miR-29a:P=0.004,rs=-0.259;联合检测风险评分:P=0.009,rs=0.238)(图5)。

图2 血清miR-192、miR-29a在肝硬化组与对照组间的差异表达

图3 血清miR-192、miR-29a在乙型肝炎与非乙型肝炎肝硬化组间的差异表达
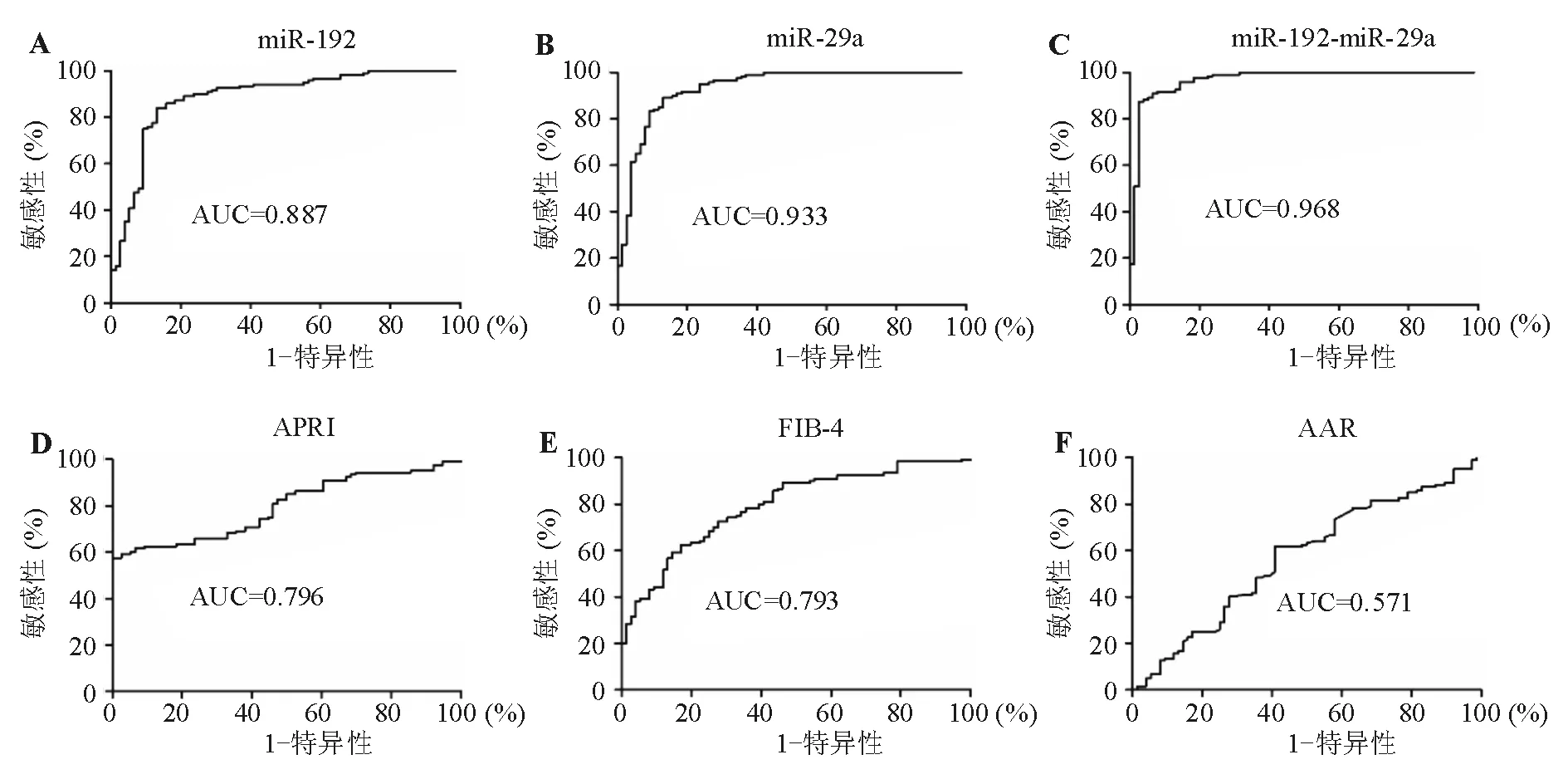
图4 不同血清学无创指标诊断肝硬化AUC比较
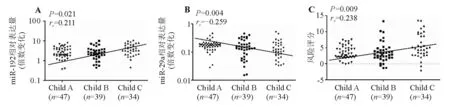
图5 血清miR-192、miR-29a表达水平以及两者联合检测风险评分与肝硬化Child-Pugh分级的相关性
讨论
近年肝硬化发病率逐年升高,严重危害人类健康。肝硬化的早期诊断和评估是临床工作中的难点,目前尚缺乏特异性、敏感性俱佳的血清学无创诊断方法,筛选血清学无创标记物是肝硬化临床诊断和评估研究的重要内容。晚近研究表明,多种纤维化疾病患者外周血中存在稳定表达的miRNAs,筛选并鉴定出一个或数个在肝纤维化/肝硬化患者血清中特异且稳定表达的miRNA作为无创生物学标记物具有很高的临床应用价值。然而目前血清miRNAs检测方法尚有待改进,特别是缺乏稳定、可靠的内参照物用于校准血清miRNAs检测值。既往研究中,RNU6B(U6)常被用作血清miRNAs real-time PCR检测的内参照物,但其血清表达水平个体差异较大且在肝纤维化患者中常较健康对照者显著下调,并不适用于人肝硬化相关血清miRNAs检测值的校准[6]。为建立准确的参照标准,多数研究者建议插入外源性RNA(spiked-in RNA)[7-9]。本研究于提取总RNA前在待测血清样本中加入非人类同源的人工合成秀丽线虫cel-miR-238作为血清miRNAs检测的内参照物[10-11],前期实验结果显示加入的外源性cel-miR-238在个体间表达稳定,是相对理想的内参照物,可明显提高血清miRNAs real-time PCR检测的准确性。
miR-192和miR-29均为与纤维化明显相关的miRNA,miR-29尚与多种恶性肿瘤如胃癌、乳腺癌、结直肠癌等关系密切,起抑癌基因作用。研究表明,在CCl4或胆总管结扎诱导的肝纤维化模型中,miR-29家族(包括miR-29a、miR-29b、miR-29c)表达均显著下调;在小鼠肝星状细胞(HSCs)中过表达miR-29可抑制HSCs活化及其细胞外基质蛋白表达[12-14]。关于miR-192在肝纤维化中作用的研究不多,但其参与肾纤维化进程已得到证实。研究发现miR-192可通过作用于E-box抑制剂Zeb1/2以及调控其他肾脏miRNAs增加胶原基因表达;抑制糖尿病小鼠肾脏miR-192可上调Zeb1/2,从而抑制转化生长因子-β(TGF-β)、纤维连接蛋白和胶原基因表达,减少胶原合成,阻止肾纤维化进程[15-17]。
本研究结果证实,肝硬化患者的血清miR-192、miR-29a表达水平与健康对照者相比差异显著,其中miR-192表达明显上调,miR-29a表达明显下调,两者单独或联合检测用于诊断肝硬化的价值明显优于APRI、FIB-4、AAR三项传统肝硬化血清学无创诊断指标。此外,本研究证实血清miR-192、miR-29a表达水平以及两者联合检测的风险评分与肝硬化严重程度有较好的相关性,可能成为评估肝硬化程度较为理想的临床指标。本研究还发现血清miR-192、miR-29a表达水平在乙型肝炎与非乙型肝炎肝硬化组间无明显差异,表明两者与肝硬化病因无直接联系,而与病情进展关系更为密切。
综上所述,miR-192、miR-29a以及两者联合检测的风险评分可作为肝硬化无创诊断和评估新的血清分子标记物。本研究在研究设计和方法学方面仍存在一定缺陷,如血清miRNAs的检测仅在临床确诊肝硬化患者中进行、纳入的临床样本数量偏小、未能与肝活检结果进行比对等。后续研究将进一 步关注包括miR-192、miR-29a在内的血清miRNAs表达谱对不同程度肝纤维化和早期肝硬化的诊断价值。随着临床研究的不断深入以及样本量的逐步扩大,血清miRNAs检测将可能为肝硬化无创诊断提供新的临床依据和研究方向。
参考文献
1 Schuppan D, Afdhal NH. Liver cirrhosis[J]. Lancet, 2008, 371 (9615): 838-851.
2 Tsochatzis EA, Bosch J, Burroughs AK. Liver cirrhosis[J]. Lancet, 2014, 383 (9930): 1749-1761.
3 Bedossa P, Dargère D, Paradis V. Sampling variability of liver fibrosis in chronic hepatitis C[J]. Hepatology, 2003, 38 (6): 1449-1457.
4 Ambros V. The functions of animal microRNAs[J]. Nature, 2004, 431 (7006): 350-355.
5 Chen X, Ba Y, Ma L, et al. Characterization of microRNAs in serum: a novel class of biomarkers for diagnosis of cancer and other diseases[J]. Cell Res, 2008, 18 (10): 997-1006.
6 Benz F, Roderburg C, Vargas Cardenas D, et al. U6 is unsuitable for normalization of serum miRNA levels in patients with sepsis or liver fibrosis[J]. Exp Mol Med, 2013, 45: e42.
7 Yamada A, Cox MA, Gaffney KA, et al. Technical factors involved in the measurement of circulating microRNA biomarkers for the detection of colorectal neoplasia[J]. PLoS One, 2014, 9 (11): e112481.
8 Trebicka J, Anadol E, Elfimova N, et al. Hepatic and serum levels of miR-122 after chronic HCV-induced fibrosis[J]. J Hepatol, 2013, 58 (2): 234-239.
9 Elfimova N, Schlattjan M, Sowa JP, et al. Circulating microRNAs: promising candidates serving as novel biomarkers of acute hepatitis[J]. Front Physiol, 2012, 3: 476.
10McDonald JS, Milosevic D, Reddi HV, et al. Analysis of circulating microRNA: preanalytical and analytical challenges[J]. Clin Chem, 2011, 57 (6): 833-840.
11Chao A, Lai CH, Chen HC, et al. Serum microRNAs in clear cell carcinoma of the ovary[J]. Taiwan J Obstet Gynecol, 2014, 53 (4): 536-541.
12Roderburg C, Urban GW, Bettermann K, et al. Micro-RNA profiling reveals a role for miR-29 in human and murine liver fibrosis[J]. Hepatology, 2011, 53 (1): 209-218.
13Sekiya Y, Ogawa T, Yoshizato K, et al. Suppression of hepatic stellate cell activation by microRNA-29b[J]. Biochem Biophys Res Commun, 2011, 412 (1): 74-79.
14Bandyopadhyay S, Friedman RC, Marquez RT, et al. Hepatitis C virus infection and hepatic stellate cell activation downregulate miR-29: miR-29 overexpression reduces hepatitis C viral abundance in culture[J]. J Infect Dis, 2011, 203 (12): 1753-1762.
15Putta S, Lanting L, Sun G, et al. Inhibiting microRNA-192 ameliorates renal fibrosis in diabetic nephropathy[J]. J Am Soc Nephrol, 2012, 23 (3): 458-469.
16Jenkins RH, Martin J, Phillips AO, et al. Pleiotropy of microRNA-192 in the kidney[J]. Biochem Soc Trans, 2012, 40 (4): 762-767.
17Deshpande SD, Putta S, Wang M, et al. Transforming growth factor-β-induced cross talk between p53 and a microRNA in the pathogenesis of diabetic nephropathy[J]. Diabetes, 2013, 62 (9): 3151-3162.
(2016-03-28收稿;2016-04-04修回)
Value of Serum miR-192 and miR-29a for Non-invasive Diagnosis of Liver CirrhosisYEChanghong1,LINLin1,CHUYimin2,JIMeng1,ZENGXin1,LINYong1.1DepartmentofGastroenterology,ShanghaiChangzhengHospital,theSecondMilitaryMedicalUniversity,Shanghai(200003);2DepartmentofEndoscopy,TongrenHospital,ShanghaiJiaotongUniversitySchoolofMedicine,Shanghai
Correspondence to: LIN Yong, Email: linyongmd@163.com
Background: Diagnosis of liver cirrhosis in early stage with early intervention may stabilize disease progression, avoiding or delaying the occurrence of decompensation. Seeking non-invasive serum biomarkers is becoming an important topic in the diagnosis and assessment of liver cirrhosis. Aims: To study the value of serum miR-192 and miR-29a as non-invasive biomarkers for the diagnosis of liver cirrhosis. Methods: Differentially expressed serum miRNAs between patients with liver cirrhosis and healthy controls were screened through online literature retrieval and then confirmed by real-time PCR. Serum levels of two confirmed miRNAs, miR-192 and miR-29a were analyzed in 120 patients with liver cirrhosis and 76 healthy volunteers by real-time PCR. A mathematical model of combined detection of miR-192 and miR-29a for diagnosis of liver cirrhosis was established by binary logistic regression. The diagnostic performance of various non-invasive serum indicators was evaluated by ROC curve analysis. Results: Compared with healthy controls, expression level of serum miR-192 in cirrhotic patients was significantly increased and that of serum miR-29a was significantly reduced (P<0.001). The diagnostic performance of risk score obtained from mathematical model of combined detection of serum miR-192 and miR-29a was superior to that of single miRNA detection or other non-invasive serum indicators, such as APRI, FIB-4 and ARR, the areas under ROC curve of the above mentioned indicators were 0.968, 0.887, 0.933, 0.796, 0.793, and 0.571, respectively. Serum levels of miR-192, miR-29a and the risk score of their combined detection were significantly correlated with the stage of liver cirrhosis according to the Child-Pugh classification (P<0.05). Conclusions: Serum miR-192, miR-29a and the risk score of their combined detection might be novel non-invasive biomarkers for the diagnosis and assessment of liver cirrhosis.
Key wordsSerum;Biological Markers;Liver Cirrhosis;Non-Invasive Diagnosis;miR-192;miR-29a
DOI:10.3969/j.issn.1008-7125.2016.05.003
*基金项目:国家自然科学基金(81170403,81370551);教育部新世纪优秀人才支持计划(A类)
#共同第一作者,叶长虹,Email: ychdeyoujian@sohu.com;林霖, Email: linlin1989ll@126.com;褚以忞, Email: yimin_chu@163.com
&本文通信作者,Email: linyongmd@163.com

