Vero细胞微载体放大培养技术研究
毕军,王强,孙文
Vero细胞微载体放大培养技术研究
毕军,王强,孙文
作者单位:430081 武汉科技大学医学院(毕军、王强);200080 上海聆海生物科技有限公司(毕军);430207 武汉生物制品研究所有限责任公司(孙文)
目前,国内大部分疫苗企业仍采用传统的转瓶细胞培养工艺来生产病毒性疫苗,该方法存在细胞密度低、病毒滴度低、劳动强度大等缺点。20 世纪 70 年代,建立了微载体/生物反应器培养动物细胞的工艺[1],把悬浮培养和贴壁培养两种培养工艺融合在一起,兼有两者的优点,使得动物细胞工业化的大规模、高密度培养,以满足生物技术发展的需要,而细胞微载体放大培养就是其中的关键技术之一[2]。
本文通过胰酶消化微载体上 Vero 细胞,实现了 5 L 到 50 L 生物反应器的放大培养,为后续更大规模的生物反应器培养 Vero 细胞,生产病毒性疫苗奠定基础并积累经验。
1 材料与方法
1.1材料
1.1.1细胞株Vero细胞,编号为 CCL-81,来自美国典型菌种保藏中心(ATCC)。
1.1.2微载体Cytodex-1 购于美国 GE Healthcare 公司,经 PBS 水化处理后使用。生物反应器应用中,微载体密度为 10 g/L。
1.1.3主要试剂细胞培养基 DMEM 购自美国 Gibco公司,加 8% ~ 10% 小牛血清,pH 7.0 ~ 7.2;细胞消化液为 0.25% 胰酶加 0.01% EDTA,其中胰酶购自美国 Gibco公司;EDTA 购自美国 Sigma 公司。
1.1.4主要设备C-Bio 型生物反应器为法国 Sysbiotech公司产品,工作体积 5 L 和 50 L。
1.2方法
1.2.15 L 生物反应器 Vero 细胞培养取 2 ~ 4 瓶生长良好的 10 L 转瓶 Vero 细胞,加入细胞消化液,待细胞层松散、细胞圆缩时,加入细胞培养液,经充分摇匀分散、合并,制成细胞悬液。
以 2.0 × 105个/ml 的细胞密度接种于 5 L 生物反应器。补加细胞培养液至罐体工作体积(5 L)。设定控制温度37 ℃、pH 7. 2、搅拌 40 ~ 50 r/min、溶氧 50% ~ 60% 进行灌流培养,灌流速度为 0 ~ 2 培养体积/d。每天取样,检测细胞密度和活率。
1.2.25 L 生物反应器细胞收获微载体细胞汇合率达到80% 以上时,关闭生物反应器各控制参数,系统终止培养。待微载体细胞充分沉降后,排出培养液上清。加入含 EDTA 的 PBS(无 Ca2+、Mg2+)溶液,洗涤微载体细胞 3 次,每次清洗10 ~ 20 min。
漂洗后,加入细胞消化液消化微载体细胞。消化期间,取样观察,待 80% 细胞脱离微载体时,加入细胞培养液终止消化。同时打开搅拌,速度为 100 r/min。5 min 后,停止搅拌。待微载体沉降后,收集 Vero 细胞悬液。
1.2.350 L 生物反应器 Vero 细胞培养将收集的 Vero细胞悬液转入至 50 L 生物反应器内。细胞接种密度,每1 个微载体对应有 5 个以上 Vero 细胞。补加细胞培养液至罐体工作体积(50 L)。设定控制温度 37 ℃、pH 7.2、搅拌 40 ~ 60 r/min、溶氧 50% ~ 60% 进行灌流培养,灌流速度为 0 ~ 2 培养体积/d。每天取样,检测细胞密度和活率。
2 结果

表1 5 L 和 50 L 生物反应器中的细胞数量和密度
2.15 L 生物反应器 Vero 细胞培养
以 2.0 × 105个/ml 的细胞密度接种于 5 L 生物反应器中,培养 120 h 后,95% 以上微载体上细胞汇合度达到95% 以上,细胞密度可达到 9.5 × 106个/ml 左右(表1),有部分微载体之间出现细胞汇合及球连球(图1)。此时,Vero 细胞已经贴满微载体表面,细胞形态良好,细胞活率保持在 95% 以上,收集 Vero 细胞悬液(图2),准备接种于 50 L 生物反应器。
细胞消化前,5 L 生物反应器内细胞总数为 4.75 × 1010个,经 PBS 漂洗和胰酶消化后,实际收集的细胞总数3.14 × 1010个(表1),Vero 细胞收获率约为 66%,细胞活率约为 80%。
2.250 L 生物反应器 Vero 细胞培养
以 6.3 × 105个/ml的细胞密度接种 50 L 生物反应器中,培养 24 h 后,细胞密度为 4.3 × 105个/ml,较初始接种密度有明显下降(表2)。培养 5 d 后,95% 以上微载体上细胞汇合度达到 95% 以上,细胞密度可达到 8.0 × 106个/ml 左右,有部分微载体之间出现细胞汇合及球连球(图3)。此时,大部分微载体表面已经贴满 Vero 细胞,细胞形态良好,细胞活率保持在 95% 左右。
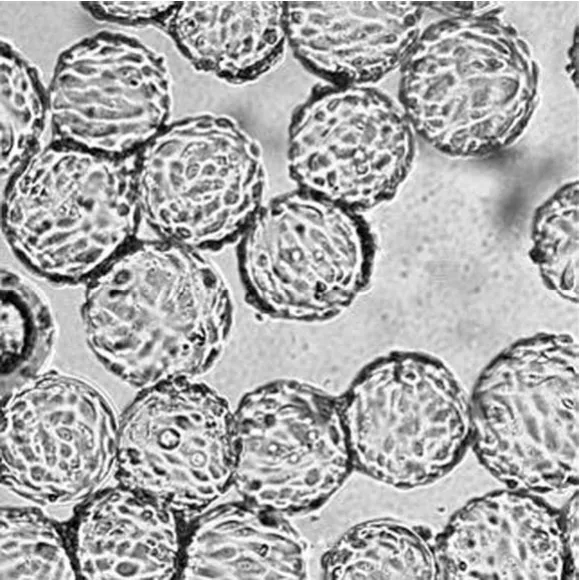
图1 5 L 生物反应器中,Vero 细胞微载体贴壁生长 5 d时的形态

图2 微载体上经胰酶消化后的 Vero 细胞
3 讨论
细胞微载体的逐级放大工艺是工艺研究中的重点和难点。近年来我国对 Vero 细胞微载体放大技术的研究,主要以胰酶消化放大[3]和球转球放大为主。球转球逐级放大方式依赖于细胞和微载体的种类[4]。对于 Vero 细胞微载体培养,高活率细胞从微载体上脱落,形成游离细胞的可能性极小,细胞与微载体之间黏附紧密,球与球之间的碰撞接触往往导致微载体间的黏连,且黏连后的微载体是很难分离的。另外还有细胞的转移效率低、微载体利用率不高和细胞生长不同步等问题,使得球转球的放大方式无法满足大规模细胞制备的生产要求。

图3 50 L 生物反应器中,Vero 细胞微载体贴壁生长 5 d时的形态
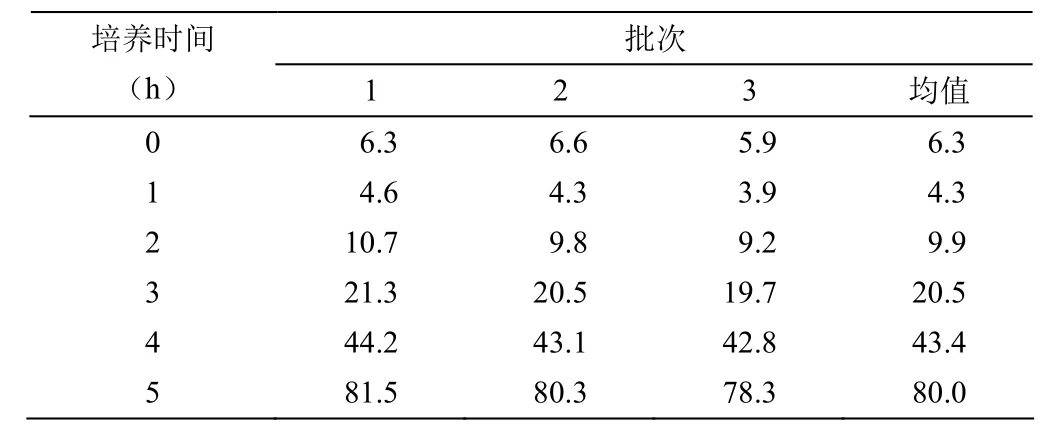
表2 50 L 生物反应器中不同批次的细胞密度(× 105个/ml)
利用胰酶将细胞从微载体上消化下来,可以获得大量游离种子细胞。在漂洗和消化过程中,有约 1/3 的损失。经分析,其原因可能有:一是在漂洗过程中,微载体及细胞经搅拌与 PBS 充分混合,微载体上部分细胞因自身贴壁不牢固,在过程中会脱落或受损;二是在胰酶消化过程中,胰酶长时间作用在细胞表面,会造成部分细胞膜受损或破裂,从微载体上提前脱落;三是在液体的排放过程中,因拦截装置未能有效地阻拦游离悬浮细胞,造成部分细胞流失。
在操作过程中存在如下问题:进行 PBS 换洗漂洗,因需筛网截流,液体排出速度较慢,时间较长,会损伤细胞,影响细胞活率。因细胞培养液中含有大量血清,经换洗后,仍有部分血清残留,会中和部分胰蛋白酶,影响细胞消化效果。拦截筛网的过滤效率,会使胰酶作用细胞时间过长,造成细胞受损;另细胞悬浮中会有胰酶残留,影响细胞活率和细胞贴壁能力。
于 50 L 反应器中培养 24 h 后,细胞密度为 4.3 × 105个/ml,较初始接种密度有明显下降。其原因可能是在进行微载体细胞消化时,因胰酶消化作用时间过长,造成细胞膜受损、细胞活率下降、部分细胞的再贴壁能力下降,从而影响微载体上的可贴壁细胞数比初始接种时细胞数少。但已贴附在微载体上的细胞经短暂静置和自我修复,适当延长细胞生长潜伏期后,即可重新恢复活率,进入细胞生长对数期。培养 5 d 后,细胞密度即可达到 8.0 × 106个/ml。
本研究实现了 5 L 到 50 L 生物反应器的 Vero 细胞微载体放大培养。也为后续由 50 L 生物反应器到 300 ~500 L 生物反应器的 Vero 细胞微载体放大培养奠定了基础。采用微载体/生物反应器系统高密度培养 Vero 细胞,可以全面替代传统的转瓶培养工艺,利于提高疫苗质量、降低生产成本。利用微载体/生物反应器系统大规模、高密度培养技术和高滴度的病毒规模化培养工艺,建立疫苗生物反应器自动化生产技术平台,可用于生产狂犬病疫苗、脊髓灰质炎病毒疫苗、轮状病毒灭活疫苗、风疹疫苗、水痘疫苗、乙脑灭活疫苗等多种疫苗产品。
参考文献
[1] Petiot E, Guedon E, Blanchard F, et al. Kinetic characterization of vero cell metabolism in a serum-free batch culture process. Biotechnol Bioeng, 2010, 107(1):143-153.
[2] Liu CC, Lian WC, Butler M, et al. High immunogenic enterovirus 71 strain and its production using serum-free microcarrier Vero cell culture. Vaccine, 2007, 25(1):19-24.
[3] Li W, Li ZP, Sun Y, et al. Preparation of purified Japanese encephalitis vaccine with Vero cells by using bioreactor. China J Biologicals, 2009, 22(6):591-592, 595. (in Chinese)李薇, 李振平, 孙燕, 等. 生物反应器制备Vero细胞乙型脑炎纯化疫苗. 中国生物制品学杂志, 2009, 22(6):591-592, 595.
[4] Luo FS, Xiao Y, Yan JH, et al. Study on vero cell two-stage scale-up culture method. J Jilin Agric Uni, 2008, 30(6):801-804. (in Chinese)罗凤山, 肖杨, 闫继红, 等. Vero细胞两阶段扩大培养工艺研究.吉林农业大学学报, 2008, 30(6):801-804.
·协会之窗·
DOI:10.3969/j.issn.1673-713X.2016.03.015
通信作者:毕军,Email:bijun_cn@163.com
收稿日期:2015-12-14

