绿色荧光蛋白放射免疫分析试剂盒的研制
姜晓静,孙秀柱,朱化彬,杜卫华,郝海生,赵学明,王栋,刘岩
绿色荧光蛋白放射免疫分析试剂盒的研制
姜晓静*,孙秀柱*,朱化彬,杜卫华,郝海生,赵学明,王栋,刘岩
作者单位:100193 北京,中国农业科学院北京畜牧兽医研究所(姜晓静、朱化彬、杜卫华、郝海生、赵学明、王栋、刘岩);712100 陕西杨凌,西北农林科技大学动物科技学院(姜晓静、孙秀柱)
*同为第一作者
绿色荧光蛋白(GFP)于 1962 年在一种学名为Aequorea Victoria 的水母中发现,包含 238 个氨基酸残基[1-2]。其基因所产生的蛋白质,在蓝色波长范围的光线激发下,会吸收蓝光的部分能量,发出绿色荧光。GFP 常用于标记某些特定的 RNA、内源性代谢产物以及靶蛋白[3],可通过荧光显微镜实时观察,也可通过荧光激活细胞,分选分离细胞[4]。这一活体生物标记[5]特性,使得 GFP 成为实时观察细胞、组织、器官不可或缺的工具[6],在转基因动物生产中也得到了广泛的应用[7-12]。
目前,对 GFP 的检测方法分为定性检测及定量检测。定性检测包括荧光观察[13]、免疫组化[14-16]、Western blot等[17-19],定量检测可以通过 ELISA 方法。但通过 ELISA 方法定量检测 GFP 含量[20-22],显色时间不容易控制,检测灵敏度受到免疫反应显色精确度的限制。对于少量 GFP 残留的检出率低,不利于精确检测[23]。
本实验应用竞争机制原理,研制了一种高灵敏度的GFP 放射免疫检测试剂盒,最低检测限位 1 pg/ml。本试剂盒的一抗使用浓度低,样品的前处理过程简单,耗时少,能同时检测大量的样品,实验效率高,样品检测成本远低于传统的仪器检测方法,对实现大批量样品的 GFP 残留监控具有重要的意义。
1 材料与方法
1.1主要试剂和仪器
缓冲液 A:0.1 mol/L 磷酸缓冲液(PBS)pH 7.2;缓冲液 B:1% 牛血清白蛋白、0.1% 冷海鱼皮胶、0.05% 叠氮钠、0.1 mol/L PBS pH 7.2;GFP 标准品购自美国 Vector公司;绿色荧光蛋白多克隆抗体(GFP 多抗)购自美国Chemicon 公司,用 0.1 mol/L PBS(pH 7.2)稀释,稀释比例为 1∶4000。PR 分离剂由驴抗兔二抗(1∶1000 稀释)、6% 聚乙二醇(PEG)、γ 球蛋白、0.1 mol/L PBS(pH 7.2)组成,其中驴抗兔二抗购于北方生物技术研究所;标准品溶液为 9 个浓度梯度,分别为 1、2、4、8、16、32、64、128 和 256 pg/ml;CG-12 型 γ 计数器为美国德普公司产品。
1.2方法
1.2.1绿色荧光蛋白的标记GFP 与放射性碘的结合采用氯胺-T 法进行[24]。将 5 μg GFP 溶于 100 μl 的磷酸缓冲液(0.1 mol/L,pH 7.2)中,加入约 37 mol/L MBq Na125I,磁力搅拌器下加入 15 μl 氯胺-T(1 μg/μl),反应 1 min 后加入 5 μl 偏重亚硫酸钠(2 μg/μl)终止反应,继续搅拌60 s,G-25 凝胶柱层析分离纯化。反应温度为 20 ℃。最终得到125I-GFP 放射性活度约 20 000 cpm/100 μl。
1.2.2绿色荧光蛋白标准品的配置临用前吸取 GFP 标准品(1.024 ng/μl)1 μl,加 2 ml 缓冲液 A 溶解,浓度为512 pg/ml,作为 S10,另取试管 9 支,编号 S9~ S1,各加缓冲液 A 1 ml,从 S10中取 1 ml 加到 S9,依次倍比稀释至 S1,S9~ S1试管的浓度分别为 256、128、64、32、16、8、4、2、1 pg/ml。
1.2.3绿色荧光蛋白放射免疫分析程序在聚苯乙烯试管上编号,包括总管(T 管)、非特异管(NSB 管)、零结合管(S0管)、标准管(S1~ S9管)、样本管(U 管),以上试管必须双管标号;向 S1~ S9管加入 200 μl 标准品、100 μl GFP 多克隆抗体及 100 μl125I-GFP;向 U 管加入200 μl 待测样本、100 μl GFP 多克隆抗体及 100 μl125I-GFP;向 NSB 管加入 200 μl 缓冲液 A、100 μl 缓冲液 B 及 100 μl125I-GFP;向 S0管加入 200 μl 缓冲液 A、100 μl GFP 多克隆抗体及 100 μl125I-GFP;充分混匀,放置4 ℃ 24 h,每管分别加入 PR 分离剂 500 μl,充分混匀,室温放置 20 min,4 ℃ 条件下,3500 r/min 离心 25 min,吸弃上清,测各管沉淀 cpm 数。
2 结果
本实验采用平衡法,数据分析采用世界卫生组织放射免疫分析推荐的 Logit 标准曲线法。标准曲线法使用的计算参数及计算过程如下:
⑴每对试管(T、NSB、S0、S1~ S9、U)的平均计数:计数 = 平均 cpm - 本底计数。
⑵非特异结合率:NSB% = NSB/T × 100%
⑶最大结合率:B0% =(B0- NSB)/T × 100%
⑷各标准管、样品管结合率:
B/B0% =(B - NSB)/(B0- NSB)× 100%,其中 B =标准管(或样本管)双管技术的均值;B0= 零标准(S0)双管计数的均值;NSB = 非特异双管计数的均值。
以上各标准点的 B/B0为纵坐标,以标准点浓度为横坐标,在 Logit-Log 双对数坐标纸上绘制标准曲线。根据待测样本的结合率,从标准曲线上查出相应的样品蛋白含量。或由自动 γ 计数器预先编制程序,直接给出有关参数,标准曲线及样品浓度。
标准曲线上 S1、S2、S3、S4、S5及 S9样品管的对应自查值分别为 0.99、2.03、7.92、16.61、30.68 和 258.52 pg/ml,与实际加入浓度相符。B 标准曲线参数 NSB% = 3.4%,B0/T = 51.04%,线性回归 r = -0.99991,A = 1.65,B = -1.41,ED75= 2.45,ED50= 14.76,ED25= 89.02。标准曲线如图1 所示,标准曲线测量数据如表1 所示。
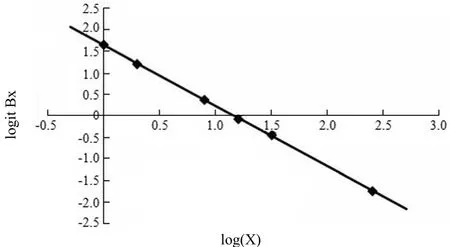
图1 Log-logit 双对数标准曲线

表1 标准曲线测量数据
试验应用竞争机制原理,标准品或样品中的 GFP 和加入的125I-GFP 共同与一定量的特异性抗体产生竞争性免疫反应。125I-GFP 同抗体的结合量与标准品或样品中 GFP 的含量呈一定的函数关系。用免疫分离试剂(PR)将结合部分(B)与游离部分(F)分离后,测定结合部分的放射性强度,并计算相应结合率 B/B0。用已知标准 GFP 含量与对应结合率作图,即得标准抑制曲线。从标准曲线上查找对应结合率的待测样品中 GFP 的含量。
3 讨论
本试剂盒检测灵敏度高,最低检测限位 1 pg/ml,明显高于商用试剂盒,如 Cell Biolabs 公司 GFP ELISA 试剂盒,灵敏度为 30 pg/ml[25-27];Bioo Scientific 公司的 GFP ELISA 试剂盒,检测范围为 2 ~ 12 ng/ml[28-29]。同位素检测灵敏度高于 ELISA 显色反应。
GFP 放射免疫试剂盒准确性高,假阳性率低。放射免疫检测的优势尤其体现在一些含有内源性的酶和生物素的动物组织中,如肝脏、脾脏、肾脏。在辣根过氧化物酶、碱性磷酸酶或生物素的 ELISA 体系中,内源性的过氧化物酶或生物素会提高阴性样本的读值,引发假阳性的 ELISA反应。放射免疫试剂盒由于直接用同位素标记抗原,与样本中抗原竞争抗体,没有生物素、过氧化物酶体系,从根源上避免了内源性酶及生物素的假阳性反应,大大提高了检测的效率。
样品的前处理过程简单。体液样本、细胞培养液可直接用于测定;组织样本,无论是否含有内源性酶及生物素,前处理步骤仅需组织总蛋白提取及总蛋白定量步骤,不需要对内源性酶及生物素进行屏蔽,减少溶液配制,精简操作步骤,节约时间,节约劳动力。而 ELISA 试剂盒通常不包含内源性酶及生物素抑制剂,需要使用者单独配置。
本试剂盒测定通量高,能同时检测大量的样品,提高实验效率,采用 CG-12 型 γ 放射免疫计数器可一次同时检测 300 个试管,大大提高检测效率。
本试验建立一种简便的、高灵敏度的绿色荧光蛋白放射免疫检测方法。根据该法研制的放射免疫试剂盒检测灵敏度为 1 pg/ml,检测范围为 1 ~ 256 pg/ml,一抗稀释比例为1∶4000,可用于测定体外转染细胞中 GFP 蛋白表达丰度,也可用于测定转基因动物血液、器官、组织蛋白溶液中的GFP 残留。
参考文献
[1] Ormö M, Cubitt AB, Kallio K, et al. Crystal structure of the Aequorea victoria green fluorescent protein. Science, 1996, 273(5280):1392-1395.
[2] Prendergast FG, Mann KG. Chemical and physical properties of aequorin and the green fluorescent protein isolated from Aequorea forskålea. Biochemistry, 1978, 17(17):3448-3453.
[3] Walker CL, Lukyanov KA, Yampolsky IV, et al. Fluorescence imaging using synthetic GFP chromophores. Curr Opin Chem Biol, 2015,27:64-74.
[4] Pinto AR, Paolicelli R, Salimova E, et al. An abundant tissue macrophage population in the adult murine heart with a distinct alternatively-activated macrophage profile. PLoS One, 2012, 7(5):e36814.
[5] Phillips GJ. Green fluorescent protein--a bright idea for the study ofbacterial protein localization. FEMS Microbiol Lett, 2001, 204(1):9-18.
[6] Nienhaus K, Nienhaus GU. Fluorescent proteins for live-cell imaging with super-resolution. Chem Soc Rev, 2014, 43(4):1088-1106.
[7] Tseng CL, Peng CL, Huang JY, et al. Gelatin nanoparticles as gene carriers for transgenic chicken applications. J Biomater Appl, 2013,27(8):1055-1065.
[8] Lin YS, Yang CC, Hsu CC, et al. Establishment of a novel,eco-friendly transgenic pig model using porcine pancreatic amylase promoter-driven fungal cellulase transgenes. Transgenic Res, 2015,24(1):61-71.
[9] Hong SG, Oh HJ, Park JE, et al. Production of transgenic canine embryos using interspecies somatic cell nuclear transfer. Zygote, 2012,20(1):67-72.
[10] Matsumoto T, Suetsugu A, Shibata Y, et al. A color-coded imageable syngeneic mouse model of stromal-cell recruitment by metastatic lymphoma. Anticancer Res, 2015, 35(9):4647-4654.
[11] Rescan PY, Ralliere C, Lebret V, et al. Analysis of muscle fibre input dynamics using a myog: GFP transgenic trout model. J Exp Biol, 2015,218(Pt 8):1137-1142.
[12] Kato H, Abe K, Yokota S, et al. Establishment of oct4:gfp transgenic zebrafish line for monitoring cellular multipotency by GFP fluorescence. In Vitro Cell Dev Biol Anim, 2015, 51(1):42-49.
[13] Loussert Fonta C, Humbel BM. Correlative microscopy. Arch Biochem Biophys, 2015, 581:98-110.
[14] Huang C, Tang M, Yehling E, et al. Over expressing sonic hedgehog peptide restores periosteal bone formation in a murine bone allograft transplantation model. Mol Ther, 2014, 22(2):430-439.
[15] O'Sullivan ML, Martini F, von Daake S, et al. LPHN3, a presynaptic adhesion-GPCR implicated in ADHD, regulates the strength of neocortical layer 2/3 synaptic input to layer 5. Neural Dev, 2014, 9:7.
[16] Liu Y, Wu Q, Cui H, et al. Expression of EGFP and NPTII protein is not associated with organ abnormalities in deceased transgenic cloned cattle. Cloning Stem Cells, 2008, 10(4):421-428.
[17] Oravcová M, Teska M, Půta F, et al. Fission yeast CSL proteins function as transcription factors. PLoS One, 2013, 8(3):e59435.
[18] Hughes AJ, Spelke DP, Xu Z, et al. Single-cell western blotting. Nat Methods, 2014, 11(7):749-755.
[19] Aligny C, Roux C, Dourmap N, et al. Ketamine alters cortical integration of GABAergic interneurons and induces long-term sex-dependent impairments in transgenic Gad67-GFP mice. Cell Death Dis, 2014, 5:e1311.
[20] Zhang Y, Angel CA, Valdes S, et al. Characterization of the promoter of grapevine vein clearing virus. J Gen Virol, 2015, 96(Pt 1):165-169.
[21] Fulton LM, Taylor NA, Coghill JM, et al. Altered T-cell entry and egress in the absence of Coronin 1A attenuates murine acute graft versus host disease. Eur J Immunol, 2014, 44(6):1662-1671.
[22] Baez A, Majdalani N, Shiloach J. Production of recombinant protein by a novel oxygen-induced system in Escherichia coli. Microb Cell Fact, 2014, 13(1):50.
[23] Fonseca JP, Steffen PA, Muller S, et al. In vivo Polycomb kinetics and mitotic chromatin binding distinguish stem cells from differentiated cells. Genes Dev, 2012, 26(8):857-871.
[24] Xiao L. Radio isotope technique. Beijing: Atomic Energy Press, 2000. (in Chinese)肖伦. 放射性同位素技术. 北京: 原子能出版社, 2000.
[25] Zhou W, Hildebrandt F. Inducible podocyte injury and proteinuria in transgenic zebrafish. J Am Soc Nephrol, 2012, 23(6):1039-1047.
[26] Gee HY, Zhang F, Ashraf S, et al. KANK deficiency leads to podocyte dysfunction and nephrotic syndrome. J Clin Invest, 2015, 125(6):2375-2384.
[27] Vemula SV, Veerasamy R, Ragupathy V, et al. HIV-1 induced nuclear factor I-B (NF-IB) expression negatively regulates HIV-1 replication through interaction with the long terminal repeat region. Viruses, 2015,7(2):543-558.
[28] Colella P, Trapani I, Cesi G, et al. Efficient gene delivery to the cone-enriched pig retina by dual AAV vectors. Gene Ther, 2014, 21(4):450-456.
[29] Trapani I, Colella P, Sommella A, et al. Effective delivery of large genes to the retina by dual AAV vectors. EMBO Mol Med, 2014, 6(2):194-211.
·协会之窗·
DOI:10.3969/j.issn.1673-713X.2016.03.014
基金项目:国家自然科学基金(31301977);农业科技创新工程(ASTIP-IAS06-2016);西北农林科技大学引进人才科研启动费(Z111021203)
通信作者:刘岩,Email:liuyan05@caas.cn
收稿日期:2015-11-04

