低温环境下容量控制性失血性休克猪的丙泊酚药代动力学研究
夏艳萍,陈克研,张铁铮,刁玉刚*
1.沈阳军区总医院麻醉科,沈阳 110016;2.滨州医学院附属医院,山东 滨州 256603
·论著·
低温环境下容量控制性失血性休克猪的丙泊酚药代动力学研究
夏艳萍1,2,陈克研1,张铁铮1,刁玉刚1*
1.沈阳军区总医院麻醉科,沈阳 110016;2.滨州医学院附属医院,山东 滨州 256603
[摘要]目的探讨低温环境下容量控制性失血性休克猪体内丙泊酚药代动力学的特点。方法24头健康巴马小型猪,应用随机数字表法将其随机分为4组,每组6头,分别为常温不休克组(C组)、常温休克组(CS组)、低温不休克组(D组)、低温休克组(DS组)。建立低温失血性休克模型,四组均静脉泵入丙泊酚200 μg/(kg·min)共10 min。在静脉泵入丙泊酚0、4、8、10、11、12、13、14、15、17.5、20、25、30、45、60、180 min时,测定丙泊酚血浆药物浓度。根据已测定的血药浓度计算丙泊酚的消除半衰期(t1/2)、血浆-效应室平衡速率常数(Ke0)、药时曲线面积(AUC)及平均驻留时间(MRT)等药代动力学参数。结果丙泊酚血药浓度:D组与C组比较,差异有统计学意义(P<0.05);DS组与CS组、D组比较,差异有统计学意义(P<0.05)。最大药物浓度(Cmax):D组高于C组,DS组高于CS组、D组,差异均有统计学意义(P<0.05)。t1/2:D组较C组延长,DS组较CS组、D组延长,差异均有统计学意义(P<0.05)。MRT:D组较C组延长,DS组较CS组、D组延长,差异均有统计学意义(P<0.05)。Ke0、AUC:D组和CS组略高于C组,但差异无统计学意义(P>0.05);DS组略高于D组、CS组,差异无统计学意义(P>0.05)。结论低温环境下容量控制性失血性休克猪丙泊酚的药代动力学特点是代谢减慢,药物的消除半衰期延长,血浆-效应室平衡速率常数增大,体内平均驻留时间延长。
[关键词]低温;失血性休克;丙泊酚;药代动力学
0引言
低温环境下失血性休克(Hemorrhagic shock,HS)对机体的影响及其机制的研究是军事劳动卫勤研究的重要内容。我国东北、新疆、内蒙古和西藏地区冬季室外温度在-30~-20 ℃的时间可持续2个月以上,休克伤员很容易暴露于低温环境,暴露时间过长甚至危及生命[1-3]。针对HS患者,为了尽快手术,往往需要进行快速诱导麻醉。在快速起效的静脉麻醉药中,主要以丙泊酚(Propofol)为主。丙泊酚有起效快、作用时间短、消除快、术后恶心呕吐发生率低等优点[4],因此,其在临床工作中受到了麻醉医生越来越多的关注。然而,低温环境下HS患者静脉麻醉药物的使用与常温环境不同。国内外关于HS丙泊酚药代动力学研究的报道较多,表明诱导及维持时减少丙泊酚的用量是可行的,但低温环境下HS患者丙泊酚的药代动力学研究目前国内外尚未见报道。本研究旨在研究低温环境下失血性休克时丙泊酚的药代动力学特点,为低温环境下HS患者合理使用静脉麻醉药提供理论依据。
1材料与方法
1.1实验动物、药物和材料健康巴马小型猪,雌雄不限,体重18~24 kg,由沈阳军区总医院实验动物室提供。1%丙泊酚注射液(广东嘉博制药有限公司)。多功能监护仪(美国通用电气医疗系统贸易公司),麻醉机[芬兰德恩-欧美达(Datex-Ohmeda)公司],微量注射泵(浙江大学医学仪器有限公司),离心机(北京白洋医疗器械有限公司),BC/BD-560FA型冰柜(青岛澳柯玛股份有限公司),超低温冰箱(美国Thermo公司)。所有动物饲养和实验操作程序符合沈阳市动物实验伦理委员会相关规定,并经本院动物伦理委员会批准。
1.2动物分组和实验方案24头健康巴马小型猪,按随机数字表法分为4组,每组6头,分别为常温不休克组(C组)、常温休克组(CS组)、低温不休克组(D组)、低温休克组(DS组)。实验前禁食12 h,不禁水。麻醉后气管插管机械通气,连接心电监护仪,右侧颈内静脉穿刺置入深静脉导管,左右两侧股动脉穿刺置管监测血压。待猪清醒稳定2 h后,C组、CS组置于常温(20~22 ℃)环境下,D组、DS组置入-15 ℃冰柜中。C组、D组静脉泵入丙泊酚200 μg/(kg·min)共10 min[5],CS组、DS组采用Chao等[6]建立的猪容量控制性HS模型的方法建立模型。待模型稳定60 min后,静脉泵入丙泊酚200 μg/(kg·min)共10 min。各组分别于静脉注射丙泊酚前0 min与静脉注射丙泊酚后4、8、10、11、12、13、14、15、17.5、20、25、30、45、60、180 min等时点[5],分别采集静脉血5 mL,置肝素化EP管中,3 000 r/min离心5 min,分离得到血浆,-80 ℃保存,备用。
1.3丙泊酚血浆样品分析方法
1.3.1分析条件色谱柱:Zobax Elipse C18柱(150 mm×4.6 mm,5 μm,美国Agilent公司);流动相:甲醇∶乙腈∶0.005 M醋酸-醋酸钠缓冲溶液(用醋酸调节pH至4.0)=55∶25∶20(v/v/v);流速:1.0 mL/min;进样量:25 μL;柱温:室温;荧光波长:Ex/Em=276/310 nm。
1.3.2血浆样品预处理取500 μL血浆置10 mL具塞玻璃试管中,分别加入30 μL内标溶液(10 μg/mL麝香草酚甲醇溶液),50 μL甲醇和1 mL乙腈-甲醇(75∶25)混合溶液,低速涡旋混合10 s。盖紧瓶塞后放入冰箱中10 min,然后取出,涡旋混合10 s,10 000 r/min低温(4 ℃)离心15 min。取25 μL上清液进行HPLC分析[7]。
1.3.3方法专属性分析取猪空白血浆500 μL,除不加内标溶液外,按“1.3.2”项方法操作,进样25 μL,记录色谱图;将一定浓度的标准溶液和内标溶液加至空白血浆中,依同法操作,记录色谱图,其中待测物和内标保留时间分别为3.7、5.5 min;取给药后收集的猪血浆样品,按“1.3.2”项方法操作,记录色谱图。
1.3.4线性关系考察取空白血浆500 μL,加入丙泊酚系列标准溶液50 μL,配制成相当于浓度为0.10、0.20、0.50、1.25、3.75、10.00 μg/mL的血浆样品,加30 μL内标溶液(10.0 μg/mL麝香草酚甲醇溶液),按“1.3.2”项方法操作,进样25 μL,记录色谱图。以血浆中丙泊酚浓度为横坐标、丙泊酚与内标物的峰面积比值为纵坐标,用加权最小二乘法[5]进行回归运算,求得的直线回归方程即为标准曲线。
1.4丙泊酚药代动力学参数测定根据已建立的丙泊酚血浆样品分析方法,测定各组不同时间点血浆样品中的丙泊酚浓度,计算丙泊酚的t1/2、Ke0、AUC及MRT等药代动力学参数。

2结果
2.1实验动物一般情况各组动物实验前体重、月龄、血红蛋白、放血量比较差异均无统计学意义(P>0.05),见表1。
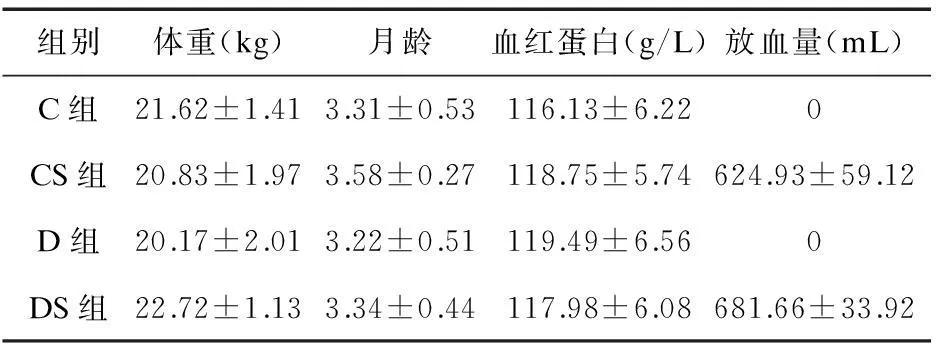
表1 四组动物一般情况比较
2.2HPLC- fluorescence法分析丙泊酚血浆样品
2.2.1方法专属性见图1。由图1可见,血浆中内源性物质不干扰丙泊酚和内标的测定。
2.2.2标准曲线以血浆中的丙泊酚浓度为横坐标、丙泊酚与内标物峰面积的比值为纵坐标,进行线性回归。图2中标准曲线所代表的丙泊酚的回归方程为Y=0.688 68X-0.013 01 (R2=0.996 3,1/X2加权),在浓度0.10~10.00 μg/mL范围内,丙泊酚与内标的峰面积比与浓度具有良好的线性关系。
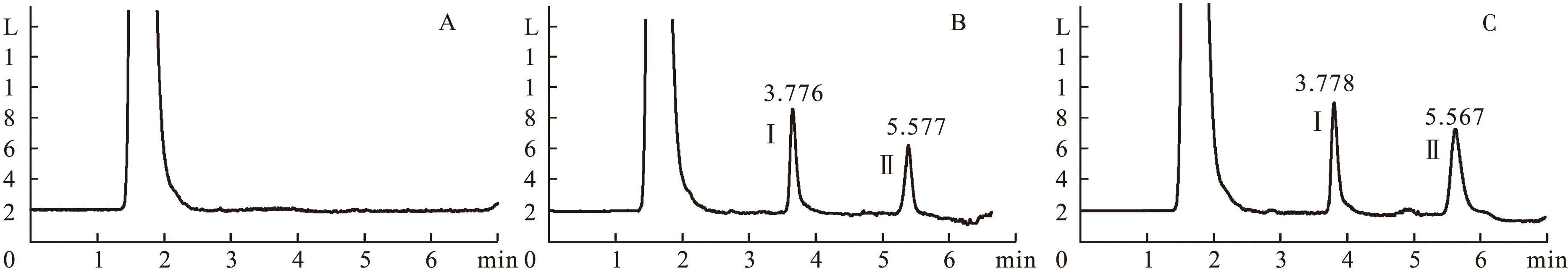
图1 丙泊酚及其内标的色谱图

图2 丙泊酚标准曲线
2.2.3精密度与回收率经测定,HPLC-fluorescence的日内及日间精密度均<10%,平均回收率>90%。见表2。由表2可见,测定猪血浆中丙泊酚的分析方法符合有关规范要求。

表2 精密度与回收率结果(%)
2.3丙泊酚血药浓度根据已建立的HPLC-fluorescence测定丙泊酚的血药浓度,各组丙泊酚浓度在泵入后,随着时间延长而增高,在泵入后10 min达到峰值。停止泵入丙泊酚后,血药浓度随时间延长而下降,在8~60 min的各时点,CS组的丙泊酚血药浓度高于C组,DS组高于D组,组间比较差异均有统计学意义(P<0.05);在10~60 min的各时点,D组的丙泊酚血药浓度高于C组,DS组高于CS组,组间比较差异有统计学意义(P<0.05),见表3。

表3 各时点的丙泊酚血药浓度(μg/mL,n=6)
注:“—”未检测到。*与C组比较,P<0.05;#与DS组比较,P<0.05
2.4丙泊酚药代动力学参数比较各组丙泊酚Tmax均为给药后10 min;各组Cmax比较,D组高于C组,DS组高于CS组、D组,组间比较差异均有统计学意义(P<0.05);各组t1/2比较,D组较C组延长,DS组较CS组、D组延长,组间比较差异均有统计学意义(P<0.05);各组MRT比较,D组较C组延长,DS组较CS组、D组延长,组间比较差异均有统计学意义(P<0.05)。见表4。

表4 四组药代动力学参数比较
注:*与C组比较,P<0.05;#与DS组比较,P<0.05
3讨论
HS动物模型的建立主要包括压力控制性HS模型和容量控制性HS模型[6-8],其中压力控制法[9]是将实验动物的平均动脉压控制在(45±5) mmHg,并维持该血压60 min。本实验组在预实验中曾采用该方法建立巴马小型猪HS模型,研究发现,猪血压降至45 mmHg时,血流动力学和氧动力学不稳定,常出现心脏骤停,死亡率较高。而本研究结果显示,丙泊酚给药后会引起血压下降,再加上低温等特殊环境的影响,很难保证实验猪的存活率,因此,本研究最终选用容量动力学方法建立HS模型,即对猪实施动脉分流实验[6],在15 min内,通过动脉放血达全身血容量的40%,待猪稳定60 min后视为模型建立成功。
低温环境下丙泊酚的药代动力学与常温环境下不同。低温暴露时,可以引起机体代谢率的改变,肝脏内含有大量的酶,其对药物的代谢起重要作用,而环境温度的改变使肝脏代谢产生变化,肝内酶系活性降低,从而使药物在肝脏内的代谢情况受到影响。当机体温度因低温暴露下降到一定程度时,则可抑制心肌功能,引起心排出量下降,导致血流的重新分布,而血流量的改变又将改变药物在体内的分布。Saricaoglu[10]和Sirvinskas[11]等的研究结果表明,机体在降温的过程中,ALT、AST、Cr及BUN均明显下降,提示肝肾功能在体温下降时,均受到不同程度的损伤。有报道,机体温度低于正常时,容易出现“冷”利尿现象及代谢性酸中毒,肠道吸收功能减弱,导致酶的活性减低而使代谢减慢[12]。丙泊酚除经过肝脏代谢外,还存在肝外代谢途径,肾脏及小肠都参与丙泊酚的代谢[13]。有研究显示,低温时,药物的代谢减慢,清除率和分布容积降低[14]。
本研究显示,低温环境下,丙泊酚在动物体内的t1/2、MRT较常温环境时均延长,说明低温环境下,由于动物机体血流分布的改变,丙泊酚的代谢减慢,其在体内的驻留时间延长。低温环境下,丙泊酚的Ke0、AUC较常温时增大,是由于低温时心输出量的减少导致组织器官血流重新分布,使到达效应位点的时间延长,从而使药物在体内的驻留时间延长。Cortinez等[15]研究了低温环境对丙泊酚药代动力学的影响,发现低温环境下丙泊酚在体内的代谢减慢,本实验支持该结论。
HS时有效循环血容量减少使心输出量下降,血浆蛋白浓度降低。心输出量在药物体内初始分布中起重要作用[16]。HS时由于血容量不足,心排出量减少,导致组织器官灌注不足,药物经血流分布到外周组织器官减少,药物分布到外周室减少,从而使血浆药物浓度升高,血浆药物浓度下降速率减慢。组织的血流量及膜的通透性决定了药物到达该组织的分布速率。在失血性休克时,因交感神经的兴奋性增强引起组织器官血流重新分布,而组织器官血流量的改变将导致药物在体内的分布发生改变[17]。血浆蛋白浓度的降低使与其有强结合力的药物的分布和清除发生改变。
本研究发现,HS动物体内丙泊酚的t1/2、MRT均明显延长,说明HS机体组织器官长时间灌注得不到改善,使药物在体内达到平衡的时间延长,最终导致丙泊酚在体内的代谢减慢。Ken等[5]研究了HS对丙泊酚药代动力学及药效学的影响,发现在HS时丙泊酚在体内的代谢减慢,本研究结果与之相符。实验发现,HS动物的Ke0、AUC较无休克动物略有升高,但差异无统计学意义,表明HS动物体内丙泊酚的血浆药物浓度与起效位点药物浓度达到平衡的半衰期以及药物的总体吸收程度没有显著差异。
本研究显示,低温环境下HS机体体内丙泊酚的t1/2、MRT较常温环境下明显延长,提示低温环境下HS机体丙泊酚代谢减慢。低温环境下HS时,由于组织器官血流的重新分布,使丙泊酚到达作用位点的时间延长。本研究显示,低温环境下HS动物的Ke0、AUC较常温延长,但差异无统计学意义,提示丙泊酚在体内的代谢减慢但在体内的总体吸收程度没有明显变化。低温HS时,由于血容量不足,心排出量减少,从而导致组织器官灌注不足,肝肾血流量减少,使丙泊酚在体内的代谢减慢。而低温HS时与药物结合的蛋白构型的改变也可能导致药物在体内的代谢减慢;肝内微粒体酶是大多数药物代谢所需的酶类,在低温HS时酶的活性下降,使药物的降解功能减弱,药物在体内的代谢减慢[18]。
综上所述,在低温环境下容量控制性HS模型中,丙泊酚的t1/2延长,血浆-效应室平衡速率常数增大,体内MRT明显延长,可能与低温HS条件下肝肾血流量减少、肝药酶活性减弱以及与药物结合的蛋白构型改变有关。提示我们在临床麻醉中对于低温HS的患者,应该适当减少丙泊酚的诱导、维持剂量,从而避免因药物代谢减慢而引起的循环抑制和苏醒延迟等不良后果。
参考文献:
[1]Subeq YM,Hsu BG,Lin NT,et al.Hypothermia caused by slow and limited-volume fluid resuscitation decreases organ damage by hemorrhagic shock[J].Cytokine,2012,60:68-75.
[2]Sherwin CM,Ngamprassertwong P,Sadhasivam S,et al.Utilization of optimal study design for maternal and fetal sheep propofol pharmacokinetics study:a preliminary study[J].Curr Clin Pharmacol,2014,9(1):64-69.
[3]Goran H,Robert GH,Anders S.Hypothermia increase rebleeding during uncontrolled hemorrhage in the rat[J].Shock,2011,36(1):60-66.
[4]Triantafillidis JK,Merikas E,Nikolakis D,et al.Sedation in gastrointestinal endoscopy:current issues[J].World J Gastroenterol,2013,19(4):463-481.
[5]Ken B,Talmage D,Steven E,et al.The influence of hemorrhagic shock on propofol:a pharmacokinetic and pharmacodynamic analysis[J].Anesthesiology,2003,99(2):409-420.
[6]Chao A,Chen K,Trask S,et al.Time to failure of arterial shunts in a pig hemorrhagic shock model[J].Am Surg,2012,78(10):1045-1048.
[7]Han E.A study of analytical methods for the determination of propofol in blood[J].Arch Pharm Res,2014,37(2):157-167.
[8]Lomas-Niera JL,Perl M,Chung CS,et al.Shock and hemorrhage:an overview of animal models[J].Shock,2005,24 (1):33-39.
[9]Roesner JP,Petzelbauer P,Koch A,et al.Bbeta15-42 (FX06) reduces pulmonary,myocardial,liver,and small intestine damage in a pig model of hemorrhagic shock and reperfusion[J].Crit Care Med,2009,37(2):598-605.
[10]Saricaoglu F,Akinci SB,Qc B,et al.The effect of halothane,isoflurane,sevoflurane and propofol infusion on renal function after coronary artery bypass surgery[J].Middle East J Anesthesiol,2006,18(5):955-964.
[11]Sirvinskas E,Kinderyte A,Trumbeckaite S,et al.Effects of sevoflurane vs.propofol on mitochondrial functional activity after ischemia-reperfusion injury and the influence on clinical parameters in patients undergopng GABA surgery with cardiopulmonary bypass[J].Perfusion,2015,33(11):42-43.
[12]Sosnowski P,Mikrut K,Krauss H.Hypothermia-mechanism of action and pathophysiological changes in the human body[J].Postepy Hig Med Dosw,2015,69(1):69-79.
[13]Takizawa D,Sato E,Hiraoka H,et al.Changes in apparent systemic clearance of propofol during transplantation of living related donor liver[J].Br J Anaesth,2005,95(5):643-647.
[14]Ahdari WS,Yamamoto K,Hiraoka H,et al.Prediction of total propofol clearance based on enzyme activities in microsomes from humarn kidney and liver[J].Eur J Clin Pharmacol,2006,62(7):527-533.
[15]Cortinez LJ,Delfino AE,Fuentes R,et al.Performance of the cerebral state index during increasing levels of propofol anesthesia:a comparison with the bispectral index[J].Anesth Analg,2007,104(3):605-610.
[16]David M,Judah B,Karuna S,et al.Endotoxic shock alters the pharmacokinetics of lidocaine and monoethyl glycinexylidide[J].Shock,2002,17(3):199-204.
[17]Tadayoshi K,Koji M,Tomiei K,et al.Influence of cardiac output on plasma propofol concentrations during constant Infusion in swine[J].Anesthesiology,2002,96(6):1498-1503.
[18]Zhou J,Empey PE,Bies RR,et al.Cardiac arrest and therapeutic hypothermia decrease isoform-specific cytochrome P450 drug metabolism[J].Drug Metab Dispos,2011,39(12):2209-2218.
Pharmacokinetics of propofol in pigs with volume controlled hemorrhagic shock in hypothermic environment
XIA Yan-pin1,2,CHEN Ke-yan1,ZHANG Tie-zhen1,DIAO Yu-gan1*
(1.Department of Anesthesiology,Shenyang General Hospital of Military Region,Shenyang 110016,China;2.Binzhou Medical University Hospital,Binzhou 256603,China)
[Abstract]ObjectiveTo investigate the pharmacokinetics characteristics of propofol in pigs with volume controlled hemorrhagic shock in hypothermic environment.MethodsTwenty-four Bama mini pigs were randomly divided into 4 groups:group C (pigs without hemorrhagic shock at room temperature),group CS (pigs with hemorrhagic shock at room temperature),group D (pigs without hemorrhagic shock at low temperature),group DS (pigs with hemorrhagic shock at low temperature).The hypothermia hemorrhagic shock models were established.Propofol 200 μg/(kg·min) was infused for 10 min;5 mL venous blood was collected before administration of propofol and at 2,4,6,8,10,11,12,13,14,15,17.5,20,25,30,45,60,180 min after infusion,and the concentration of propofol was analyzed by high performance liquid chromatography fluorescence (HPLC- fluorescence).SPSS was used to calculate the elimination half-life (t1/2) of propofol,the plasma-effect site equilibration rate content (Ke0),the drug′s area under the curve (AUC),the mean residence time (MRT) and the other pharmacokinetic parameters.ResultsAt 10~60 min after infusion,the plasma concentration of propofol in group D was higher than that of group C,and the concentration in group DS was higher than that of group CS (P<0.05).Cmaxin group D was higher than that of group C,and the index in group DS was higher than those of group CS and group D,there being significant differences (P<0.05).The t1/2and MRT in group D was longer than that of group C,and the indexes in group DS were longer than those of group CS and group D,there being significant differences (P<0.05).The Ke0and AUC in group D and group CS were slightly higher than those of group C,and the indexes in group DS were slightly higher than those of group D and group CS,but there was no significant difference (P>0.05).ConclusionThe pharmacokinetics characteristic of propofol in pigs with volume controlled hemorrhagic shock in hypothermic environment is manifested as slower metabolism,longer elimination half-life,increased Ke0and longer MRT.
Key words:Hypothermic;Hemorrhagic shock;Propofol;Pharmacokinetics
收稿日期:2015-08-31
基金项目:军队后勤科研重点项目(BWS12J008);国家自然青年科学基金项目(31201758)
DOI:10.14053/j.cnki.ppcr.201604001
*通信作者

