白藜芦醇对脂多糖诱导体外小鼠腹腔巨噬细胞活性的影响
孙 平,付帅才,肖 乐,龚昆梅*
1.昆明理工大学医学院,昆明 650000;2.云南省第一人民医院,昆明 650000
*通信作者
白藜芦醇对脂多糖诱导体外小鼠腹腔巨噬细胞活性的影响
孙平1,付帅才1,肖乐2,龚昆梅2*
1.昆明理工大学医学院,昆明 650000;2.云南省第一人民医院,昆明 650000
[摘要]目的探讨白藜芦醇(RES)对脂多糖(LPS)诱导体外小鼠腹腔巨噬细胞(PMA)活化的影响。方法制备腹腔巨噬细胞,分为阴性对照组、LPS组和(RES+LPS)Ⅰ~Ⅵ组,培养24 h后,分别进行中性红染色观察细胞活性。应用酶联免疫吸附法和硝酸还原法实验,用酶标仪检测细胞上清液中肿瘤坏死因子-α (TNF-α)、一氧化氮(NO)和超氧阴离子水平。结果对照组细胞活性比较低,LPS诱导后,腹腔巨噬细胞大量活化,细胞上清液中TNF-α、NO、超氧阴离子水平显著增高,加入RES治疗的PMA细胞活性逐渐减弱,并且相应的细胞上清液中TNF-α、NO、超氧阴离子水平明显降低。结论RES可以抑制PMA的细胞活化,从而减少TNF-α、NO和超氧阴离子的过度分泌。
[关键词]巨噬细胞(PMA);白藜芦醇(RES);脂多糖(LPS);TNF-α;NO;超氧阴离子
0引言
白黎芦醇(Resveratrol,RES)是从虎杖中提取的多酚类化合物[1-3],其化学结构为3,5,4′-三羟基苯二烯。近年研究发现,白藜芦醇具有抗炎、抗氧化、抗血小板凝聚、改善微循环、保护血管内皮、保护神经系统、增强免疫力、延缓衰老等作用[4-5]。脂多糖(Lipopolysaccharides,LPS)是革兰阴性菌细胞壁的主要成分,是引起传染性疾病的主要原因。炎症过程中巨噬细胞的活化能够引起白细胞介素-1(IL-1)、肿瘤坏死因子-α(TNF-α)、超氧阴离子(O2-)、血小板活化因子(PAF)和一氧化氮(NO)等大量炎症介质释放[6-9],这些炎症介质具有多种活性,介导多种生理作用,并且许多作用能够相互叠加,出现协同效应,从而促使炎症过程的发生和发展[10-12]。本研究旨在探讨白藜芦醇对LPS诱导的小鼠腹腔巨噬细胞(PMA)活化产生炎症损伤的抑制作用,探讨其对细胞保护作用的可能机制,为治疗炎症、保护细胞活力、延缓细胞衰老提供新的有效思路和临床治疗方法。
1材料与方法
1.1材料ICR品系小鼠,雌雄不拘,体重(25±3)g,购于昆明医科大学动物实验室,SPF级;脂多糖、白藜芦醇(Sigma公司);10%小牛血清(BI);中性红及台盼蓝染液,检测TNF-α、超氧阴离子、NO试剂盒(南京建成生物制品公司);蒸馏水、乙醚等为国药集团化学试剂分析纯;酶标仪(Multiskan G0美国Thermo公司);倒置荧光显微镜(ZXZ-SLP,OLYMPUS);二氧化碳培养箱(水套式,上海一恒科学仪器有限公司);液氮罐YDS-10型(成都金凤液氮容器有限公司);雪花制冰机;电子天平(FA2004N型);-80 ℃冰箱;手术器械、一次性无菌注射器等。
1.2方法
1.2.1小鼠腹腔巨噬细胞的制备取2只6~8周、体型相仿、体重接近相等(22 g)的小鼠(饲养条件:室温20~26 ℃;相对湿度:45%~60%;光照时间:每天12 h;提供充足的食物和饮水,以便小鼠随意进食饮水),乙醚下处死,75%乙醇消毒3~5 min,在无菌条件下给每只小鼠腹腔液注射10%的小牛血清培养基(引发小鼠体内产生大量巨噬细胞) 2.5 mL,灌洗适当时间后,取2.8 mL腹腔液加入培养基稀释至9 mL,铺到96孔板,每孔为200 μL,置于37 ℃、5% CO2饱和湿度的培养箱中贴壁细胞培养24 h。
1.2.2用RES、LPS处理小鼠腹腔巨噬细胞用体积分数10%的小牛血清培养基调整PMA浓度约为2×106个/mL,随机分为对照组、LPS组、RESⅠ~Ⅵ组。对照组PMA加双纯水(2 μg/mL);LPS组PMA加入LPS (2 μg/mL);RES组PMA加入LPS (2 μg/mL)培养30 min后,分别加入浓度为1、1.2、1.5、1.8、2、5 μg/mL的RES。各组均在37 ℃、5% CO2饱和湿度的培养箱中继续培养24 h。
1.2.3中性红检测细胞活力继“1.2.2”项用RES、LPS处理小鼠腹腔巨噬细胞,在37 ℃、5% CO2饱和湿度的培养箱中继续培养24 h后,去除细胞培养液,用PBS液冲洗未贴壁的细胞,向孔内加入新鲜配制的中性红工作液200 μL,在37 ℃、5% CO2条件下,孵育2 h,立即用倒置荧光显微镜拍照。弃去上清,用PBS洗涤1遍,加入萃取液(乙醇∶水∶醋酸=50∶49∶1),酶标仪540 nm检测光吸收值(D540值)。
1.2.4TNF-α、NO、抗超氧阴离子含量的检测经2 μg/mL LPS预处理PMA细胞损伤,加入不同浓度Res对PMA细胞进行24 h治愈保护作用。①TNF-α的检测:收集细胞的上清液,96孔板,每孔样本量100 μL,采用双抗体夹心法测定标本中小鼠TNF-α水平,按试剂盒使用说明进行,酶标仪在450 nm波长下测定吸光度(D450值),根据标准品绘制成的标准曲线,得出回归方程,根据回归方程计算样品中小鼠TNF-α的浓度。②收集细胞的上清液,根据Griess法测定培养液中的NO,具体按照试剂盒使用说明,每孔样本量100 μL,实验后用酶标仪进行NO检测;③收集细胞的上清液,根据试剂盒的实验步骤,每孔加样样本量为50 μL,酶标仪检测出超氧阴离子OD值,然后根据试剂盒中的计算公式,计算出抗超氧阴离子的活力单位(U/L)。
1.2.5统计学分析所有数据进行单向方差分析,各组间比较差异有统计学意义的再进行多重比较。实验数据采用统计软件包GraphPad Prism5进行统计分析,检验显著水准α=0.05。
2结果
2.1RES、LPS对腹腔巨噬细胞活性的影响见图1。中性红检测细胞活力(应用倒置荧光显微镜拍照),见图2。
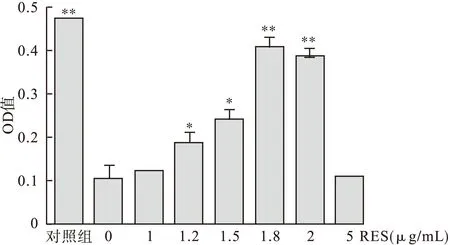
图1 酶标仪检测各组细胞的OD值
由图2可见,培养24 h后,对照组腹腔巨噬细胞大量贴壁生长,形状呈不规则的菱形,多数被中性红染成红色,说明腹腔巨噬细胞大量存活生长良好。LPS组腹腔巨噬细胞只有很少的细胞染成红色,形状多为圆形,说明腹腔巨噬细胞贴壁生长较少,且大量死亡,表明LPS诱导腹腔巨噬细胞衰老死亡。RESⅠ~Ⅵ组,随着白藜芦醇药量的加大,腹腔巨噬细胞被染成红色且贴壁生长,形状呈不规则菱形的腹腔巨噬细胞数量越来越多,说明白藜芦醇抑制LPS引起的细胞衰老死亡。但是白藜芦醇药量较大的RESⅤ组的腹腔巨噬细胞的贴壁生长,形状呈菱形的腹腔巨噬细胞数量有变小的趋势,说明浓度过大的白藜芦醇对细胞有毒副作用。
2.2RES对LPS诱导后巨噬细胞TNF-α的影响见图3、表1。

图2 中性红染色PMA活性观察(200×)
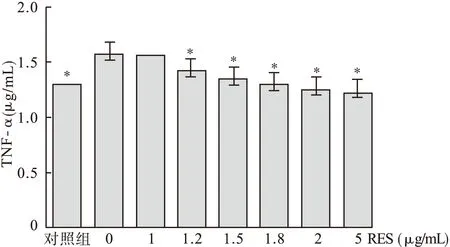
图3 白藜芦醇对LPS诱导小鼠腹腔巨噬细胞TNF-α的影响
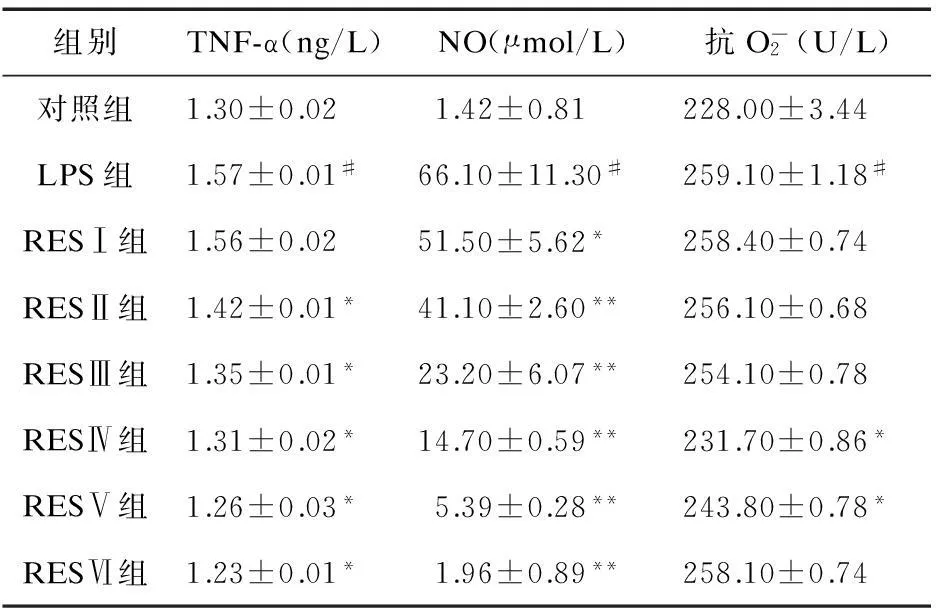
组别TNF-α(ng/L)NO(μmol/L)抗O-2(U/L)对照组1.30±0.021.42±0.81228.00±3.44LPS组1.57±0.01#66.10±11.30#259.10±1.18#RESⅠ组1.56±0.0251.50±5.62*258.40±0.74RESⅡ组1.42±0.01*41.10±2.60**256.10±0.68RESⅢ组1.35±0.01*23.20±6.07**254.10±0.78RESⅣ组1.31±0.02*14.70±0.59**231.70±0.86*RESⅤ组1.26±0.03*5.39±0.28**243.80±0.78*RESⅥ组1.23±0.01*1.96±0.89**258.10±0.74
注:*与LPS处理组比较,P<0.01;#与对照组比较,P<0.01
由图3、表1可见,LPS组PMA经过LPS诱导产生的TNF-α含量明显高于对照组(P<0.01);RES组中,随着RES量的增加,对LPS致巨噬细胞产生TNF-α的抑制更加明显。
2.3RES对LPS诱导后的巨噬细胞生成NO的影响酶标仪NO检测结果见图4、表1。由图4、表1可见,LPS组的PMA经过LPS诱导产生的NO含量明显高于对照组(P<0.01);RES组中,随着RES量的增加,对LPS致巨噬细胞产生NO的抑制更加明显。
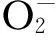

图4 白藜芦醇对LPS诱导小鼠腹腔巨噬细胞NO的影响
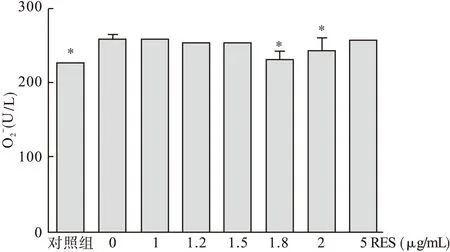
图5 白藜芦醇对LPS诱导小鼠腹腔巨噬细胞
3讨论
研究表明,当前白藜芦醇已经成为有效遏制和治疗肿瘤和癌变的最有前途的药物之一,被美国著名杂志《抗衰老圣典》列为100种最有效的抗衰老药物之一,被誉为新的抗癌绿色药物[13-16]。研发富含白藜芦醇的食品、药物及抗皮肤衰老的化妆品具有非常广阔的市场前景。随着分子调控机制、蛋白通路研究的完善,越来越多的白藜芦醇相关研究涉及基因调控、蛋白调控方面,运用高通量技术探寻在RES保护治疗下有关miRNA、LncRNA差异表达谱,筛选在RES保护下关键miRNA、LncRNA,对其相关功能进行研究,探索出一系列转录翻译、蛋白修饰表达通路。本研究体外培养小鼠腹腔巨噬细胞,探讨对小鼠腹腔巨噬细胞有保护作用的RES给药浓度,为后续小鼠体内实验提供可靠的用药剂量方面的实验数据,同时也为之后用药动物建模筛选的关键基因提供依据。
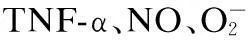
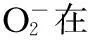
参考文献:
[1]MacKay DG,Johnson LW,Graham ER,et al.Aging,emotion,attention,and binding in the taboo stroop task:data and theories[J].Int J Environ Res Public Health,2015,12(10):12803-12833.
[2]Drescher C,Konishi M,Ebner N,et al.Loss of muscle mass:current developments in cachexia and sarcopenia focused on biomarkers and treatment[J].Int J Cardiol,2015,202:766-772.
[3]Zhang DQ,Sun P,Jin Q,et al.Resveratrol regulates activated hepatic stellate cells by modulating NF-κB and the PI3K/Akt signaling pathway[J].J Food Sci,2015[Epub ahead of print].
[4]Hu L,Cao D,Li Y,et al.Resveratrol sensitized leukemia stem cell-like KG-1a cells to cytokine-induced killer cells-mediated cytolysis through NKG2D ligands and TRAIL receptors[J].Cancer Biol Ther,2012,13(7):516-526.
[5]Zhang S,Cao HJ,Davis FB,et al.Oestrogen inhibits resveratrol induced post-translational modification of p53 and apoptosis in breast cancer cells[J].Br J Cancer,2004,91(1):178-185.
[6]Ish-Shalom E,Meirow Y,Sade-Feldman M,et al.Impaired SNX9 expression in immune cells during chronic inflammation:prognostic and diagnostic implications[J].J Immunol,2015[Epub ahead of print].
[7]Stafforini DM.Diverse functions of plasma PAF-AH in tumorigenesis[J].Enzymes,2015,38:145-155.
[8]Kono N,Arai H.Intracellular platelet-activating factor acetylhydrolase,type II:a unique cellular phospholipase A2 that hydrolyzes oxidatively modified phospholipids[J].Enzymes,2015,38:43-54.
[9]Cheng XL,Liu XG,Wang Q,et al.Anti-inflammatory and anti-arthritic effects of Guge Fengtong Formula:in vitro and in vivo studies[J].Chin J Nat Med,2015,13(11):842-853.
[10]Cheng J,Grande JP.Cyclic nucleotide phosphodiesterase (PDE) inhibitors:novel therapeutic agents for progressive renal disease[J].Exp Biol Med (Maywood),2007,232(1):38-51.
[11]Cassol E,Rossouw T,Malfeld S,et al.CD14+ macrophages that accumulate in the colon of African AIDS patients express pro-inflammatory cytokines and are responsive to lipopolysaccharide[J].BMC Infect Dis,2015,15(1):430.
[12]Joshi VM,Sansi R.Imaging in sinonasal inflammatory disease[J].Neuroimaging Clin N Am,2015,25(4):549-568.
[13]Yuan SX,Wang DX,Wu QX,et al.BMP9/p38 MAPK is essential for the antiproliferative effect of resveratrol on human colon cancer[J].Oncol Rep,2015[Epub ahead of print].
[14]Zulueta A,Caretti A,Signorelli P,et al.Resveratrol:a potential challenger against gastric cancer.[J].World J Gastroenterol,2015,21(37):10636-10643.
[15]Zhang P,Yang B,Yao YY,et al.PIAS3,SHP2 and SOCS3 expression patterns in cervical cancers:relevance with activation and resveratrol-caused inactivation of STAT3 signaling[J].Gynecol Oncol,2015,S0090-8258(15)30148-7.
[16]Narayanan NK,Kunimasa K,Yamori Y,et al.Antitumor activity of melinjo (Gnetum gnemon L.) seed extract in human and murine tumor models in vitro and in a colon-26 tumor-bearing mouse model in vivo[J].Cancer Med,2015[Epub ahead of print].
[17]Wang YX,An N,Ouyang XY.Molecular mechanism involved in adhesion of monocytes to endothelial cells induced by nicotine and Porphyromonas gingivalis-LPS[J].Beijing Da Xue Xue Bao,2015,47(5):809-813.
Effect of resveratrol on oxidative activity of murine abdominal peritoneal macrophage induced by lipopolysaccharideinvitro
SUN Pin1,FU Shuai-cai1,XIAO Le2,GONG Kun-mei2*
(1.Medical College of Kunming University of Science and Technology,Kunming 650000,China;2.First People′s Hospital of Yunnan Province,Kunming 650000,China)
[Abstract]ObjectiveTo study the effect of resveratrol on oxidative activity of murine peritoneal macrophages induced by lipopolysaccharied stimulated with lipopolysaccharide (LPS) in vitro.MethodsPeritoneal macrophages were prepared and divided into control group,LPS group and (RES+LPS) Ⅰ~Ⅵ group.After incubation for 24 h,the activity of neutral red stained cell was observed.Enzyme-linked immunosorbent method and nitrate reduction method were used.The tumor necrosis factor-α (TNF-α),nitric oxide (NO) and superoxide anion levels of cell supernatants were detected by microplate reader.ResultsThe cell activity in control group was lower.A large number of peritoneal macrophages were activated after being induced by LPS,and the TNF-α,NO and superoxide anion levels were significantly higher in cell supernatant;the cell activity of PMA was weakened gradually after RES treatment,and the TNF-α,NO,superoxide anion levels decreased significantly.ConclusionRES can inhibit the cell activation of PMA and reduce the excessive secretion of TNF-α,NO and superoxide anion.
Key words:Macrophages(PMA);Resveratrol (RES);Lipopolysaccharides (LPS);TNF-α;NO;Superoxide anion
收稿日期:2015-11-17
基金项目:云南省应用基础研究(2012FB089、2013FB199),国家自然科学基金(81260066)
DOI:10.14053/j.cnki.ppcr.201604002

