改良FLAG与HAA方案治疗复发难治性急性髓系白血病疗效的对比研究*
曹翊雄,李君君,罗泽宇,文 锋
(南华大学附属第一医院血液内科,湖南衡阳421001)
改良FLAG与HAA方案治疗复发难治性急性髓系白血病疗效的对比研究*
曹翊雄,李君君,罗泽宇,文锋
(南华大学附属第一医院血液内科,湖南衡阳421001)
摘要:目的对比分析改良氟达拉滨联合阿糖胞苷和粒细胞集落刺激因子方案(FLAG)与高三尖杉酯碱、Ara-C和阿柔比星联合方案(HAA)对复发难治性急性髓系白血病(AML)的疗效及安全性。方法回顾性分析29例复发难治性成年非M3型AML患者的临床资料,按化疗方案分为改良FLAG组(17例)和HAA组(12例),观察两组的疗效及不良反应。结果改良FLAG组完全缓解(CR)10例(58.80%),部分缓解(PR)1例(5.88%),总有效率(OR^)为64.68%(11/17)。HAA组CR 6例(50.00%),PR 1例(8.33%);OR^为58.33%(7/12)。两组有效率比较差异无统计学意义(P>0.05)。两组患者的主要不良反应为骨髓抑制、感染,改良FLAG组骨髓抑制作用较HAA组重,但两组在并发感染、出血、肝脏及心脏毒性等非血液学不良反应发生率方面比较,差异无统计学意义。结论改良FLAG方案和HAA方案均为复发难治性AML的有效治疗方案,两者疗效相近,心脏毒性低,不良反应可耐受,可作为复发难治性AML的一线治疗方案。
关键词:白血病;急性;髓样;复发;难治;氟达拉滨
复发难治是目前导致急性髓系白血病(acute myelocytic leukemia,AML)患者治疗失败的主要原因,是当前AML治疗的重点和难点。目前,国际上对于复发难治性AML尚无首选的化疗方案。近年来FLAG方案[氟达拉滨(Fludarabine,Flud)联合阿糖胞苷(arabinosyl cytosine,Ara-C)和粒细胞集落刺激因子(granulocyte colony-stimulating factor,G-CSF)]用于治疗复发难治性AML,取得较好的疗效[1]。由于使用该方案后骨髓抑制重,易出现重度感染,治疗相关死亡率(treatment related mortality,TRM)较高,限制该方案的临床应用。HAA[高三尖杉酯碱(Homohar ringtonine,HHT)、Ara-C和阿柔比星(Aclacinomycin,Acla)3药联合]在初治AML诱导治疗中有较好的临床疗效,在复发难治AML中的应用也越来越多,获得较好的疗效[2]。本研究将FLAG方案中的Ara-C大剂量改为中剂量,作为改良的FLAG方案,并对比分析改良FLAG方案与HAA方案治疗复发难治AML的疗效和不良反应。
1 资料与方法
1.1 病例资料
回顾性分析2012年7月-2015年1月本院收治的29例复发难治成年AML(M3除外)患者的临床资料。所有患者经骨髓细胞形态学、免疫学、细胞遗传学、分子生物学分型诊断明确。均符合复发、难治诊断标准[3]:复发性AML定义为完全缓解(complete response,CR)后,外周血重新出现白血病细胞或骨髓原始细胞>0.05(除巩固化疗后骨髓重建等其他原因外)或髓外出现白血病细胞浸润。难治性AML定义为:①标准方案诱导化疗2个疗程未获CR;②第1次CR后6个月内复发;③第1次CR后6个月后复发,经原方案再诱导化疗失败;④≥2次复发;⑤髓外白血病持续存在。
29例患者按化疗方案分为改良FLAG组和HAA组。其中,改良FLAG组17例,男性7例,女性10例;中位年龄45岁(23~62岁);按法美英分型标准,M2 12例,M4 1例,M5 4例;其中复发性患者3例,难治性患者14例。HAA组12例,男性6例,女性6例;中位年龄48.7岁(25~60岁);按法美英分型标准,M1 1例,M2 7例,M4 1例,M5 3例;其中复发性患者5例,难治性患者7例。两组患者在化疗前除白细胞计数(white blood count,WBC)HAA组较FLAG组高外,骨髓幼稚细胞比例、中位血小板计数(Platelets,PLT)、血红蛋白(Hemoglobin,Hb)比较,差异无统计学意义(P>0.05)。所有患者体力状态评分≤2分;无严重的呼吸、循环系统疾病及肝肾功能损害。两组患者的一般资料见表1。

表1 两组患者一般资料比较
1.2 治疗方案
1.2.1 改良FLAG方案Flud 30 mg/(m2·d),静脉滴注,第1~5天;Ara-c 1g/(m2·d),Flud 4h后静脉滴注,第1~5天;G-CSF 200μg/(m2·d),皮下注射,第1~5天。WBC>20×109/L时停用G-CSF。
1.2.2 HAA方案HHT 2 mg/(m2·d),静脉滴注,第1~5或1~7天;Ara-c 100~150 mg/(m2·d),静脉滴注,第1~5或1~7天;Acla 12~15 mg/(m2·d),静脉滴注,第1~5或1~7天。根据外周血白细胞计数及PLT减少程度决定化疗时间长短(5~7天)。
1.2.3 后续治疗以上两方案治疗1疗程后如获得CR,继续使用1疗程巩固治疗。如获得部分缓解(partial response,PR),再使用1疗程,观察缓解情况。如未缓解则改用其他方案或临床试验。
1.3 支持治疗
所有患者化疗的同时予以护肝、护心、止吐、水化、碱化治疗。治疗期间予以生理盐水与碳酸氢钠交替漱口,高锰酸钾坐浴;病房常规进行紫外线消毒,2次/d。监测患者血常规及肝肾功能、电解质。当患者有发热、咳嗽、腹泻等感染症状时,予以行病原学检查如血培养、痰培养等,并根据经验和药敏结果予以广谱抗生素治疗,并加强营养支持治疗。如检出真菌或使用广谱抗生素>96 h仍发热,则同时予以抗真菌治疗。骨髓抑制期当WBC<2×109/L时使用G-CSF;PLT<20×109/L予以输注血小板;血红蛋白<60 g/L时输注红细胞。
1.4 疗效及不良反应判断
化疗后结束后4周予以骨髓细胞形态学检查,复发难治性急性髓系白血病疗效标准参照文献[3-4],分为:CR、PR、未缓解(Nonresponse,NR);以CR和PR的患者数之和计算总有效率(overall response,OR)。血液学和非血液学不良反应参照世界卫生组织药物不良反应分级。化疗后4周内死亡为早期死亡。
1.5 统计学方法
采用SPSS 20.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,用t检验;计数资料以用百分比或率表示,用Fisher’s确切概率法,P<0.05为差异有统计学意义。
2 结果
2.1 临床疗效
改良FLAG组17例患者中CR 10例(58.80%),PR 1例(5.88%),总有效率为64.70%;HAA组12例患者中CR 6例(50.00%),PR 1例(8.30%);总有效率为58.30%。两组CR率及总有效率比较,差异无统计学意义(P=0.716和0.728)。改良FLAG组3例复发患者中2例CR(66.7%),HAA组5例复发患者均为CR,缓解率为100.0%;改良FLAG组14例难治患者中8例CR(57.1%),1例PR,总有效率为64.3%,HAA组7例难治患者,仅1例CR(14.3%),1例PR,总有效率为28.6%,FLAG方案对于难治AML患者CR率优于HAA组(P=0.024)。见表2。
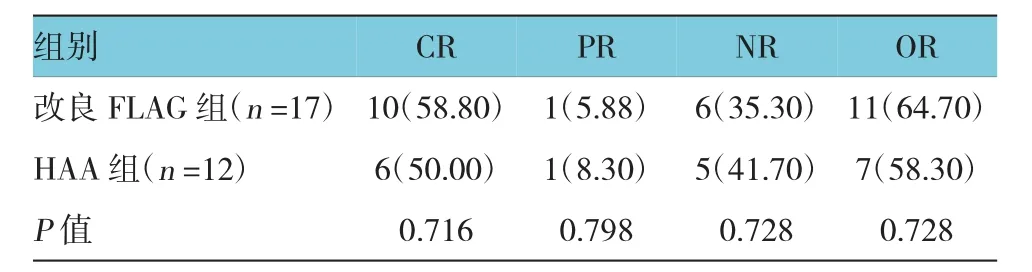
表2 两组患者疗效比较 例(%)
2.2 不良反应
2.2.1 血液学不良反应血液学不良反应主要表现为骨髓抑制,改良FLAG组和HAA组4级血液不良反应发生率分别为100.00%和91.67%,差异无统计学意义(P>0.05);但改良FLAG组患者血细胞减少的持续时间较HAA组长。改良FLAG组有3例患者中性粒细胞(absolute neutrophil count,ANC)重度减低未恢复;其余14例患者ANC<0.5×109/L持续的中位时间为14 d(10~28 d);有3例患者PLT重度减低未恢复,剩余14例患者PLT<20×109/L持续的中位时间为12 d(4~28 d);HAA组12例患者ANC<0.5×109/L持续的中位时间为12 d(0~20 d);PLT<20×109/L持续的中位时间为10 d(3~21 d)。改良FLAG组出血8例(47%),多为皮肤黏膜出血、牙龈出血及鼻衄,重度出血1例,为呕血;HAA组出血4例(33%),重度出血1例,为咯血,两组出血发生率比较差异无统计学意义(P>0.05)。
2.2.2 感染虽然改良FLAG组患者中性粒细胞减少的持续时间较HAA组长,但两组感染发生率比较差异无统计学意义(P>0.05):改良FLAG组感染发生率为82.4%(14/17);HAA组感染发生率为83.3% (10/12)。败血症、肺部感染为主要感染并发症。HAA 组1例出现结核感染,1例肛周脓肿,3例肠道感染。两组各有1例患者因严重感染出现早期死亡。
2.2.3 其他非血液学不良反应化疗期间两组患者均有不同程度恶心、呕吐、肝功能损害等不良反应。改良FLAG组与HAA组均发生1例肝功能损伤,为谷丙转氨酶轻度升高,在护肝治疗后均恢复正常。改良FLAG组有1例患者发生阵发性室上性心动过速,予以控制心室率治疗,血象恢复后转心内科行射频消融术后好转。两组患者呕吐、心脏毒性、肝毒性发生率比较,差异无统计学意义(P>0.05)。见表3。
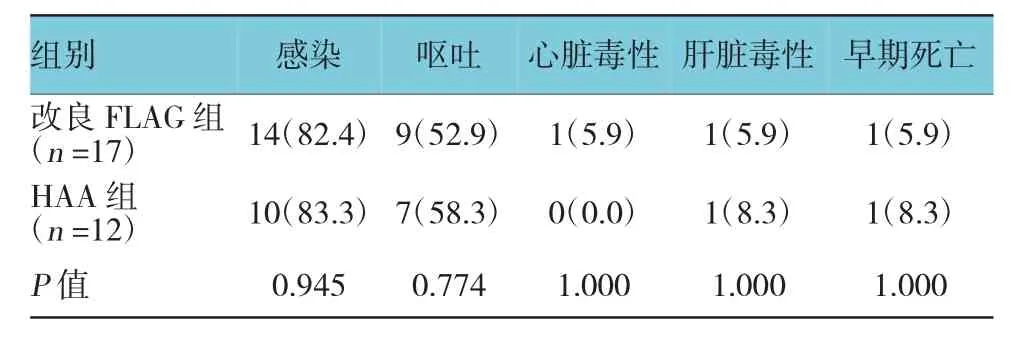
表3 两组患者非血液学不良反应比较 例(%)
3 讨论
近年来,成年AML患者的化疗已取得明显效果。一线药物可使80%的患者获得CR,但复发难治性AML治疗效果差,是导致AML治疗失败的最根本原因,迄今为止,复发难治性AML尚无理想的化疗方案。近年来,FLAG方案被应用于治疗复发难治性急性髓系白血病,并取得令人满意的效果。Flud是第二代嘌呤核苷类似物,通过作用于DNA聚合酶和核苷酸还原酶,能有效抑制多种肿瘤细胞的DNA、RNA和蛋白质合成,并且与Ara-C具有协同作用。G-CSF可以动员G0期细胞进入G1期,从而增强骨髓白血病细胞对Ara-C的敏感性,因而由Flud、Ara-C、G-CSF组成的FLAG方案在复发难治AML的治疗中疗效显著,文献报道其治疗复发难治性急性髓系白血病的缓解率可达50%~80%[5-6]。但是传统的FLAG方案骨髓抑制较重,易出现严重感染等不良反应。LEE等[7]研究发现,61例复发难治的AML患者CR率达47.5%,但是治疗相关死亡率也达11.4%,主要为侵袭性真菌感染。因此,如何在保证FLAG显著疗效的前提下,减少其不良反应,也是众多学者思考的问题。国内一项多中心试验报道改良的FLAG方案[Ara-c 1 g/(m2·d)]CR率为47.62%,FLAG方案[Ara-c 2 g/(m2·d)]CR率为50.00%,TRM率分别为3.57% 和10.34%[8],可见改良FLAG方案在减少不良反应的同时,临床疗效未受明显的影响。本研究应用改良FLAG方案治疗17例复发难治AML患者,CR率为58.8%,TRM率为5.88%,与国内外报道的传统FLAG方案疗效相当,且严重不良反应发生率低,进一步证实改良FLAG方案具有良好的临床疗效及安全性。
HHT是从三尖杉植物中提取的生物碱类抗癌药,其作用机制为抑制肿瘤细胞DNA和蛋白质合成。与其他抗白血病化疗药相比,具有较低的心脏和骨髓毒性,已被广泛使用。研究表明,HHT与Acla不存在交叉耐药[9],而体外实验也进一步证实HHT 与Acla之间存在协同效应。MAI等[10]研究发现,HHT有将白血病细胞阻滞于S期的作用,而S期正是DNA合成期,可能加强Ara-c的诱导凋亡作用,从而起到协同抗白血病效应。因此由HHT、Acla、Ara-c组成的HAA被广泛应用于临床,且在初治及复发难治性AML治疗中表现出良好的疗效[2,11]。本研究应用HAA方案治疗复发难治白血病12例患者,CR率达50%,效果良好,与相关报道结果一致。
基于改良FLAG方案和HAA均为复发难治AML切实有效的化疗方案,笔者将两者进行疗效对比研究,分析其对复发难治AML的疗效与不良反应。本研究证实,改良FLAG方案对于复发难治AML的CR率达58.8%,总有效率为64.7%,而HAA 组CR率也达50.0%,总有效率为58.3%,疗效相当。在复发组两方案均表现出极高的CR率,HAA组CR率达100%,改良FLAG组CR率达80%。但是对于难治组患者,改良FLAG组CR率达57.1%,总有效率为64.3%;而HAA组CR率仅为14.3%,总有效率为28.6%,改良FLAG组对难治AML患者的疗效优于HAA组。
在不良反应方面,两组均表现出来较强的骨髓抑制。改良FLAG组3例患者中性粒细胞未恢复,3例患者PLT未恢复,均为未缓解患者,考虑与化疗无效有关。改良FLAG组血液学不良反应虽较HAA方案重,但两组患者的感染率比较,差异无统计学意义。在积极抗感染和强力支持治疗下,大部分患者能安全度过骨髓抑制期,两组仅各出现1例患者早期死亡。同时在心、肝、肾毒性方面也未出现明显的不良反应,耐受性良好。
综上所述,改良FLAG方案和HAA方案治疗复发难治性AML总疗效相近,均有较好的疗效,对于难治性AML,改良FLAG方案疗效更佳。两者非血液学不良反应较小,耐受性良好。虽然改良FLAG方案骨髓抑制作用更强,但其感染发生率并未增加。在目前复发难治性AML尚无标准化疗方案的情况下,改良FLAG与HAA方案均为不错的选择。由于本研究病例数较少,有待大规模、多中心的前瞻性随机临床试验进一步证实。
参考文献:
[1]FIEGL M,UNTERHALT M,KERN W,et al. Chemomodulation of sequential high-dose cytarabine by fludarabine in relapsed or refractory acute myeloid leukemia: a randomized trial of the AMLCG[J]. Leukemia,2014,28(5): 1001-1007.
[2]胡小山,宫立众,岑坚,等. HAA方案诱导治疗初治及复发、难治急性髓系白血病临床分析[J].白血病?淋巴瘤,2013,22(4): 226-229.
[3]中华医学会血液学分会.急性髓系白血病(复发难治性)中国诊疗指南(2011年版)[J].中华血液学杂志,2011,32(12): 887-888.
[4]张之南,沈悌.血液病诊断及疗效标准[M].第3版.北京:科学出版社,2007: 131-134.
[5]CAMERA A,RINALDIC R,PALMIERI S,et al. Sequential continuous infusion of fludarabine and eytarabine associated with liposomal daunorubicin(Dauno Xome(R)(FLAG)in primary refractory or relapsed adult acute myeloid leukemia patients[J]. Ann Hematol,2009,88(2): 151-158.
[6]KANTARJIAN H,WANG X,PLUNKETT W K,et al. Treatment of core-binding-factor in acute myelogenous leukemia with fludarabine,cytarabine,and granulocyte colony-stimulating factor results in improved event-flee survival[J]. Cancer,2008,113(11): 3181-3185.
[7]LEE S R,YANG D H,AHN J S,et al. The clinical outcome of FLAG chemotherapy without idarubicin in patients with relapsedor refractory acute myeloid leukemia[J]. J Korean Med Sci,2009,24(3): 498-503.
[8]李军民.改良剂量的FLAG方案在复发或难治的急性髓系白血病治疗中的疗效及安全性研究:一项中国多中心随机对照临床研究中期报告[A].中华医学会血液学分会,第十一届全国白血病淋巴瘤学术会议论文汇编[C];2011年.
[9]林茂芳,曾波航,吴佳丽,等. 61例成人急性非淋巴细胞白血病诱导化疗HA和DA的比较[J].临床血液学杂志,1992,5(1): 1-4.
[10]MAI W Y,LIN M F. Induction of apoptosis by homoharringtonine in G1 phase human chronic myeloid leukemia cells[J]. Chin Med J,2005,118(6): 487-492.
[11]叶佩佩,牧启田,陈菲菲,等. HAA方案诱导治疗成人初发急性髓系白血病236例疗效观察[J].中华血液学杂志,2013,34(1): 825-829.
(童颖丹编辑)
Curative effects of modified FLAG and HAA on relapsed refractory acute myeloid leukemia*
Yi-xiong Cao,Jun-jun Li,Ze-yu Luo,Feng Wen
(Department of Hematology,the First Hospital,University of South China,Hengyang,Hunan 421001,China)
Abstract:Objective To investigate the efficacy and toxicity of modified FLAG and HAA on relapsed refractory acute myeloid leukemia(AML). Methods Retrospective analysis was used to observe the therapeutic effects and side effects of 29 cases of relapsed refractory adult AML,which were divided into modified FLAG group(17 cases)and HAA group(12 cases)according to chemotherapy regimens. Results In the modified FLAG group,the complete remission(CR)rate was 58.80%(10/17),the partial remission(PR)rate was 5.88% (1/17),the overall response(OR^)rate was 64.68%(11/17). In the HAA group,the CR rate was 50.00%(6/12),the PR rate was 8.33%(1/12),and the overall response OR^rate was 58.33%(7/12);there were no statistical differences between the two groups(P>0.05). The main toxicities of the two groups were myelosupression and infection. Myelosupression in the modified FLAG group was severer than that in the HAA group. There was no significant difference in the incidence of secondary infection,haemorrhagia,hepatic toxicity or cardiac toxicities between both groups. Conclusions Both HAA regimen and modified FLAG regimen are effective for treatment of relapsed refractory adult acute myeloid leukemia with similar efficacy and low cardiac toxicity,and their side effects can be well tolerated. Thus,modified FLAG regimen and HAA regimen can be used as first-line treatment for this disease.
Keywords:leukemia,myeloid,acute;relapsed;refractory;Fludarabine
中图分类号:R733.71
文献标识码:B
DOI:10.3969/j.issn.1005-8982.2016.11.015
文章编号:1005-8982(2016)011-0072-05
收稿日期:2016-01-15
*基金项目:湖南省自然科学基金(No:2016JJ4078);湖南省卫生计生委科研计划课题(No:B2016131)

