辛伐他汀对肥胖哮喘小鼠气道炎症的作用及其机制*
李 君,王丽霞,韩 伟,吕维红,唐华平
(青岛大学医学院附属青岛市市立医院东院1.呼吸科,2.感染科,山东青岛266071)
辛伐他汀对肥胖哮喘小鼠气道炎症的作用及其机制*
李君1,王丽霞1,韩伟1,吕维红2,唐华平1
(青岛大学医学院附属青岛市市立医院东院1.呼吸科,2.感染科,山东青岛266071)
摘要:目的探讨辛伐他汀对肥胖哮喘小鼠气道炎症的作用及其机制。方法将60只C57BL/6J小鼠随机分为空白对照组、肥胖哮喘组、地塞米松治疗组和辛伐他汀治疗组。其中,肥胖哮喘组、地塞米松治疗组、辛伐他汀治疗组小鼠采用卵蛋白致敏、激发的方法和高脂饮食诱导建立肥胖哮喘模型。地塞米松治疗组每日给予地塞米松(0.5 mg/kg)饮水干预,辛伐他汀治疗组每日给予辛伐他汀(40 mg/kg)饮水干预,其余两组正常饮水。治疗4周后,计数存活小鼠,采外周血生化分析仪测定血糖、血脂、肝功能水平;收集支气管肺泡灌洗液,计数支气管肺泡灌洗液中白细胞总数及各炎症细胞所占比例;肺病理切片观察小鼠气道炎症和结构变化。结果肥胖哮喘组、地塞米松治疗组、辛伐他汀治疗组气道炎症评分、回抽收集灌洗液中白细胞总数及中性粒细胞百分比、血清总胆固醇水平均较空白对照组升高,其中辛伐他汀治疗组上述指标较肥胖哮喘组、地塞米松治疗组下降,差异有统计学意义(P<0.05)。且总胆固醇水平与支气管肺泡灌洗液中中性粒细胞百分比呈正相关(r=0.724,P=0.020)。结论辛伐他汀治疗可以减轻肥胖哮喘的气道炎症,改善哮喘病情,这一作用与其降低血脂水平有一定关系。
关键词:肥胖;哮喘;他汀类药物;血脂;炎症
近年来肥胖及肥胖相关疾病的发病率逐年升高,研究表明,肥胖是哮喘发病的独立危险因素,肥胖者不仅哮喘率更高,对常规哮喘治疗的反应不佳[1]。患者反复大剂量激素治疗,引发血糖升高、骨质疏松等全身副作用,急需寻找针对性的治疗方法。研究发现,他汀类药物除降脂作用以外,还具有抗炎及免疫调节作用[2],但他汀类药物对哮喘的疗效尚存在争议,也未见其治疗肥胖哮喘的疗效评价。本研究在慢性肥胖哮喘动物模型上,探讨辛伐他汀对肥胖哮喘气道炎症的影响及其机制。
1材料与方法
1.1 一般资料
1.1.1 实验动物3周龄雌性C57BL/6J小鼠60只,无特定病原体动物级别,体重(10.91±0.25)g,购自常州卡文斯动物实验有限公司[Scxk(苏)20110003]。所有动物均饲养于青岛大学医学院动物房,12 h光照/12 h黑暗,25℃恒温,普通或高脂无卵蛋白饲料,自由饮水摄食。该研究已经青岛市市立医院伦理委员会许可。
1.1.2 主要实验试剂与器材60%Kcal高脂饲料(美国Research Diets),卵白蛋白(Ovalbumin,OVA)(Grade V,美国Sigma公司),佐剂铝凝胶(美国Pierce公司),雾化器(德国百瑞公司),光学显微镜(日本Olympus公司),地塞米松片(欣辰药业股份有限公司),辛伐他汀片(杭州默沙东制药有限公司)。
1.2 方法
1.2.1 肥胖哮喘模型建立和分组将60只C57BL/6J小鼠随机平均分成4组:空白对照组、肥胖哮喘组、地塞米松治疗组和辛伐他汀治疗组,每组15只。空白对照组给予普通饲料,其余3组按照参考文献[3],给予60%Kcal高脂饲料,连续喂养15周。以8周末作为第0天,于第1、7、14天,给予OVA致敏混悬液0.2 ml腹腔注射(含50μg OVA,等体积氢氧化铝佐剂1 mg),第21天将小鼠以1%OVA雾化激发,连续雾化7 d,每次30 min,之后改为隔天1次,连续3周。空白对照组在相应的时间内给予等量的生理盐水腹腔注射并予以生理盐水雾化吸入;地塞米松治疗组从21 d起每日给予地塞米松(0.5 mg/kg)饮水干预;辛伐他汀组从21 d起每日给予辛伐他汀片(40 mg/kg)饮水干预。空白对照组和肥胖哮喘组普通饮水。
1.2.2 标本的采集及处理末次激发24 h内,小鼠以5%水合氯醛0.4 ml腹腔注射麻醉,眼球取血1 ml后固定于手术台,分离气管,打开胸腔,分离肺脏,气管插管。结扎右肺门并自远端分离右肺,取较大肺叶放入10%中性甲醛溶液中固定[4]。气管插管接注射器以PBS 0.4 ml低压灌洗左肺,保留30 s,回抽收集支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF),反复灌洗3次,回收率>80%,共回收灌洗液1 ml。
1.2.3 BALF白细胞计数和分类使用低温离心机,在4℃、300×g离心BALF 10 min。取细胞沉渣,重悬后计数细胞总数。调整细胞浓度后,行Wright染色。计数200个白细胞中嗜酸性粒细胞、中性粒细胞、巨噬细胞和淋巴细胞比例。
1.2.4 血清葡萄糖、脂肪和肝功能测定采集外周血室温静置30 min后,2 000×g离心取上清液,生化分析仪测定血清中葡萄糖(Glucose,Glu)、三酰甘油(Triglycerides,TG)、总胆固醇(total cholesterol,TC)、谷丙转氨酶(alanine aminotransferase,ALT)和谷草转氨酶(aspartate transaminase,AST)水平。
1.2.5 病理改变肺组织经10%中性甲醛固定后,送病理科进行石蜡包埋、切片及苏木精-伊红染色(hematoxylin-eosin staining,HE)、过碘酸雪夫染色(periodic acid-schiff,PAS)。每张切片在显微镜下放大100倍,随机选取横断面较圆、直径100~200 nm完整的细支气管横截面,采用AxioVision 3.1图像分析系统观察组织形态、气道上皮脱落、气管周围炎症细胞浸润情况以及气道杯状细胞增生、黏液分泌情况。进行炎症程度分级:0级,无炎症细胞;1级,少许炎症细胞;2级,较多分布不均的炎症细胞;3级,大量炎症细胞,分布较均匀,少见聚集成团;4级,大量炎症细胞聚集成团[5]。
1.3 统计学方法
采用SPSS 17.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,各组间比较用单因素方差分析,两两比较用LSD检验;计数资料比较用χ2分析,两两比较用Fisher确切概率法;用Pearson进行相关性分析,P<0.05为差异有统计学意义。
2 结果
2.1 小鼠一般情况
高脂饲料诱导后,肥胖哮喘组、地塞米松治疗组和辛伐他汀治疗组小鼠体重较空白对照组明显增加。饲养8周后,肥胖哮喘组、地塞米松治疗组和辛伐他汀治疗组小鼠平均体重分别为(25.92±0.70)、(25.68±0.51)和(26.02±0.66)g,比空白对照组(21.12±0.70)g高20%。OVA致敏干预后,肥胖哮喘组、地塞米松治疗组和辛伐他汀治疗组小鼠的体重增长速度均减慢。实验结束时,肥胖哮喘组体重最低,但肥胖哮喘组、地塞米松治疗组和辛伐他汀治疗组3组比较,差异无统计学意义(F=2.143,P=0.139)。
2.2 小鼠哮喘症状表现
肥胖哮喘组、地塞米松治疗组和辛伐他汀治疗组在激发过程中均有哮喘急性发作的表现,如烦躁不安、打喷嚏、弓背直立、呼吸加深加快、烦躁不安或安静少动、大小便次数增多,但地塞米松治疗组和辛伐他汀治疗组小鼠哮喘症状较肥胖哮喘组轻。空白对照组无哮喘急性发作表现。
2.3 BALF中白细胞总数及炎症细胞分类所占比例
4组小鼠BALF中白细胞总数、嗜酸性粒细胞比例及中性粒细胞比例比较,差异有统计学意义(P<0.01)。其中,肥胖哮喘组、地塞米松治疗组和辛伐他汀治疗组小鼠BALF中白细胞总数、中性粒细胞和嗜酸性粒细胞比例均较空白对照组升高(t白细胞=19.765、11.134和10.871,P白细胞=0.000、0.000和0.000;t中性粒细胞=14.474、19.419和19.310,P中性粒细胞=0.000、0.000和0.000,t嗜酸性粒细胞=14.072、13.824和11.868,P嗜酸性粒细胞=0.000、0.000和0.000;P<0.01),符合哮喘气道炎症表现。地塞米松治疗组和辛伐他汀治疗组BALF的白细胞总数和嗜酸性粒细胞比例均较肥胖哮喘组减少(t白细胞=7.884和10.020,P白细胞=0.000和0.000;t嗜酸性粒细胞=7.884和4.124,P嗜酸性粒细胞=0.000和0.039,P<0.05),提示2种治疗药物均有一定的抗炎疗效。但值得注意的是,辛伐他汀治疗组的中性粒细胞比例较肥胖哮喘组下降(t=2.196,P=0.038)。见表1。
表1 小鼠BALF中细胞计数的比较(±s)
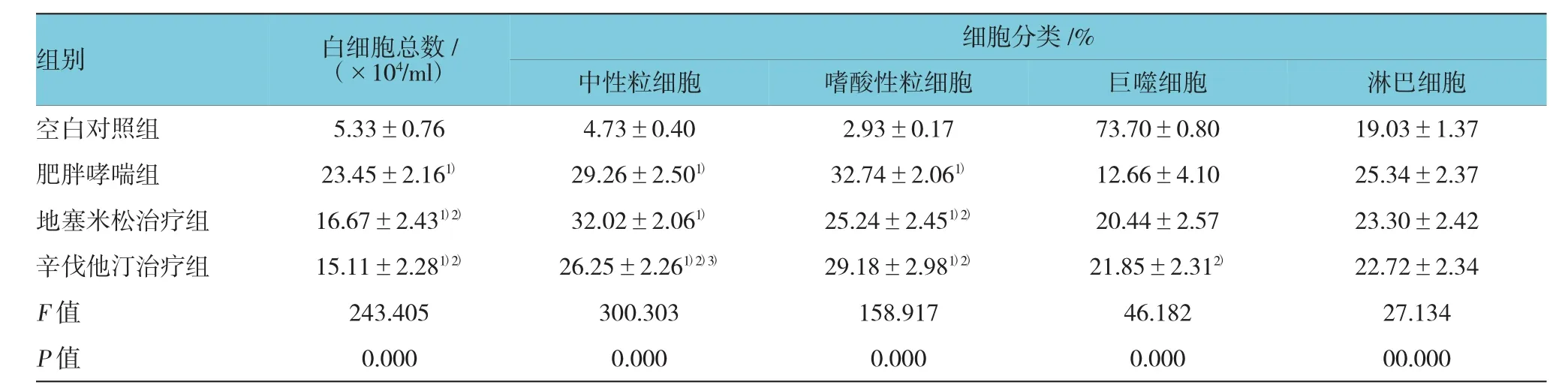
表1 小鼠BALF中细胞计数的比较(±s)
注:1)与空白对照组比较,P<0.05;2)与肥胖哮喘组比较,P<0.05;3)与地塞米松治疗组比较,P<0.05
组别 白细胞总数/ (×104/ml)细胞分类/%中性粒细胞 嗜酸性粒细胞 巨噬细胞 淋巴细胞空白对照组 5.33±0.76 4.73±0.40 2.93±0.17 73.70±0.80 19.03±1.37肥胖哮喘组 23.45±2.161)29.26±2.501)32.74±2.061)12.66±4.10 25.34±2.37地塞米松治疗组 16.67±2.431)2)32.02±2.061)25.24±2.451)2)20.44±2.57 23.30±2.42辛伐他汀治疗组 15.11±2.281)2)26.25±2.261)2)3)29.18±2.981)2)21.85±2.312)22.72±2.34 F值 243.405 300.303 158.917 46.182 27.134 P值 0.000 0.000 0.000 0.000 00.000
2.4 气道炎症及重建情况
除空白对照组外,其他各组小鼠的支气管上皮细胞均出现不同程度的破坏、脱落,周围炎症细胞浸润,甚至集聚成团,部分肺泡腔融合形成肺气肿,杯状细胞增生,黏液分泌增多,气道重塑(见附图)。空白对照组、肥胖哮喘组、地塞米松治疗组和辛伐他汀治疗组炎症评分依次为(0.13±0.35)、(3.40±0.51)、(2.87±0.64)和(2.80±0.67)分,肥胖哮喘组、地塞米松治疗组和辛伐他汀治疗组炎症评分均高于空白对照组(t=12.238、9.469和9.438,P=0.000、0.000和0.000,P<0.01),地塞米松治疗组和辛伐他汀治疗组较肥胖哮喘组降低(t=3.183和2.779,P=0.004和0.010),但地塞米松治疗组和辛伐他汀治疗组两组比较,差异无统计学意义(t=0.288,P=0.776)。
2.5 各组小鼠血糖和血脂水平
4组小鼠血糖、TG、TC水平比较,差异有统计学意义(P<0.01),空白对照组、肥胖哮喘组、辛伐他汀治疗组的血糖水平相当(F=1.875,P=0.175),地塞米松治疗组较其余3组升高(t=5.917、3.830和5.323,P=0.000、0.000和0.000,P<0.01),符合全身糖皮质激素治疗对血糖代谢的影响。肥胖哮喘组、地塞米松治疗组和辛伐他汀治疗组TG和TC均高于空白对照组(tTG=3.553、4.257和3.754,PTG=0.001、0.000和0.000;tTC=7.241、8.509和7.106,PTC=0.000、0.000和0.000,P<0.01),提示高脂饲料引起小鼠血脂代谢紊乱。地塞米松治疗组的TG和TC与肥胖哮喘组比较,差异无统计学意义(t=0.177和0.921,P=0.861和0.717),而辛伐他汀治疗组TC水平低于肥胖哮喘组(t=2.457,P=0.021),提示辛伐他汀的降脂作用。相关性分析显示,TC水平与BALF中中性粒细胞比例呈正相关(r=0.724,P=0.020)。见表2。
表2 各组小鼠血糖和血脂水平比较(mmol/L,±s)
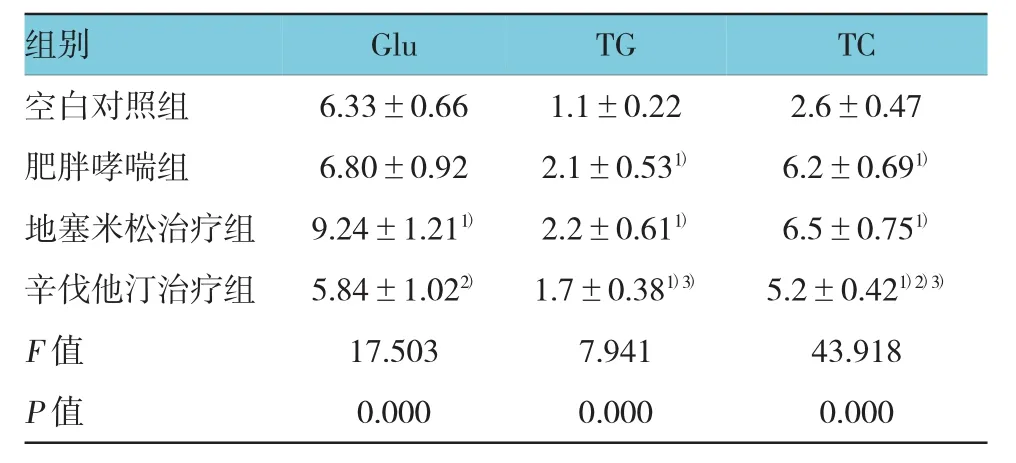
表2 各组小鼠血糖和血脂水平比较(mmol/L,±s)
注:1)空白对照组比较,P<0.05;2)与地塞米松治疗组比较,P<0.05;3)与肥胖哮喘组比较,P<0.05
组别 Glu TG TC空白对照组 6.33±0.66 1.1±0.22 2.6±0.47肥胖哮喘组 6.80±0.92 2.1±0.531)6.2±0.691)地塞米松治疗组 9.24±1.211)2.2±0.611)6.5±0.751)辛伐他汀治疗组 5.84±1.022)1.7±0.381)3)5.2±0.421)2)3)F值 17.503 7.941 43.918 P值 0.000 0.000 0.000
2.6 各组小鼠不良事件
实验结束时,空白对照组无小鼠死亡,肥胖哮喘组1只小鼠死亡,地塞米松治疗组3只小鼠死亡,而辛伐他汀治疗组1只小鼠死亡。空白对照组小鼠AST或ALT均正常,肥胖哮喘组1只小鼠ALT升高,地塞米松治疗组和辛伐他汀治疗组各有2只小鼠出现不同程度的AST或ALT升高。4组小鼠的死亡率或肝损率比较差异无统计学意义(死亡率:χ2=3.418,P=0.377;肝损率:χ2=2.456,P=0.740)。地塞米松治疗组小鼠总不良事件率(死亡率和肝损率之和)高于空白对照组(Fisher P=0.042),提示肥胖哮喘小鼠全身应用糖皮质激素后副作用增多。
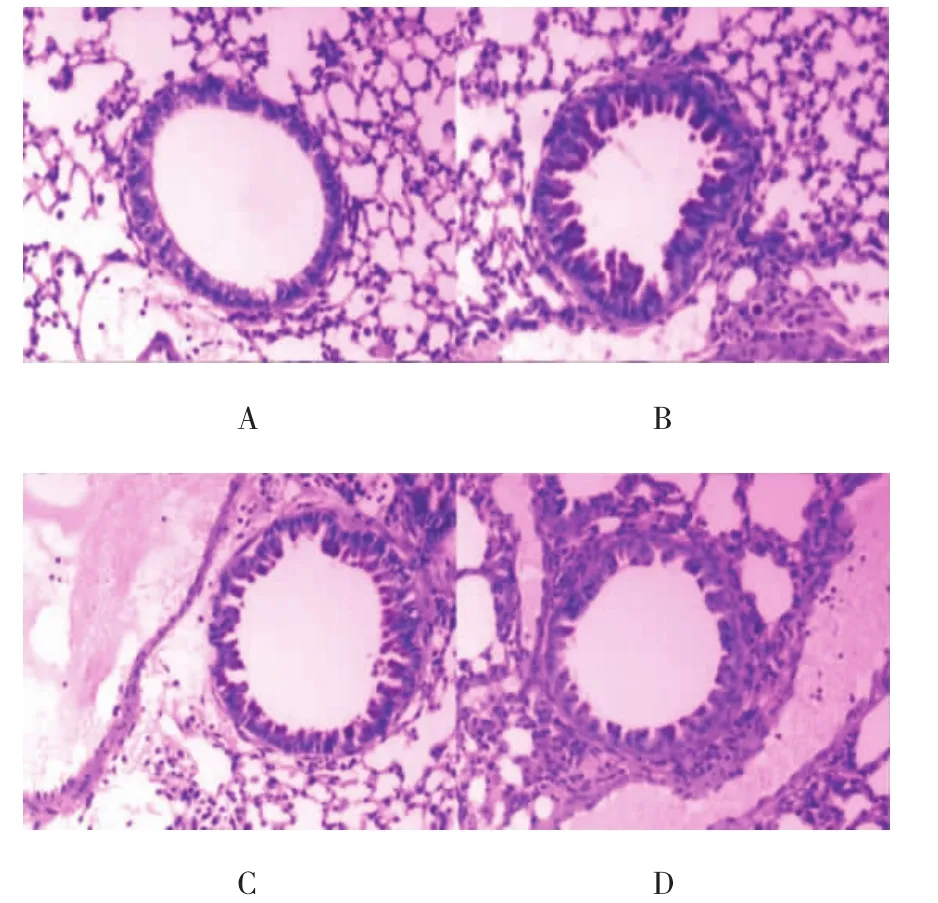
A:空白对照组;B:肥胖哮喘组;C:地塞米松治疗组;D:辛伐他汀治疗组附图 各组小鼠气道病理改变(PAS×100)
3 讨论
随着生活方式和环境的改变,肥胖和哮喘的发病率逐年升高,临床研究发现肥胖者的哮喘不仅病情严重,还对糖皮质激素治疗不敏感,因此学者将肥胖者的哮喘定义为一种特殊的临床表型——肥胖相关性哮喘或肥胖哮喘加以研究和治疗[6]。本研究在肥胖哮喘小鼠模型上评价辛伐他汀对肥胖哮喘气道炎症的作用并探讨其机制。
本研究采用饮食诱导和OVA致敏激发方法建立肥胖哮喘小鼠模型。不同于JOHNSTON等[7]遗传性肥胖,饮食诱导肥胖更符合大多数肥胖者的发病方式,因而更能反映肥胖哮喘的临床特征。研究证实,肥胖哮喘小鼠的体内存在明显的代谢紊乱,表现为血脂和血糖水平较高,符合代谢综合征的表现,且肥胖哮喘小鼠气道炎症反应更为强烈,中性粒细胞增多,不同于一般哮喘的气道表现,属于难治性哮喘,与SUTHERLAND等[8]研究结果一致。临床上对于难治性哮喘,常采用全身糖皮质激素治疗。但本研究发现,全身地塞米松治疗进一步加重肥胖哮喘小鼠的代谢紊乱,表现为血糖和血脂升高,且中性粒细胞比例和小鼠死亡率增加,因此糖皮质激素无法在肥胖哮喘患者中取得良好的治疗效果[9]。
研究发现,脂肪组织产生的一系列脂肪细胞因子和炎症因子,能够调节人体免疫反应,降低免疫耐受,增加哮喘的发生风险,因此调控脂肪代谢可望成为肥胖哮喘治疗的新靶点[10]。他汀类药物为羟甲基戊二酰辅酶A还原酶的竞争性抑制剂,抑制胆固醇的生物合成,临床上多用于降低血脂及心血管疾病[11]。近年来一些动物和临床研究观察辛伐他汀、洛伐他汀等多种他汀类药物对哮喘的治疗作用,认为他汀类药物可以通过抑制炎症细胞从血液向炎症部位的迁移;减少细胞因子释放和嗜酸性粒细胞募集,改善上皮细胞功能失调,减少黏液分泌等多种方式抑制气道炎症,降低气道高反应性[12]。但在临床研究中,他汀治疗并不能改善哮喘患者的病情,COWAN等[13]研究认为,辛伐他汀不能减少激素的用量,且与病情和肺功能改善无关。因此,他汀类药物对哮喘的抗炎作用应有特定优势人群。
本研究中应用辛伐他汀治疗后,肥胖哮喘的血脂和血糖代谢紊乱改善,BALF中白细胞总数、中性粒细胞比例均较地塞米松组下降,死亡率也有所降低,提示辛伐他汀确能抑制肥胖哮喘的气道炎症,降低死亡率。且他汀类药物治疗后BALF中中性粒细胞比例与小鼠血清胆固醇水平存在相关性,提示辛伐他汀治疗肥胖哮喘的疗效或与纠正血脂紊乱有关,肥胖哮喘人群可能是他汀类药物抗炎作用的优势人群。但ARNAUD等[14]认为,他汀类药物的抗炎作用是其特殊的药理作用,而与其降脂作用无关,因此应该进行更多的临床和基础研究,进一步阐明他汀类药物的抗炎机制。
虽然众多研究显示他汀类药物对哮喘的抗炎作用,但是长期使用他汀类药物可能存在多种副作用,如肝功能损害、肌病等。本研究辛伐他汀组小鼠治疗4周后2只小鼠出现不同程度AST和ALT升高,1只小鼠死亡。为避免全身使用的副作用,除研制新型药物,开发新型给药方式也是重要策略之一。吸入疗法具有作用迅速、用药量少、可避免肝脏的首过效应、全身副作用少等优点。XU等[15]系统评价不同给药方式(包括吸入、气管内给药、灌胃、腹腔内注射),对哮喘小鼠气道炎症的作用,结果发现吸入辛伐他汀较全身给药其肺组织药物浓度更高,血药浓度更低。因此,未来开发适应于吸入治疗的他汀类药物对促进其在哮喘治疗中的应用具有积极作用。
综上所述,辛伐他汀通过调节体内脂质代谢,改善肥胖哮喘的糖皮质激素抵抗,降低哮喘症状和气道炎症。因此,他汀类药物有望成为一种富有潜力的哮喘治疗新选择。鉴于人体和动物模型的差异,未来还应开展严谨的临床研究以评估辛伐他汀在肥胖哮喘患者的疗效,并研发适合局部使用或副作用更小的他汀类药物。
参考文献:
[1]JUEL C T,ULRIK C S. Obesity and asthma: impact on severity,asthma control,and response to therapy[J]. Respir Care,2013,58(5): 867-873.
[2]ANTONOPOULOS A S,MARGARITIS M,LEE R,et al. Statins as anti-inflammatory agents in atherogenesis: molecular mechanisms and lessons from the recent clinical trials[J]. Curr Pharm Des,2012,18(11): 1519-1530.
[3]KIM H Y,LEE H J,CHANG Y J,et al. Interleukin-17-producing innate lymphoid cells and the NLRP3 inflammasome facilitate obesity-associated airway hyperreactivity[J]. Nat Med,2014,20(1): 54-61.
[4]韩伟,陈凯,唐华平,等.肥胖型哮喘小鼠体内氧化应激反应变化及其与气道炎症和重构的关系[J].中国呼吸与危重监护杂志,2011,10(4): 331-334.
[5]HENDERSON W J,TANG L O,CHU S J,et al. A role for cysteinyl leukotrienes in airway remodeling in a mouse asthma model[J]. Am J Respir Crit Care Med,2002,165(1): 108-116.
[6]DIXON A E,HOLGUIN F,SOOD A,et al. An official American Thoracic Society Workshop report: obesity and asthma[J]. Proc Am Thorac Soc,2010,7(5): 325-335.
[7]JOHNSTON R A,ZHU M,RIVERA-SANCHEZ Y M,et al. Allergic airway responses in obese mice[J]. Am J Respir Crit Care Med,2007,176(7): 650-658.
[8]SUTHERLAND E R,GOLEVA E,KING T S,et al. Cluster analysis of obesity and asthma phenotypes[J]. PLoS One,2012,7(5): e36631. DOI: 10.1371/journal. pone. 0036631.
[9]BOARDMAN C,CHACHI L,GAVRILA A,et al. Mechanisms of glucocorticoid action and insensitivity in airways disease[J]. Pulm Pharmacol Ther,2014,29(2): 129-143.
[10]LINDERHOLM A L,BRATT J M,SCHUSTER G U,et al. Novel therapeutic strategies for adult obese asthmatics[J]. Immunol Allergy Clin North Am,2014,34(4): 809-823.
[11]方利华.瑞舒伐他汀对冠心病合并高脂血症老年患者血脂水平和炎症因子影响的临床研究[J].中国现代医学杂志,2014,24(36): 43-45.
[12]LIOU C J,CHENG P Y,HUANG W C,et al. Oral lovastatin attenuates airway Inflammation and mucus secretion in ovalbumin-induced murine model of asthma[J]. Allergy Asthma Immunol Res,2014,6(6): 548-557.
[13]COWAN D C,COWAN J O,PALMAY R,et al. Simvastatin in the treatment of asthma: lack of steroid-sparing effect[J]. Thorax,2010,65(10): 891-896.
[14]ARNAUD C,VEILLARD N R,MACH F. Cholesterol-independent effects of statins in inflammation,immunomodulation and atherosclerosis[J]. Curr Drug Targets Cardiovasc Haematol Disord,2005,5(2): 127-134.
[15]XU L,DONG X W,SHEN L L,et al. Simvastatin delivery via inhalation attenuates air-way inflammation in a murine model of asthma[J]. Int Immunopharmacol,2012,12(4): 556-564.
(申海菊编辑)
Effect of Simvastatin on airway inflammation in obese asthma mice and its mechanism*
Jun Li1,Li-xia Wang1,Wei Han1,Wei-hong Lyu2,Hua-ping Tang1
(1. Department of Respiratory Diseases,2. Department of Hospital Infection Control,East Hospital of Qingdao Municipal Hospital,Medical College of Qingdao University,Qingdao,Shandong 266071,China)
Abstract:Objective To investigate the effect of Simvastatin on airway inflammation in obese asthma mice and the mechanism. Methods Sixty C57BL/6J mice were randomly divided into four groups:blank control group(group A),obese asthma group(group B),Dexamethasone treatment group(group C)and Simvastatin treatment group(group D). The mice fed with high-fat diet were sensitized and challenged with ovalbumin(OVA)to establish the model of chronic obese asthma. The mice of the group C were treated with Dexamethasone (0.5 mg/kg)daily,and the mice of the group D were treated with Simvastatin(40 mg/kg)daily in 4 weeks. After last OVA challenge,the survival number of mice and mice reaction during challenge in each group were recorded. After the mice were anesthetized,blood,bronchoaveolar lavage fluid(BALF)and lung tissue were collected and kept respectively. The serum FBG,TC,TG,AST and ALT were measured by biochemical analyzer. The total number of white cells and the proportion of leukocytes,eosinophils,neutrophils and macrophages in the BALF were counted under microscope. The structural changes and inflammation in the lung tissue sections of mice were observed and recorded. Results The airway inflammation score,the total number of white blood cells and neutrophil proportion in the BALF and serum TC levels were higher in thegroups B,C and D than those in the group A;the above indexes in the group D significantly decreased compared with the groups B and C(P<0.05). Serum TC level was positively correlated with the proportion of neutrophils in the BALF(r=0.724,P=0.020). Conclusions Simvastatin can alleviate airway inflammation and asthma attack partly by correcting lipid disorder.
Keywords:obesity;asthma;Simvastatin;lipid;inflammation
中图分类号:R562.25
文献标识码:A
DOI:10.3969/j.issn.1005-8982.2016.11.002
文章编号:1005-8982(2016)11-0007-05
收稿日期:2015-11-30
*基金项目:国家自然科学基金(No:81400024);山东省自然科学基金(No:ZR2014HM105)
[通信作者]韩伟,E-mail:slyyicqd@163.com;Tel:0532-88905525

